W Ę G L O W O D O R Y A R O M A T Y C Z N E - ARENY
BENZEN
Benzen
odkrył
Faraday
w 1825 r. w Londynie, w oleistej pozostałości zbierającej się na dnie
ulicznych lamp, oświetlanych gazem z gazowni.
Michał Faraday (1791-1867); ur. W Newington Butts, Surrey, Wielka Brytania, dyrektor laboratorium w Royal
Institution, prof. chemii w Royal Institution.
Cykloheksa-1,3,5-trien
, noszący zwyczajową nazwę
benzenu
, pomimo że zawiera trzy podwójne
wiązania C=C nie wykazuje właściwości chemicznych typowych dla alkenów, ani sprzężonych
polienów, np.
heksa-1,3,5-trienu
. Przede wszystkim
nie ulega
charakterystycznym dla alkenów
reakcjom addycji elektrofilowej
.
COOH
COOH
OH
Cl
KMnO
4
/HOH
H
+
/HOH
HCl/eter
cykloheksen
kwas adypinowy cykloheksanol chlorocykloheksan
Podobnie
heksa-1,3,5-trien
:
OH
OHOH
Cl
Cl Cl
KMnO
4
/HOH
H
+
/HOH
HCl/eter
heksen-1,3,5-trien
CH
2
=CH-CH=CH-CH=CH
2
2 CO
2
+
2 (COOH)
2
CH
3
CHCH
2
CHCHCH
3
CH
3
CHCH
2
CHCHCH
3
kwasy
heksano-2,3,5-triol 2,3,5-trichloroheksan
Benzen
jest niepodatny na działanie tych reagentów:
KMnO
4
/HOH
H
+
/HOH
HCl/eter
benzen
brak
reakcji
brak
reakcji
brak
reakcji
Geometria wiązań w cząsteczce
benzenu
jest inna niż w alkenach czy polienach sprzężonych.
W
benzenie
wszystkie wiązania C-C i C=C są jednakowej długości. Nie ma różnicy pomiędzy
1,2-dimetylobenzem
zapisanym wg poniżej podanych dwóch wzorów. To nie są izomery
konstytucyjne, tj. ten sam związek:
H
H
H
H
H
H
H
H
H
H
H
H
H
H
H
H
CH
3
CH
3
H
H
H
H
CH
3
CH
3
benzen 1,2-dimetylobenzen
długość wiązania C-C = C=C = 1,39 Å; kąty w pierścieniu = 120
o
.
Występowanie
Związki aromatyczne są rozpowszechnione w przyrodzie, wiele z nich pełni ważne funkcje
biochemiczne:
H
H
H
OH
O
H
O
N CH
3
O
H
O
H
OH
OH
CH
2
NHCH
3
H
O
H
H
3
C
CH
2
CHCOOH
NH
2
CH
2
CHCOOH
OH
NH
2
CH
3
H
O
H
H
H
3
CNH
fenyloalanina
aminokwas
tyrozyna
aminokwas
efedryna
,
adrenalina estradiol morfina
,
alkaloid neuroprzenośnik żeński hormon narkotyk,
płciowy alkaloid (lek)
Źródła węglowodorów aromatycznych
Węglowodory aromatyczne występują w ropie naftowej, ale zwykle w małym stężeniu. Znane są
jednak gatunki ropy naftowej o podwyższonej zawartości arenów w stosunku do średniej. W
dużych ilościach znajdują się w smole pogazowej – produkcie
wysokotemperaturowej pirolizy
węgla kopalnego. Z wsadu węglowego powstaje 3-4% smoły pogazowej. Obok smoły pogazowej
w produktach
pirolizy
węgla znajduje się gaz (np. gaz koksowniczy) i koks. Gaz koksowniczy po
ochłodzeniu ulega częściowo skropleniu i ta ciekła frakcja nazywa się benzolem surowym.
Znajduje się w niej głównie
benzen
(>70%) i
toluen
(~15%). Smołę pogazową – bogate źródło
arenów – poddaje się destylacji i uzyskuje się frakcje różniące się lotnością. W zależności od ich
lotności w przewadze znajduję się takie substancje, jak:
benzen
,
toluen
,
ksyleny
,
etylobenzen
,
polialkilowane benzeny,
kumen
,
naftalen
,
inden
,
antracen
i wyższe areny oraz pochodne
węglowodorów aromatycznych, np. fenole, aminy aromatyczne,
pirydyna
i inne.
CH
3
CH
3
CH
3
CH
3
CH
3
CH
3
CH
3
CH
2
CH
3
toluen o-ksylen m-ksylen p-ksylen etylobenzen
Areny powstają z węglowodorów alifatycznych (np. z frakcji ropy naftowej) w procesie
reformingu
, polegającym na ogrzewaniu ich w wysokiej temp. w obecności katalizatorów. Z
benzyny lekkiej (frakcji wrzącej w temp. 60-85
o
C) powstaje głównie
benzen
, z frakcji 60-105
o
C
w produktach
reformingu
przeważają
benzen
i
toluen
, a z destylatu 105-140
o
C otrzymuje się
przede wszystkim
ksyleny
i
etylobenzen
. Proces przekształcania alkanów w areny składa się z
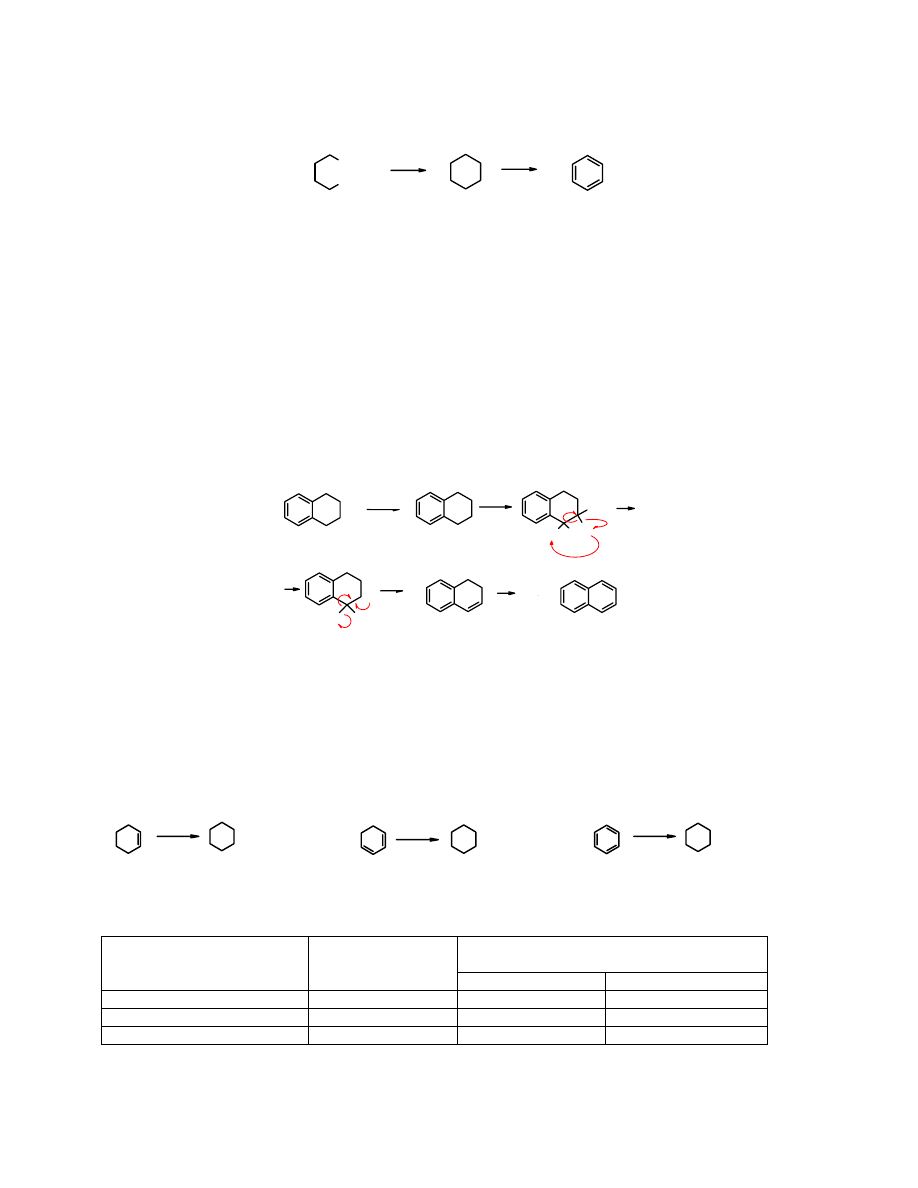
etapów
cyklizacji
i
aromatyzacji
. Najcenniejszym surowcem do otrzymywania arenów są
frakcje zawierające dużo cykloalkanów.
CH
3
CH
3
∆
-H
2
Pt
500
o
C
n-heksan cykloheksan benzen
W przemyśle petrochemicznym areny wytwarza się też z gazu płynnego, czyli
propanu
i
butanów w procesie dehydrocyklooligomeryzacji, zwanej
procesem Cyclar
. Jest to
skomplikowany cykl reakcji obejmujących odwodornienie alkanów do alkenów, następnie ich
izomeryzację
,
oligomeryzację
,
cyklizację
i w końcu
aromatyzację
, czyli dalsze
odwodornienie
. W produktach przeważa
toluen
.
Aromatyzację
cykloalkenów można również przeprowadzić za pomocą utleniaczy takich, jak
siarka lub selen, a nawet tlen. W reakcjach układów cyklicznych z S lub Se następuje
eliminacja
odpowiednio H
2
S lub H
2
Se i utworzenie wiązań podwójnych. Im więcej podwójnych wiązań w
pierścieniu, tym łatwiej dochodzi do
aromatyzacji
. Stosunkowo łatwo
aromatyzacji
ulegają
produkty
addycji
Dielsa-Adlera, ponieważ są one cykloalkenami.
Mechanizm reakcji utleniającego odwodornienia:
S HH
H
S
H
H
250
o
C
- H
.
.
S
.
.
- HS
.
S - HS
.
tetralina
naftalen
Do
odwodornienia
cykloalkanów dochodzi również w obecności katalizatorów
heterogenicznych (np. Pt). Jest to odwrócony kierunek uwodornienia.
Uwodornienie arenów
Uwodornienie katalityczne arenów jest możliwe, jednak
zachodzi znacznie trudniej niż
alkenów
i wydziela się mniej energii niż podczas uwodornienia 3 moli alkenu.
H
2
katalizator
2 H
2
katalizator
2 H
2
katalizator
cykloheksen cykloheksan
cykloheksa-1,3-dien cykloheksan
-28,6 kcal/mol
-55,4 kca/mol
-49,8 kcal/mol
benzen cykloheksan
Ciepło uwodornienia Tabela 8.1.
Ciepło uwodornienia
∆H
o
, kcal/mol
Substrat
Produkt
oczekiwane Oznaczone
cykloheksen
cykloheksan
28,6 28,6
cykloheks-1,3-dien
cykloheksan
57,2 55,4
benzen
cykloheksan
85,8 49,8

Z porównania obliczonej (oczekiwanej) wartości ciepła uwodornienia (trzykrotnie więcej niż
wynosi
∆H
o
uwodornienia cykloheksenu), a oznaczonej wartości wynika, że energia
potencjalna
benzenu
jest o 36 kcal/mol niższa niż hipotetycznego, niearomatycznego
cykloheksa-1,3,5-trienu
.
Benzenu
nie zalicza się do alkenów (polienów). Tego typu układy nazwano związkami
aromatycznymi, w skrócie arenami. Charakterystycznymi właściwościami
benzenu
i innych
związków aromatycznych są:
•
cykliczna budowa;
•
planarność i wysoka symetria cząsteczki, np. sześciobok foremny o bokach
(długościach wiązań) równych 1,39 Å i kątach 120
o
;
•
układ 3 sprzężonych podwójnych wiązań;
•
wysoka stabilność cząsteczki (niska energia potencjalna);
•
brak aktywności w reakcjach addycji eletrofilowej (typowej dla alkenów);
•
podatność na substytucję elektrofilową.
Te właściwości zostały uznane za cechy związków aromatycznych
.
Wymagania dotyczące struktury elektronowej i geometrii związków aromatycznych zawiera
reguła Hückela:
Do związków aromatycznych zalicza się płaskie związki pierścieniowe, które zawierają
elektrony
π w liczbie określonej wzorem 4n + 2, gdzie n jest liczbą naturalną = 0, 1, 2, 3,
4,.....
Innymi słowy związkami aromatycznymi są te płaskie związki pierścieniowe, w których znajduje
się 2, 6, 10, 14, 18 .... sprzężonych elektronów
π.
Erich Hückel (1896-1980), ur. w Stuttgardzie, doktorat u Debye’a w Getyndze, prof. fizyki w Stuttgardzie i
Marburgu.
Cząsteczkę
benzenu
można przedstawić za pomocą dwóch wzorów różniących się położeniem
elektronów
π.
Przedstawiają one tę samą cząsteczkę
, są równocenne i tylko oba razem opisują
właściwości tej cząsteczki:
mezomeryczne wzory cząsteczki
benzenu
Zjawisko polegające na tym, że tę samą cząsteczkę można opisać za pomocą dwóch lub więcej
wzorów, różniących się jedynie położeniem elektronów
π lub wolnych elektronów nazywa się
mezomerią
(
rezonansem
) i jest charakterystyczne dla związków aromatycznych (nie tylko).
Wzór
benzenu
jako
cykloheksylo-1,3,5-trienu
zaproponował w 1864 r. twórca teorii budowy
związków organicznych - A. Kekulé. Początkowo koncepcja Kekulégo nie została powszechnie
zaakceptowana, ponieważ wzór trienu nie tłumaczył
aromatycznych właściwości
benzenu
.
Pojawiły się różne inne propozycje, ale żadna z nich również nie wyjaśniała właściwości
aromatycznych takiego związku. Dużo czasu upłynęło zanim zaczęto rysować wzory
benzenu
w
postaci sześcioboku foremnego, z trzema podwójnymi wiązaniami rozmieszczonymi
symetrycznie (czyli prawie zgodnie z propozycją Kekulégo) i wprowadzono pojęcie mezomerii.
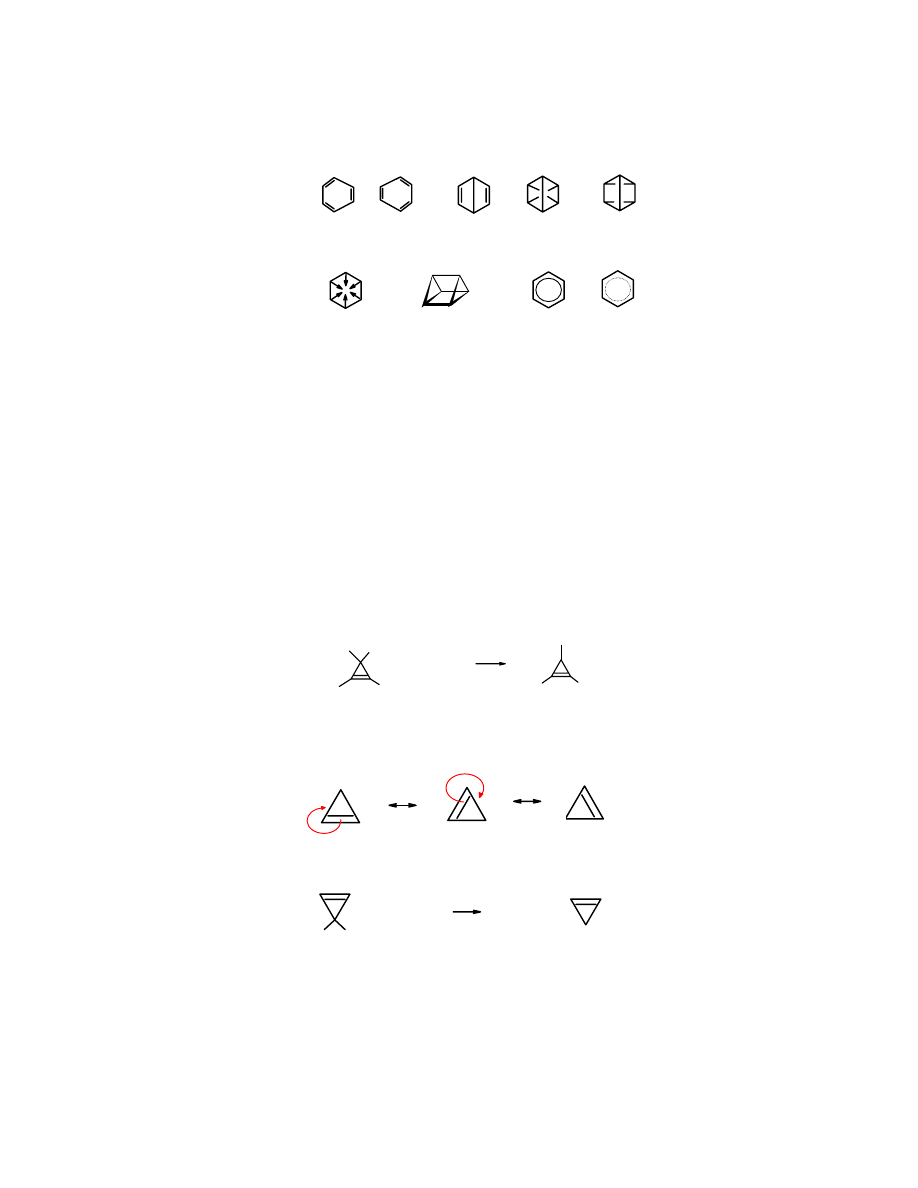
Poniżej przedstawione są różne sposoby rysowania wzoru
benzenu
zaproponowane przez
Kekulégo, Ladenburga, Dewara, Clausa, Baeyera i z kółeczkiem w środku, obrazującym
sprzężone elektrony
π.
Kekulégo
Dewara
Clausa
Baeyera Ladenburga z pierścieniem
elektronów
π
Możliwość zapisania cząsteczki za pomocą dwóch lub więcej wzorów mezomerycznych
sugeruje niższą energię potencjalną danej cząsteczki. Niższą, niż można sądzić obserwując
pojedynczy wzór. Pojedynczy wzór
benzenu
sugeruje, że jest on dienem sprzężonym, dwa wzory
mezomeryczne świadczą o jego
aromatycznym charakterze
.
Czasami cząsteczkę
benzenu
przedstawia się za pomocą innych pojedynczych wzorów, ale one
też nie oddają aromatycznego charakteru związku:
Z reguły Hückela wynika, że związek aromatyczny nie musi mieć kształtu sześcioczłonowego
pierścienia. Istotnie znane są związki aromatyczne zbudowane z pierścieni o innych rozmiarach
niż homologi
benzenu
.
Może to być związek trójczłonowy, np. pochodna kationu cyklopropyliowego:
Cl
Cl
Cl
Cl
Cl
Cl
Cl
+ SbCl
5
+
- SbCl
6
-
1,2,3,3-tetrachlorocyklopropen jon 1,2,3-trichlorocyklopropyliowy
(2 e)
Kation cyklopropyliowy jest płaski i spełnia regułę Hückela odnośnie liczby elektronów
π w
pierścieniu. Można dla niego rozpisać wzory mezomeryczne:
+
+
+
Wzory mezomeryczne kationu cyklopropyliowego
Kation cyklopropyliowy powstaje z
3-chlorocyklopropanu
pod wpływem działania SbCl
5
:
H
Cl
+ SbCl
5
+
SbCl
6
-
.
3-chlorocyklopropen heksachloroantymonian cyklopropyliowy
Cyklobuta-1,3-dien
jest płaski, jednak ma 4 elektrony
π, a więc nie spełnia reguły Hückela.
Nie
ma właściwości aromatycznych
– jest bardzo reaktywny, nawet w temperaturze -78
o
C,
zachowuje się jak sprzężony dien, tzn. reaguje zgodnie z reakcją Dielsa-Adlera, tworząc
tricykliczny
oktadien
:
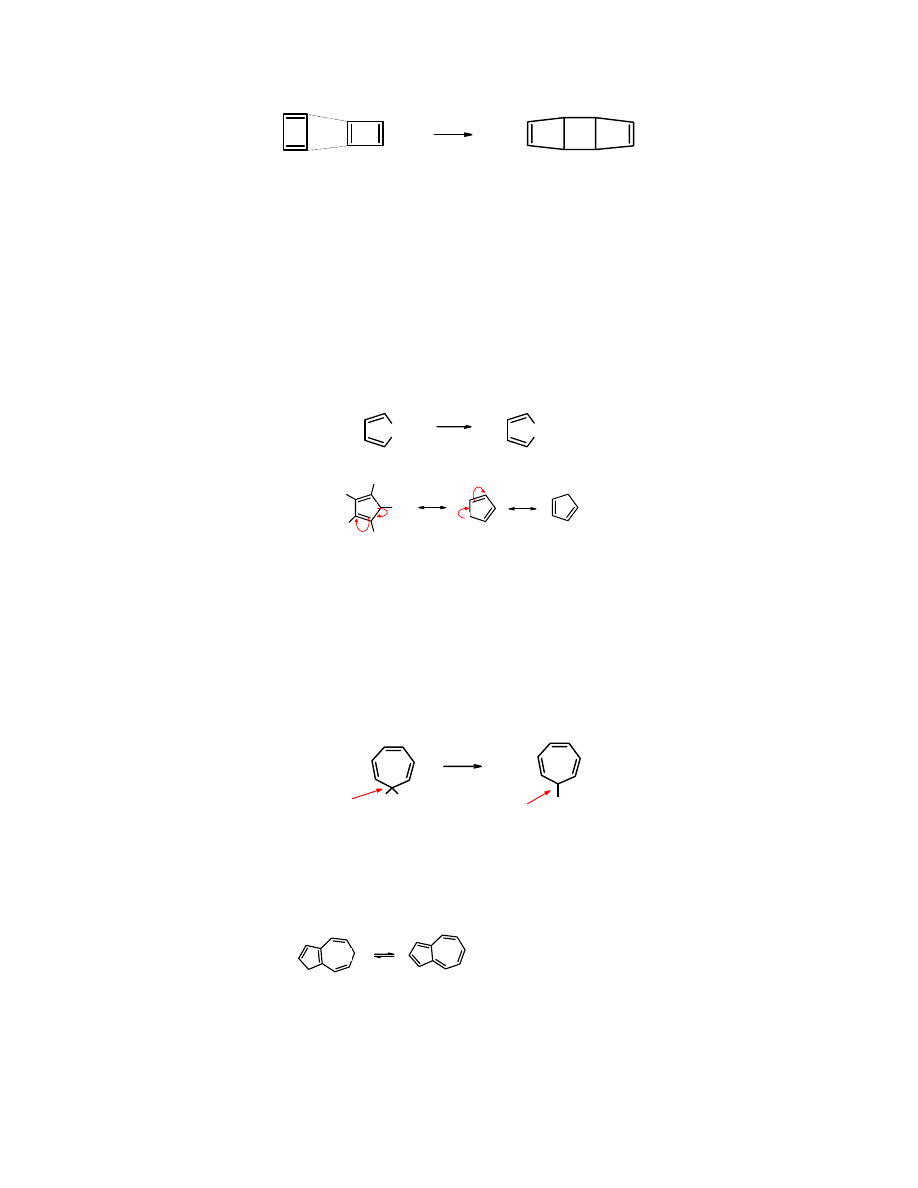
+
-78
o
C
reakcja
Dielsa-Adlera
cyklobuta-1,3-dien tricyklo[2,0,2,0]okta-2,6-dien
Niektórzy autorzy
cyklobuta-1,3-dien
nazywają
związkiem antyaromatycznym
.
Cyklopenta-1,3-dien
jest prawie płaski, ale liczba sprzężonych elektronów w pierścieniu nie
spełnia reguły Hückela – są 4e, zamiast 2 lub 6. Wystarczy jednak
cyklopenta-1,3-dien
przekształcić w anion, a zyska on cechy aromatyczności. Z anionową parą elektronów osiąga
wymaganą liczba 6 sprzężonych elektronów (4
π + 2), których orbitale mogą się wzajemnie na
siebie nakładać. Z tego powodu allilowe atomy wodoru w
cyklopenta-1,3-dienie
są wyjątkowo
kwaśne – jak na atomy H związane z atomem węgla – stosunkowo łatwo można je oderwać.
Tego typu związki nazywane są
C-kwasami
.
CH
2
CH
-
OH
:
- H
+
-
Cyklopenta-1,3-dien
po oderwaniu protonu staje się układem aromatycznym
H
H
H
H
H
:
:
..
Wzory mezomeryczne anionu cyklopentadienowego
Kolejny węglowodór pod względem wielkości pierścienia –
benzen
, jak już zostało powiedziane
spełnia regułę Hückela.
Był on pierwszym poznanym związkiem aromatycznym; on i jego
homologi bez zastrzeżeń spełniają regułę Hückela.
Cyklohepta-1,3,5-trien
ma, co prawda liczbę elektronów wymaganą przez regułę Hückela (6e),
ale jego pierścień nie jest płaski. Wystarczy jednak przekształcić go w kation, zwany kationem
cykloheptatrienylowym lub tropyliowym, żeby cząsteczka stała się płaska, a tym samym układ
zyskał właściwości aromatyczne. Karbokation ma hybrydyzację sp
2
, wobec czego jest płaski.
H H
H
Br
2
- HBr
+
sp
2
sp
3
Zadanie: Narysuj wzory mezomeryczne kationu cykloheptatrienylowgo.
Azulen
zbudowany z dwóch pierścieni – cyklopentadienylowego i cykloheptatrienylowego – jest
węglowodorem aromatycznym, ponieważ w rzeczywistości skondensowane są pierścienie
anionu
cyklopentadienylowego i
kationu
cykloheptatrienylowego:
niebieski
moment dipolowy
µ = 1,0 D
-
+
azulen
↑
Rozdzielone ładunki
wpływają na wzrost wartości momentu dipolowego cząsteczki
azulenu
.
Bardziej znany izomer azulenu –
naftalen
– jest bezbarwny, a jego moment dipolowy jest równy
0, ponieważ oba skondensowane sześcioczłonowe pierścienie w
naftalenie
, podobnie jak w
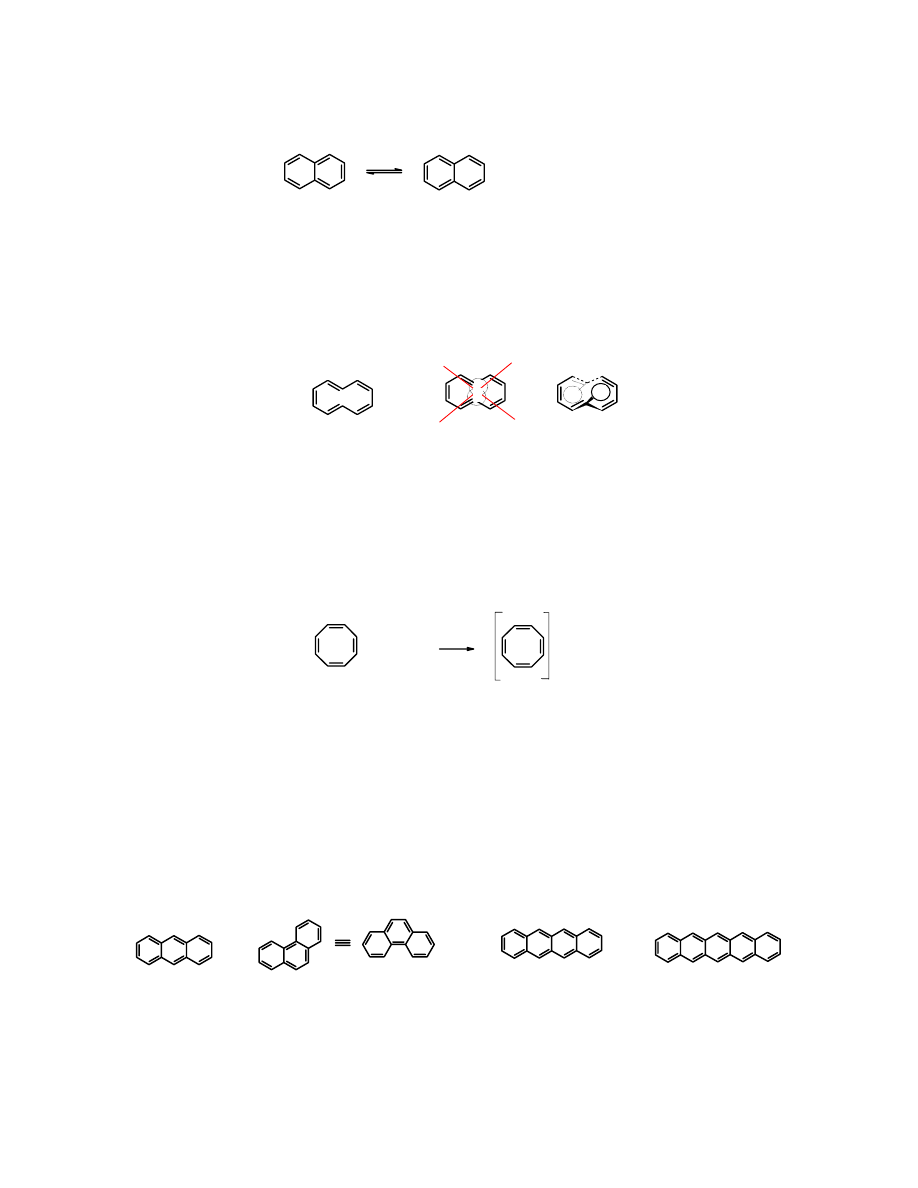
benzenie
są aromatyczne z „natury” i cząsteczka nie ulega żadnym przemianom, żeby osiągnąć
aromatyczność.
bezbarwny
moment dipolowy
µ = 0
naftalen
Cyklodeka-1,3,5,7,9-pentaen
(zwany inaczej
10-anulem
), chociaż bardzo zbliżony budową do
naftalenu
, co widać, kiedy jest przedstawiony za pomocą wzoru, jak na rysunku,
nie jest
węglowodorem aromatycznym
, chociaż spełnia regułę Hückela (10e). Jednak wbrew pozorom
jego cząsteczka nie jest płaska, ponieważ atomy wodoru w położeniach 2 i 7 nie mają
wystarczająco dużo miejsca, żeby ułożyć się obok siebie; zajmują one położenie „nad” i „pod”
pierścieniem, przez co odchylają atomy C2 i C7, zaburzając planarność cząsteczki:
1 2 3
4
5
6
8
9
10
H
H
H
7
2
2
7
7
H
cyklodeka-1,3,5,7,9-pentaen
Wzajemne odpychanie się atomów wodoru przy C2 i C7 powoduje, że cząsteczka
cyklodeka-
1,3,5,7,9-pentaenu
nie jest płaska.
Zadanie: Określ geometrię wiązań podwójnych w cząsteczce
cyklodeka-1,3,5,7,9-pentaenu
Cząsteczka
cyklookta-1,3,5,7-tetraenu
, jest płaska (wszystkie atomy C mają hybrydyzację sp
2
),
ale związek staje się aromatycznym dopiero po zyskaniu dwóch elektronów:
+ 2 Na
2e
2 Na
2
-
+
aromatyczny dianion cyklooktatetraenylowy
Cyklookta-1,3,5,7-tetraen
łatwo reaguje z metalami alkalicznymi w wyniku, czego powstaje
dianion cyklooktatetraenylowy wykazujący właściwości aromatyczne. Obniżenie energii układu
poprzez przekształcenie się w związek aromatyczny jest przyczyną dużej kwasowości dwóch
atomów wodoru
cyklooktatetraenu
– kolejny przykład
C-kwasu
.
Cyklookta-1,3,5,7-tetraen
, podobnie jak
cyklobuta-1,3-dien
nazywany jest
związkiem
antyaromatycznym
.
Znanych jest wiele węglowodorów aromatycznych, w których strukturach można wyróżnić
skondensowane pierścienie benzenowe:
antracen fenantren tetracen pentacen
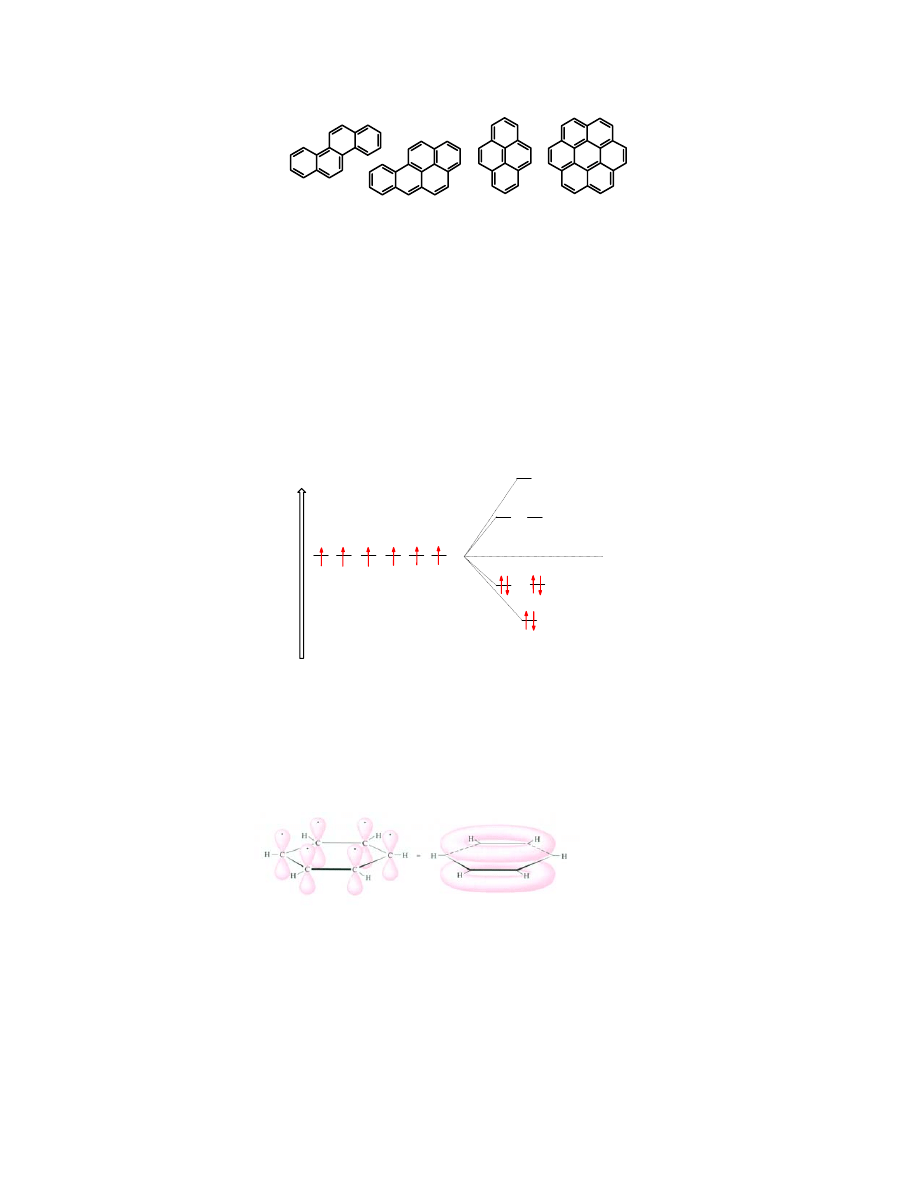
chryzen benzo[a]piren piren koroner
Benzo[a]piren
należy do najsilniejszych, znanych związków rakotwórczych.
Znane są wyjątki od reguły Hückla. Należy do nich
piren
, który zawiera 16 elektronów
π (8
wiązań
C=C), czyli nie spełnia tej reguły. Jednak jego właściwości chemiczne i nawet fizyczne
wskazują na to, że należy on do rodziny węglowodorów aromatycznych.
Struktura elektronowa benzenu
Wszystkie atomy węgla w cząsteczce benzenu mają hybrydyzację sp
2
. Trzy elektrony orbitali sp
2
atomów C
benzenu
tworzą wiązania
σ: jedno z atomem wodoru, dwa z sąsiednimi atomami
węgla. Sześć orbitali atomowych p, sześciu atomów węgla tworzących cząsteczkę
benzenu
nakłada się tworząc sześć orbitali cząsteczkowych: trzy wiążące i trzy antywiążące:
ψ
1
ψ
2
ψ
3
ψ
4
ψ
5
ψ
6
,
*
*
*
,
orbitale wiążące
orbitale antywiążące
energia
Rys.8.1 Sześć orbital atomowych p 6 atomów węgla w cząsteczce nakłada się i powstaje orbitali cząsteczkowych
ψ
Z doświadczenia wiadomo, że orbitale cząsteczkowe
benzenu
ψ
1
,
ψ
2
i
ψ
3
są równocenne, należy
więc przyjąć, że dochodzi do dalszego ich wzajemnego nałożenia i uśrednienia ich energii. W
takim przypadku mówimy o orbitalach zdegenerowanych (o tej samej energii). Orbital wiążący
powstały po nałożeniu się orbitali
ψ
1
,
ψ
2
i
ψ
3
ma kształt dwóch obwarzanek zajmujących pozycje
symetryczne nad i pod płaszczyzną pierścienia cząsteczki
benzenu
:
Rys.8.2 Zdelokalizowane orbitale
π
benzenu
,
wg J. McMurry, Chemia Organiczna, PWN, Warszawa 2000
Struktura elektronowa naftalenu
W
naftalenie
10 atomowych orbitali p nakłada się tworząc 5 cząsteczkowych orbitali wiążących i
5 antywiążących.
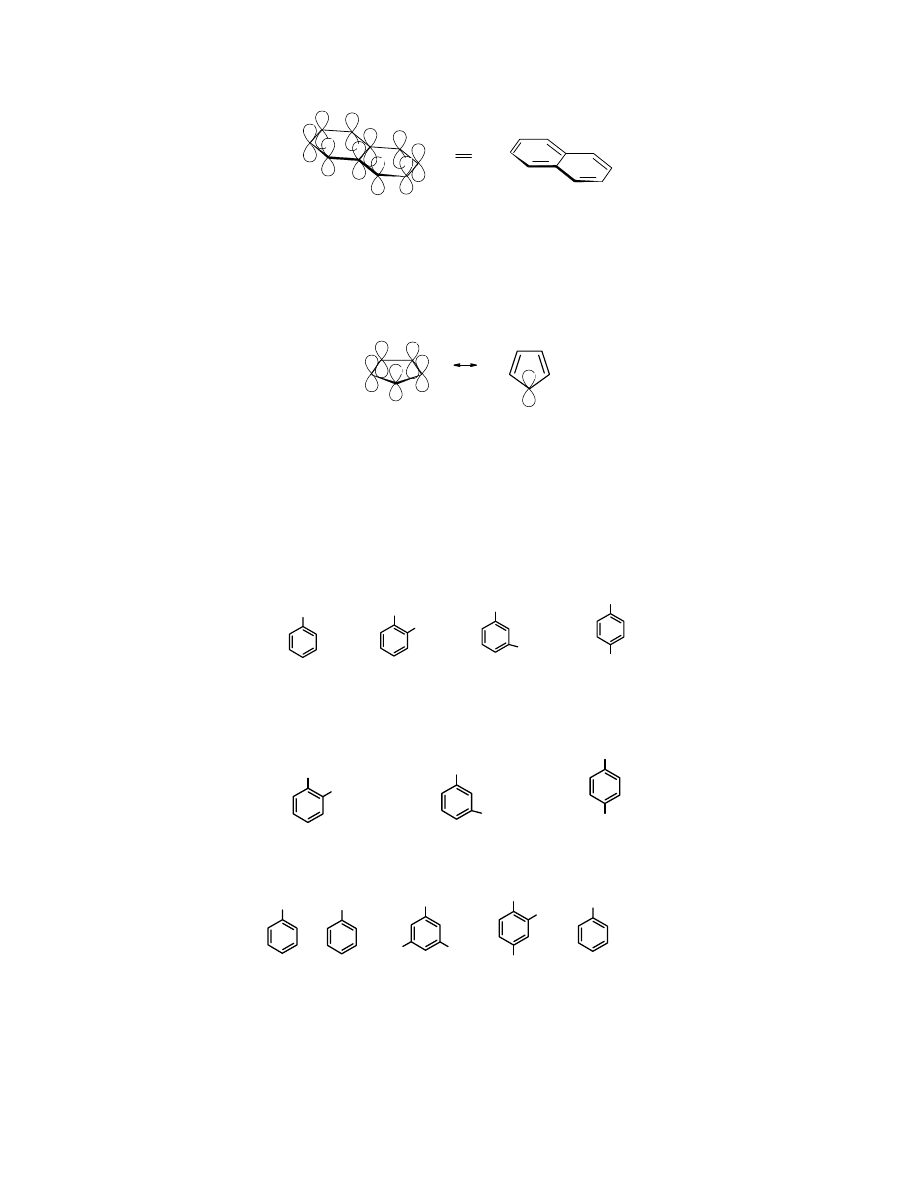
.
.
.
.
.
.
.
.
.
.
Dla zachowania przejrzystości detali ważnych dla omawianego problemu, w powyższych
wzorach nie uwzględniono 6 atomów H związanych po jednym z każdym atomem C.
Struktura elektronowa anionu cyklopentadienowego
W anionie cyklopentadienowym nakładają się na siebie cztery orbitale atomowe p zawierające
po 1 elektronie i jeden orbital p anionowego atomu węgla zawierający 2 elektrony:
..
.
.
.
.
..
Należy pamiętać jeszcze o atomach wodoru przy każdym z atomów C.
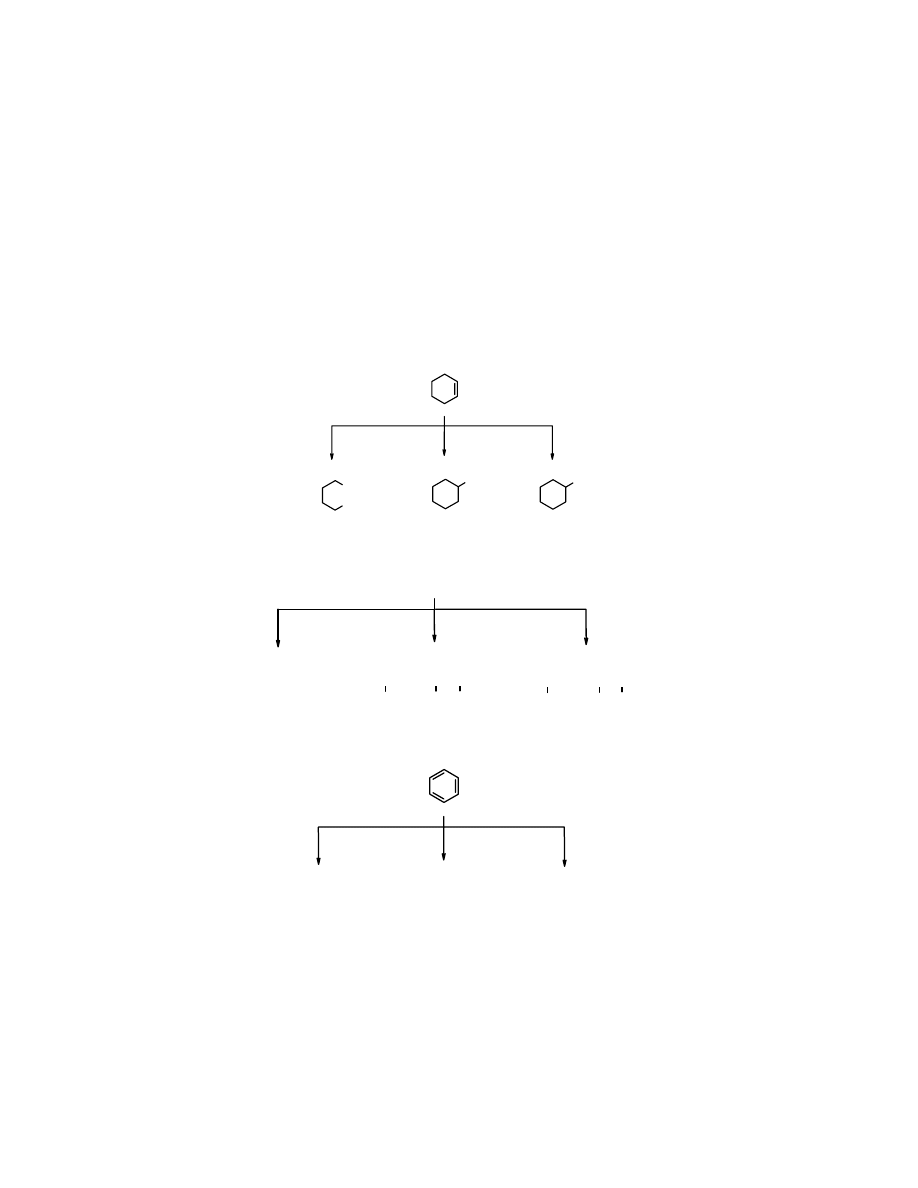
Nazewnictwo pochodnych benzenu
Nazwy pochodnych benzenu tworzy się poprzez dodanie w przedrostku nazwy podstawnika,
poprzedzonej lokantem, jeżeli z pierścieniem związanych jest więcej niż jeden podstawnik. Wiele
popularnych pochodnych benzenu ma nazwy zwyczajowe. Często wzajemne położenie dwóch
(nie więcej) podstawników w pierścieniu określa się za pomocą pisanych kursywą przedrostków
orto- (1,2), meta- (1,3) i para 1,4).
CH
3
CH
3
CH
3
CH
3
CH
3
CH
3
CH
3
toluen orto-ksylen meta-ksylen para-ksylen
(
metylobenzen
)
(
1,2-dimetylobenzen
)
(
1,3-dimetylobenzen
)
(
1,4-dimelobenzen
)
Zamiast pełnych nazw przedrostków stosuje się również skróty o-, m- i p-:
CH
3
Cl
CH
3
Cl
CH
3
Cl
o-chlorotoluen m-chlorotoluen p-chlorotoluen
Często używane nazwy zwyczajowe:
OH
NH
2
CH(CH
3
)
2
CH
3
CH
3
C
H
3
CH
3
CH
3
CH
3
fenol anilina mezytylen pseudokumen kumen
Reszta
benzenu
po usunięciu atomu wodoru nosi nazwę fenylu. Fenyl jako przedrostek służy do
tworzenia nazw w sposobie podstawnikowym:

C
H
3
CH
2
-CH-CH
3
OH
1-fenylo-4-metylocykloheksan 1-fenylopropan-2-ol
Właściwości fizyczne:
Benzen
,
toluen
i niektóre inne alkilobenzeny są cieczami o aromatycznym zapachu, stąd
pochodzi nazwa tej grupy związków.
Benzen
wrze w temperaturze 80
o
C, a
toluen
111
o
C.
Benzen
ze względu na swoją symetryczna budowę, a więc łatwość do tworzenia struktur
uporządkowanych ma stosunkowo wysoką tt., wynoszącą 5,5
o
C, podczas gdy tt.
toluenu
jest
znacznie niższa – -95
o
C.
Naftalen
jest ciałem stałym, tt. = 80
o
C. Węglowodory aromatyczne są
trudno rozpuszczalne w wodzie.
Benzen
należy do jednych z najbardziej niebezpiecznych popularnych związków organicznych, z
uwagi na swoje właściwości toksyczne, kancerogenne i teratogenne.
Właściwości chemiczne węglowodorów aromatycznych zostaną omówione później.
Document Outline
- W Ę G L O W O D O R Y A R O M A T Y C Z N E - ARENY
- BENZEN
- Baeyera Ladenburga z pierścieniem
- Struktura elektronowa naftalenu
Wyszukiwarka
Podobne podstrony:
benzen lecture
Toksycznosc benzenu i jego pochodnych, Rat med rok 2, Toksykologia
zwroty czeskie, CoNieCo
Benzen do chrom (HPLC)
kl 2, kartkowka-benzen, Benzen - C6H6 Wzór Elektronowy - 6¬¬C KL 1H K Węglowodory Aromatyc
Karta BENZEN[1]
chlorowanie benzenu
kostka H, CoNieCo
0007 Benzen
chemia organiczna benzen, chemia liceum
zwroty czeskie2, CoNieCo
Benzen Pochsolv
ściąga z chemi z BENZENU (1), Chemia
Benzen HPLC
alkilowanie benzenu etylenem 4
coniecosciaga, EIT, Ruchoma
więcej podobnych podstron