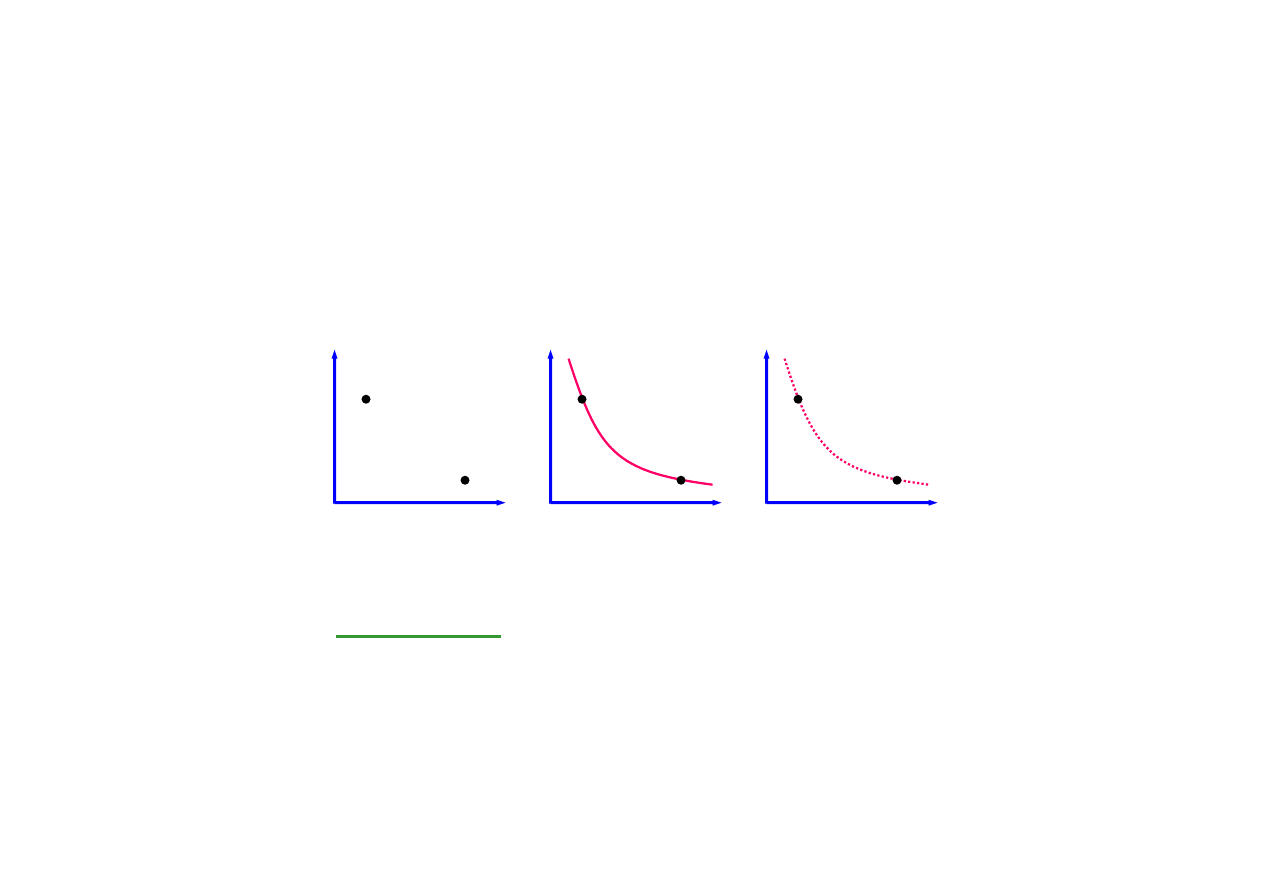
II
ga
zasada termodynamiki
y
procesy odwracalne i nieodwracalne
p
1
p
1
p
1
2
V
2
V
2
V
odwracalny: nieskończenie mała zmiana
t ó
ż
d
ó ić
parametrów może odwrócić proces
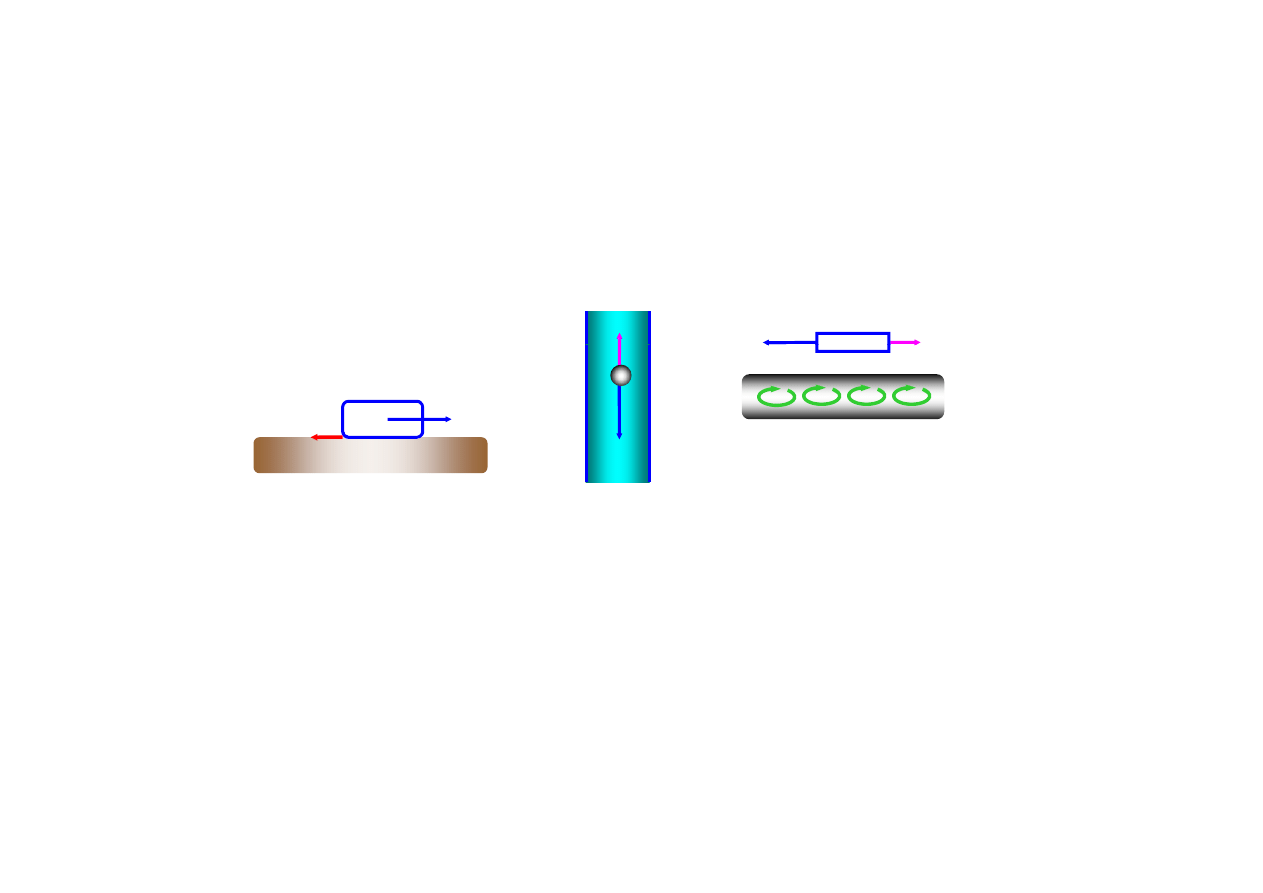
procesy nieodwracalne
p
y
siła
N
S
siła tarcia
siła
lepkości
N
S
prądy wirowe w metalu
prądy wirowe w metalu
żaden proces rzeczywisty
nie może być w pełni odwracalny
nie może być w pełni odwracalny
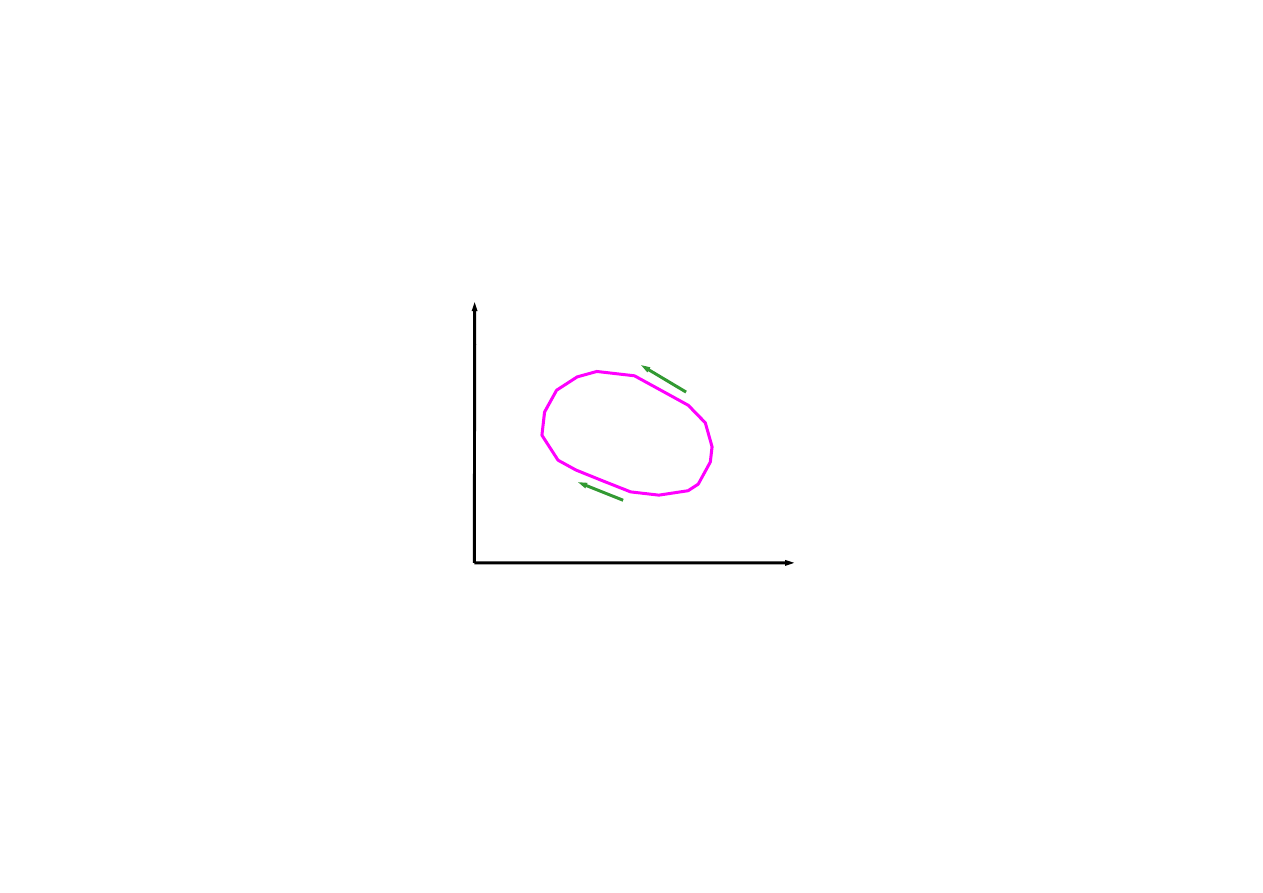
cykl termodynamiczny
y
y
y
p
chłodziarka
chłodziarka
maszyna cieplna
V
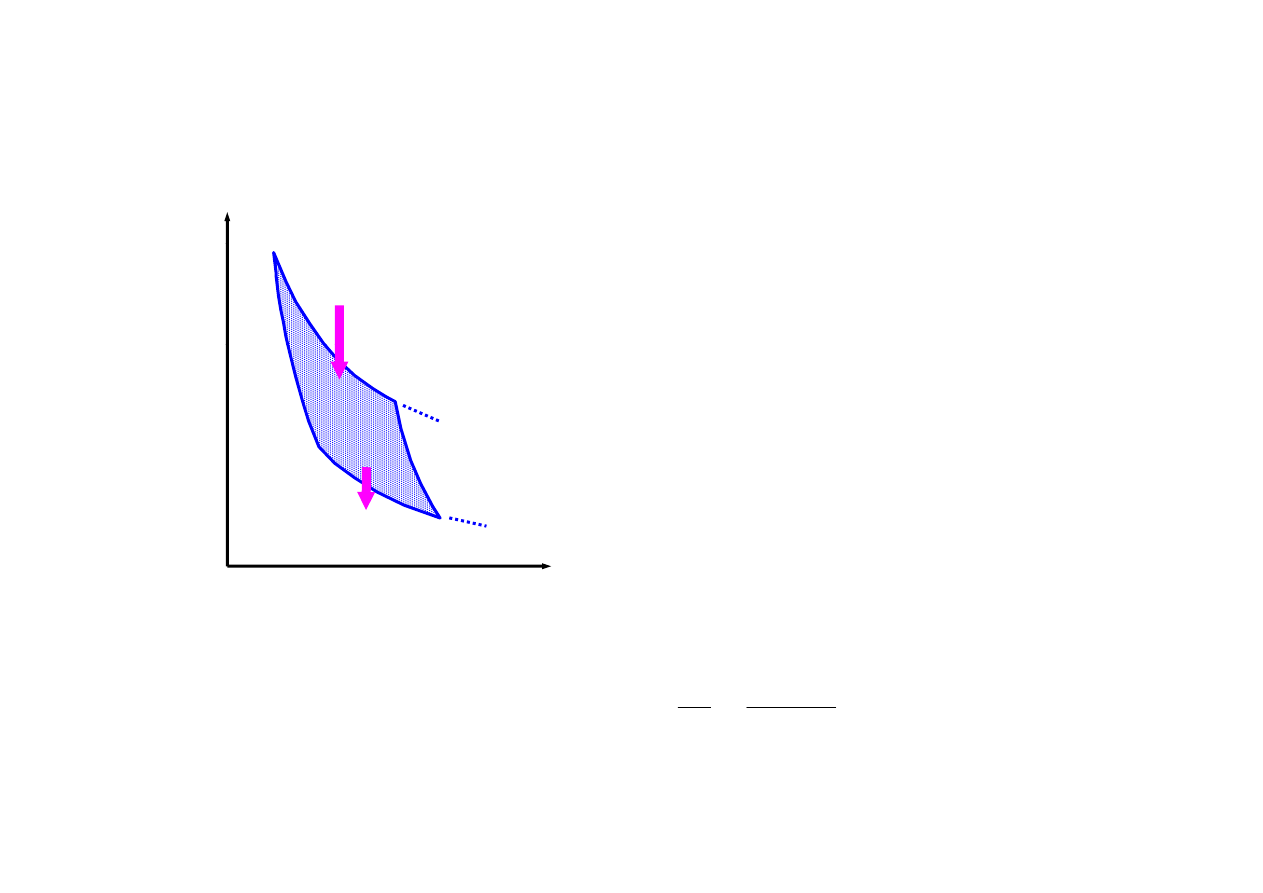
cykl Carnota
y
p
1
p
1
Q
W
U
W
Q
→
→
→
→
3
,
2
2
,
1
3
2
2
1
T
2
U
W
Q
W
→
→
→
→
∗
1
,
4
4
,
3
1
4
4
3
Q
∗
T
∗
3
4
∗
−
−
+
=
Q
Q
W
W
W
W
W
W
W
1
,
4
4
,
3
3
,
2
2
,
1
V
3
∗
−
=
−
=
Q
Q
W
W
4
,
3
2
,
1
Q
Q
Q
Q
W
def
∗
−
=
=
η
sprawność:

sprawność
p
Q
Q
W
def
∗
−
ść
1
ln
−
′
∗
T
T
V
RT
Q
d
k
ł
Q
Q
Q
Q
=
=
η
sprawność:
1
ln
<
=
→
=
T
V
RT
Q
C
η
ν
gaz doskonały:
przykładowo:
p
T
%
25
K
400
=
⎬
⎫
=
η
T
przykładowo:
T
ma
x
d
l
i
kl
(
d C
)
%
25
K
300
=
⎭
⎬
=
∗
η
T
T
min
dowolny inny cykl:
η ≤ η
C
(zasada Carnota)
nieodwracalny cykl Carnota:
η´
C
≤ η
C
V
T
min
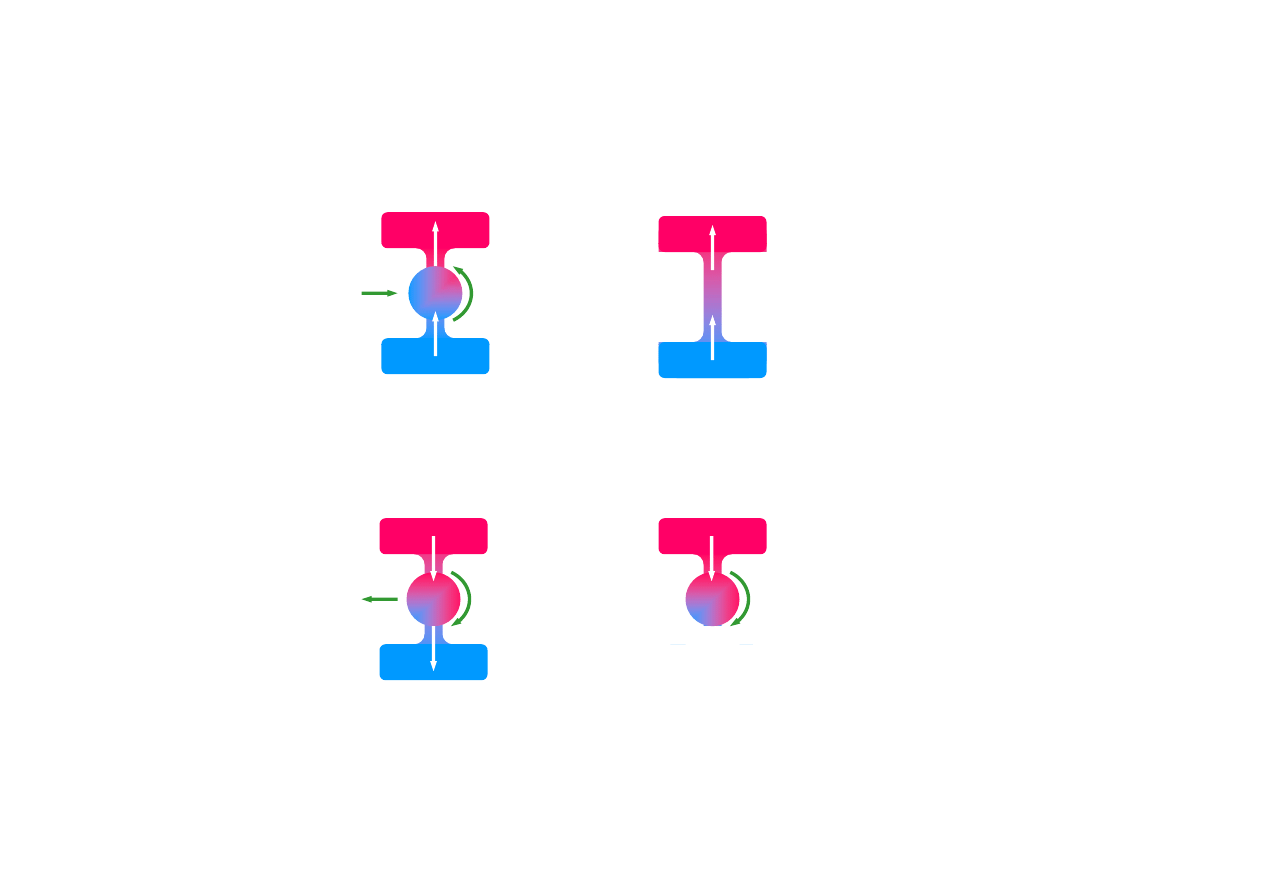
II zasada termodynamiki
y
T
1
> T
2
Q
1
Q
1
T
1
Clausius 1850
1
Q
1
= Q
2
W = Q
1
- Q
2
1
T
niemożliwy jest proces, którego jedynym rezultatem jest
Q
2
Q
2
T
2
przekazanie ciepła od ciała zimniejszego do cieplejszego
Q
1
Q
1
T
1
1
W = Q
1
- Q
2
1
W = Q
1
Kelvin 1851
Q
2
niemożliwy jest proces, którego jedynym rezultatem
j t
i
i
ł
ó
ż
T
2
jest zamiana ciepła na równoważną mu pracę
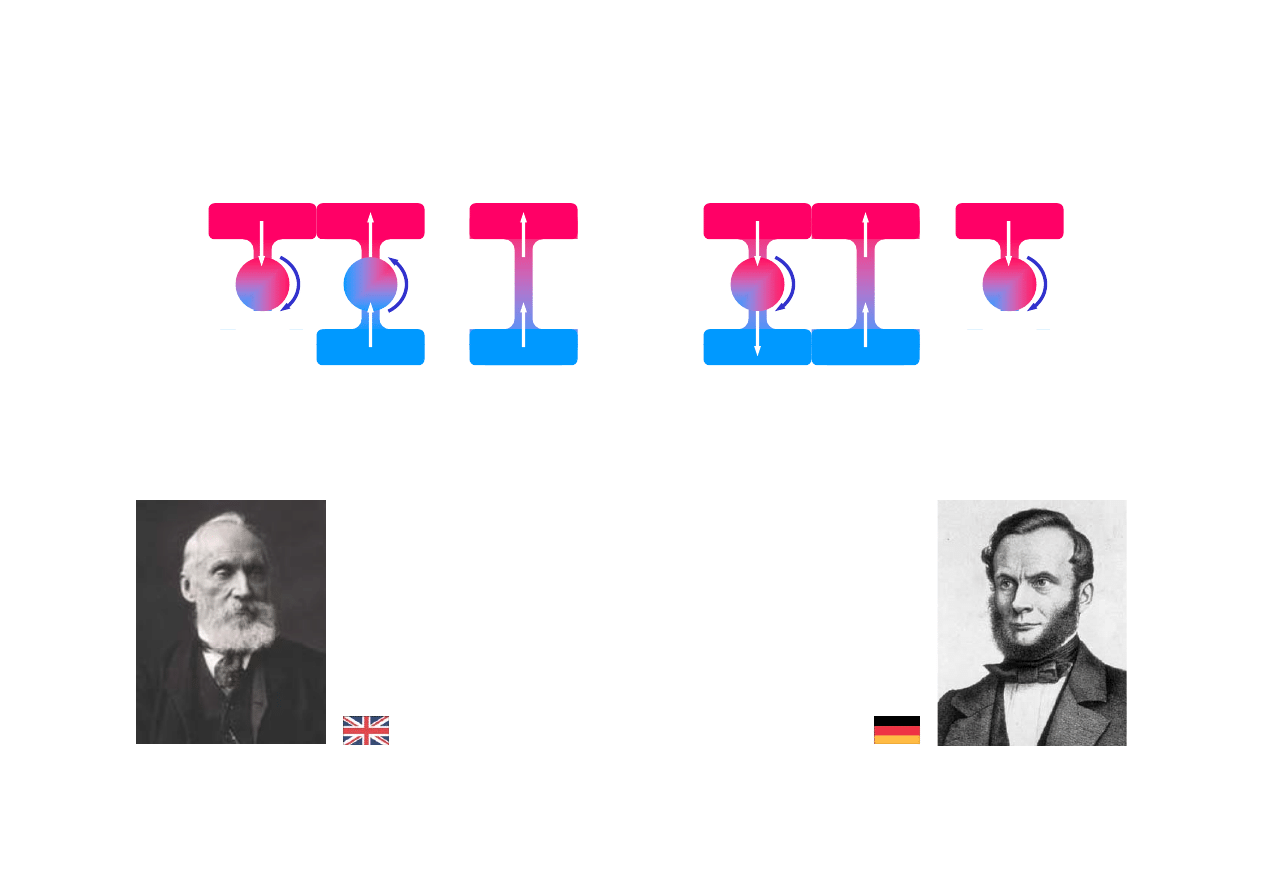
cd.
Q
1
Q
1
Q
1
Q
1
Q
1
Q
1
Q
Q
Q
⇒
⇒
Q
...również zasada Carnota jest równoważna
Q
2
Q
2
Q
2
Q
2
j
lord Kelvin, William Thomson
(1824 - 1907)
Rudolf Emanuel Clausius
(1822 - 1888), ur. w Koszalinie
entropia
p
funkcja stanu związana z I:
energia wewnętrzna U
funkcja stanu związana z II:
entropia S
1
2
1
g.d.
1
2
1
T
T
T
Q
Q
Q
−
=
−
0
2
2
1
1
=
+
T
Q
T
Q
T
Q
0
=
∫
T
Q
δ
- ciepło zredukowane
ogólniej:
stąd:
dS
T
Q =
δ
różniczka zupełna
∫
=
−
=
Δ
2
1
1
2
T
Q
S
S
S
δ

ilościowe ujęcie II zasady
termodynamiki
termodynamiki
η
η
<
∗
0
2
2
1
1
>
+
T
Q
T
Q
w procesie nieodwracalnym ( )
0
>
∫
T
Q
δ
ogólniej w procesach nieodwracalnych:
każdemu procesowi nieodwracalnemu towarzyszy wzrost entropii
0
=
ΔS
tylko w procesie odwracalnym i adiabatycznym

np.
p
zmiana entropii przy przepływie (nieodwracalnym) ciepła
od ciała cieplejszego (T
1
) do ciała zimniejszego (T
2
)
1
0
2
T
T
T
←
→
2
2
1
0
T
T
T
+
=
1
0
2
2
0
0
1
ln
0
0
T
T
C
T
dT
C
T
Q
S
T
T
=
=
=
Δ
∫
∫
δ
0
2
1
1
ln
0
0
1
1
T
T
C
T
dT
C
T
Q
S
T
T
T
T
T
T
T
=
=
=
Δ
∫
∫
∫
∫
δ
2
2
2
T
T
T
T
T
∫
∫
ln
ln
0
0
2
1
⎟⎟
⎠
⎞
⎜⎜
⎝
⎛
+
=
Δ
+
Δ
=
Δ
T
T
T
T
C
S
S
S
(
)
0
4
ln
ln
2
1
2
2
1
2
1
2
0
2
1
>
+
=
=
⎠
⎝
T
T
T
T
C
T
T
T
C
T
T
1
2
1
2
1
>
43
42
1

x
izotermiczne rozprężanie (neodwracalne) gazu
izotermiczne rozprężanie (neodwracalne) gazu
V
1
V
V
2
0
ln
ln
1
2
2
2
>
=
⎟⎟
⎠
⎞
⎜⎜
⎝
⎛
=
Δ
=
=
Δ
∫
V
V
R
V
V
RT
T
T
Q
T
Q
S
ν
ν
δ
1
1
1
⎟
⎠
⎜
⎝
∫
V
V
T
T
T

przykład
p y
obliczyć przyrost entropii gazu doskonałego
pdV
dT
C
Q
V
+
=
δ
RT
pV
ν
=
obliczyć przyrost entropii gazu doskonałego
p
V
p
V
T
V
RdV
T
dT
C
T
pdV
T
dT
C
T
Q
S
V
V
+
=
+
=
=
Δ
∫
∫
∫
∫
∫
ν
δ
0
0
0
0
ln
ln
ln
ln
ln
ln
S
V
C
p
C
S
V
R
T
C
V
V
R
T
T
C
p
V
V
V
′
+
+
=
+
+
=
+
=
ν
ν
p
entropia S jest zdefiniowana z dokładnością do stałej
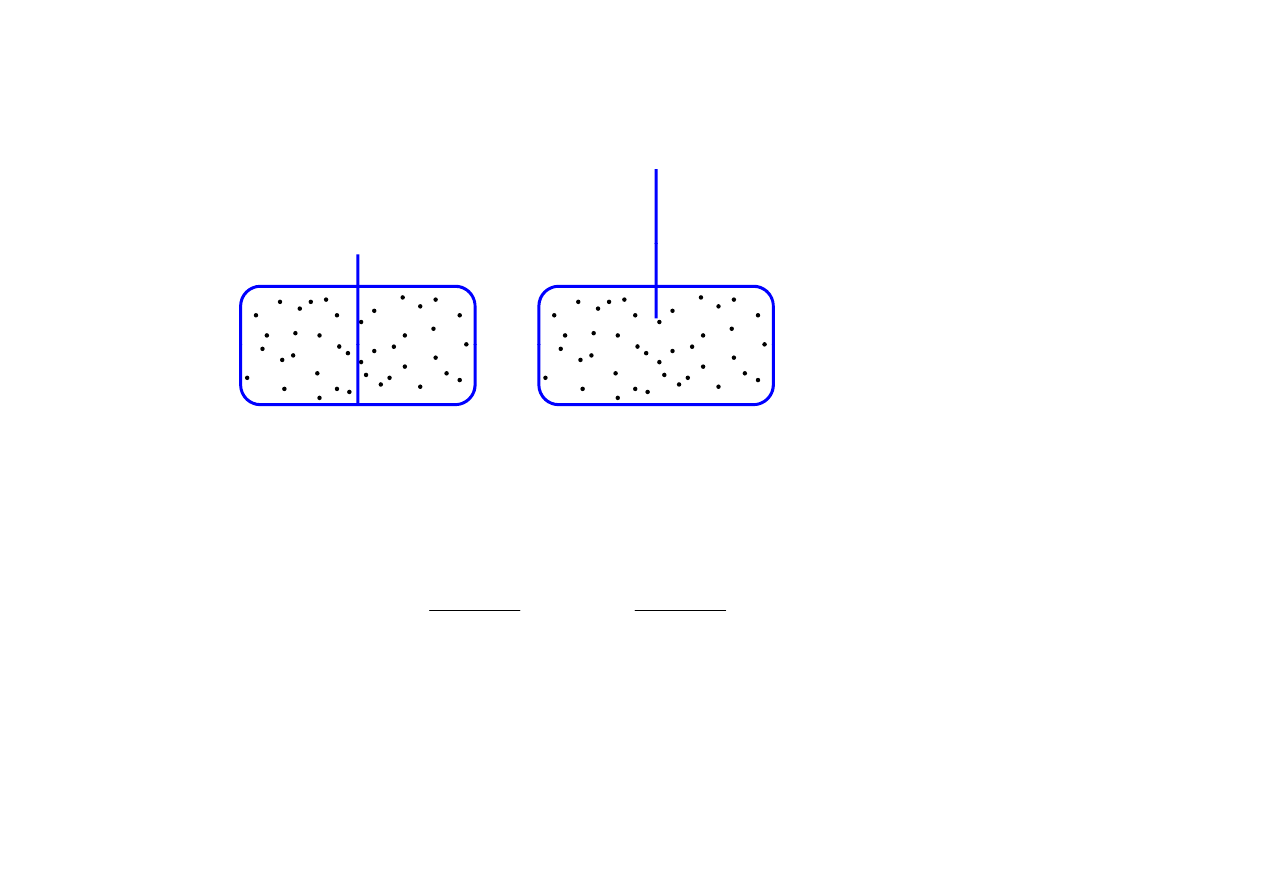
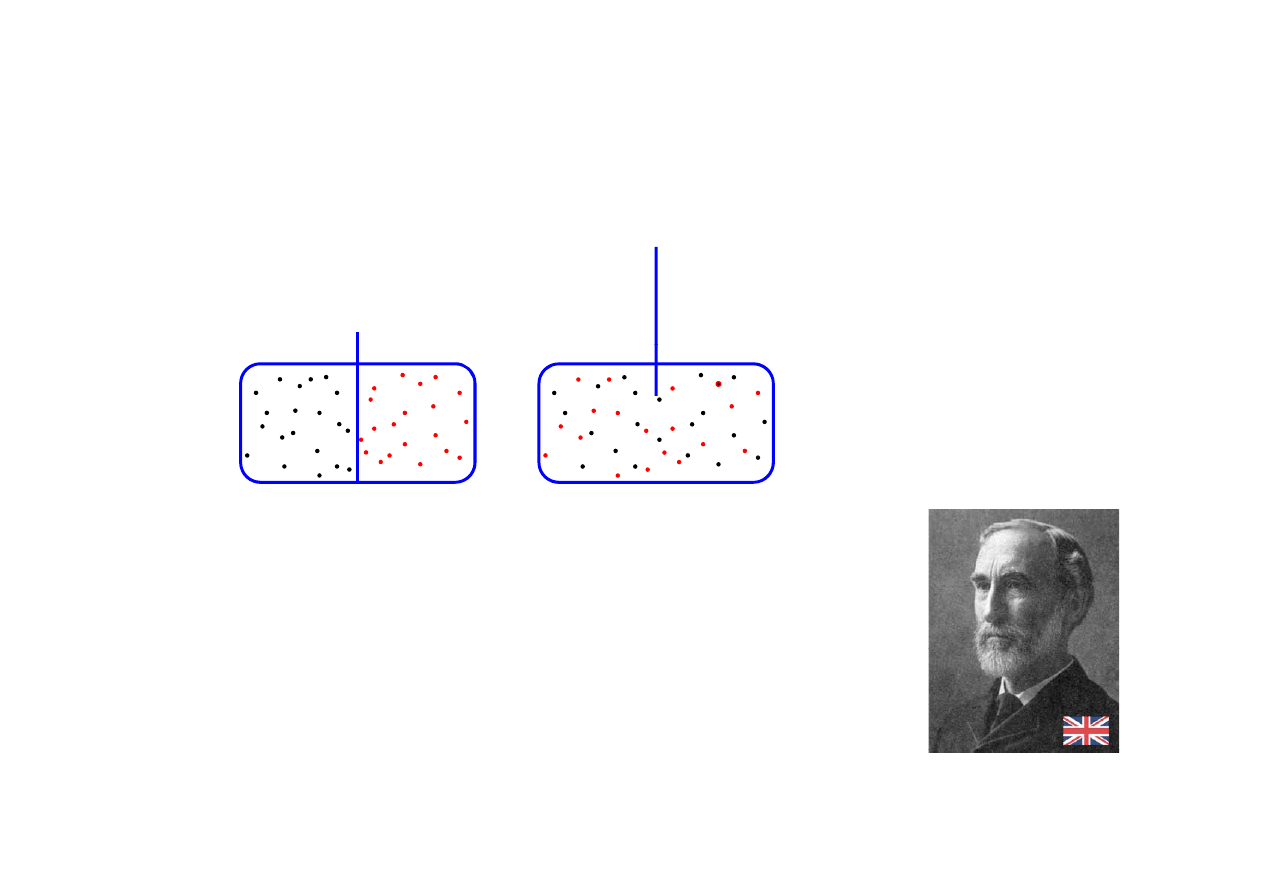
paradoks Gibbsa
p
identyczny gaz z lewej i z prawej
2
2
1
2
1
2
1
1
ln
ln
V
V
V
R
V
V
V
R
S
+
+
+
=
Δ
ν
ν
izotermicznie
2
1
0
2
ln
2
2
1
>
=
Δ
⎭
⎬
⎫
=
=
R
S
V
V
V
ν
ν
ν
ν
!?
2
1
⎭
=
=
V
V
V
x
Josiah Willard Gibbs (1839 - 1903)

III zasada termodynamiki
y
entropia układu w temperaturze zera bezwzględnego równa się zero
( )
0
lim
0
=
→
T
S
T
( )
0
lim
0
=
→
T
C
T
T
dT
( )
∫
=
T
T
dT
T
C
S
0
i
ż
i
ć t
t
T
0
≡ nie można osiągnąć temperatury T = 0 w
skończonej liczbie kroków (W.Nernst - 1905)
zweryfikowano eksperymentalnie…
Walther Hermann Nernst (1864 - 1941)
1920
tk P lk
1920, matka Polka

ver-01
Wyszukiwarka
Podobne podstrony:
3 termo g1 id 606404 Nieznany (2)
G2 PB 02 B Rys 3 11 id 185401 Nieznany
G2 PB 02 B Rys 3 22 id 185421 Nieznany
G2 PB 02 B Rys 3 07 id 185395 Nieznany
G2 PB 02 B Rys 3 13 id 185405 Nieznany
G2 PB 02 B Rys 3 24 id 185425 Nieznany
G2 PB 02 B Rys 3 10 id 185399 Nieznany
G2 PB 02 B Rys 3 06 id 185393 Nieznany
G2 PB 02 B Rys 3 23 id 185423 Nieznany
G2 PB 02 B Rys 3 05 id 185391 Nieznany
G2 PB 02 B Rys 3 14 id 185407 Nieznany
G2 PB 02 B Rys 3 20 id 185417 Nieznany
G2 PB 02 B Rys 3 08 id 185397 Nieznany
G2 PB 02 B Rys 3 12 id 185403 Nieznany
G2 PB 02 B Rys 3 17 id 185413 Nieznany
G2 PB 02 B Rys 3 15 id 185409 Nieznany
G2 PB 02 B Rys 3 11 id 185401 Nieznany
G2 PB 02 B Rys 3 22 id 185421 Nieznany
Abolicja podatkowa id 50334 Nieznany (2)
więcej podobnych podstron