termodynamika
termodynamika
termodynamika fenomenologiczna
y
g
własności termiczne ciał makroskopowych
uogólnienie licznych badań doświadczalnych
układ termodynamiczny
wielkości termodynamiczne
(parametry) np : T V p
opis makro i mikro
rezygnacja z przyczynowości
znaczenie praktyczne
(parametry) np.: T, V, p
stan układu
równanie stanu
stan stacjonarny
znaczenie praktyczne
p
stan stacjonarny
stan zrównoważony
proces kwazistatyczny
d
l
proces odwracalny
V

temperatura
p
istnieje wielkość skalarna „temperatura” będąca własnością
układu termodynamicznego, która ma jednakową wartość dla
układów w równowadze termodynamicznej
równość temperatur jest warunkiem koniecznym i
wystarczającym równowagi termodynamicznej
relacja przechodnia:
C
A
C
B
B
A
~
~
~
⇒
∧
ilościowe określenie temperatury poprzez własności termometryczne
ilościowe określenie temperatury poprzez własności termometryczne
(objętość cieczy, opór elektryczny, rozmiary liniowe ciał, etc.)
energia wewnętrzna
g
ę
podstawowa funkcja stanu U:
energia kin. i pot. molekuł
energia atomowa, jądrowa itd…
b
i ki
i
t
kł d j k
ł ś i
·
bez energi kin. i pot. układu jako całości
określa stan termodynamiczny układu
istotny do opisu procesów jest przyrost
ΔU
(można przyjąć, że w T =0 również U = 0)
W – praca: sposób przekazu energii (makroskopowy)
Q – ciepło; inny sposób przekazu energii (mikroskopowy)
y
g (
y)
I zasada termodynamiki:
ogólniejsza zasada zachowania energii
{ {
od
do
W
Q
U
−
=
Δ
od
do

cd.
Julius Robert von Mayer (1814 - 1878) D
1842
f
ł
i
1842 – sformułowanie
James Prescott Joule (1818 - 1889) GB
1843 d ś i d
i
1843 - doświadczenie
Hermann Ludwig Ferdinand von Helmholtz (1821 - 1894)
1847 matematyczne
1847 - matematyczne

energia wewnętrzna
g
ę
W
Q
dU
δ
δ
−
=
d - różniczka zupełna, zależy od stanu pocz. i końc.
δ
- przyrost infinitezymalny, zależy od procesu
∫
=
Δ
2
dU
U
δ
przyrost infinitezymalny, zależy od procesu
∫
1
∫
Γ
=
W
W
δ
∫
Γ
=
Q
Q
δ
Γ
δW - praca wykonana przez układ
δQ - ciepło dostarczone do układu

równanie Clapeyrona
p y
równanie stanu gazu doskonałego
RT
pV
ν
=
A
N
N
=
ν
ν
– liczba moli
N
A
– liczba Avogadra
mol
1
10
022
,
6
23
⋅
=
def
A
N
A
R
– stała gazowa
p
– ciśnienie
K
mol
J
31
,
8
=
R
S
F
p
def
=
[ ]
Pa
m
N
2
ozn
p
=
=
paskal
SI
Benoît Pierre Émile Clapeyron (1799 - 1864)
p y
(
)
Amadeo Avogadro di Quaregna (1776 - 1856)
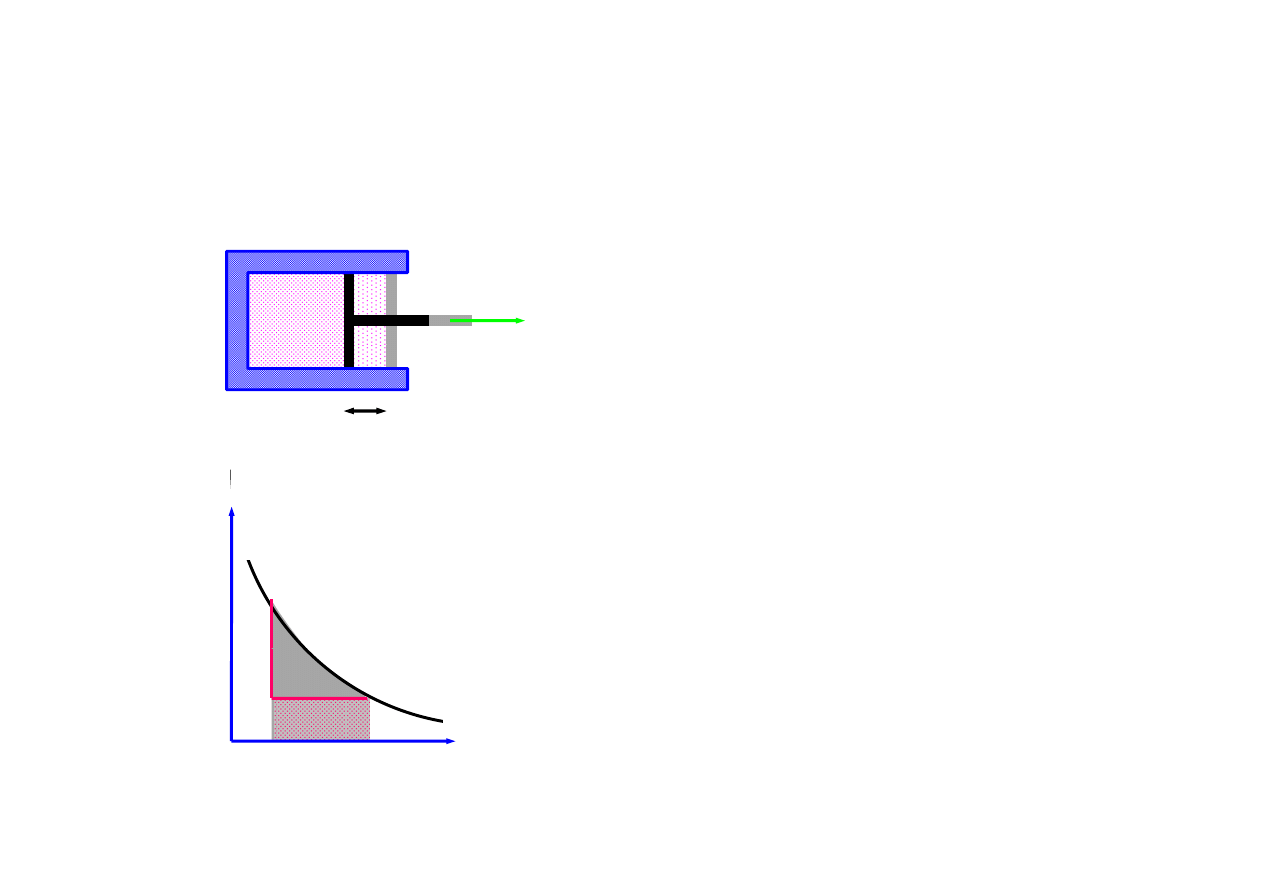
praca
p
F
pdV
pSdl
Fdl
W
=
=
=
δ
pdV
W
=
δ
F
dl
pdV
W
=
δ
( )
∫
2
V
dV
V
p
W
dl
( )
∫
=
1
V
dV
V
p
W
p
2
,
3
,
1
2
,
1
W
W
≠
1
( )
V
p
– funkcja zależna od procesu
,
,
,
2
3
V
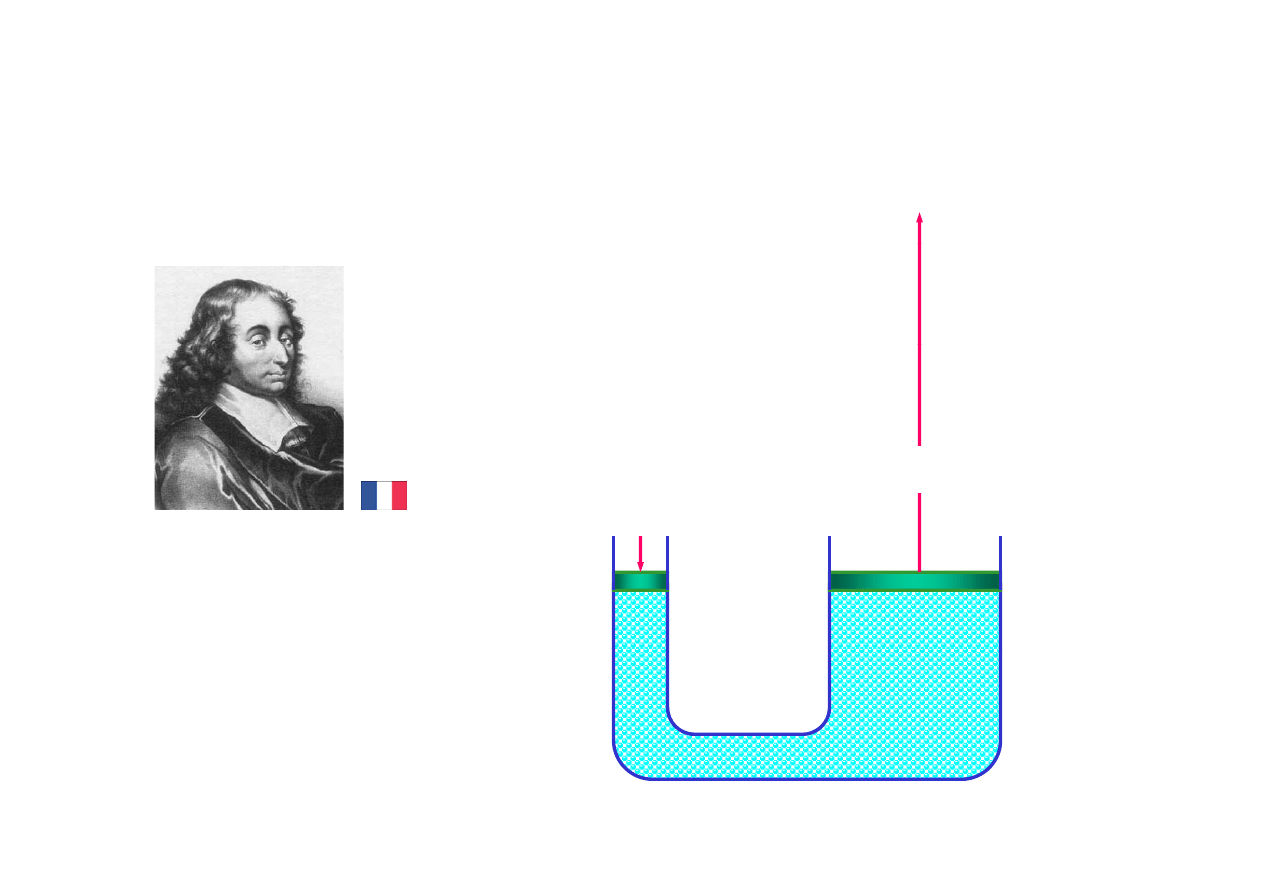
prasa hydrauliczna Pascala
p
y
F
1
F
2
=
(S
2
/S
1
)F
1
Blaise Pascal (1623 1662)
Blaise Pascal (1623 - 1662)

pojemność cieplna
p j
p
Q
δ
zależy od procesu (
δ
Q)
dT
Q
C
def
δ
=
CdT
Q
=
δ
Q
C
δ
ilość ciepła potrzebna do ogrzania o 1 K
proces izochoryczny
const
=
=
V
V
dT
Q
C
δ
Q
C
δ
– proces izochoryczny
i b
const
=
=
p
p
dT
Q
C
pdV
CdT
dU
i
I
d t
d
iki
– proces izobaryczny
pdV
CdT
dU
−
=
Q
def
δ
1
więc I zasada termodynamiki:
dT
Q
m
c
δ
1
=
NB: ciepło właściwe

proces izochoryczny
p
y
y
dU
dT
C
0
W
δ
V
=
const
p
dU
dT
C
V
=
0
=
W
δ
T
T
∫
∫
2
2
p
↑
T
C
dT
C
dU
U
V
T
V
T
Δ
=
=
=
Δ
∫
∫
1
1
prawo Charlesa
↑
ogrzewanie
↓ oziębianie
więc teraz I zasada termodynamiki:
prawo Charlesa
V
V
0
pdV
dT
C
CdT
V
+
=
(w dowolnym procesie)
Jaques Alexandre César Charles (1746 - 1823)

proces izobaryczny
p
y
y
p
p
p
=
const
p
0
dT
C
Q
=
δ
→ ogrzewanie
← oziębianie
dT
C
Q
p
δ
pdV
dT
C
dT
C
+
=
V
pdV
dT
C
dT
C
V
p
+
=
(
)
2
V
V
p
W
W
V
=
=
∫
δ
(
)
1
2
1
V
V
p
W
W
V
−
=
=
∫
δ
prawo Gay - Lussaca
y
L
i J
h G
L
(1778 1850)
Louis Joseph Gay-Lussac (1778 - 1850)

równanie Mayera
y
RT
pV
ν
=
RdT
pdV
ν
=
⇒
p
R
C
C
V
p
ν
=
−
V
p
C
C
>
μ
R
c
c
V
p
=
−
lub:
ν
μ
m
def
=
masa molowa:
(
)
T
R
W
RT
pV
V
V
p
W
p
Δ
=
⎭
⎬
⎫
=
−
=
⇒
=
ν
ν
1
2
const
praca jaką 1 mol gazu wykonuje rozszerzając się
K
mol
J
3
,
8
=
Δ
=
T
W
R
ν
praca jaką 1 mol gazu wykonuje rozszerzając się
izobarycznie przy
Δ
T
=
1 K (interpretacja stałej gazowej R)
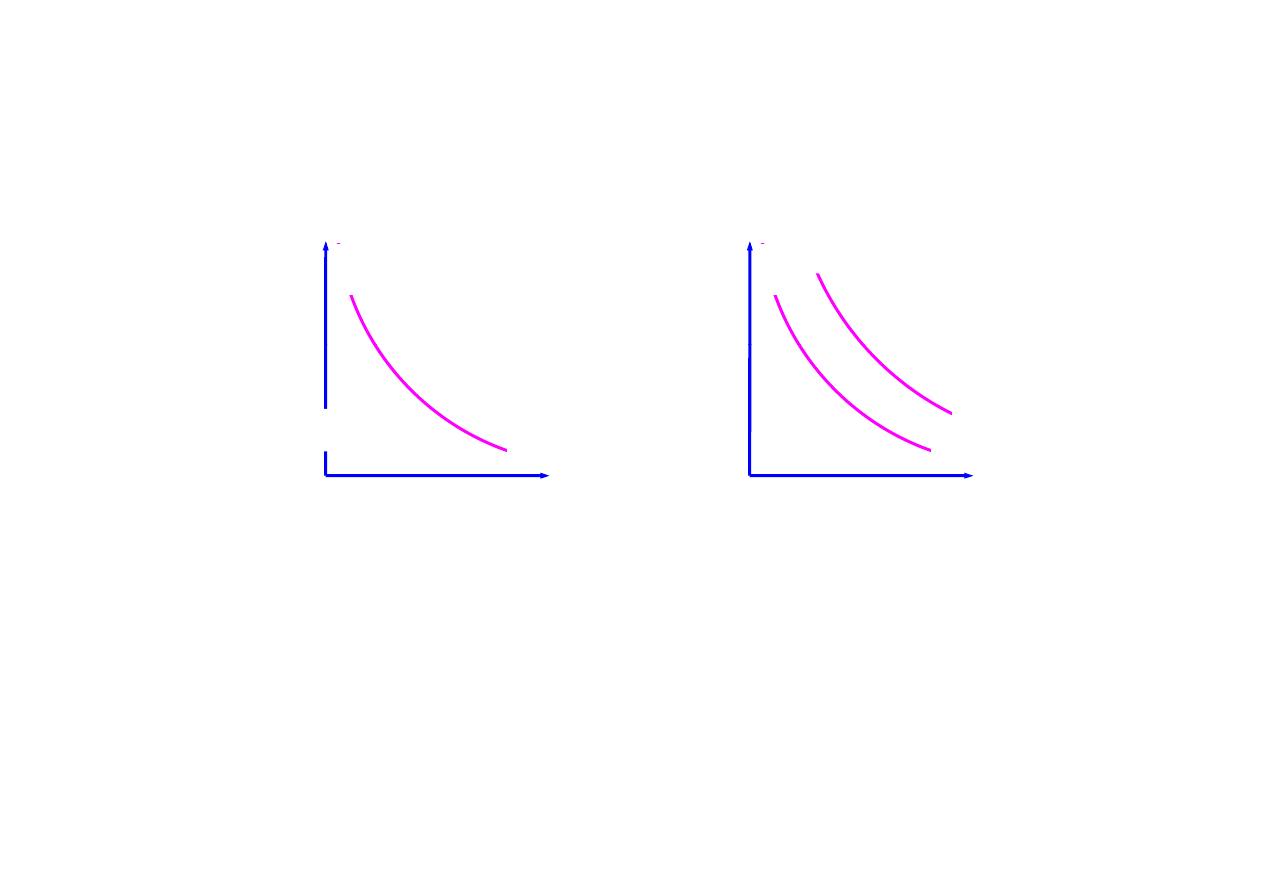
proces izotermiczny
p
y
p
T
2
T
1
< T
2
p
É
oddawanie
ciepła
T
1
pobieranie
Ì
ciepła
ciepła
pV = const
V
V
prawo Boyla–Mariotte’a: w stałej temperaturze (pV = const) podczas
ż
i dl
i
i
t ł j t
t
i b ć d
t
rozprężania dla zapewnienia stałej temperatury musi być dostarczane
ciepło, kosztem którego zostaje wykonana praca bez zmiany energii
wewnętrznej

cd.
const
=
T
const
=
U
dT
C
dU
V
=
W
Q
δ
δ
= W
Q
δ
δ
2
ln
2
2
V
RT
m
dV
RT
m
pdV
Q
V
V
=
=
=
Δ
∫
∫
1
ln
1
1
V
RT
V
RT
pdV
Q
V
V
μ
μ
=
=
=
Δ
∫
∫
V
RT
m
p
μ
=
Robert Boyle (1627 - 1691)
Edmé Mariotte (1620 - 1684)
Edmé Mariotte (1620 1684)

proces adiabatyczny
p
y
y
0
Q
δ
i l j
i
0
=
Q
δ
izolacja termiczna
zmieniają się trzy parametry: p V T
0
=
+ W
dU
δ
zmieniają się trzy parametry: p, V, T
RdT
Vdp
pdV
ν
=
+
0
+ pdV
dT
C
równanie Clapeyrona:
0
=
+ pdV
dT
C
V
R
C
C
V
p
ν
=
−
oraz:
oraz:
V
p
C
C
Vdp
pdV
dT
−
+
=
(
)
0
=
+
+
−
pdV
Vdp
pdV
C
C
C
V
p
V
p

cd.
d f
C
0
=
+ Vdp
pdV
C
C
V
p
V
p
def
C
C
=
κ
współczynnik Poissona
0
=
+
p
dp
V
dV
κ
const
ln
ln
=
+ p
V
κ
const
ln
=
κ
pV
const
=
κ
pV
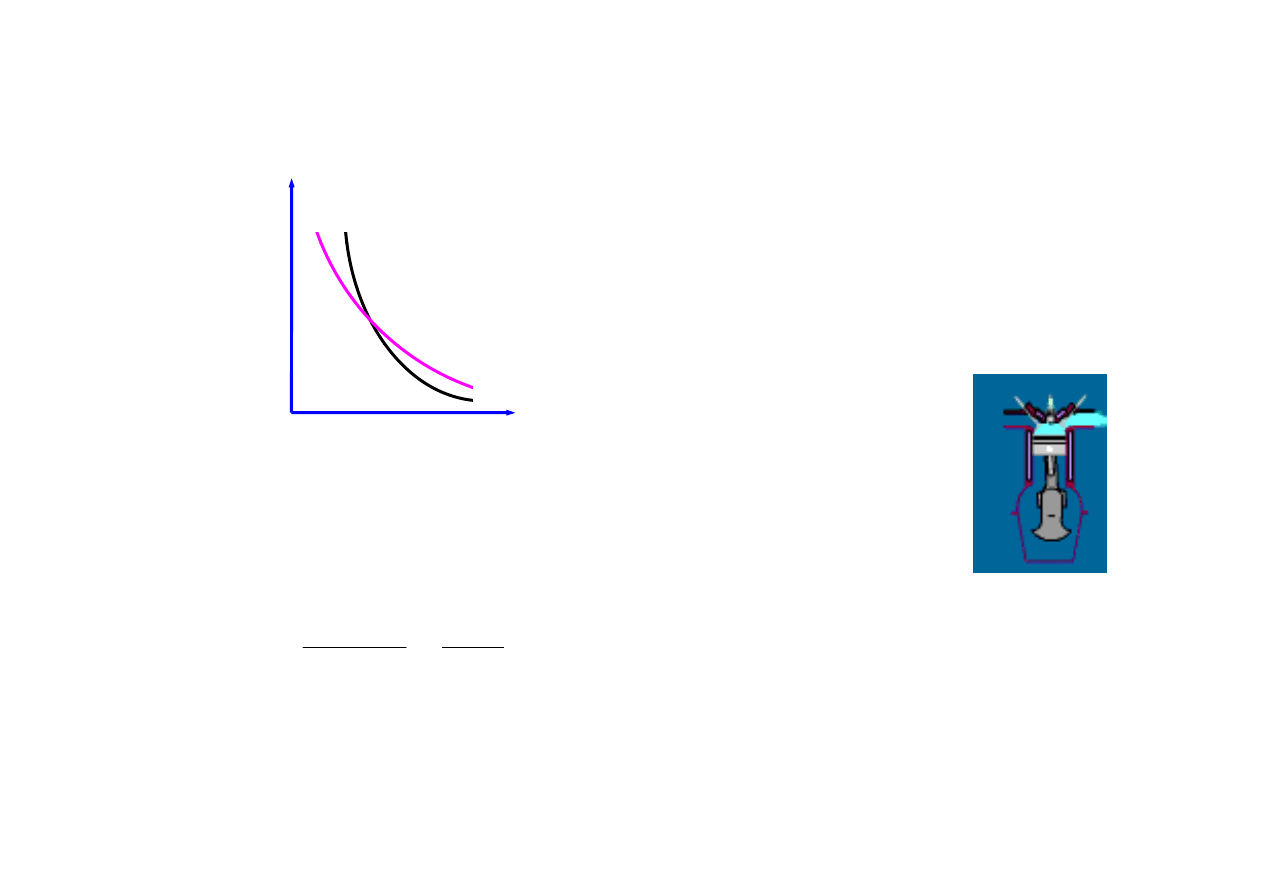
równanie Poissona
p
pV = const
const
=
κ
pV
1
>
κ
V
V
adiabatyczne rozprężanie – gaz ochładza się (CO
2
)
adiabatyczne sprężanie gaz ogrzewa się (Diesel)
temperatura sublimacji: -78,5 °C
=
=
=
pV
pV
C
T
C
U
V
(
)
T
C
C
RT
pV
−
=
=
ν
adiabatyczne sprężanie – gaz ogrzewa się (Diesel)
gdyż:
1
−
=
−
=
=
κ
C
C
T
C
U
V
p
V
(
)
T
C
C
RT
pV
V
p
=
=
ν
gdyż:
Siméon Denis Poisson (1781 - 1840) F
Rudolf Diesel (1858 - 1913) D

proces politropowy
p
p
p
y
const
=
C
⎧
⎧
+ W
dU
Q
δ
δ
⎩
⎨
⎧
=
+
+
=
RdT
Vdp
pdV
pdV
dT
C
CdT
V
ν
⎩
⎨
⎧
=
+
=
RT
pV
W
dU
Q
ν
δ
δ
(
)
(
)
R
pdV
Vdp
pdV
C
C
V
ν
=
+
−
(
)
(
)
0
=
−
+
−
−
Vdp
C
C
pdV
R
C
C
V
V
ν
p
C
(
)
(
)
mpV
Vdp
C
C
pdV
C
C
V
p
1
0
=
−
+
−
(
)
(
)
(
)
(
)
0
=
−
+
−
dp
C
C
dV
C
C
V
(
)
(
)
const
ln
ln
=
−
+
−
p
C
C
V
C
C
V
p
(
)
(
)
0
+
p
C
C
V
C
C
V
p

cd.
– politropa
const
=
n
pV
V
p
C
C
C
C
n
−
−
=
1
−
−
=
n
C
nC
C
p
V
n
C
izobaryczna
0
C
p
izotermiczna
1
∞
izotermiczna
1
∞
adiabatyczna
κ
0
izochoryczna
∞ C
V
y
V

ver-01
Wyszukiwarka
Podobne podstrony:
3 termo g2 id 606405 Nieznany (2)
G1 PW D Czesc opisowa 1 id 1853 Nieznany
Abolicja podatkowa id 50334 Nieznany (2)
4 LIDER MENEDZER id 37733 Nieznany (2)
katechezy MB id 233498 Nieznany
metro sciaga id 296943 Nieznany
perf id 354744 Nieznany
interbase id 92028 Nieznany
Mbaku id 289860 Nieznany
Probiotyki antybiotyki id 66316 Nieznany
miedziowanie cz 2 id 113259 Nieznany
LTC1729 id 273494 Nieznany
D11B7AOver0400 id 130434 Nieznany
analiza ryzyka bio id 61320 Nieznany
pedagogika ogolna id 353595 Nieznany
Misc3 id 302777 Nieznany
cw med 5 id 122239 Nieznany
więcej podobnych podstron