
LABORATORIUM Z CHEMII ORGANICZNEJ
INSTRUKCJA DO ĆWICZEŃ
Miejsce ćwiczeń: Laboratoria Katedry Chemii Organicznej,
Bioorganicznej i Biotechnologii,
budynek N1 („Nowa Chemia”)
ul. Krzywoustego 4, I piętro
Opracowali: Andrzej Rajca i Andrzej Skibiński
Opracowali:
Rafał Jędrysiak, Andrzej Rajca i Andrzej Skibiński
Politechnika Śląska
Wydział Chemiczny
KATEDRA CHEMII ORGANICZNEJ
BIORGANICZNEJ I BIOTECHNOLOGII
Laboratorium z Chemii Organicznej
Semestr V
kierunek: technologia chemiczna

2
Spis treści
Spis treści ......................................................................................................................................................... 2
1.
Program ćwiczeń laboratoryjnych w semestrze V dla kierunku technologia chemiczna .............................. 3
2.
Przepisy bezpieczeństwa ........................................................................................................................... 4
2.1.
Nakazy i zakazy................................................................................................................................. 4
2.2.
Wypadki w laboratorium ................................................................................................................... 5
2.2.1.
Pożar ......................................................................................................................................... 5
2.2.2.
Urazy chemiczne........................................................................................................................ 6
2.2.3.
Skaleczenia................................................................................................................................ 6
2.2.4.
Stłuczenia termometru i rozlanie rtęci......................................................................................... 6
3.
Przepisy porządkowe ................................................................................................................................ 7
3.1.
Organizacja semestru......................................................................................................................... 7
3.2.
Zeszyty.............................................................................................................................................. 7
3.3.
Materiały pomocnicze........................................................................................................................ 7
3.4.
Odzież............................................................................................................................................... 7
3.5.
Odczynniki w laboratorium................................................................................................................ 8
3.6.
Szafki laboratoryjne........................................................................................................................... 8
3.7.
Odpady.............................................................................................................................................. 9
3.8.
Tok pracy .......................................................................................................................................... 9
3.9.
Dyżury studentów............................................................................................................................ 10
4.
Rozdział mieszaniny dwuskładnikowej metodami chemicznymi.............................................................. 11
5.
Określanie grup rozpuszczalności............................................................................................................ 11
6.
Syntezy preparatów ................................................................................................................................ 12
6.1.
Przygotowanie się do wykonania preparatu ...................................................................................... 12
6.2.
Analiza przepisu i obliczanie proporcji reagentów ............................................................................ 13
6.3.
Tabela obliczeniowa ........................................................................................................................ 15
6.4.
Kolokwium ..................................................................................................................................... 18
6.5.
Wykonanie preparatu....................................................................................................................... 19
6.5.1.
Pobieranie odczynników .......................................................................................................... 19
6.5.2.
Pobieranie dodatkowego szkła laboratoryjnego......................................................................... 19
6.5.3.
Montaż aparatury ..................................................................................................................... 19
6.5.4.
Wykonanie syntezy .................................................................................................................. 20
6.5.5.
Notatki laboratoryjne................................................................................................................ 22
6.5.6.
Obliczanie wydajności ............................................................................................................. 23
6.5.7.
Sporządzanie wykresu Sankey’a............................................................................................... 24
6.5.8.
Zaliczenie preparatu ................................................................................................................. 24
7.
Przygotowanie opracowania literaturowego............................................................................................. 26
7.1.
S
trona tytułowa ............................................................................................................................... 26
7.2.
M
etody otrzymywania .................................................................................................................... 26
7.3.
D
ane fizyczne i spektroskopowe...................................................................................................... 26
7.4.
Z
astosowanie lub/i właściwości chemiczne...................................................................................... 26
7.5.
I
nne informacje ............................................................................................................................... 26
7.6.
W
ybrana metoda otrzymywania i przepis wykonania....................................................................... 26
7.7.
P
rzepis wykonania wraz z zaleceniami bhp i utylizacją odpadów ..................................................... 26
7.8.
N
otatki laboratoryjne....................................................................................................................... 26
7.9.
L
iteratura cytowana......................................................................................................................... 27
8.
Literatura zalecana:................................................................................................................................. 29
9.
Załączniki............................................................................................................................................... 29
9.1.
Załącznik 1. Aktualny program ćwiczeń laboratoryjnych.................................................................. 29
9.2. Załącznik 2.
Międzynarodowe kody zagrożeń i zaleceń bezpieczeństwa (Risk and Safety Phrases) .. 29
9.3. Załącznik 3.
Typowe zestawy laboratoryjne .................................................................................... 29
9.4. Załącznik 4.
Wzór opracowania literaturowego .............................................................................. 29

3
1.
Program ćwiczeń laboratoryjnych w semestrze V dla kierunku
technologia chemiczna
Ramowy program ćwiczeń:
a) Badania rozpuszczalności związków organicznych czyli określenie charakteru
kwasowego i zasadowego składników mieszaniny dwuskładnikowej (określenie grup
rozpuszczalności) oraz rozdział tej mieszaniny metodami fizycznymi lub chemicznymi,
bądź wydzielanie czystego składnika z substancji pochodzenia roślinnego.
b) Synteza prostych preparatów i ich oczyszczenie przez krystalizację, destylację prostą,
destylację z parą wodną, destylację pod zmniejszonym ciśnieniem, bądź metodami
chromatograficznymi.
c) Opracowanie bilansu materiałowego dla jednego z wykonywanych preparatów.
d) Opracowanie literaturowe zagadnień związanych z syntezą i właściwościami wybranej
substancji organicznej.
e) Wyszukanie Karty Bezpieczeństwa dla wskazanego związku chemicznego.
Warunki zaliczenia:
Aby uzyskać zaliczenie z Laboratorium z Chemii Organicznej należy:
a/
rozdzielić
próbkę
mieszaniny
dwuskładnikowej
metodą
chemiczną
z wykorzystaniem ekstrakcji lub destylacji z parą wodną i oznaczyć właściwości
fizyczne jednego ze składników lub wydzielić składnik z substancji pochodzenia
roślinnego lub opcjonalnie dostarczonych przez prowadzącego ćwiczenia
b/
zaliczyć test ze znajomości „grup rozpuszczalności” i zasad rozdziału mieszanin
dwuskładnikowych oraz kartkówki ze znajomości obliczeń chemicznych, wybranych
technik laboratoryjnych,
c
/
zsyntezować preparaty wskazane przez prowadzącego. Syntezę poprzedza
wykonanie odpowiednich obliczeń i zdanie kolokwium ze znajomości prowadzonej
reakcji, jej mechanizmu, przepisu wykonania preparatu, właściwości chemicznych
substratów i produktów oraz podstaw teoretycznych stosowanych metod oczyszczania
takich jak krystalizacja czy destylacja,
d/
sporządzać (na bieżąco w trakcie prowadzenia syntezy) sprawozdania
z wykonanie preparatów w „dzienniku laboratoryjnym”,
e/
sporządzić, dla wskazanego przez prowadzącego jednego z wykonywanych
preparatów, „wykres Sankey’a” z uwzględnieniem w bilansie materiałowym ilości
rozpuszczalników użytych do mycia aparatury,
f/
sporządzić opracowanie literaturowe dotyczące metod otrzymywania oraz
właściwości fizycznych i chemicznych dla substancji organicznej wskazanej przez
prowadzącego,
g/
po zakończeniu ćwiczeń należy uporządkować szafki laboratoryjne, w których nie
można pozostawić żadnego brudnego szkła (szkło laboratoryjne ma być umyte
i wysuszone), preparatów, odczynników, rozpuszczalników i innych rzeczy nie
będących na wyposażeniu szafki, oddać do biblioteki Katedry wypożyczone
skrypty i inne materiały oraz uzupełnić straty w powierzonym sprzęcie i szkle
laboratoryjnym. UWAGA – PUNKT TEN OBOWIĄZUJE TAKŻE STUDENTÓW,
KTÓRZY NIE UZYSKALI ZALICZENIA!

4
Wpis zaliczenia laboratorium:
Studenci po zakończeniu ćwiczeń, uzyskują wpis zaliczenia laboratorium do
karty i indeksu dopiero po uzupełnieniu strat w powierzonym im sprzęcie i szkle
laboratoryjnym.
Po rozliczeniu zawartości szafek laboratoryjnych lista należności dostępna jest
w magazynie podręcznym. Po uzupełnieniu strat każdy student otrzymuje od kierownika
magazynu kwit z odpowiednią adnotacją o rozliczeniu strat. Indeksy wraz z kartami
zaliczeniowymi i kwitami z adnotacjami o rozliczeniu strat oddaje się grupowo
prowadzącemu zajęcia. Podpisane karty i indeksy odbiera się w sekretariacie Katedry.
Szczegółowy program i harmonogram ćwiczeń obowiązujący w danym roku
akademickim wraz z oceną punktową ćwiczeń oraz warunkami zaliczenia podano
w Załączniku 1.
2.
Przepisy bezpieczeństwa
W laboratoriach Katedry Chemii Organicznej, Bioorganicznej i Biotechnologii
w trosce o zdrowie i bezpieczeństwo pracujących tam osób obowiązują następujące
2.1. Nakazy i zakazy
1.
W salach laboratoryjnych mogą przebywać jedynie osoby upoważnione –
studenci odbywający ćwiczenia i pracownicy Katedry.
2.
Osoby przebywające w laboratoriach Katedry zobowiązane są nosić
okulary ochronne. Okularami ochronnymi NIE SĄ okulary korekcyjne.
Zabrania się noszenia szkieł kontaktowych.
3.
Praca w laboratoriach dozwolona jest jedynie w fartuchu laboratoryjnym
(nie z tworzyw sztucznych)
4.
Praca w laboratorium dozwolona jest jedynie, gdy w tym samym lub
sąsiednim laboratorium znajdują się inne osoby, z którymi można
nawiązać kontakt głosowy.
5.
Przed rozpoczęciem jakichkolwiek czynności z substancjami, które mogą
być toksycznymi, drażniącymi, parzącymi, wybuchowymi lub żrącymi
bezwzględnie
należy
zapoznać
się
z
ich
właściwościami
i niebezpieczeństwami grożącymi przy pracy z nimi.
6.
W pomieszczeniach laboratoryjnych obowiązuje zakaz jedzenia, picia.
7.
W pomieszczeniach laboratoryjnych obowiązuje zakaz chodzenia
w butach na wysokich obcasach.
8.
W pomieszczeniach laboratoryjnych obowiązuje zakaz palenia tytoniu.
9.
W trakcie ćwiczeń obowiązuje zakaz korzystania z telefonów
komórkowych.
10.
W trakcie ćwiczeń laboratoryjnych nie jest zalecane noszenie biżuterii.
11.
Odpady nie mogą być wylewane do kanalizacji, a jedynie do odpowiednich
pojemników na odpady. Wyjątkiem są niewielkie objętości wodnych
roztworów naturalnych aminokwasów, cukrów i niektórych prostych soli
(patrz punkt 3.7.).
5
Toksyczne właściwości większości substancji nie są dokładnie znane w związku z tym
praca w laboratorium może być niebezpieczna i szkodliwa dla zdrowia, gdy toksyczne
substancje chemiczne obecne w laboratorium przenikną do organizmu.
Szkodliwe substancje przedostają się do organizmu trzema drogami:
N z powietrzem którym oddychamy,
N poprzez skórę gdy ręce lub inna część skóry zostanie nimi skażona,
N doustnie.
Dlatego należy:
N unikać wdychania par substancji łatwo lotnych i gazów,
N nie dopuścić do zetknięcia cieczy i ciał stałych ze skórą, oczami i ustami,
N nie spożywać w laboratorium żadnych posiłków.
Każda osoba pracująca w laboratorium, zobowiązana jest do utrzymania porządku na
swoim stanowisku pracy i sali laboratoryjnej. Powinna ona także dbać o to, aby butelki
i słoiki z odczynnikami były zawsze zamknięte i prawidłowo oznaczone.
Każda osoba pracująca w laboratorium zobowiązana jest do znajomości:
M
lokalizacji i obsługi środków ochrony przeciwpożarowej (gaśnic, koca
gaśniczego, prysznica, włącznika instalacji alarmowej),
M
dróg ewakuacji oraz lokalizacji i obsługi stanowiska do przemywania oczu,
M
wyłączników prądu i gazu.
2.2. Wypadki w laboratorium
2.2.1.
Pożar
Zaalarmuj otoczenie głosem i przy użyciu instalacji alarmowej (włącznik znajduje
się przy wyjściu z każdej sali). Wyłącz gaz i prąd. Spróbuj ugasić pożar używając gaśnicy
śniegowej lub koca gaśniczego. Jeżeli istnieje poważne niebezpieczeństwo rozszerzenia
pożaru ewakuuj salę. Nie ponoś osobistego ryzyka!
Płonąca odzież: Przewróć płonącą osobę na ziemię. Nie dopuść, by uciekała
w panice. Użyj koca gaśniczego, fartucha laboratoryjnego lub prysznica gaśniczego, który
znajduje się przy wyjściu z każdej sali, by stłumić płomień. W ostateczności użyj gaśnicy
śniegowej, lecz pamiętaj, że możesz wywołać tym poważne odmrożenie.
Płonące rozpuszczalniki: Wyłącz palnik lub prąd. Jeżeli to możliwe odetnij dopływ
powietrza przez nakrycie płonącego naczynia płytką metalową lub mokrą ścierką. Użyj
gaśnicy lub koca gaśniczego.
Płonący gaz: odetnij dopływ gazu.

6
2.2.2.
Urazy chemiczne
Oczy:
Dokładnie przemyj dużą ilością bieżącej wody. Stanowisko do
przemywania oczu znajduje się na każdej z sal laboratoryjnych. Poinformuj
prowadzącego zajęcia. Udaj się natychmiast do okulisty.
Usta:
Wypłucz wielokrotnie wodą. Poinformuj prowadzącego zajęcia.
Połknięcie:
Wypij dużą ilość wody jako rozcieńczalnika. Staraj się usunąć zawartość
żołądka prowokując wymioty. Poinformuj prowadzącego zajęcia.
Skonsultuj się z lekarzem.
Skóra:
Zmyj dużą ilością zimnej wody. Umyj mydłem i wodą nawet jeżeli
substancja skażająca skórę jest nierozpuszczalna w wodzie. Poinformuj
prowadzącego zajęcia.
UWAGA!!! W przypadku oparzenia bromem (Br
2
) usuń go z miejsca
oparzenia benzyną, alkoholem etylowym lub 5% wodnym roztworem
Na
2
S
2
O
3,
w ostateczności wodą.
Płuca:
Usuń osobę poszkodowaną z skażonego obszaru, okryj ją by utrzymać
ciepło. Gdy ustał oddech zastosuj sztuczne oddychanie. Poinformuj
prowadzącego zajęcia.
2.2.3.
Skaleczenia
Materiały opatrunkowe i środki dezynfekcyjne – znajdują się w apteczkach na salach
laboratoryjnych oraz w magazynie podręcznym pokój 113.
2.2.4.
Stłuczenia termometru i rozlanie rtęci
Zabezpiecz obszar, na którym rozlała się rtęć przed osobami przechodzącymi, tak by
nie roznosiły kropelek rtęci na butach. Zawiadom prowadzącego ćwiczenia. Posyp obszar
skażony równomiernie siarką. Po około 30 minutach zmieć siarkę z kropelkami rtęci. Bardzo
starannie zbierz resztki rozlanej rtęci ze skażonego obszaru. Zasyp ponownie skażony obszar
preparatem do neutralizacji rtęci lub siarką.
Więcej informacji o zagrożeniach w laboratorium i sposobach ich unikania zawiera
Instrukcja pracy dla stanowisk laboratoryjnych w Katedrze Chemii Organicznej,
Bioorganicznej i Biotechnologii Politechniki Śląskiej – egzemplarz jest dostępny na każdej
sali laboratoryjnej.
7
3.
Przepisy porządkowe
3.1. Organizacja semestru
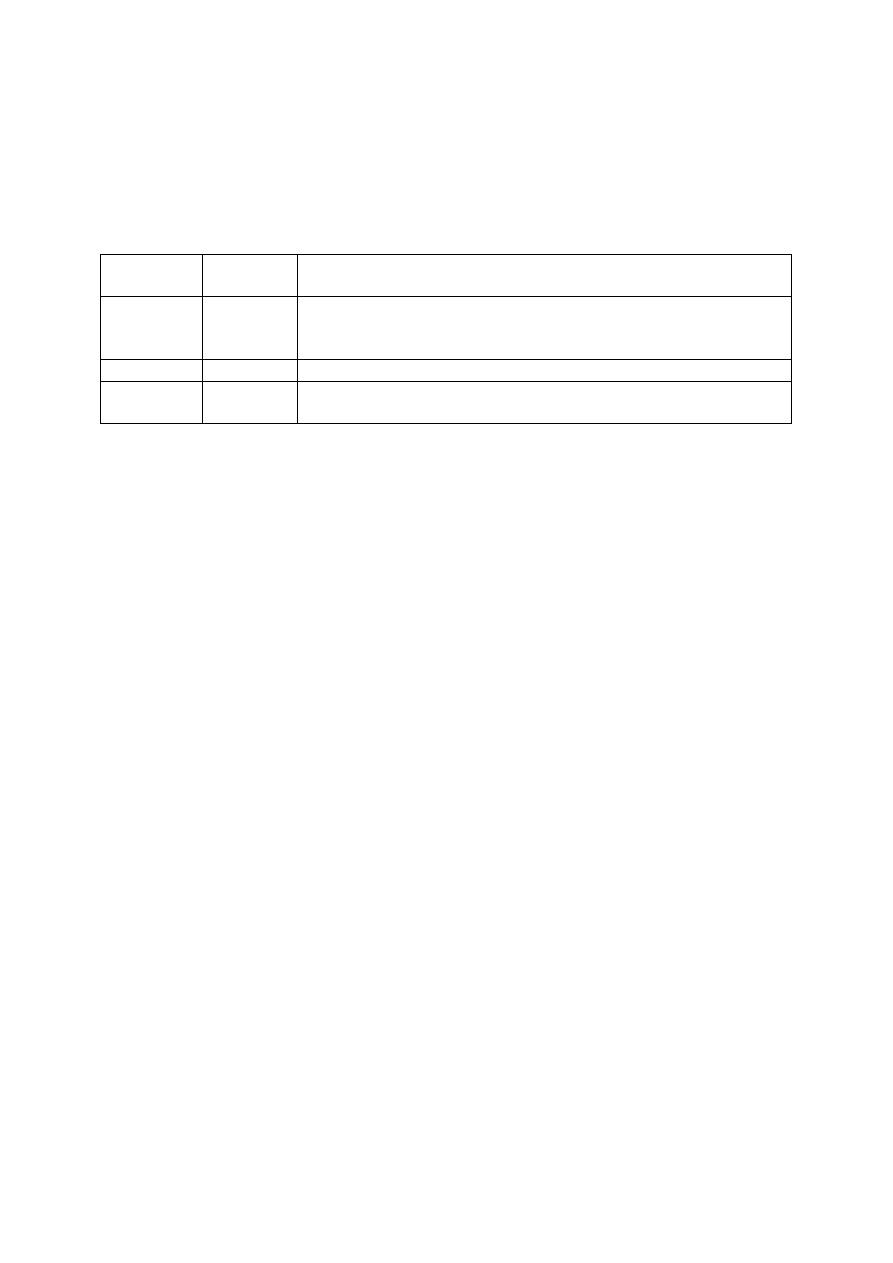
Tabela 1. Organizacja semestru
Termin
Godzin
lekcyjnych
Przeznaczenie
1
5
Sprawy organizacyjne, podział studentów na grupy ćwiczeniowe
i sale laboratoryjne, szkolenie BHP oraz odebranie szafek
laboratoryjnych wraz z wyposażeniem.
2 – 14
5
Realizacja programu podanego w p. 1 oraz Załączniku 1
15
5
Mycie
szkła,
porządkowanie
szafek,
zdawanie
szafek
laboratoryjnych wraz z wyposażeniem, zaliczenia.
3.2. Zeszyty
Każdy student zobowiązany jest do zaopatrzenia się w dwa zeszyty 32 kartkowe
w kratkę. Na pierwszej stronie pierwszego zeszytu należy wpisać tytuł: „Przepisy
i obliczenia” oraz: imię i nazwisko, rok, grupę dziekańską i rok akademicki, podać salę
laboratoryjną, termin odbywania ćwiczeń oraz listę wykonywanych preparatów. Zeszyt ten
służy do wpisywania przepisów wykonywania ćwiczeń, prowadzenia obliczeń, wpisywania
tabelek obliczeniowych. Powinien on także zawierać rysunki potrzebnej aparatury oraz wykaz
aparatury i odczynników, które muszą być pobrane z magazynu podręcznego. Zeszyt ten
należy każdorazowo przynosić na ćwiczenia. Wzór jego prowadzenia znajduje się w
skryptach uczelnianych nr 564 i nr 955 [7].
Drugi zeszyt należy zatytułować „Dziennik laboratoryjny” i opisać podobnie jak
zeszyt pierwszy. Zeszyt ten służy do prowadzenia notatek laboratoryjnych i po każdym
ćwiczeniu jest przekazywany prowadzącemu. W zeszycie tym należy uwzględnić 2,5 cm
margines na uwagi prowadzącego ćwiczenia. Sposób prowadzenia zapisów w „Dzienniku
laboratoryjnym” omówiony jest szerzej w punkcie 6.5.5. Notatki laboratoryjne.
3.3. Materiały pomocnicze
Każdy student obowiązany jest zaopatrzyć się we własne okulary ochronne oraz
rękawice gumowe, które nie mogą być uszkodzone, by stanowiły ochronę dla rąk.
Każdy student proszony jest o zaopatrzenie się w ręcznik i mydło do własnego
użytku, ręczniki papierowe, ściereczki do wycierania szkła i stołu laboratoryjnego, szczotkę
do mycia butelek oraz skoncentrowany detergent do mycia szkła laboratoryjnego. Bardzo
pożądane i ułatwiające pracę w laboratorium jest posiadanie wykonanej z grubego drutu,
najlepiej nierdzewnego (należy rozklepać jeden koniec), szpatułki umożliwiającej
wydobywanie osadów z naczyń laboratoryjnych. Ponadto przydatne, (wręcz konieczne),
w laboratorium są: nóż, nożyczki oraz zapałki lub zapalniczka.
3.4. Odzież
Studenci są proszeni o używanie w laboratorium niekosztownej odzieży, bowiem jest
ona narażona na ewentualne przyspieszone zużycie. Zalecane jest noszenie wygodnych butów

8
osłaniających stopy. W pomieszczeniach laboratoryjnych obowiązuje zakaz chodzenia
w butach na wysokich obcasach. Każdy Student obowiązany jest pracować w fartuchu
laboratoryjnym (nie z tworzywa sztucznego).
Odzieży wierzchniej (płaszcze, kurtki) nie wolno przetrzymywać na sali
laboratoryjnej, należy umieścić ją w szafce w szatni w piwnicy. Szafkę należy zamknąć
własną kłódką patentową. Po zakończeniu ćwiczeń w danym dniu należy szafkę opróżnić
i pozostawić otwartą. Na sali ćwiczeniowej mogą znajdować się w wyznaczonym miejscu
jedynie niewielkie torby.
3.5. Odczynniki w laboratorium
Odczynniki znajdujące się na półkach w salach laboratoryjnych przeznaczone są do
analiz i oznaczeń grup rozpuszczalności. Nie wolno ich używać do wykonywania syntez.
Wyjątkiem mogą być katalityczne ilości kwasów i zasad oraz środki suszące i pomocnicze jak
wazelina, smar, gliceryna czy węgiel aktywny.
Środki suszące, takie jak bezwodne sole: CaCl
2
, Na
2
SO
4
, MgSO
4
, znajdują się
w zakręcanych słoiczkach na każdej z sal laboratoryjnych. Po użyciu środka suszącego należy
bezwzględnie szczelnie zakręcić słoik.
Odczynniki do syntez pobiera się z magazynu podręcznego na podstawie wykazu
odczynników, wpisanego do książeczki materiałowej. Wykaz ten musi być podpisany przez
prowadzącego zajęcia, a podpis prowadzącego można uzyskać dopiero po zdaniu
kolokwium.
3.6. Szafki laboratoryjne
Grupa studentów (2 lub 3 osoby) obejmuje na okres jednego semestru szafkę
laboratoryjną ze szkłem i wyposażeniem i jest materialnie odpowiedzialna za jej zawartość.
Osoby te wypełniają rewers, potwierdzający odbiór znajdującego się w szafce szkła i innego
sprzętu. Na końcu ćwiczeń studenci rozliczają się z powierzonego im szkła laboratoryjnego.
Szkło, szczególnie elementy ze szlifami i termometry są drogie!!! Na salach
laboratoryjnych wiszą informacje o cenach elementów szklanych!
Każdy ze studentów otrzymuje w szafce książeczkę materiałową. Na podstawie tej
książeczki pobiera odczynniki lub wypożycza szkło i sprzęt z magazynu podręcznego. Jedna
część książeczki służy do pobierania odczynników, druga do pobierania szkła i sprzętu.
Książeczkę należy bardzo starannie przechowywać. Zagubienie książeczki jest związane
z dotkliwą karą finansową! Niektóre rodzaje szkła i aparatury pobierane są na indywidualne
rewersy i muszą być zwrócone czyste, w tym samym dniu, po zakończeniu pracy
w laboratorium.
W szafce należy utrzymywać porządek. Nie wolno pozostawiać w szafkach
otwartych naczyń zawierających substancje organiczne ani brudnego szkła laboratoryjnego.
Klucze do szafek przechowywane są w magazynie podręcznym i wydawane jedynie
użytkownikom na czas ćwiczeń. Na końcu każdego z ćwiczeń, po zamknięciu szafek, klucze
należy bezwzględnie oddać do magazynu podręcznego (pokój 113).
Brudne szkło laboratoryjne należy myć wodą z detergentami, natomiast jeżeli nie
daje to rezultatu, to można użyć do mycia niewielkich ilości acetonu. Prosimy o oszczędne
używanie acetonu. Rozpuszczalnik ten, jakkolwiek rozpuszcza się w wodzie, jest bardzo
szkodliwy dla środowiska, szczególnie dla mikroorganizmów w oczyszczalni ścieków.
Dlatego acetonu nie wolno wprowadzać do kanalizacji, a zużyty w trakcie mycia należy

9
obowiązkowo wprowadzać do pojemnika na odpady oznaczonego literą O lub F jeżeli zlewki
zawierają dodatkowo fluorowce.
3.7. Odpady
Na każdej sali laboratoryjnej znajduje się wyciąg z instrukcji postępowania
z odpadami chemicznymi. Każdy student zobowiązany jest do zaznajomienia się z nim
i przestrzegania zaleceń tam zawartych. Informacje na temat postępowania z odpadami
zawarte są również w skrypcie [8].
Odpadów chemicznych organicznych nie wolno wprowadzać do kanalizacji, należy
umieścić je w jednym z pojemników na odpady. W pojemniku oznaczonym zieloną etykietą
z symbolem O (organiczne) gromadzi się odpady ciekłe organiczne nie zawierające
fluorowców. W pojemniku oznaczonym fioletową etykietą z symbolem F (fluorowce)
gromadzi się odpady ciekłe organiczne zawierające więcej niż 1% wagowych fluorowców.
Do pojemników nie wolno wprowadzać związków reaktywnych, mogących gwałtownie
reagować ze zgromadzonymi odpadami, substancji kwaśnych ani zasadowych, substancji
reagujących z wydzielaniem się toksycznych gazów, substancji piroforycznych, mogących
wywołać samozapalenie się odpadów, substancji o intensywnym nieprzyjemnym zapachu itp.
Tego rodzaju substancje, zanim zostaną wprowadzone do pojemników na odpady, muszą
zostać przekształcone w substancje względnie bezpieczne. Więcej informacji można znaleźć
w literaturze oraz w „Listach bezpieczeństwa odczynników chemicznych” na serwerze
wydziałowym w zakładce iChem https://ichem.chemia.polsl.pl:8443/psl/ (zakładka Merck lub
POCh) ® nazwa związku ® karty bezpieczeństwa odczynników. Odpady stałe pakuje się w
worki foliowe, opisuje trwale i czytelnie ich zawartość a następnie wkłada do pojemnika na
odpady stałe palne.
Istnieje jedynie niewielka liczba związków, które w niewielkich ilościach (do
kilkunastu gramów) można wprowadzić w postaci wodnych roztworów do systemu
kanalizacyjnego. Są to naturalne aminokwasy, cukry i proste sole takie jak: chlorki,
fosforany(V), octany, siarczany(VI) i węglany amonu, sodu, potasu, magnezu i wapnia.
Należy jednak zwrócić uwagę, czy nie są one zanieczyszczone toksycznymi związkami
nieorganicznymi lub organicznymi. Jeżeli są, to zalicza się je do odpadów niebezpiecznych
i nie wolno wylewać ich do zlewu.
3.8. Tok pracy
Studenci określają rozpuszczalność otrzymanej mieszaniny dwuskładnikowej
w kilku typowych rozpuszczalnikach organicznych, wodzie oraz w 5% wodnym roztworze
wodorotlenku sodu i 5% kwasie solnym. Następnie wykonują rozdział mieszaniny
dwuskładnikowej metodami fizycznymi (destylacja, chromatografia) lub chemicznymi z
wykorzystaniem ekstrakcji lub destylacji z parą wodną lub wydzielają substancje z
produktów naturalnych. W kolejnym etapie syntezują preparaty w kolejności zalecanej
przez prowadzącego zajęcia.
Na zajęciach, zgodnie z grafikiem, odbywa się test ze znajomości grup
rozpuszczalności związków organicznych i metod rozdziału mieszanin oraz kartkówki ze
znajomości obliczeń chemicznych i wybranych technik laboratoryjnych.
Szkolenie literaturowe, na którym omówione są sposoby poszukiwania informacji
w literaturze chemicznej, odbywa się na początku semestru zgodnie z grafikiem zajęć dla
poszczególnych grup studenckich.
Wykonanie syntezy każdego preparatu, poprzedzone jest ustnym, indywidualnym
kolokwium dopuszczeniowym. Po pozytywnym zaliczeniu tego kolokwium student wypisuje

10
w książeczce materiałowej odczynniki potrzebne do wykonania preparatu, przedstawia je
prowadzącemu ćwiczenia do akceptacji i podpisu, po czym pobiera je z magazynu
podręcznego i przystępuje do wykonania preparatu. W trakcie syntezy prowadzi notatki
w „Dzienniku Laboratoryjnym”. Po wykonaniu preparatu i oznaczeniu jego właściwości
fizycznych oblicza wydajności, wypełnia „Kartę oddania preparatu” i przedstawia wykonany
preparat prowadzącemu wraz z kartą i notatkami w „Dzienniku laboratoryjnym”. Prowadzący
potwierdza fakt wykonania preparatu podpisem na karcie oddania preparatu i w „Dzienniku
laboratoryjnym”. Preparat wraz z kartą student oddaje w magazynie podręcznym (sala 113).
3.9. Dyżury studentów
W trakcie każdego z ćwiczeń jeden ze studentów z grupy odbywającej ćwiczenia
pełni dyżur. Dyżurny odpowiedzialny jest za porządek na sali w trakcie i po zakończeniu
ćwiczeń. Do obowiązków dyżurnych należy (bezpośrednio po rozpoczęciu ćwiczeń):
@ włączenie dygestoriów, suszarek i wagi elektronicznej,
@ zadbanie by na sali była napełniona butla z wodą destylowaną oraz flaszki
z odczynnikami,
w toku ćwiczeń:
@ dopilnowanie by każdy ze studentów utrzymywał w trakcie ćwiczeń swoje
stanowisko laboratoryjne w porządku i posprzątał je na zakończenie,
na końcu ćwiczeń:
@ wyłączenie suszarki i wagi elektronicznej (proszę nie wyciągać wtyczki
z gniazdka),
@ sprawdzenie zamknięcie kurków gazowych i wodnych,
@ sprawdzenie porządku pod dygestoriami i na sali, a w razie potrzeby posprzątanie
sali,
@ zgłoszenie prowadzącemu oraz dyżurującemu technikowi zakończenia ćwiczeń na
danej sali.

11
4. Rozdział mieszaniny dwuskładnikowej metodami chemicznymi
Każdy ze studentów otrzymuje indywidualną próbkę mieszaniny dwuskładnikowej.
Po określeniu jej rozpuszczalności w typowych rozpuszczalnikach oraz stwierdzeniu
charakteru kwasowego, zasadowego lub obojętnego poszczególnych składników próbki
uzyskuje od prowadzącego zajęcia informację jaką metodą rozdziału ma się posłużyć, jaki
składnik ma oczyścić i wyznaczyć jego właściwości fizyczne. Opis sposobu wykonania
rozdziału mieszaniny znajduje się w pozycjach literaturowych [1], [3], [5],
[9]. Po wykonaniu
zadania student przedstawia prowadzącemu ćwiczenia wyodrębnione substancje,
sprawozdanie z wykonanych czynności oraz wpisuje w „Dzienniku laboratoryjnym” masy
otrzymanych substancji i właściwości fizyczne tej z nich, którą oczyszczał.
W przypadku wydzielania substancji z produktów naturalnych student przedstawia
sprawozdanie z wykonanych czynności oraz masę otrzymanej substancji i jej właściwości
fizyczne.
Sprawdzenie
znajomości
zagadnień
związanych
z
rozdziałem
mieszanin
dwuskładnikowych metodami chemicznymi w powiązaniu z ekstrakcją i destylacją z parą
wodną jest w formie testu. Test obejmuje ponadto zagadnienia określania grup
rozpuszczalności i odbywa się w terminie podanym w grafiku.
5. Określanie grup rozpuszczalności
Celem ćwiczenia jest zapoznanie studentów z właściwościami związanymi
z rozpuszczalnością substancji w sposób fizyczny jak i ich charakterem chemicznym.
Wybraną przez prowadzącego substancję/substancje student, po uzyskaniu informacji o
jej/ich składzie pierwiastkowym, przyporządkowuje do określonej grupy rozpuszczalności.
Sposób wykonania prób oraz związane z rozpuszczalnością zagadnienia opisane są
w skryptach [8], [9] oraz w podręcznikach [1], [2], [3].
Po wykonaniu analiz każdy student przedstawia wyniki analiz w formie tabeli w
„Dzienniku laboratoryjnym” (Tabela 2).
Tabela 2. Przykładowe wyniki analizy rozpuszczalności
Rozpuszczalność w:
Nr. Próbki
(pierwiastki)
H
2
O
Et
2
O
5% NaOH 5%NaHCO
3
5% HCl
stęż. H
2
SO
4
Grupa
rozpuszcz
.
1 (C,H,O)
nr
-
r
r
-
-
IIIa
4 (C,H,O)
r
r
-
-
-
-
I
7 (C,H,O)
nr
-
nr
-
nr
r
V
9 (C,H,O,S)
r
nr
r
r
II
11 (C,H,Br)
nr
-
nr
nr
nr
nr
VI
12( C,H,N)
nr
-
nr
-
nr
nr
VII

12
6. Syntezy preparatów
6.1. Przygotowanie się do wykonania preparatu
Student
otrzymuje
od
prowadzącego
spis
preparatów
do
wykonania
z wyszczególnieniem ilości substancji wyjściowej z której preparat należy wykonać np.:
Etanian benzylu z 10 g chlorku benzylu
Benzylidenoaceton z 0,07 m acetonu......
@
Pierwszą czynnością jest znalezienie przepisu wykonania preparatu w dostępnej
literaturze, zazwyczaj w jednym ze skryptów uczelnianych lub podręczników
preparatyki organicznej (patrz spis literatury na końcu niniejszej instrukcji),
@
w zeszycie „Przepisy i obliczenia” należy wpisać nazwę wykonywanego preparatu
i ilość substancji wyjściowej z której zostanie on wykonany,
@
następnie należy napisać stechiometryczne równanie reakcji,
@
w następnej kolejności należy przepisać do zeszytu „Przepisy i obliczenia” znaleziony
w literaturze szczegółowy sposób wykonania preparatu,
@
znaleźć właściwości fizyczne (temperatura topnienia, temperatura wrzenia, gęstości)
substratów, produktów i substancji pomocniczych używanych w trakcie wykonania
preparatu (pomocne mogą być Kalendarz Chemiczny, Poradnik Fizykochemiczny,
podręczniki preparatyki, bazy danych w internecie),
@
wyznaczyć proporcje molowe pomiędzy substratami, produktami reakcji i substancjami
pomocniczymi jakie występują w równaniu stechiometrycznym i w przepisie
wykonania preparatu (patrz punkt 6.2),
@
znaleźć właściwości toksykologiczne i sposób obchodzenia się ze stosowanymi
reagentami i powstającymi produktami (sprawdź ”Listy Bezpieczeństwa” odczynników
w programie iChem https://ichem.chemia.polsl.pl:8443/psl/ uwagi zawarte w nowszych
przepisach laboratoryjnych, w podręcznikach preparatyki, dane w katalogach
firmowych odczynników chemicznych, a w szczególności zawarte w nich symbole
zagrożeń R i symbole bezpieczeństwa S. Wyjaśnienia tych symboli znajdują się
w Załączniku 2),
@
przemyśleć sposób zabezpieczenia się przed szkodliwym działaniem reagentów
i produktów,
@
przemyśleć
elementy
ryzyka
związane
z
wykonywanymi
czynnościami
(niebezpieczeństwo pożaru, implozji, skażenia chemicznego),
@
zapoznać się z właściwościami chemicznymi i podstawowymi reakcjami substancji
używanych w toku wykonania preparatu (podstawowe podręczniki chemii organicznej),
@
zapoznać się z mechanizmem odpowiedniej reakcji,
@
zastanowić się jakie reakcje uboczne mogą zakłócać wykonanie preparatu,
@
przeanalizować przepis wykonania – określić etapy wykonania, zachodzące w nich
reakcje i operacje fizyczne i ich znaczenie dla otrzymania preparatu (patrz punkt 6.2.
Analiza przepisu i obliczanie proporcji reagentów),
@
przemyśleć sposób wykonania preparatu – aparaturę (szkic aparatury narysować w
zeszycie „Przepisy i obliczenia”), pojemność naczyń reakcyjnych używanych do
syntezy, sposób kontroli ilości dozowanych reagentów, reżim i kontrolę temperatury
mieszaniny reakcyjnej, techniki stosowane do oczyszczania surowego produktu
(pomocne mogą być podręczniki techniki laboratoryjnej stosowanej w preparatywnej
chemii organicznej),
@
sformułować koncepcję postępowania z odpadami.
13
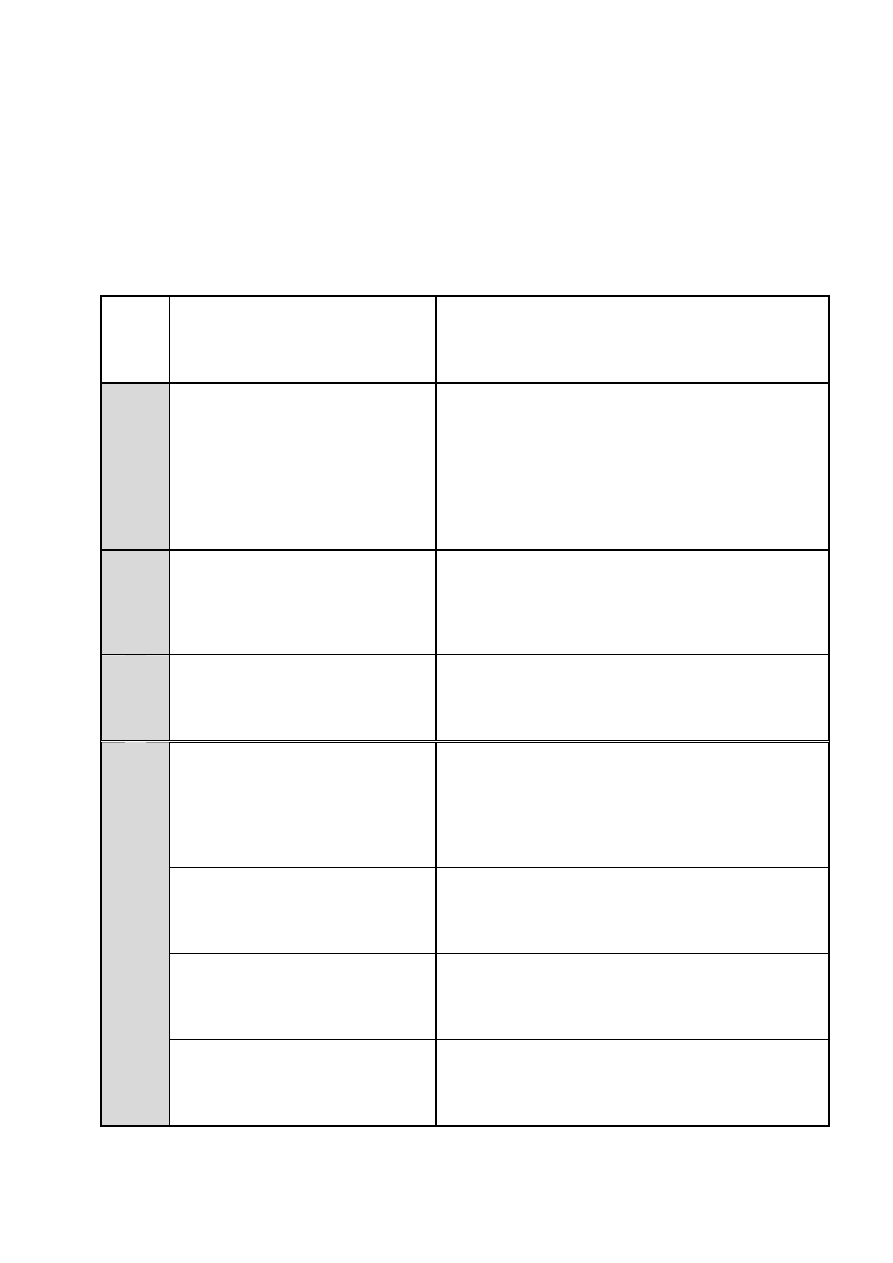
6.2. Analiza przepisu i obliczanie proporcji reagentów
Dla zilustrowania obliczeń niezbędnych ilości substratów i substancji pomocniczych
używanych w toku wykonywania preparatu oraz używanych stosunkach molowych
reagentów prześledźmy przepis wykonania etanianu benzylu z 10 g chlorku benzylu. Przepis
znajduje się na stronie 111 skryptu uczelnianego nr 2142 [8].
Tabela 3.
Analiza przepisu wykonania etanianu benzylu:
Analiza poszczególnych etapów
syntezy
Przepis wykonania
B
H
P
Ocena ryzyka
Sprawdzić
właściwości
toksyczne
używanych
związków, rodzaje możliwych zagrożeń (symbole
R), zagrożeń związanych z przeprowadzaną reakcją
oraz konieczne środki bezpieczeństwa i zasady
prawidłowego
postępowania
z
występującymi
w reakcji związkami (symbole S). Wyjaśnienia
występujących zwrotów R i S znajdują się
w Załączniku 2.
P
rz
ygot
o
-
w
ani
e
Przygotowanie aparatury, przygo-
towanie mieszaniny reakcyjnej
W kolbie trójszyjnej zaopatrzonej w mieszadło,
termometr i chłodnicę zwrotną umieszcza się
trójwodny octan sodu (0,790 mola), chlorek benzylu
(0,1 mola) i bromek tetrabutyloamoniowy (TBABr)
(0,008 mola).
R
ea
kc
ja
Przeprowadzenie reakcji
Zawartość kolby intensywnie miesza się i utrzymuje
w temperaturze 105-110°C przez jedną godzinę,
a następnie ochładza
Rozdział mieszaniny poreakcyjnej
przez ekstrakcję w układzie woda/
eter dietylowy. Produkt gromadzi
się w fazie organicznej, produkty
uboczne w fazie wodnej
i wprowadza wodę (140 cm
3
). Zawartość kolby
przenosi do rozdzielacza, rozdziela warstwy (jeżeli
występują problemy z rozdziałem mieszaniny,
należy dodać do niej 10 cm
3
eteru dietylowego)
i warstwę wodną trzykrotnie ekstrahuje się eterem
dietylowym (po 15 cm
3
).
Oczyszczanie ekstraktu – usuwa-
nie z fazy organicznej pozostałości
soli (octanu i chlorku sodu)
Wszystkie warstwy organiczne łączy się i po
przemyciu wodą do odczynu obojętnego
Suszenie fazy organicznej – usu-
wanie wody utrudniającej desty-
lację i usunięcie środka suszącego
wraz ze związaną wodą
suszy bezwodnym siarczanem(VI) magnezu. Po
usunięciu środka suszącego
W
ydz
ie
la
ni
e
sur
ow
ego
pr
odukt
u
oddestylowanie rozpuszczalnika
oddestylowuje
się
eter
z
kolby
Claisena
zaopatrzonej w krótką kolumnę Vigreux,
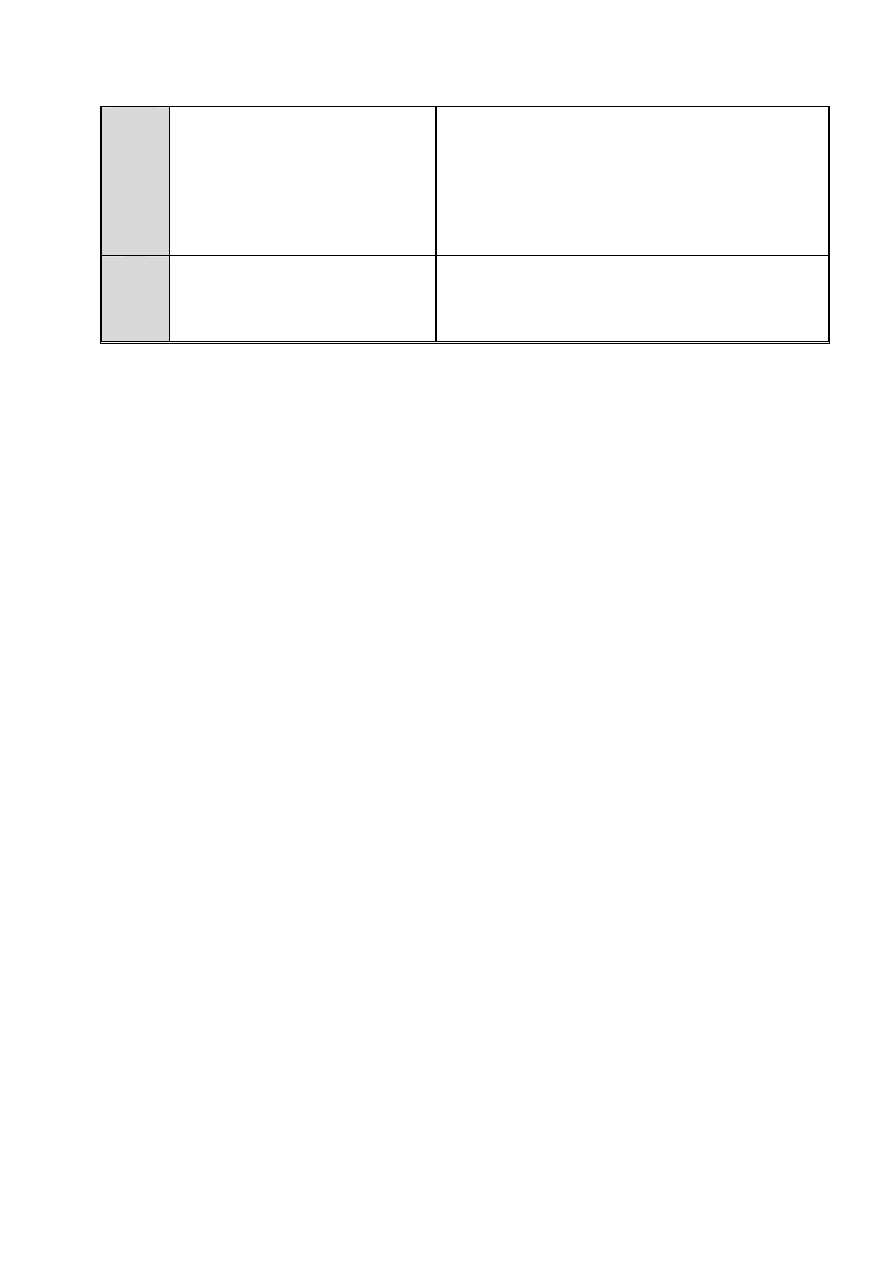
14
O
cz
ys
zc
z
ani
e
pr
odukt
u
Końcowe oczyszczenie produktu
przez destylację pod zmniejszo-
nym ciśnieniem
a następnie pozostałość poddaje się destylacji pod
zmniejszonym ciśnieniem. Zbiera się frakcję wrzącą
w temperaturze 98-101°C/14 mmHg. Temperatura
wrzenia czystego octanu benzylu wynosi 94-96
°C/14 mmHg, 104-105 °C/22 mmHg, 217 °C.
Otrzymuje się 13,9 g (0,93) mola produktu, co
stanowi 93 % wydajności.
O
dpa
dy
Postępowanie z odpadami
Jakie występują substancje odpadowe, ile ich
powstaje i na jakim etapie, czy mogą być jeszcze
wykorzystane, czy wymagają wstępnej neutralizacji,
do jakich pojemników należy je wprowadzić?
Kolejność wykonywania obliczeń może być następująca
1. Przeliczyć proporcjonalnie ilości substratów stechiometrycznie potrzebne do
przeprowadzenia reakcji na 1 mol substancji wyjściowej podanej przez prowadzącego,
a następnie na ilość, z której faktycznie wykonana będzie synteza. Ilości substancji
wyliczyć zarówno w molach jak i w gramach.
Równanie stechiometryczne reakcji i proporcje stechiometryczne substratów na 1 mol
chlorku benzylu wynoszą:
C
6
H
5
CH
2
Cl + CH
3
COONa
.
3 H
2
O ® C
6
H
5
CH
2
OCOCH
3
+ NaCl + 3H
2
O
1 mol
1 mol
1 mol
1 mol
3 mole
126,5g
136 g
150 g
58,5 g
54 g
Ponieważ synteza wykonywana będzie z 10 g chlorku benzylu (to znaczy z 10 g/126,5 g/mol
= 0,079 mola) więc stechiometrycznie do przeprowadzenia reakcji potrzebne będzie 0,079
mola trójwodnego octanu sodu (tj.10,74 g). W reakcji, gdyby zaszła stechiometrycznie,
można otrzymać po 0,079 mola etanianu benzylu i NaCl oraz 0,079
.
3=0,237 moli wody).
2. Wyznaczyć proporcje molowe pomiędzy substratami, produktami reakcji
i substancjami pomocniczymi jakie autorzy podali w przepisie. Ilości substancji
oblicza się zarówno w molach jak i w gramach, uwzględniając gęstości i procentowe
zawartości substancji w roztworach. Uwaga! Stosunki molowe pomiędzy substratami
w przepisie często nie odpowiadają stosunkom wynikającym z równania
stechiometrycznego. Należy zastanowić się dlaczego!!!
W przypadku syntezy etanianu benzylu przepis przewiduje użycie następujących ilości
substratów:
Substraty:
trójwodny octan sodu
- 0,790 mola - 107,4 g
chlorek benzylu
- 0,100 mola - 12,65 g
Inne:
bromek tetrabutyloamoniowy
- 0,008 mola - 2,58 g
Produkt:
etanian benzylu
- 0,093 mola - 13,9 g

15
Ponieważ zgodnie z równaniem stechiometrycznym jeden mol chlorku benzylu reaguje
z 1 molem octanu sodu, więc w reakcji 0,1 m chlorku benzylu zużyje się co najwyżej 0,1 m
octanu sodu. Pozostała ilość (0,790 m – 0,1 m) jest nadmiarem ponad ilość stechiometrycznie
potrzebną do reakcji. Nadmiar ten wyrażony w % ilości stechiometrycznie potrzebnej do
reakcji wynosi:
(0,790m – 0,100m)/0,100m = 6,9 m/m = 690%
Tak duży nadmiar prowokuje w trakcie kolokwium pytanie: Dlaczego autorzy przepisu
zastosowali aż taki nadmiar tego substratu?
W przeciwieństwie do octanu sodu, bromek tetrabutyloamoniowy użyty jest w dużym
niedomiarze zarówno w stosunku do chlorku benzylu jak też i do ilości powstającego
produktu.
Skłania to do postawienia pytania: Dlaczego w tej syntezie używa się tak mało bromku
tetrabutyloamoniowego i jaka jest jego rola w tej syntezie?
3. Przeliczyć proporcjonalnie ilości substancji podanych w przepisie na ilość substancji
wyjściowej z której należy wykonać preparat.
Preparat będzie wykonany z 10 g chlorku benzylu co stanowi 10 g / 126,5 g/mol =
0,079 mola. Aby obliczyć ilość potrzebnego trójwodnego octanu sodu korzystamy
z proporcji:
0,1 mola C
6
H
7
Cl - 0,79 mola CH
3
COONa
.
3H
2
O
0,079 mola C
6
H
7
Cl -
X
X = 0,79
.
0,079/0,1 mola = 0,624 mola
0,624 mola CH
3
COONa
.
3 H
2
O x 136 g / mol = 84,9 g
Aby zachować stosunki molowe substratów zakładane w przepisie musimy w reakcji
na 0,079 mola tj. 10 g chlorku benzylu użyć 0,624 mola tj. 84,9 g trójwodnego octanu sodu.
Podobnie z proporcji przeliczamy ilości powstających w reakcji produktów. Gdy przepis nie
podaje ile produktów ubocznych powstaje, przyjmujemy ilości stechiometryczne.
Analogicznie wyznaczamy ilość używanego w reakcji bromku tetrabutyloamoniowego,
jakkolwiek nie występuje on w równaniu stechiometrycznym. Powinniśmy użyć go w ilości
0,0063 mola (2,035 g).
4. Wyniki obliczeń zebrać w tabelce obliczeniowej, która ma być wpisana do zeszytu
„Przepisy i obliczenia”
6.3. Tabela obliczeniowa
Tabela obliczeniowa (patrz Tabela 4) posiada 4 podwójne wiersze główne oraz tyle
kolumn ile substratów i produktów występuje w równaniu stechiometrycznym reakcji. Ważne
substancje pomocnicze jak np. katalizatory czy kwasy lub zasady służące do neutralizacji
półproduktów umieszcza się również w tabeli.
Wiersze tabeli zawierają:
I.
Ilości stechiometryczne potrzebnych substratów i powstających produktów na 1 mol
substancji wyjściowej (w naszym przykładzie na 1 mol chlorku benzylu). Ilości te
podaje się zarówno w molach jak gramach.

16
II.
Ilości stechiometryczne substratów i produktów w przeliczeniu na ilość substancji
wyjściowej, z której faktycznie wykonamy syntezę (w naszym przykładzie na 10 g
chlorku benzylu). Ilości te podaje się zarówno w gramach jak i molach.
III.
Ilości substratów i produktów podane oryginalnie w przepisie, z którego korzystamy –
w molach i w gramach, bez zmiany ilości podanych przez autorów przepisu
(w naszym przypadku na 0,1 mola chlorku benzylu).
IV.
Ilości substratów i produktów wg przepisu, ale przeliczone na ilość substancji
wyjściowej, z której faktycznie wykonamy syntezę – podane w molach i w gramach
V.
Wiersz uzupełniający, w którym podaje się nadmiary substratów oraz wydajność
przewidywaną przez autorów przepisu.
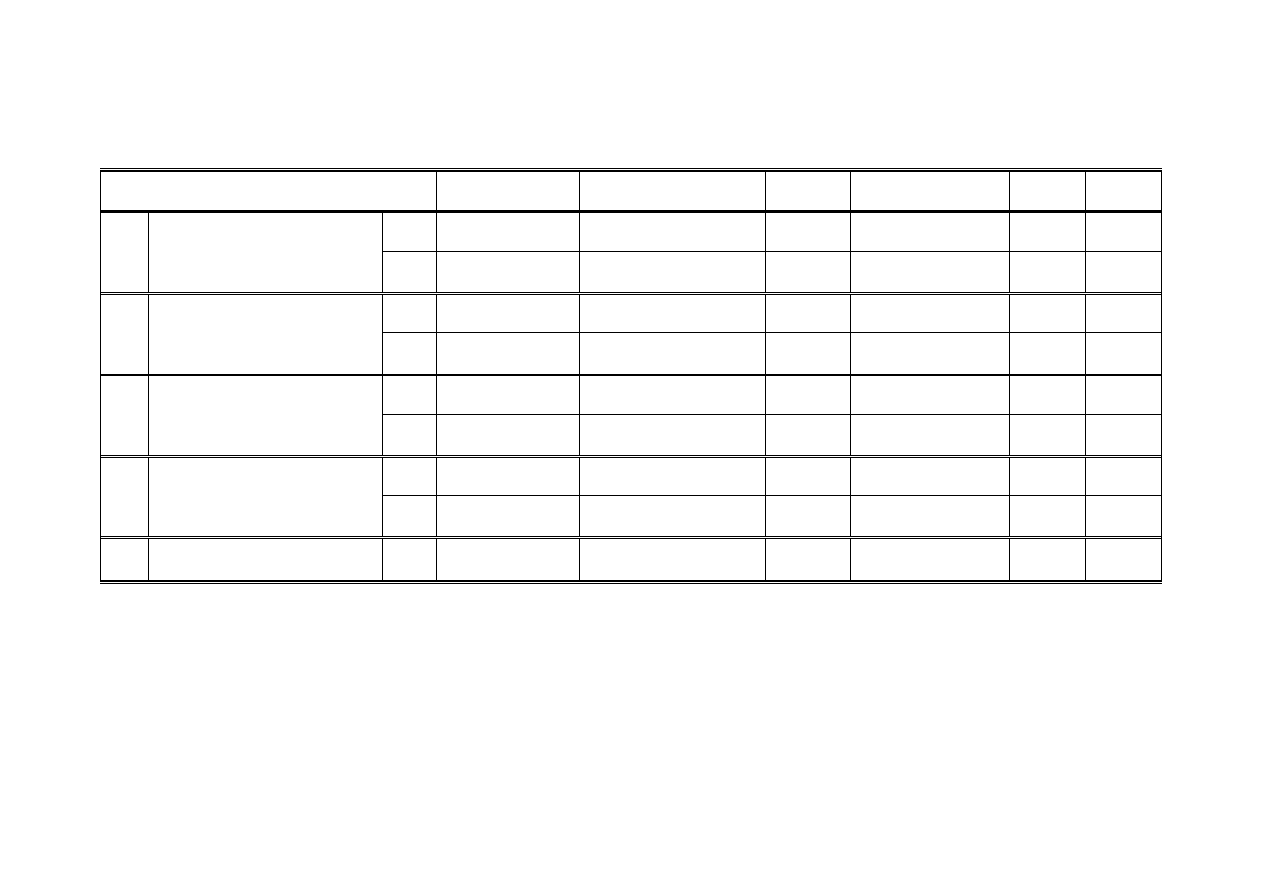
Tabela 4. Przykład - tabela obliczeniowa do syntezy etanianu benzylu z 10 g chlorku benzylu
C
6
H
5
CH
2
Cl
CH
3
COONa
.
3H
2
O
Bu
4
N
+
Br
-
CH
3
COOCH
2
C
6
H
5
NaCl
H
2
O
mol
1
1
-
1
1
3
I
Stechiometrycznie na
1 mol
chlorku benzylu
g
126,5
136
-
150
58,5
54
mol
0,079
0,079
-
0,079
0,079
0,237
II
Stechiometrycznie na
0,079 mol
chlorku benzylu
g
10
10,74
-
11,85
4,62
4,27
mol
0,1
0,790
0,008
0,093
0,1
0,3
III
Wg przepisu na
0,1 mol
chlorku benzylu
g
12,65
107,4
2,58
13,9
5,85
5,4
mol
0,079
0,624
0,063
0,073
0,079
0,237
IV
Wg przepisu na
0,079 mol
chlorku benzylu
g
10
84,9
2,04
11,02
4,62
4,27
V
Nadmiary i wydajność.
690%
93%

Jeżeli w preparacie używa się roztworów jakiegoś związku to w tabeli należy podać
nie ilość roztworu tylko ilości czystego reagenta, czyli o stężeniu 100%, a pod tabelą
przeliczyć ilości tego reagenta na ilość jego roztworu w gramach i w cm
3
. Na przykład
używając kwasu solnego w tabeli umieścimy ilość moli i gramów czystego HCl
(chlorowodoru), a następnie pod tabelą przeliczymy ilości chlorowodoru na ilość wodnego
roztworu HCl (czyli kwasu solnego) o określonym stężeniu i podamy te wartości w gramach
i w cm
3
.
6.4. Kolokwium
Przystępując do kolokwium student przedstawia prowadzącemu zeszyt „Przepisy
i Obliczenia” z kompletem informacji o wykonywanym preparacie tj.:
Przepisem
Tabelą z właściwościami substratów, produktów i odczynników pomocniczych,
Tabelą obliczeniową
Schematami aparatury,
Listą odczynników do pobrania z magazynu,
Listą szkła do pobrania z magazynu,
a następnie odpowiada na zadane pytania.
Przykładowe pytania (do etanianu benzylu):
ü Jakie Pan/Pani zna typy mechanizmów substytucji nukleofilowej?
ü Proszę przedstawić mechanizm S
N
1 (S
N
2)?
ü Jaki jest efekt stereochemiczny mechanizmu S
N
1 (S
N
2) jeżeli substratem reakcji jest
halogenek alkilowy z centrum chiralności przy atomie stanowiącym centrum reakcji?
ü Jakim reakcjom ulegają estry?
ü Jakie Pan/Pani zna inne reakcje przebiegające wg mechanizmu substytucji
nukleofilowej? – proszę podać co najmniej 3 różne reakcje.
ü Jakie w tej reakcji możliwe są produkty uboczne?
ü Jakimi innymi metodami można otrzymać etanian benzylu?
ü Jak Pan/Pani zmontuje aparaturę do syntezy?
ü W jaki sposób Pan/Pani wykona syntezę etanianu benzylu?
ü Na czym polega działanie bromku tetrabutyloamoniowego w toku syntezy preparatu?
ü Dlaczego w toku wykonania preparatu stosuje się intensywne mieszanie?
ü Dlaczego autorzy przepisu użyli tak znacznego nadmiaru octanu sodu?
ü Dlaczego ekstrakcję fazy wodnej eterem dietylowym przeprowadza się trzykrotnie
używając za każdym razem po 15 cm
3
eteru?
ü Jaki byłby efekt gdyby ekstrakcję przeprowadzić jeden raz używając 45 cm
3
eteru?
ü Czy niezbędna jest neutralizacja fazy wodnej po ekstrakcji?
ü Proszę
narysować schemat aparatury do oddestylowania eteru.
ü Jakie
niebezpieczeństwa
związane
są
z
destylacją
lotnych
i
palnych
rozpuszczalników?
ü W jakich przypadkach stosuje się destylację pod zmniejszonym ciśnieniem?
ü Jakie niebezpieczeństwa związane są z destylacją pod zmniejszonym ciśnieniem i jak
ich unikać?
ü Jaka jest zależność temperatury wrzenia od ciśnienia?
ü Proszę
narysować schemat aparatury do destylacji pod zmniejszonym ciśnieniem.

19
Po pozytywnym zdaniu kolokwium i sprawdzeniu zeszytu prowadzący podpisuje
tabelkę i stawia ocenę z kolokwium oraz podpisuje w książeczce materiałowej zgodę na
pobranie odczynników z magazynu podręcznego.
6.5. Wykonanie preparatu
6.5.1.
Pobieranie odczynników
Po zdaniu kolokwium student przystępuje do wykonania preparatu. Potrzebne do tego
odczynniki pobiera w magazynie podręcznym. Podstawą do pobrania substratów jest podpis
prowadzącego pod listą potrzebnych do syntezy odczynników w książeczce materiałowej.
Ilości pobieranych substratów ciekłych mają być podane zarówno w gramach jak i w cm
3
.
Substancje ciekłe pobiera się do czystych, suchych, zamykanych i opisanych butelek lub
kolbek. Substancje stałe higroskopijne, reagujące na powietrzu, o intensywnym
nieprzyjemnym zapachu, żrące oraz toksyczne są pobierane do zamykanego szczelnie słoika.
Jedynie substancje nieszkodliwe i trwałe na powietrzu można pobrać do opisanego
papierowego pudełka.
6.5.2.
Pobieranie dodatkowego szkła laboratoryjnego
W razie gdy student nie dysponuje odpowiednimi elementami aparatury w swojej
szafce może pobrać odpowiednie elementy z magazynu podręcznego na podstawie wpisu do
książeczki materiałowej – wpisuje je do książeczki i pobiera bez konieczności uzyskania
akceptacji prowadzącego. Wyjątkiem są zestawy do destylacji próżniowej, wyparek
rotacyjnych, niektóre zestawy do destylacji z parą wodną oraz urządzenia elektryczne i drogie
szkło szlifowe (rozdzielacze, niektóre termometry, itp.) gdzie wymagane jest wypełnienie
specjalnego, otrzymanego w magazynie podręcznym rewersu, który jest parafowany przez
prowadzącego. Aparatura pożyczona na rewers z magazynu podręcznego MUSI być
zwrócona czysta, jak najszybciej, najpóźniej w tym samym dniu pod koniec zajęć, gdyż może
być ona potrzebna innemu studentowi.
Proszę pamiętać, że za elementy pożyczone z magazynu podręcznego jak i zawartość
swojej szafki laboratoryjnej student jest odpowiedzialny materialnie.
6.5.3.
Montaż aparatury
Montaż aparatury przeprowadza się zgodnie z wymaganiami zawartymi w przepisie.
Należy zwróć uwagę na objętości mieszaniny reakcyjnej i pamiętać o doborze pojemności
naczyń reakcyjnych czy destylacyjnych (powinny być napełnione w około 70%). Gdy są za
małe będą kłopoty z przeprowadzeniem reakcji. Gdy są za duże można stracić dużą część
preparatu. W razie wątpliwości proszę zapytać prowadzącego.
Należy pamiętać, że szkło laboratoryjne jest kruche – nigdy nie należy stosować
brutalnej siły!
Należy pamiętać, że gdy mocuje się kolbę w łapie to szkło nie powinno bezpośrednio
stykać się z metalem – między szkłem a metalem powinna znajdować się podkładka z filcu,
korka lub gumy. Należy uważać, by nie ścisnąć za mocno kolby, bo łatwo może pęknąć. Jest
to szczególnie ważne gdy aparatura jest ogrzewana, gdyż wraz ze wzrostem temperatury
zwiększa ona swoje wymiary. Jednak gdy zbyt słabo umocuje się kolbę w łapie to może się
ona wysunąć i stłuc.
Należy pamiętać, że połączenia szlifowe muszą być czyste, suche i cienko
przesmarowane wazeliną lub smarem silikonowym. W przeciwnym razie mogą się zapiec,
i aparatura nie da się rozmontować.

20
W miarę możliwości należy zmontować aparaturę na jednym statywie – szczególnie
jest to istotne, gdy używa się mieszadła mechanicznego – drgania aparatury mogą
spowodować jej pęknięcie.
Po zmontowaniu aparatury należy zgłosić się do prowadzącego z prośbą o jej
sprawdzenie.
6.5.4.
Wykonanie syntezy
Sposób wykonania syntezy etanianu benzylu przedstawiono w Tabeli 5.
Tabela 5. Sposób wykonania syntezy octanu benzylu
Na statywie zamontuj kolbę trójszyjną o pojemności 250 cm
3
, umieszczając ją na płytce metalowej
położonej na trójnogu lub w łaźni olejowej. W środkowej szyi kolby umieść mieszadło
z uszczelnieniem z węża gumowego. Mieszadło połącz z wałem giętkim mieszadła elektrycznego.
Uszczelnienie przesmaruj wazeliną. Sprawdź czy mieszadło obraca się swobodnie i czy obroty
mieszadła dają się regulować w szerokim zakresie oraz czy uszczelnienie zapewnia szczelność.
Kolbę zaopatrz w chłodnicę zwrotną „kulkową” (wprowadzenie wody chłodzącej od dołu chłodnicy)
oraz w termometr. Sprawdź (nie uruchamiając silnika mieszadła!) czy mieszadło przy obrotach nie
zawadza o zbiorniczek z rtęcią termometru. Rysunki typowej aparatury laboratoryjnej znajdziesz w
Załączniku 3.
P
rz
ygot
ow
an
ie
a
p
ar
at
ury
P
rz
ygot
o
w
an
ie
m
ie
sz
an
iny
re
ak
cyj
ne
j
Odmierz cylindrem miarowym 9,1 cm
3
chlorku benzylu lub odważ do czystej i suchej kolbki
stożkowej 10 g chlorku benzylu i wprowadź go do kolby trójszyjnej przez szyję, w której
zamontowany jest termometr (po jego czasowym zdemontowaniu). Odważ 84,9 g trójwodnego
octanu sodu, rozdrobnij i wprowadź do kolby trójszyjnej. Odważ 2,58 g bromku tetrabutylo-
amoniowego i wprowadź do kolby. Zamontuj termometr.
P
rz
eprow
ad
ze
n
ie
re
ak
cj
i
Uruchom mieszadło i ogrzewaj łaźnię olejową tak by temperatura w kolbie osiągnęła 105 °C. Ustaw
grzanie łaźni olejowej lub wyreguluj palnik gazowy tak by temperatura mieszaniny reakcyjnej
utrzymywała się w zakresie 105 – 110 °C.
Kontynuuj ogrzewanie i mieszanie przez 1 godzinę, dbając by wskazania termometru cały czas
mieściły się w wyznaczonym zakresie a mieszanie było intensywne. Jeżeli temperatura opadnie
poniżej wyznaczonego zakresu przedłuż okres mieszania i ogrzewania. Wyłącz ogrzewanie, poczekaj
aż mieszanina ostygnie.
P
rz
erób
ka
-
roz
d
zi
ał
m
ie
sz
an
iny
por
ea
k
cyj
ne
j
Odmierz cylindrem miarowym 140 cm
3
wody, wlej przez chłodnicę do kolby reakcyjnej i rozmieszaj
aż do całkowitego rozpuszczenia fazy stałej.
Zdemontuj ogrzewanie, chłodnicę zwrotną, termometr i mieszadło. Na statywie zamontuj pierścień
metalowy i umieść w nim rozdzielacz o pojemności 500 cm
3
. Sprawdź czy jest czysty, czy kran jest
drożny, czy jest zamknięty oraz sprawdź szczelność rozdzielacza wlewając do niego 10 cm
3
eteru
dietylowego (użyj eteru do późniejszego przemycia kolby reakcyjnej i ekstrakcji). Przelej zawartość
kolby reakcyjnej do pustego rozdzielacza. Kolbę reakcyjną przemyj 10 cm
3
eteru dietylowego i dodaj
eter do rozdzielacza. Wlot do rozdzielacza zamknij dopasowanym korkiem szlifowym i zakołysz
delikatnie kilkakrotnie rozdzielaczem przytrzymując korek. Wyjmij korek wypuszczając nadmiar par
eteru z rozdzielacza. Odstaw rozdzielacz na statyw i poczekaj kilka minut aż warstwy organiczna
i wodna dobrze się rozdzielą. Usuń korek szlifowy z rozdzielacza. Warstwę wodną wprowadź do
czystej kolby stożkowej na 250 cm
3
lub do kolby reakcyjnej, którą umieść bezpiecznie w naczyniu
uniemożliwiającym przewrócenie się kolby. Warstwę organiczną (górną) wprowadź do czystej
kolbki stożkowej o pojemności 100 cm
3
. Warstwę wodną wprowadź ponownie do rozdzielacza,
dodaj 15 cm
3
eteru, zamknij rozdzielacz i wytrząśnij początkowo delikatnie, likwidując ciśnienie par
eteru, a następnie energicznie i dokładnie kilka razy tak by zapewnić dobry kontakt fazy organicznej
i fazy wodnej i starannie wyekstrahować pozostałą w warstwie wodnej część octanu benzylu. Za
każdym razem odpowietrzaj rozdzielacz. Odstaw rozdzielacz do rozdzielenia warstw, zlej fazę
wodną do kolbki, w której znajdowała się uprzednio, a fazę eterową dołącz do fazy organicznej
z pierwszej ekstrakcji. Czynności te powtórz dwukrotnie z dwoma świeżymi porcjami po 15 cm
3
eteru.
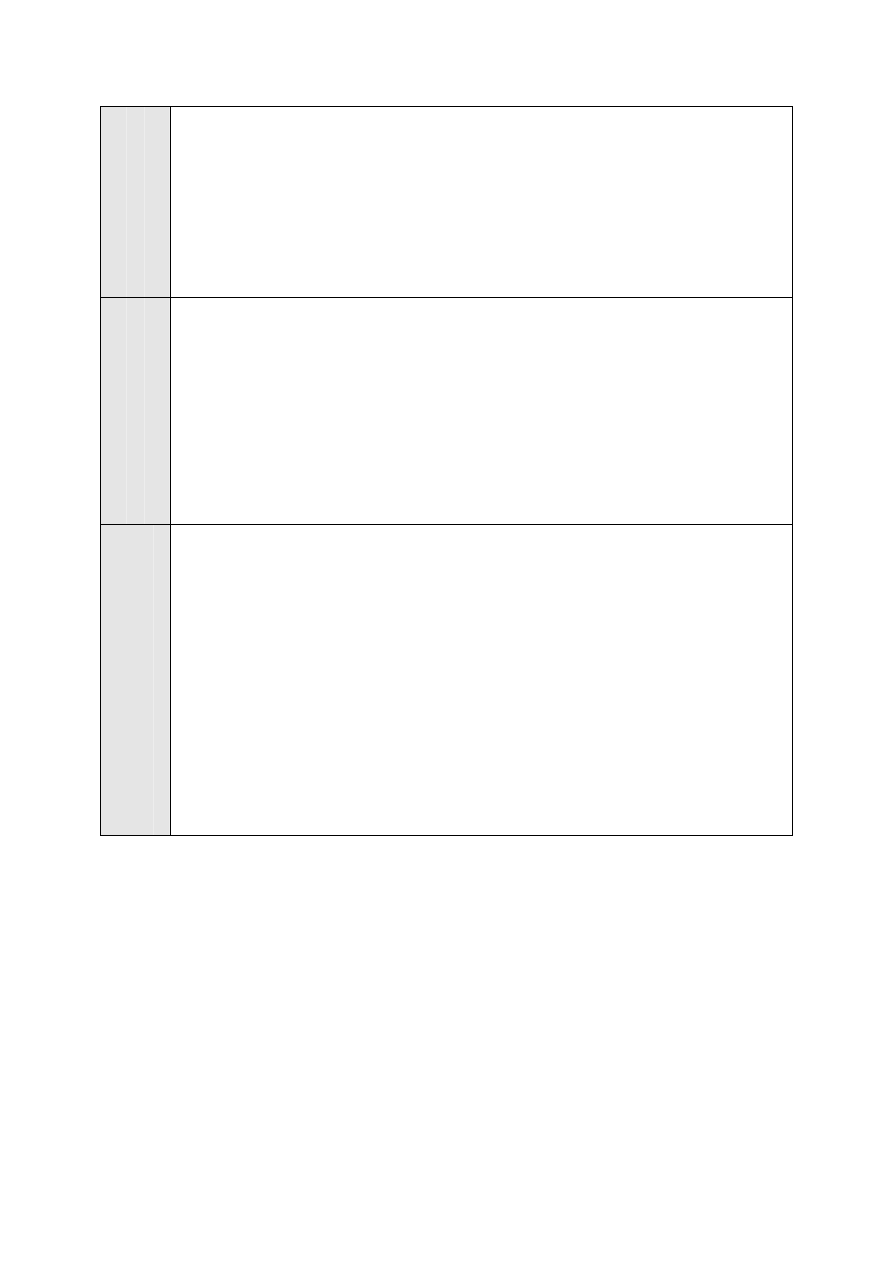
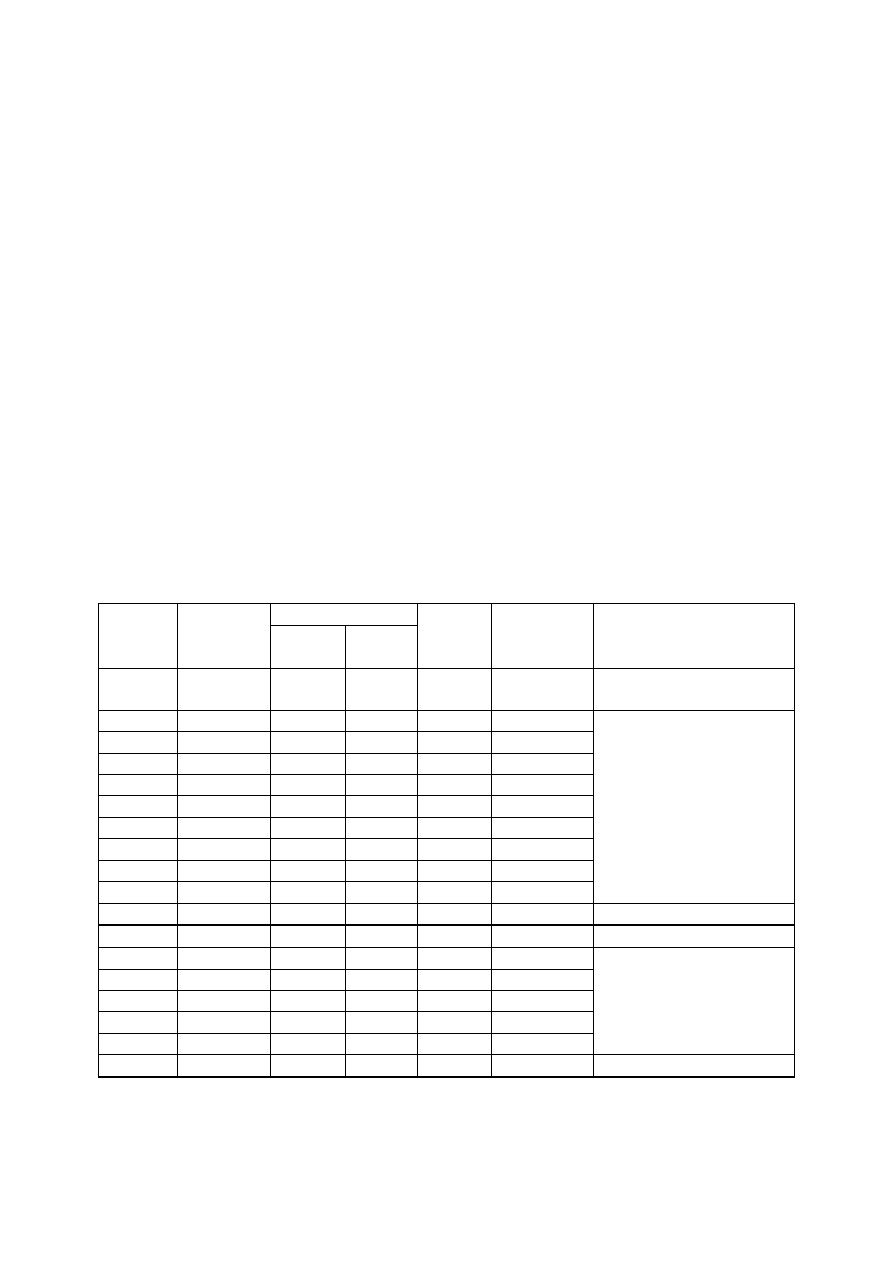
21
P
rz
erób
ka
–
c
.d.
Połączone warstwy eterowe umieść w rozdzielaczu. Dodaj około 20 cm
3
wody, wytrząśnij starannie
(odpowietrzając rozdzielacz) poczekaj do rozdzielenia warstw. Fazę wodną dołącz do fazy wodnej
z pierwszej ekstrakcji, a fazę organiczną przemyj jeszcze dwukrotnie w analogiczny sposób wodą.
Sprawdź czy odczyn fazy wodnej jest obojętny. Jeżeli tak to fazę organiczną wprowadź do czystej
i suchej kolbki stożkowej. Zwróć uwagę by do kolbki nie dostała się większa ilość wody. Do kolbki
dodaj taką ilość bezwodnego siarczanu(VI) magnezu by siarczan już się nie zbrylał (2-3 g). Sprawdź
czy środek suszący jeszcze się zbryla lub czy nie rozpływa się i czy nie tworzy drugiej fazy ciekłej.
Jeżeli tak, to fazę tą lub zbrylony środek suszący należy oddzielić od fazy organicznej i dodać świeżą
porcję środka suszącego. Zamknij kolbkę i odstaw, co najmniej na 30 minut by siarczan związał
wodę rozpuszczoną w eterze. W tym czasie przygotuj kapilarę do destylacji pod zmniejszonym
ciśnieniem.
W
yd
zi
el
eni
e
surow
ego
produ
kt
u
Zmontuj aparaturę składającą się z kolbki Claisena z kolumną Vigreux w szyi bocznej o pojemności
50 cm
3
, chłodnicy Liebiga, przedłużacza z odprowadzeniem par i odbieralnika. W szyi głównej kolby
Claisena umieść na korku gumowym kapilarę sięgającą dna kolby. Po dopasowaniu długości,
kapilarę wraz z korkiem wyciągnij i schowaj. Do kolby wprowadź teraz kilka „zarodników wrzenia”
– małych kawałków porowatej porcelany. W szyi głównej kolby zamontuj wkraplacz, z którego w
trakcie destylacji będziesz stopniowo wprowadzać eterowy roztwór octanu benzylu. W szyi bocznej
umieść termometr tak by zbiorniczek z rtęcią znajdował się nieco poniżej wlotu do chłodnicy. Do
rozdzielacza przesącz przez fałdowany sączek wysuszony roztwór eterowy. Napełnij kolbę
destylacyjną w połowie i rozpocznij ogrzewanie. Kolbę ogrzewaj ostrożnie na łaźni wodnej lub na
czaszy grzejnej. W trakcie oddestylowania eteru ciągle uzupełniaj ilość roztworu w kolbie z
szybkością równą szybkości destylacji aż do wyczerpania się roztworu eterowego w rozdzielaczu.
Destylację kontynuuj aż do zaniku destylacji eteru (t
wrz
= 39 °C). Uważaj, aby nie przekroczyć
temperatury 50°C.
K
ońc
ow
e
o
cz
ys
zc
za
n
ie
prod
ukt
u
pr
ze
z
de
st
yl
ac
ję
po
d
zm
n
ie
js
zo
n
ym
c
iś
ni
eni
em
Przebuduj aparaturę tak by nadawała się do destylacji pod zmniejszonym ciśnieniem. Z szyi głównej
kolby Claisena usuń wkraplacz i w to miejsce wprowadź wcześniej dopasowaną kapilarę wraz z
korkiem (jej długość sprawdziłeś jeszcze, gdy aparatura nie została napełniona roztworem
eterowym!). Na końcu chłodnicy umieść „krówkę” umożliwiającą zmianę odbieralnika w trakcie
destylacji bez zapowietrzania aparatury. Zważ odbieralniki przed rozpoczęciem destylacji. Połącz
aparaturę z układem próżniowym – manometrem, flaszką zabezpieczającą i źródłem próżni. Przed
aparaturą umieść ekran zabezpieczający. Włącz próżnię i poczekaj do ustalenia próżni w aparaturze.
Odczytaj ciśnienie na manometrze. W razie potrzeby doszczelnij aparaturę. Po ustaleniu ciśnienia
sprawdź, jaka powinna być temperatura wrzenia twojej substancji pod tym ciśnieniem. Ogrzewaj
kolbę destylacyjną i zbieraj poszczególne frakcje zgodnie z przepisem notując, co 30 sekund
temperaturę wrzenia i ciśnienie, zachowując stałe tempo destylacji w zakresie 1-3 krople na sekundę.
Po zakończeniu destylacji wyłącz ogrzewanie, zamknij manometr, pozostaw aparaturę do
ostygnięcia, wprowadź powietrze do aparatury (uważaj, aby odbieralniki nie zsunęły się ze szlifów!),
ściągnij odbieralniki i wyłącz próżnię. Bardzo ostrożnie wprowadź powietrze do manometru.
Rozmontuj aparaturę i uporządkuj stanowisko do destylacji próżniowej. Umyj aparaturę.
Zważ odbieralniki wraz z frakcjami uzyskanymi w trakcie destylacji. Przelej produkt do kolbki
stożkowej o odpowiedniej pojemności i opisz czytelnie podając nazwę preparatu i jego wagę oraz
temperaturę wrzenia i ciśnienie, a także swoje nazwisko i numer sali, na której wykonujesz ćwiczenia
Porównując zwięzły przepis, zawarty w skrypcie [8], wykonania preparatu o średnim
stopniu złożoności, jakim jest octan benzylu (patrz też Tabela 3), ze znacznie bardziej
szczegółowym opisem koniecznych czynności (Tabela 5) łatwo zauważyć, iż
w przygotowaniu się do wykonania preparatu należy uwzględnić wiele informacji
dotyczących sposobu wykonywania różnych czynności laboratoryjnych. Znajomość
odpowiednich elementów techniki laboratoryjnej jest bardzo istotnym, a często decydującym
czynnikiem, dla pomyślnego wykonania syntezy. Technika laboratoryjna opisana jest
w podręcznikach preparatyki i dotyczącym jej skrypcie [1-6].
22
6.5.5.
Notatki laboratoryjne
Należy pamiętać, aby notatki laboratoryjne były tak napisane, aby po dłuższym
czasie ktokolwiek mógł powtórzyć opisany w notatkach eksperyment, bez zaglądania do
innych materiałów.
Notatki laboratoryjne prowadzone w „Dzienniku laboratoryjnym” są formą
sprawozdania z wykonania syntezy preparatu. Powinny być prowadzone na bieżąco w trakcie
wykonywania syntezy. Nie mogą być ograniczone do przepisania przepisu wykonania.
Powinny być możliwie zwięzłe, ale szczegółowe. Należy w nich opisać użytą aparaturę
(rysunek), sposób jej ogrzewania lub chłodzenia, koniecznie zanotować ilości i kolejność
dozowania reagentów, czasy prowadzenia reakcji, ogrzewania, chłodzenia, ilości
wprowadzanych katalizatorów i substancji pomocniczych, oraz obserwacje dotyczące zmian
w wyglądzie i zachowaniu się mieszaniny reakcyjnej – zmiany barwy, wydzielanie się gazów,
wytrącanie osadów, efekty cieplne, samorzutne wrzenie itp.
Przy opisie destylacji należy podać ile substancji wzięto do destylacji, w jakiej
aparaturze prowadzono destylację, jaka była pojemność kolby destylacyjnej, jak ogrzewano
kolbę, oraz zanotować parametry destylacji – temperaturę wrzenia, ciśnienie, przy którym
prowadzono destylację, przybliżone tempo destylacji (ilość kropel na sekundę). Dane te
tradycyjnie podaje się w postaci „tabelki destylacyjnej”, w której bardzo wyraźnie wyróżnia
się granice wyciętych frakcji (przykład - Tabela 6.). Oprócz tego podaje się wagi pustych
i zapełnionych odbieralników i wagi poszczególnych frakcji.
Tabela 6. Destylacja octanu butylu
Łaźnia*
Czas
Ciśnienie*
[mmHg]
Moc
grzałki*
Temp.
łaźni*
Temp.
wrzenia
[°C]
Tempo
destylacji
[kropli/10s]
Uwagi
11.15
[**]
odbieralnik I = 51,23 g
początek destylacji,
11.21.20
0.3
38
5
+30 s
39
10
+30 s
39
15
+60 s
39
20
+60 s
39
20
…
+60 s
39
10
+60 s
40
5
+60 s
38
2
Przedgon I =
rozpuszczalnik
11.39
0.6
73,38 – 51,23
11.43
0.6
98
odbieralnik II = 57,95 g
11.45
110
3
+30 s
118
6
+30 s
123
10
+30 s
124
10
+30 s
124
10
Przedgon II
+30 s
124
10
60,15 – 57,95 = 2,20 g
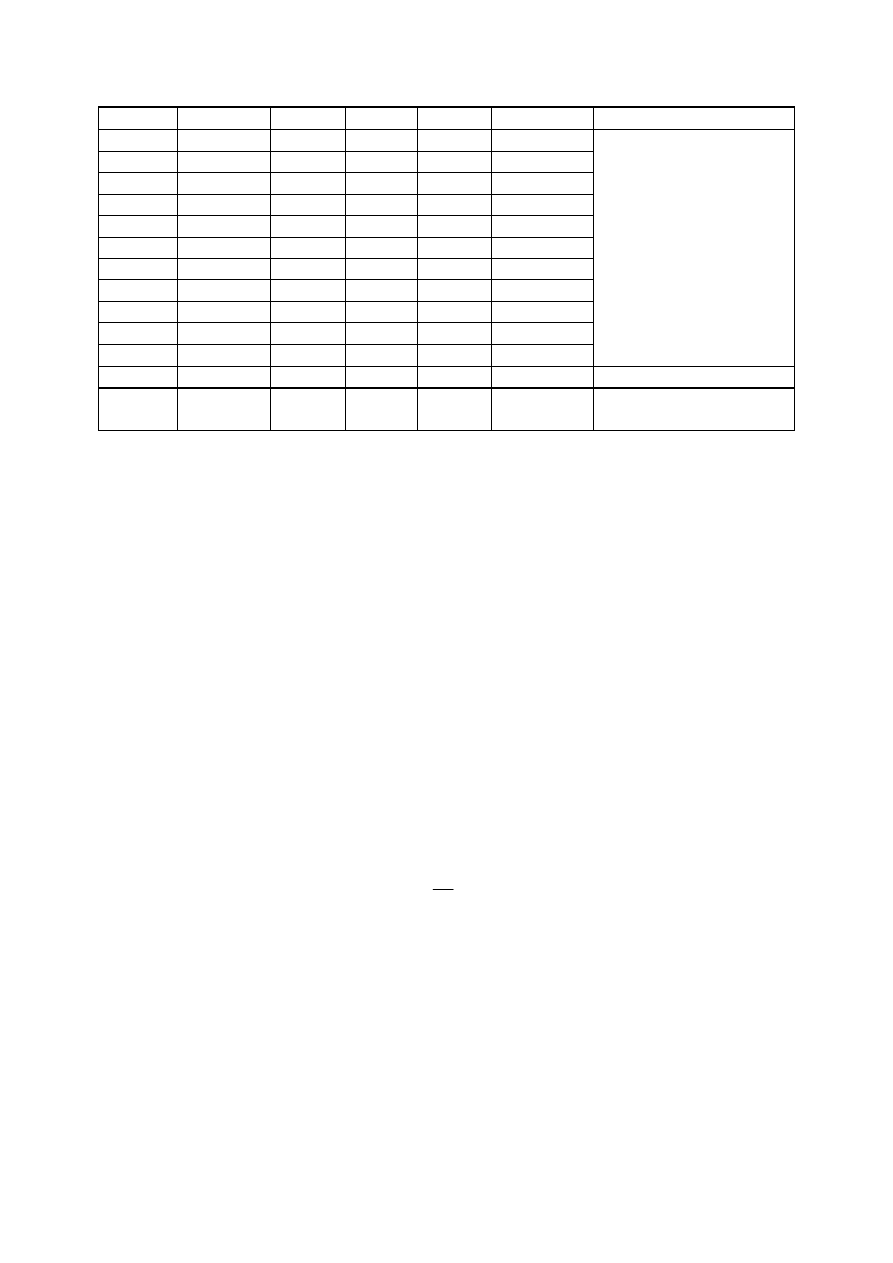
23
+30 s
0.6
124,5
10
odbieralnik III = 58,10 g
+30 s
124
10
+30 s
124,5
15
+30 s
124,5
15
+60 s
124,5
15
…
+60 s
125
10
+60 s
0.7
125,5
20
…
126
15
+60 s
125,5
10
+60 s
123
10
+60 s
121
2
Frakcja główna
+60 s
120
0
74,90 – 58,10 = 16,80 g
12.09
koniec
Pogon
156,47 – 151,84 = 5,63 g
* - opcjonalnie, ** - położenie pokrętła regulatora mocy czaszy grzejnej
Notując dane dotyczące krystalizacji zapiszemy ile surowego produktu wzięto do
krystalizacji, ile wzięto rozpuszczalnika, w jakiej aparaturze prowadzono krystalizację, ile
dodawano dodatkowo rozpuszczalnika dla osiągnięcia rozpuszczenia, czy osad rozpuścił się
całkowicie, czy dodano środka adsorbującego (ile?, jakiego?), czy roztwór sączono na gorąco,
czy po ochłodzeniu osad samorzutnie się wytrącił, czy roztwór chłodzono dla przyspieszenia
osiągnięcia określonej temperatury, czy roztwór oziębiano, czy powstawało ewentualne
zmętnienie, czy wytrącał się olej, czy roztwór zaszczepiono kryształkami produktu, jaką
ilością rozpuszczalnika przemyto osad po odsączeniu, jak go suszono, ile otrzymano
wysuszonego produktu i jaka była jego temperatura topnienia, jak wykonano ten pomiar.
6.5.6.
Obliczanie wydajności
W naszym laboratorium przed przedstawieniem preparatu do zaliczenia obowiązuje
tradycyjnie obliczenie dwóch wydajności, tzw. „wydajności teoretycznej” i „wydajności
praktycznej”.
„Wydajność teoretyczna” jest obliczana wg wzoru:
%
100
t
t
m
m
W =
gdzie: m – masa substancji otrzymanej w toku syntezy, m
t
– masa substancji którą można by
otrzymać z użytej ilości substratów gdyby reakcja zaszła stechiometrycznie w 100%
(wielkość tę wyliczyłeś już w tabeli obliczeniowej w wierszu II). Jest więc to
wydajność odniesiona do maksymalnej ilości stechiometrycznie możliwej do
otrzymania. Wydajność taka jest podawana w większości przepisów w literaturze
chemicznej.

24
„Wydajność praktyczna” jest obliczana wg wzoru:
%
100
p
p
m
m
W =
gdzie: m – masa substancji otrzymanej w toku syntezy, m
p
– masa substancji którą powinno
się otrzymać z użytej ilości substratów zgodnie z przepisem (wielkość tę wyliczyłeś
w tabeli obliczeniowej w wierszu IV). Jest więc to wydajność odniesiona do ilości
przewidywanej przez autorów przepisu i charakteryzuje stopień odtworzenia przepisu.
6.5.7.
Sporządzanie wykresu Sankey’a
Przykłady wykresów Sankey’a dla syntezy preparatów zawarte są w skrypcie [8]
str.17 i 18. Wykres należy sporządzić najlepiej na papierze milimetrowym w odpowiednio
dobranej skali, a w bilansie materiałowym uwzględnić ilość zużytego do mycia aparatury
acetonu.
6.5.8.
Zaliczenie preparatu
Przed zaliczeniem preparatu należy w „Dzienniku laboratoryjnym”, po zakończonych
notatkach z syntezy danego preparatu, umieścić podsumowanie, w którym podaje się
otrzymaną ilość związku, uzyskane wydajności i oznaczone właściwości fizyczne, także wg
literatury. Należy także wypełnić kartę oddania preparatu – karta jest do pobrania
w magazynie podręcznym.
KARRTA ODDANIA PREPARATU
Imię i Nazwisko
...............................................................................................................................
Numer preparatu
.......................................
Skala
........................................................................
Nazwa preparatu
............................................................................................................................
Własności fizyczne otrzymane
.................................................................................................
wg lit.
................................................................................................................................................
Otrzymana ilość
....................................
Wydajność prakt.
................................
Wydajność teoret.
.......................................
Podpis prowadzącego ćwiczenia
..........................................................................
Sprawdził
............................................................
N
az
w
a
pr
epa
ra
tu
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
.
O
dda
ny
do
m
aga
zynu
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
O
de
bra
ł.
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
..
.
..
Właściwości fizyczne podawane w „Dzienniku laboratoryjnym” i w karcie oddania
preparatu to temperatura wrzenia (zakres temperatur w jakim zebrano frakcję główną i pod
jakim ciśnieniem) lub temperatura topnienia (zakres temperatur w którym substancja się topi).

25
Temperaturę topnienia oznacza się dla substancji stałych oczyszczanych przez krystalizację,
po wysuszeniu produktu krystalizacji. Zawsze należy podać zakres temperatur wrzenia lub
topnienia – nigdy nie podaje się jednej temperatury.
Właściwości fizyczne wg literatury podaje się zgodnie z przepisem otrzymywania
preparatu. Jeżeli podaje się inne dane, należy wyszczególnić ich źródło (publikacja
literaturowa, baza danych, Poradnik Fizykochemiczny itp.)
Otrzymany preparat wraz z kartą oddania i notatkami w „Dzienniku laboratoryjnym”
przedstawia się prowadzącemu ćwiczenia do akceptacji. Prowadzący potwierdza podpisem na
karcie oddania i w dzienniku fakt wykonania preparatu. Preparat wraz z kartą oddania student
oddaje do magazynu podręcznego. Fragment KARTY ODDANIA PREPARATU, znajdujący
się po prawej stronie, po podpisaniu przez dyżurującego technika wraca do prowadzącego
zajęcia

26
7. Przygotowanie opracowania literaturowego
Opracowanie powinno zawierać podane poniżej punkty i być przedstawione w sposób
podany w Załączniku 4.
7.1. STRONA TYTUŁOWA
uczelnia, wydział i katedra, kierunek, semestr, rok akademicki, data
tytuł „OPRACOWANIE LITERATUROWE”
wzór strukturalny związku,
wzór sumaryczny,
masę cząsteczkową,
numer CAS,
nazwę związku w języku polskim i inne nazwy spotykane w literaturze,
nazwisko prowadzącego,
nazwisko wykonującego.
7.2. METODY OTRZYMYWANIA
(tytuł, reakcja, krótki opis, odnośniki literaturowe)
7.3. DANE FIZYCZNE I SPEKTROSKOPOWE
(temperatura topnienia, temperatura wrzenia, gęstość, współczynnik załamania
światła, skręcalność itp., wybrane dane spektroskopowe. Wszystkie dane powinny
mieć odwołania do literatury źródłowej)
7.4. ZASTOSOWANIE LUB/I WŁAŚCIWOŚCI CHEMICZNE
(informacje wg Beilsteina lub internetu lub wg wskazówek prowadzącego)
7.5. INNE INFORMACJE
(inne informacje zebrane wg zaleceń prowadzącego)
7.6. WYBRANA METODA OTRZYMYWANIA I PRZEPIS WYKONANIA
(przepis powinien być podany w oryginale oraz w tłumaczeniu wraz
z odnośnikiem literaturowym)
7.7. PRZEPIS
WYKONANIA
WRAZ
Z ZALECENIAMI BHP
I
UTYLIZACJĄ
ODPADÓW
(w sposób przyjęty w skrypcie [8])
7.8. NOTATKI LABORATORYJNE
(zgodnie z zaleceniami podanymi w instrukcji)

27
7.9. LITERATURA CYTOWANA
Istnieje kilka sposobów cytowania źródeł informacji chemicznej. Jednym z
najpopularniejszych jest poniżej przedstawiony styl zaproponowany przez American
Chemical Society zwany stylem ACS. Według niego najpierw podaje się numer pozycji
literaturowej następnie autorów, skrót nazwy czasopisma lub numer patentu, rok, tom i stronę
artykułu lub miesiąc, dzień i rok udzielenia patentu. W przypadku cytowania pozycji
książkowej po autorach podaje się tytuł książki, nazwę wydawnictwa, miejsce wydania oraz
rok. Przy podanym opisie stosuje się też odpowiednie style czcionek i nawiasy. Więcej
szczegółów można znaleźć w ACS Style Guide.
Oto jak wygląda taki zapis, używane style czcionek i nawiasy:
[kolejny numer cytowanej pozycji literaturowej]
Artykuły cytuje się w następujący sposób:
Pierwsze litery imion, nazwisko lub nazwisko i pierwsze litery imon (podać wszystkich
autorów), należy pamiętać aby sposób cytowania nazwisk i imion autorów był
konsekwentnie realizowany w całym opracowaniu,
Skrót nazwy czasopisma (tak jak w Chemical Abstracts).,
Rocznik,
Numer tomu,
(numer zeszytu – jeżeli jest dostępny),
pierwsza strona artykułu lub zakres stron.
[cytowanie informacji o tym, że cytowaną pozycję literaturową zaczerpnięto z Chemical
Abstracts – tak jak artykułu z tym, że zamiast strony podaje się numer streszczenia C.A.]
[cytowanie informacji o tym, że cytowaną pozycję literaturową zaczerpnięto z encyklopedii
Beilsteina – skrót nazwy encyklopedii, tom główny (H) numer, strona, uzupełnienie (E)
numer, strona – jeżeli z wersji komputerowej to po skrócie nazwy encyklopedii słowo komp.].
Patenty cytuje się w następujący sposób:
nazwiska i imiona autorów (analogicznie jak przy cytowaniu artykułu) lub firmy,
patent kraju np. patent amerykański,
Numer patentu poprzedzony między narodowym skrótem państwa,
rok udzielenia patentu lub bardziej precyzyjnie miesiąc (słownie) dzień, rok.
Są dwa sposoby cytowania książek:
pierwszy gdy mamy jednego lub kilku autorów,
nazwiska i imiona autorów (analogicznie jak przy cytowaniu artykułu)
Tytuł książki lub „Tytuł książki”,
wydanie numer (np. 3rd ed., wyd. 3) – nie podaje się gdy jest to wydanie pierwsze,
Nazwa wydawnictwa
rok wydania – jeżeli dotyczy to konkretnej informacji podaje się również numer rozdziału
(podrozdziału) lub strony np., 2007, rozdział 12 lub strona 343.
drugi gdy jest to praca zbiorowa pod czyjąś redakcją:
Tytuł książki lub „Tytuł książki”,
praca pod redakcją tu podać nazwisko redaktora (pierwsze litery imion, nazwisko)
Nazwa wydawnictwa
rok wydania, ewentualnie rozdział lub strona.

28
Informacje z internetu cytuje się w następujący sposób:
Publikacje, książki, patenty cytuje się w sposób jak podano powyżej z tym, że po nazwie
czasopisma, książki, numeru patentu dodaje się w nawiasie kwadratowym słowo online –
[online]. Na koniec po numerze strony lub dacie podaje się dokładną ścieżkę dostępu wraz z
datą „przeglądano dnia . . . ”.
Należy pamiętać aby kolejność i sposób cytowania były konsekwentnie realizowane
w całym przygotowanym spisie cytowanych pozycji literaturowych!

29
8. Literatura zalecana:
1.
A. Vogel, Preparatyka Organiczna, Warszawa, Wydawnictwa Naukowo-Techniczne
1964, 1984 i 2006.
2.
Preparatyka Organiczna, tłumaczenie zbiorowe z języka niemieckiego pod redakcją
B. Bochwica, PWN, Warszawa 1969.
3.
Preparatyka i Elementy Syntezy Organicznej, praca zbiorowa pod redakcją J. Wróbla
przy współpracy K. Kabzińskiej PWN, Warszawa 1983.
4.
M. Mąkosza, Synteza Organiczna, PWN, Warszawa 1972.
5.
Preparatyka Organiczna cz. I, Technika Laboratoryjna w Chemii Organicznej, praca
zbiorowa pod redakcją T. Kiersznickiego, skrypt Politechniki Śląskiej w Gliwicach
nr 1485, wyd. 3, Gliwice 1989.
6.
Laboratorium chemii organicznej, techniki pracy i przepisy bhp, praca zbiorowa pod
redakcją P. Kowalskiego, WNT, Warszawa 2004.
7.
Preparatyka Organiczna cz. II, Przepisy preparatywne wraz z zasadami BHP i
Tablicami własności fizycznych, praca zbiorowa pod redakcją T. Kiersznickiego,
skrypt Politechniki Śląskiej w Gliwicach nr 564, Gliwice 1974, nr 955, Gliwice
1980.
8.
Synteza Preparatów i Elementy Jakościowej Analizy Organicznej, praca zbiorowa
pod redakcją J. Suwińskiego, skrypt Politechniki Śląskiej w Gliwicach nr 2142,
Gliwice 1999.
9.
S. Goszczyński, Instrukcja do ćwiczeń z Chemii Organicznej Cz. II Analiza
Identyfikacyjna Związków Organicznych, skrypt Politechniki Poznańskiej nr 462,
Poznań 1973.
10. Organic Syntheses – cykliczne wielotomowe wydawnictwo książkowe drukujące od
1921 sprawdzone, dobrze opracowane przepisy preparatywne (tomy 1-77 oraz tomy
zbiorcze dziesięcioletnie I - IV) , J. Wiley & Sons, New York.
9.
Załączniki
9.1. Załącznik 1.
Aktualny program ćwiczeń laboratoryjnych
9.2. Załącznik 2.
Międzynarodowe
kody
zagrożeń
i
zaleceń
bezpieczeństwa (Risk and Safety Phrases)
9.3. Załącznik 3.
Typowe zestawy laboratoryjne
Str. 1
– zestawy reakcyjne z wkraplaniem, mieszaniem, ogrzewaniem
i chłodzeniem,
Str. 2
– zestaw reakcyjny z ogrzewaniem i absorpcją par,
Str. 2
– zestaw reakcyjny z nasadką azeotropową,
Str. 3
– zestawy do sączenia,
Str. 3-4
– zestawy do destylacji pod ciśnieniem atmosferycznym,
Str. 5
– zestaw do destylacji pod zmniejszonym ciśnieniem,
Str. 5
– zestaw do destylacji z parą wodną.
9.4. Załącznik 4.
Wzór opracowania literaturowego
Wyszukiwarka
Podobne podstrony:
Pytania od dr, Studia, IV rok, IV rok, VIII semestr, Metody instrumentalne
instrukcja gry monopoly od zera do milionera
Instrukcja do zad proj 13 Uklad sterowania schodow ruchom
MSIB Instrukcja do Cw Lab krystalizacja
Instrukcja do MHDD
OPB materialy od dr Hajdasz
Instrukcja do cwiczenia 1
Instrukcja do programu WSPR
'zagadnienia' od dr Lisewskiej
Perswazyjny telemarketing 50 narzedzi sprzedazy i obslugi klienta przez telefon do zastosowania od z
Instrukcja do ćw 18 Montaż i demontaż magazynu składowania MPS
Instrukcja do VirtualPneumoLab2
Instrukcje do ćwiczeń 2013
Instrukcja do ćw 06 Sterowanie pracą silnika indukcyjnego za pomocą falownika
Ćw.1 Wybrane reakcje chemiczne przebiegające w roztworach wodnych ćwiczenie 1, Chemia ogólna i żywno
CZĘŚĆ IV - Kopia, medycyna zabrze SUM lekarski, ginekologia opracowanie bazy pytań od dr. Bodzka
LIST DO ROMEA OD OJCA LAURENTEGO W KTÓRYM ZAKONNIK WYJAŚNIA SWÓJ PODSTĘP
więcej podobnych podstron