Roztwory
Rozpuszczalność substancji
konspekt
Iloczyn jonowy wody
Odczyn roztworu – pH wskaźniki
Roztwory buforowe
Iloczyn rozpuszczalności
Potencjał chemiczny
Aktywność rozpuszczalnika i substancji rozpuszczonej
Stan standardowy
Prawo Henry'ego
Lepkość
Iloczyn jonowy wody
auto-dysocjacja wody
H
2
O + H
2
O = H
3
O
+
+ OH
-
powstaje
jon hydroniowy
H
3
O
+
oraz
jon hydroksylowy
OH
-
H
2
O = H
+
+ OH
-
]
[
]
][
[
2
O
H
OH
H
K
]
][
[
]
[
2
OH
H
O
H
K
3
2
5
,
55
18
1000
]
[
dm
mol
g
g
O
H
14
3
3
16
2
10
5
,
55
)
10
8
,
1
(
]
[
dm
mol
dm
mol
O
H
K
iloczyn jonowy wody
iloczyn stężeń jonów wodorowych i jonów hydroksylowych
w temperaturze pokojowej (20
0
C ) i pod ciśnieniem
atmosferycznym (1,013bara) iloczyn ten wynosi
14
10
]
[
]
[
OH
H
odczyn roztworu – pH
miarą kwasowości roztworu jest stężenie jonów wodorowych
3
7
10
]
[
]
[
dm
mol
OH
H
roztwór w którym stężenie jonów wodorowych jest
równoważne stężeniu jonów hydroksylowych
nazywamy roztworem obojętnym
14
]
log[
]
log[
OH
H
]
log[
H
pH
]
log[
OH
pOH
Oranż metylowy, heliantyna, (CH
3
)
2
NC
6
H
4
N=NC
6
H
4
SO
3
-
Na
+
,
sól sodowa kwasu p-N,N-dimetyloaminoazobenzeno-p-sulfonowego, wskaźnik,
zmienia barwę z czerwonej na pomarańczową w zakresie pH 3,1-4,4. Żółty
proszek, dobrze rozpuszczalny w wodzie.
Powstaje w wyniku sprzęgania zdiazowanego kwasu sulfanilowego z N,N-
dimetyloaniliną.
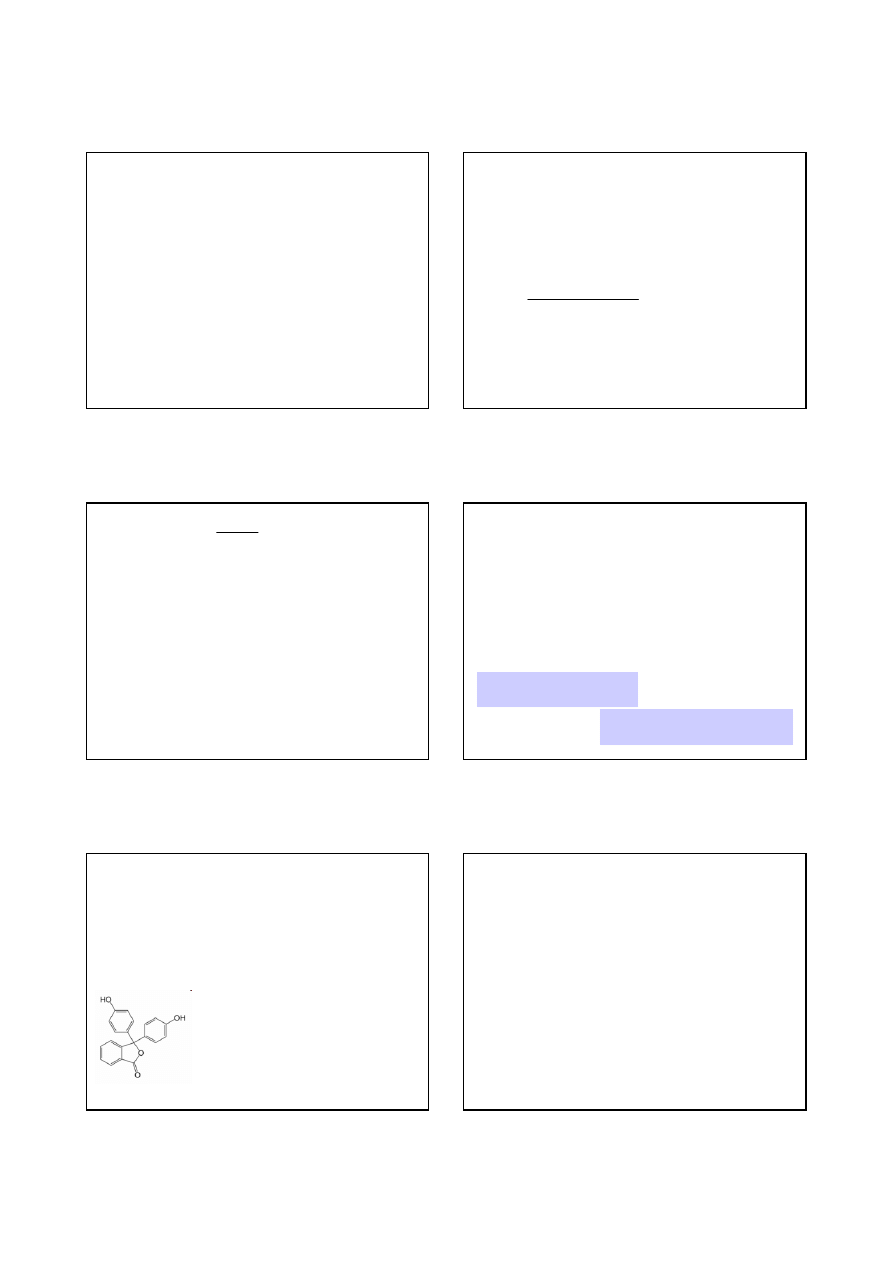
Fenoloftaleina (nazwa chemiczna: dihydroksyftalofenon, C
20
H
14
O
4
.
W stanie czystym jest to bezbarwna substancja krystaliczna, nierozpuszczalna
w wodzie, rozpuszczalna w alkoholach. W laboratoriach spotykana jest
głównie jako ok. 1% bezbarwny roztwór w etanolu.
Roztwory buforowe
Roztwory, których wartość pH po dodaniu mocnych
kwasów albo zasad, jak i po rozcieńczeniu wodą
zmienia
się nieznacznie.
Roztworami buforowymi są najczęściej wodne roztwory
słabych kwasów albo zasad i ich odpowiednich soli o
zbliżonych stężeniach.
Według teorii Brönsteda i Lowry'ego buforami są roztwory
słabych kwasów i sprzężonych z nimi zasad:
CH
3
COOH i CH
3
COO
-
,
HCOOH i HCOO
-
,
HCO
3
-
i CO
2
2-
,
H
2
PO
4
-
i HPO
4
2-
lub HPO
4
2-
i PO
4
3-
)
albo roztwory słabych zasad i sprzężonych z nimi kwasów
(np. NH
3
i NH
4
+
)
Roztwory buforowe charakteryzują się określonym
stężeniem
jonów wodorowych i służą do
utrzymania stałej kwasowości
roztworów oraz do jej
kontroli.
Cecha charakterystyczna roztworów buforowych:
•praktycznie
stałe stężenie jonów wodorowych
podczas
rozcieńczania roztworu
•niewielka zmiana stężenia jonów wodorowych
po dodaniu do
roztworu niewielkich ilości mocnego kwasu lub mocnej
zasady - mniejszych niż stężenie składników buforu (kwasowość
roztworu buforowego nie powinna zmienić się więcej niż o
jednostkę pH
)
•łzy, pot, ślina - ok. 7
•krew - 7,36 - 7,43
•mocz 5 - 7
•sok żołądkowy 0,8 - 0,98
•osocze - średnio 7,4
•pokarm kobiety - 6,8
bufor octanowy: pH - 3,7-5,6
CH
3
COOH + CH
3
COONa
CH
3
COO
-
, Na
+
, H
+
OH
-
+
H
+
<=> + H
2
O
OH
-
H
+
H
+
+
CH
3
COO
-
<=>
-
CH
3
COOH
soli
kw
kw
c
c
pK
pH
log
bufor amonowy pH - 8
NH
3
H
2
O + NH
4
Cl
NH
4
OH + NH
4
Cl
NH
4
+,
Cl
-
, OH
-
OH
-
+
NH
4
+
<=> NH
4
OH
OH
-
H
+
H
+
+
OH
-
<=> H
2
O
soli
zas
zas
w
c
c
pK
pK
pH
log
bufor fosforanowy: KH
2
PO
4
, K
2
HPO
4
pH = 5,5 - 8
bufor boranowy: H
3
BO
3
, Na
2
B
4
O
7
pH = 7 - 9
Zdolność buforowa -
liczba moli mocnego kwasu lub zasady
- wprowadzona do 1 dm
3
roztworu buforowego zmienia jego
pH o jedność
Pojemność buforu
() wyraża liczbę moli kwasu (zasady),
która wprowadzona do 1dm
3
roztworu buforowego powoduje
zmianę wartości pH o jednostkę.
Pojemność buforowa =
0,1,
gdy dodanie
0,1 mola
mocnego kwasu lub
zasady do
1dm
3
roztworu buforowego spowoduje zmianę pH o
0,1 jednostki
.
Maksymalna pojemność buforowa uzyska się dla buforów sporządzonych z
równoważnych ilości słabego kwasu (zasady) i jego soli. Pojemność buforowa jest
tym większa im większe jest całkowite stężenie słabego kwasu (zasady).
dpH
dc
dpH
dc
kw
zas
Iloczyn rozpuszczalności
n
m
osad
m
n
mA
nM
A
M
}
{
m
n
n
m
A
M
I
]
[
]
[
osad
m
n
m
n
n
m
A
M
A
M
K
]
[
]
[
]
[
m
n
n
m
osad
m
n
A
M
A
M
K
]
[
]
[
]
[
Iloczyn stężeń jonowych danej substancji jonowej w roztworze
nasyconym.
Iloczyn rozpuszczalności jest wielkością stałą w określonych warunkach
ciśnienia i temperatury, charakterystyczną dla danego układu
trudno rozpuszczalna substancja jonowa / rozpuszczalnik.
Potencjał chemiczny
A
A
p
p
ln
T
R
A
A
Potencjał chemiczny
charakteryzuje zdolność danego składnika układu
do opuszczania jednej z faz układu.
W samorzutnie zachodzących przemianach fazowych (parowanie, krzepnięcie,
krystalizacja), przy powstawaniu roztworów i w przebiegu reakcji chemicznych
określony składnik układu może przejść jedynie z fazy układu
o wyższym
potencjale chemicznym do fazy
o niższym
potencjale.
A
= potencjał chemiczny
A
*= standardowy potencjał chemiczny, czyli molowa entalpia swobodna czystego
gazu pod ciśnieniem 1 atm
R= stała gazowa. Dla roztworów idealnych R= 8,314 J/mol·K. R - stała fizyczna =
pracy wykonanej przez 1mol gazu doskonałego podgrzewanego o 1 K podczas
przemiany izobarycznej.
p
A
= prężność pary gdy jest to składnik roztworu
p
A
*= prężność pary nad czystą cieczą
p
A
= x
A
p
A
*
A
A
p
p
ln
T
R
A
A
x
ln
T
R
A
A
A
Potencjał chemiczny jest wielkością intensywną, tzn. niezależną od masy
substancji. Jednostką potencjału chemicznego jest [J·mol
-1
].
Entalpia (H) (zawartość ciepła) - wielkość fizyczna będąca funkcją stanu mająca
wymiar energii, będąca też potencjałem termodynamicznym. H = U + pV.
H - entalpia układu
U - energia wewnętrzna układu
p - ciśnienie
V - objętość .
Entalpia jest równa sumie energii wewnętrznej, czyli energii jaka jest potrzebna
do utworzenia układu gdy jest on tworzony w otoczeniu próżni oraz iloczynu p·V,
który jest równy pracy jaką należy wykonać nad otoczeniem by w danych
warunkach uzyskać miejsce na układ.
Potencjał chemiczny składnika roztworu doskonałego (
i
)
jako funkcja jego ułamka molowego x
i
x
ln
T
R
A
A
A
0
ln x
i
i
*
i
a
ln
T
R
A
A
A
a
A
– aktywność substancji A, czyli efektywny ułamek molowy
a
A
= p
A
/p
A
*
Poprzez pomiar prężności pary
Prężność pary 0,5 molowego KNO
3
= 749,7 Tr a
A
= 749,7/760= 0,9864
Aktywność rozpuszczalnika
a
A
x
A
gdy x
A
1
Współczynnik aktywności
a
A
=
A
x
A
A
1
gdy x
A
1
RTln
x
ln
T
R
A
A
A
A
Aktywność substancji rozpuszczonej
x
ln
T
R
B
B
B
Roztwór idealny ( rozcieńczony)
Roztwór rzeczywisty
a
ln
T
R
B
B
B
a
B
=p
B
/K
B
K = stała empiryczna
a
B
=
B
x
B
B
1
gdy x
B
0
Obliczyć aktywność i współczynnik aktywności chloroformu
rozpuszczonego w acetonie (t = 25
0
C)
Stan standardowy
Stan standardowy substancji w danej temperaturze odpowiada
jej czystej postaci pod ciśnieniem1 bar.
H
o
H
o
298K
Standardowa entalpia reakcji to zmiana entalpii w procesie
przemiany czystych, nie zmieszanych substratów, w czyste, rozdzielone
produkty, prowadzonym pod ciśnieniem normalnym.
Temperatura nie wchodzi w skład definicji stanu standardowego, jednak ze
względów historycznych dotyczy zwykle 25
o
C.
Stan standardowy
rozpuszczalnika -
czysta ciecz pod
ciśnieniem 1 bar, wartość x
A
= 1
Stan standardowy
składnika
-
składnikowi w stanie
standardowym przypisuje się wartości aktywności (a
B
=1) i
współczynnika aktywności - równe jedności.
Stanem standardowym rozpuszczalnika jest zatem
1 mol czystego rozpuszczalnika w danych warunkach p i T
Stan roztworu nieskończenie rozcieńczonego: a
i
= x
i
dla x
i
-> 0.
Wartości stężeń są stałe, lecz nie są równe zeru.
Dla rozpuszczalnika
a
A
x
A
x
A
1
A
1
gdy
Dla substancji rozpuszczonej
a
A
x
A
A
1
gdy
x
A
0
Warunki standardowe - ciśnienie 1 bar i temperatura 298 K.
1 bar
= 105 Pa
= 1,0197 at
= 0,98692 atm
= 750,06 Tr
Paskal
2
2
s
m
kg
m
N
Pa
at =1 kgf/cm
2
Temperatura to z
wielkość proporcjonalna
do średniej energii
kinetycznej
cząsteczek substancji.
Wielkości ekstensywne
– objętość, masa, ilość moli
poszczególnych składników, energia wewnętrzna, entropia dla
takiego układu są sumą swoich wartości dla poszczególnych
produktów.
Wielkości intensywne
- ciśnienie, temperatura (średnia energia
kinetyczna), gęstość nie zmieniły się po połączeniu.
Dwa identyczne układy scharakteryzowane przez ten sam
zespół parametrów stanu.
T
1
, V
1
, p
1
, m
1
, d
1
T
2
, V
2
, p
2
, m
2
, d
2
p – ciśnienie,
V – objętość,
n – liczba moli),
T –temperatura, T [K] = t [°C] + 273,15
R – uniwersalna stała gazowa
Równanie stanu
pV =nRT
Do opisu gazu doskonałego wystarczy podać trzy parametry dla jednoznacznego
określenia stanu układu.
William Henry
(ur. 12.12.1775 w
Manchesterze, zm.
02.091836 w
Pendlebury) -
brytyjski chemik i
lekarz.
Prawo
rozpuszczalności
gazów
Prawo Henry'ego, sformułowane w 1803 r. opisuje zależność
objętości v gazu rozpuszczonego w jednostce masy lub objętości
cieczy od ciśnienia tego gazu p nad powierzchnią cieczy.
Prężność pary substancji rozpuszczonej jest proporcjonalna do
ułamka molowego, a współczynnik proporcjonalności nie jest równy
prężności pary tej substancji w fazie czystej.
p
B
=x
B
K
B
K
B
– stała empiryczna [wymiar ciśnienia]
Roztwory idealne rozcieńczone:
-
rozpuszczalnik
spełnia prawo Raoulta,
-
substancja rozpuszczona
spełnia prawo Henry'ego.
Stosuje się tylko do tych gazów, które nie reagują z rozpuszczalnikiem.
..
.
.
W roztworze rozcieńczonym cząsteczki
rozpuszczalnika znajdują się o otoczeniu
nieznacznie różnym od otoczenia w czystym
rozpuszczalniku. Cząsteczki substancji
rozpuszczonej są w innej sytuacji.
Roztwór idealny
rozcieńczony prawo
Henry'ego
Roztwór idealny
prawo Raoulta
p
K
B
p
B
Ułamek molowy B x
B
0
1
Rozpuszczalnik jest
prawie czysty, prężność
pary jest proporcjonalna
do ułamka molowego.
Współczynnik
nachylenia = p
B
prawo
Raoulta
Składnik występujący w
niewielkim stężeniu
występuje stała
proporcjonalności K
B
.
Wykres prężności pary
składnika B jako funkcji
ułamka molowego jest
styczny do krzywej
doświadczalnej.
Przesuwaniu się cząsteczek cieczy względem sąsiednich
przeciwstawia się tarcie wewnętrzne, czyli
lepkość
.
Cząsteczki długie - lepkość większa, wpływ grup funkcyjnych.
Lepkość
Istnienie sił spójności między cząsteczkami cieczy powoduje, że
przesuwanie się jednych warstw cieczy względem drugich natrafia w
ruchu jednostajnym na pewien opór zwany tarciem wewnętrznym
lub lepkością. Mało ruchliwe płyny o dużej lepkości jak gliceryna
czy olej to ciecze o dużym tarciu wewnętrznym.
dx
dv
S
F
dx
dv
S
F
Zgodnie z laminarnym modelem przepływu lepkość wynika ze
zdolności płynu do przekazywania pędu pomiędzy warstwami
poruszającymi się z różnymi prędkościami.
Pęd – wielkość fizyczna opisująca ruch ciała.
Pęd punktu materialnego = iloczynowi masy i prędkości punktu.
Pęd jest wielkością wektorową kierunek i zwrot pędu jest zgodny z
kierunkiem i zwrotem prędkości.
p=mv
Lepkością nie jest opór przeciw płynięciu
powstający na granicy płynu i ścianek naczynia
Dla laminarnego przepływu warstwowego siła styczna F potrzebna
do wywołania różnicy szybkości dwóch warstw jest proporcjonalna
do różnicy tych prędkości, a odwrotnie proporcjonalna do
odległości pomiędzy warstwami
- współczynnik lepkości dynamicznej lub krótko lepkością
dynamiczną.
Różnice w prędkościach warstw są charakteryzowane w
modelu laminarnym przez szybkość ścinania.
Szybkość ścinania (ang. shear rate) – kinematyczny parametr
skalarny stosowany w mechanice płynów, wyrażający granicę
stosunku względnej różnicy prędkości między sąsiadującymi ze
sobą warstwami płynu do odległości między nimi.
Lepkość jest właściwością materii we wszystkich stanach
skupienia, związaną z oddziaływaniami międzycząsteczkowymi.
Lepkością albo tarciem wewnętrznym nazywa się opór, jaki
występuje podczas ruchu jednych części (warstw) ośrodka
względem innych.
Tradycyjnajednostka w układzie CGS (centymetr-gram sekunda) jest puaz P:
1P = 10-1Pa·s
s
Pa
m
m
s
m
N
S
dv
dx
F
2
Lepkość dynamiczna wyrażająca stosunek naprężeń ścinających do
szybkości ścinania.
Jednostka lepkości dynamicznej w układzie SI - kg/m·s
Lepkość kinematyczna czasami nazywana też kinetyczną jest
stosunkiem lepkości dynamicznej do gęstości płynu:
Jednostka lepkości kinematycznej w układzie SI - m
2
/s
Puaz (P) (poise) - jednostka lepkości dynamicznej w nazwana
na cześć francuskiego fizyka i lekarza Jeana L. Poisenille`a.
1 P = 1 dyn·s/cm
2
= 1 g·cm
−1
·s
−1
Lepkość cieczy w granicach 10
-2
-10
-3
poise`a
Zjawisko lepkości wykazują wszystkie ciecze i gazy. Jedynym szczególnym
wyjątkiem jest ciekły hel, który w temperaturach bliskich zera
bezwzględnego wykazuje zjawisko, nadciekłości, czyli zupełne zniknięcie
lepkości.
Ciecze – siły oddziaływań międzycząsteczkowych wraz ze
wzrostem temperatury maleją, czyli wzrost temperatury powoduje
obniżenie lepkości cieczy.
Gazy – wykazują wzrost lepkości w miarę przyrostu temperatury.
W stanie gazowym siły międzycząsteczkowe są bardzo słabe i ich
wpływ na tarcie wewnętrzne jest mały. Wzrost temperatury
zwiększa średnią prędkość cząsteczek gazu a to z kolei zmniejsza
średnią drogę swobodną i zwiększa częstotliwości zderzeń
cząsteczek, co prowadzi do wzrostu lepkości.
Pomiar poprzez mierzenie prędkości, z jaką ciecz wypływa pod
działaniem własnego ciężaru z naczynia zaopatrzonego w wąski
otwór u dołu.
Metody pomiaru lepkości cieczy
Metody oparte na pomiarze szybkości
-przepływu cieczy przez rurkę
-opadania kulki w badanej cieczy.
Wiskozymetr Ostwalda
Działanie wiskozymetrów kapilarnych opiera się na: strumień objętości
proporcjonalny jest do gradientu ciśnienia wzdłuż przewodu, a zatem i do różnicy
ciśnień na końcach przewodu.
Prawo Hagena-Poiseuille'a - prawo fizyczne opisujące zależność między
strumieniem objętości cieczy a jej lepkością.
l
p
r
v
8
4
Φ
V
– strumień objętości przepływu,
r – promień wewnętrzny przewodu,
η – współczynnik lepkości dynamicznej
płynu,
Δp – różnica ciśnień na końcach
przewodu,
l – długość przewodu.
Badaniem zjawiska lepkości zajmuje się reologia. Dział dotyczący technik
wyznaczania współczynników lepkości nazywa się wiskozymetrią, a
odpowiednie przyrządy – wiskozymetrami.
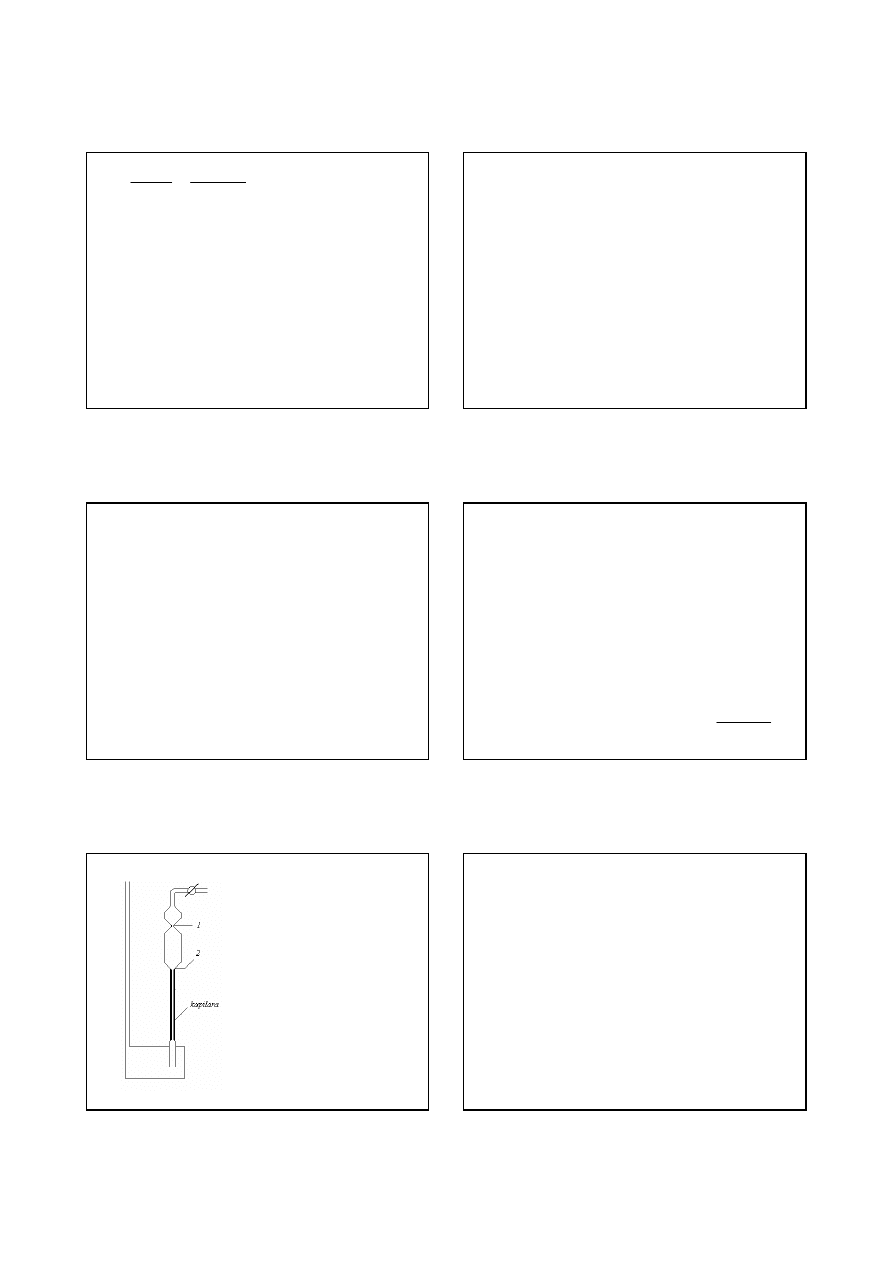
Wiskozymetr kapilarny - wiskozymetr Ostwalda
Wiskozymetr zapełnia się
określoną ilością cieczy,
zasysa się ją do ramienia
kapilary i mierzy się czas
potrzebny na to, by ciecz
swobodnie spłynęła od
znaku górnego (1) do
dolnego (2)
Wiskozymetr Höpplera
Miarą lepkości jest prędkość opadania kulki o znanych wymiarach i
gęstości w badanym ośrodku pod wpływem stałej siły zewnętrznej
(zwykle siły ciężkości). Wiskozymetr Höpplera służy do
dokładnych pomiarów lepkości gazów i cieczy przezroczystych o
charakterze newtonowskim. Przy zachowaniu poprawnej
temperatury próbki, lepkościomierz z opadającą kulką jest
najdokładniejszym z wiskozymetrów.
Zbudowany jest z rurki wypełnionej badaną cieczą. W rurce umieszczona jest
kulka. Jej średnica jest niewiele mniejsza od średnicy rurki, co zapewnia
stosunkowo długi czas opadania kulki. Wydłużenie tego czasu ma na celu
zwiększenie precyzji pomiaru. Rurka z badaną cieczą umieszczona jest w
cylindrycznym płaszczu wodnym połączonym z termostatem. Całość jest
nachylona pod kątem ok. 10° do pionu, aby ustabilizować pozycję kulki
względem rurki. Specjalne zawieszenie umożliwia obrót przyrządu o 180°, tak
aby kulka, która opadła na dół, znów znalazła się w górze.
Wiskozymetr ten został
skonstruowany przez
niemieckiego chemika Fritza
Höpplera.
Służy do pomiaru
współczynnika lepkości
dynamicznej cieczy.
= A(p
k
-p
c
)·t
ρ
k
– gęstość stali,
ρ
c
– gęstość badanej cieczy,
t – wyznaczany czas opadania.
Współczynnik Α to stała
wiskozymetru. Jest ona zazwyczaj
podawana przez producenta sprzętu.
Stałą tę można wyznaczyć
doświadczalnie poprzez kalibrację
wiskozymetru, używając cieczy o
znanym współczynniku lepkości.
Wiskozymetr Englera
Lepkość wyznacza się na podstawie czasu przepływu określonej ilości
płynu przez odpowiednio skalibrowane rurki kapilarne pod działaniem
znanej różnicy ciśnień. Wiskozymetr Englera stosowany jest głównie
do wyznaczania lepkości olejów i smarów.
Lepkościomierz (wiskozymetr) Englera składa się z następujących części:
właściwego naczynia pomiarowego, odbieralnika i termometrów.
Naczynie pomiarowe lepkościomierza Englera, wewnątrz polerowane
i złocone, umieszczone jest w kąpieli wodnej mającej na celu stabilizację
temperatury badanej cieczy w trakcie trwania pomiarów. Wewnątrz naczynia
pomiarowego, na bocznej jego ścianie umieszczone są trzy ostrza, według
których ustala się poziom badanej cieczy. Kapilara o znormalizowanych
wymiarach znajduje się w środku dna naczynia pomiarowego. Do zamykania
otworu kapilary służy odpowiednia zatyczka, osadzona przesuwnie w
pokrywie naczynia pomiarowego. Termometry umieszcza się w odpowiednich
tubusach. Służą one do pomiarów temperatury kąpieli wodnej i badanej cieczy
w naczyniu pomiarowym.
Ciecze newtonowskie i nienewtonowskie.
Ciecze, które stosują się do prawa Newtona, noszą nazwę cieczy
newtonowskich.
dx
dv
S
F
S
F
Naprężenie ścinające
gradient szybkości, zwany też szybkością ścinania
dx
dv
Dla cieczy newtonowskich naprężenie ścinające jest więc
proporcjonalne do gradientu szybkości, a lepkość stanowi
współczynnik proporcjonalności między tymi wielkościami.
Zasady dynamiki określają związki między ruchem ciała a siłami działającymi na nie.
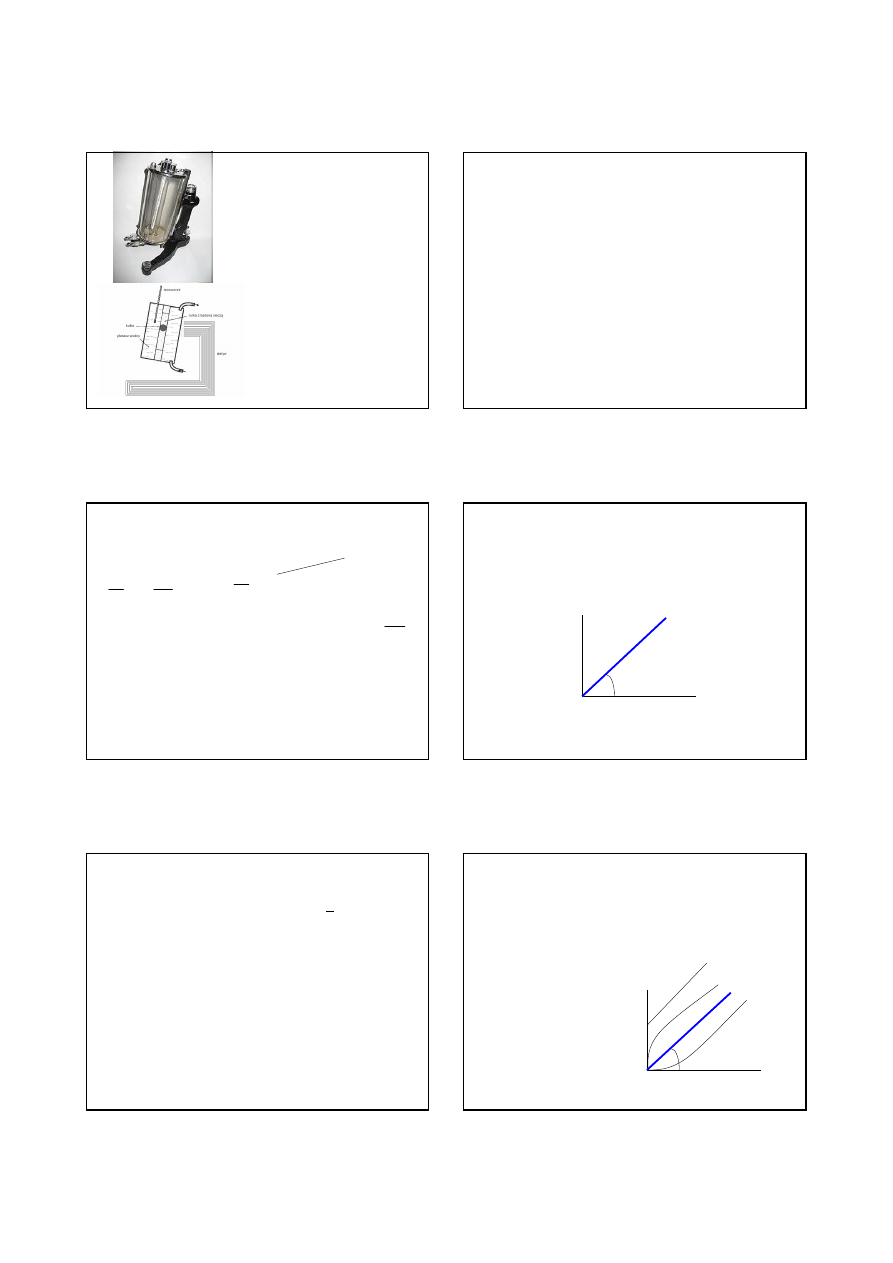
Krzywą płynięcia cieczy newtonowskiej jest linia prosta. Ciecze o
małej i średniej masie cząsteczkowej oraz roztwory substancji o
małej masie cząsteczkowej są cieczami newtonowskimi.
Krzywą płynięcia nazywamy wykres zależności naprężenia
stycznego od szybkości ścinania.
=tg
Krzywa płynięcia dla cieczy newtonowskich
Wiele układów koloidalnych i substancji stosowanych w praktyce
wykazuje jednak odstępstwa od prawa Newtona, polegające na tym,
że ze wzrostem gradientu prędkości iloraz
(nadal nazywany lepkością) maleje lub rośnie. Przyczyną takiego
zachowania jest tworzenie struktur wewnętrznych, które powodują
powstanie dodatkowej lepkości, zwanej lepkością strukturalną –
zależną od budowy cząsteczki i jej ewentualnego oddziaływania z
cząsteczkami rozpuszczalnika.
a
Ciecze nienewtonowskie są to ciecze, których krzywe płynięcia nie
są liniami prostymi. Ich lepkość często jest nazywana lepkością
pozorną lub strukturalną.
Lepkość (pozorna) η
a
cieczy nienewtonowskich zależy m.in. od
szybkości ścinania, kształtu naczynia, rodzaju procesu jakim
uprzednio poddawano ciecz.
= f()
Podział cieczy na newtonowskie i nienewtonowskie ma charakter umowny, gdyż
każda ciecz newtonowska zachowuje się w określonych warunkach (temperatury,
ciśnienia, prędkości ścinania itp.) jak ciecz nienewtonowska.
Ciecze nienewtonowskie można podzielić na 3 zasadnicze grupy.
ciecze, których własności reologiczne nie zmieniają się w czasie
ciecze, których własności reologiczne zmieniają się w czasie
ciecze lepkosprężyste, wykazujące oprócz własności
lepkościowych i efekty sprężyste.
Reologia - nauka
o plastycznej
deformacji
(odkształceniach)
oraz płynięciu
materiałów.
Szybkość
ścinania
Naprężenie
styczne
=tg
1
2
3
4
o
Krzywe płynięcia dla różnych płynów;
1-ciecz zagęszczona ścinaniem (n>1),
2-ciecz newtonowska (n=1, tgα=η),
3-ciecz rozrzedzona ścinaniem (n<1),
4-ciało plastyczne, τ
o
- granica płynięcia).
Wyszukiwarka
Podobne podstrony:
Chemia wyklad I i II (konfiguracja wiÄ…zania Pauling hybrydyzacja wiazania pi i sigma)
Chemia Wykład 6
pytania testowe i chemia budowlana -zestaw3, Szkoła, Pollub, SEMESTR II, chemia, wykład, testy
Chemia Wyklad 4 id 111675
chemia wykłady (6)
Chemia Wykład 9
ściąga chemia wykład, Studia, Sem 1,2 +nowe, ALL, szkoła, Chemia
chemia wykład
(CHEMIA WYKŁAD 7)
chemia wyklady wskrzynka(1), BUDOWNICTWO PŁ, Semestr I, chemia wykład
10.dysocjacja wykład, AGH różne, chemia wykłady
Chemia wykłady, koło II sem v.3.0 - do nauki, Izomeria optyczna
chemia wykład 2
3 chemiaogolna wyklad 061009
pytania testowe i chemia budowlana -zestaw1, Szkoła, Pollub, SEMESTR II, chemia, wykład, testy
więcej podobnych podstron