
MOHSEN HAJHEIDARI1, MOHAMMAD ABDOLLAHIAN-NOGHABI2, HOSSEIN
ASKARI1,
MANZAR HEIDARI1, SEYED Y. SADEGHIAN2, ERIC S. OBER3 AND GHASEM
HOSSEINI SALEKDEH1
PROTEOMICS 2005, 5, 950–960
Proteome analysis of sugar
beet leaves under
drought stress
WSTĘP
Susza
jest głównym czynnikiem hamującym
wydajność upraw buraka cukrowego (Beta vulgaris
L.). Mimo, że rośliny zbożowe są bardziej podatne na
niedobór wody to i tak powoduje poważne szkody w
uprawie buraka cukrowego w Wielkiej Brytanii oraz
Iranie.
Niedobór wody występuje kiedy wskaźnik transpiracji
jest większy od wskaźnika pobierania wody przez
roślinę. Zjawisko to jest dodatkowo potęgowane przez
zasolenie gleby oraz wysoką temperaturę powietrza.
Dochodzi wówczas do obniżenia potencjału wody,
obniżenia zawartości wody w komórce oraz zamykania
komórek szparkowych i zmniejszenia asymilacji CO2.
w konsekwencji roślina magazynuje mniej cukru w
korzeniach
Ekspozycja roślin na czynnik stresowy powoduje
szeroki zakres odpowiedzi w całej roślinie, na poziome
komórkowym oraz molekularnym.
Zmiany dotyczyły białek zaangażowanych w
odpowiedź na stres, detoksykację, zwijanie białek,
degradację białek oraz białek nie powiązanych
bezpośrednio ze stresem.
Głównym celem rośliny odpowiadającej na czynnik
stresowy jest utrzymanie homeostazy, pozbycia się
elementów toksycznych(detoksykacja) oraz
regeneracja.
Wcześniejsze badania prowadzone na ryżu, kukurydzy
czy dzikim arbuzie wykazują, że susza ma wpływ na
szeroką gamę szlaków metabolicznych: poczynając od
fotosyntezy do lignifikacji.
CELE BADANIA
Ilościowo określić zmiany w proteomie liścia buraka
cukrowego porównując grupę kontrolną i rośliny
wyeksponowane na stres suszy
Określić stopień zmian genetycznych w odpowiedzi na suszę na
poziomie molekularnym mierząc ilościowo oraz jakościowo
zmiany w proteomie dwóch genotypów buraka cukrowego
Głównym celem badania była ostateczna identyfikacja
genu dla MAS, aby poprawić tolerancję na suszę oraz
zwiększyć efektywność wykorzystania wody.
MAS
Proces, w którym znacznik (morfologiczny,
biochemiczny lub oparty na zmienności
DNA/RNA) użyty jest do wyszukania
markerów genów powodujących odpowiedź
na zmiany wywołane przez czynnik nas
interesująy(np. wydajność, odporność na
choroby, odporność na stres abiotyczny)
Materiały i metody
Do badań użyto dwóch genotypów buraka
cukrowego: 7112 oraz 7219-P.69 w zagęszczeniu
100 000 roślin na hektar. Nasiona wysiano na
kwadratowych poletkach doświadczalnych w
trzech powtórzeniach
Wszystkie rośliny podlewano do stadium 4 liścia,
następnie podlewano już tylko grupę kontrolną
Próbki do badań zebrano po 157 dniach po
wysianiu
Podczas badań każda roślina w warunkach
kontrolnych oraz w warunkach stresu suszy
otrzymała odpowiedni: 935 i 380 mm wody
Materiał do badań
Do badań użyto 3 próbek;
I próba zawierała: blaszkę wyizolowaną z
ogonka liściowego oraz korony korzeniowe(100
losowo wybranych roślin) wysuszone w w 80◦C
przez 48h aż do uzyskania suchej masy.
II próba zawierała po ¼ liścia(10 losowo
wybranych roślin) niezbędnych do zbadania
względnej zawartości wody
III próba zawierała podobne morfologicznie
liście(10 losowo wybranych roślin), zastosowane
później do badań proteomicznych, które zostały
natychmiast zamrożone w ciekłym azocie
Ekstrakcja białek
Homogenizacja próbek i denaturacja białek:
ciekły azot, 10% TCA, 0,07 %DTT,
Liofilizacja osadu
Zawieszenie proszku w buforze rozpuszczającym
zawierającym 9 M mocznik, 4% CHAPS, 1% DTT ,
związki amfoteryczne, pH 3-10, Tris zasadowy
Określenie całkowitego stężenia białek metodą
ilościowej analizy Bradforda
Wykonanie IEF(ogniskowanie izoelektryczne)
oraz elekroforezy SDS-PAGE, wizualizacja białek
azotanem srebra oraz zabarwienie żelu kumazyną
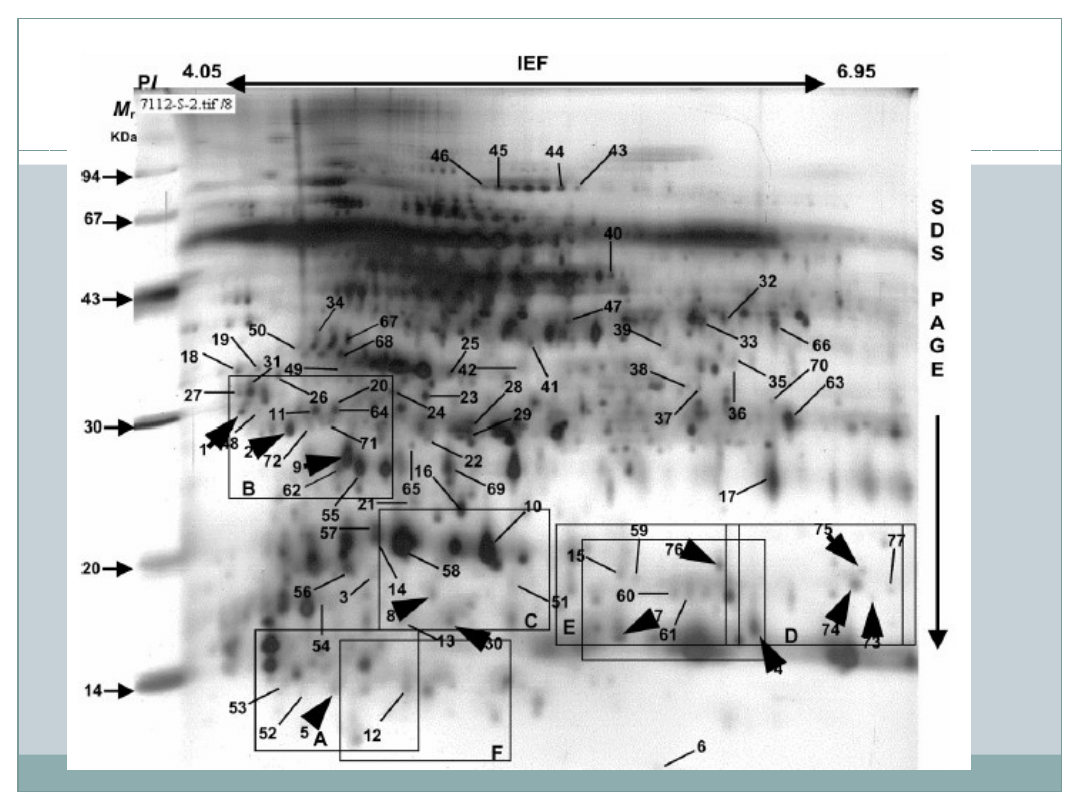
Analiza obrazu i informacji
Analiza LC-MS/MS
Uzyskany rozdział białek na żelu
zeskanowano używając densytometru
Obróbka obrazu, detekcja „punktów”
białkowych, analiza ilościowa za pomocą
programu Melanie 3
20 białek pokazujących największe zmiany w
roślinie pod wpływem suszy wysłano do
analizy LC-MS/MS
Identyfikacja białek za pomocą programu
Mascot
Wyniki
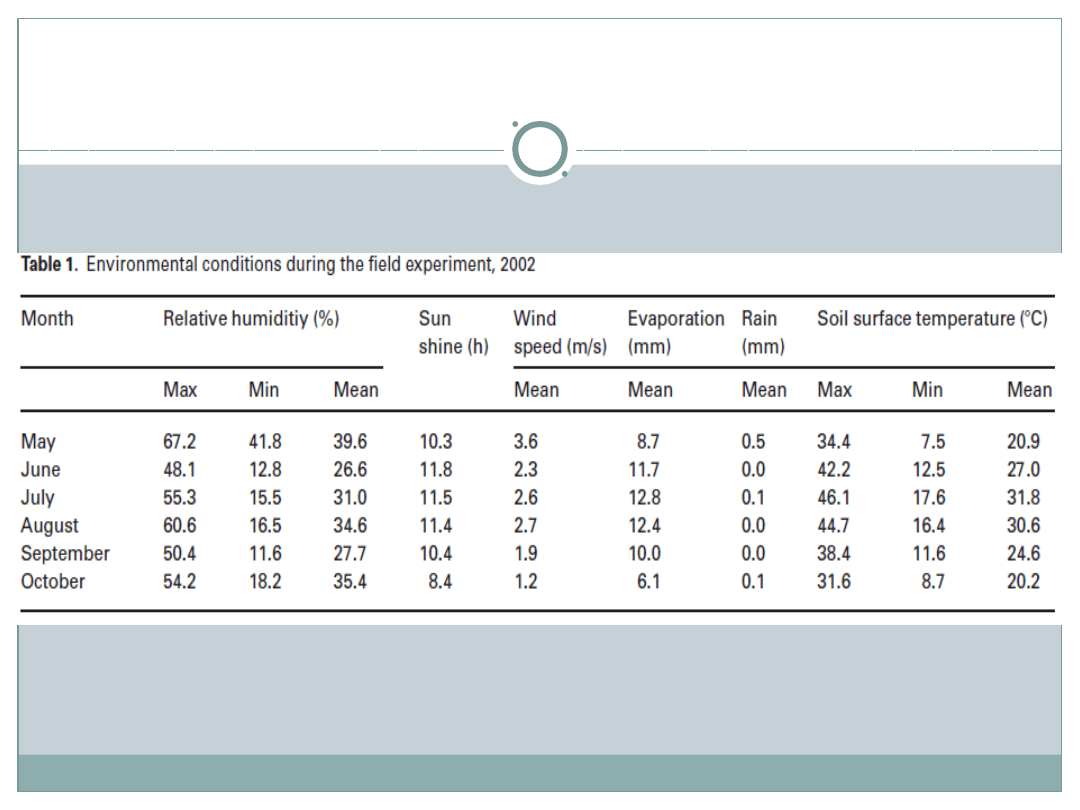
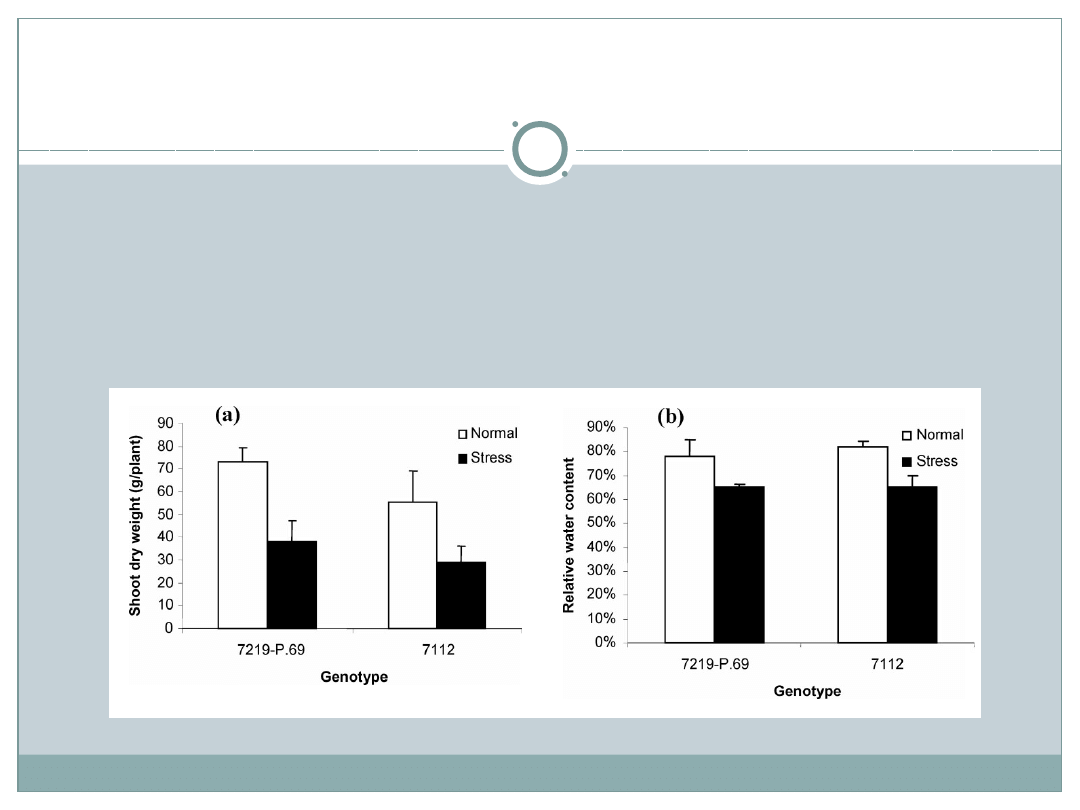
Po 157 dniach po wysianiu w warunkach stresu suszy w
obu genotypach zaobserwowano mniejszą zawartość wody-
ok. 65% oraz mniejszą masę pędów- ok. 50%. Pod tym
względem rośliny nie różnią się miedzy sobą. Dopiero
analiza proteomiczna wykaże subtelne różnice niewidoczne
podczas badania suchej masy.
Podczas barwienia azotanem srebra
wykryto, powtarzalnie, ponad 500 punktów
białkowych. Z nich 77 wykazało znaczące
zmiany między proteomem obu genotypów a
grupą kontrolną grupy 7112 wywołane
deficytem wody
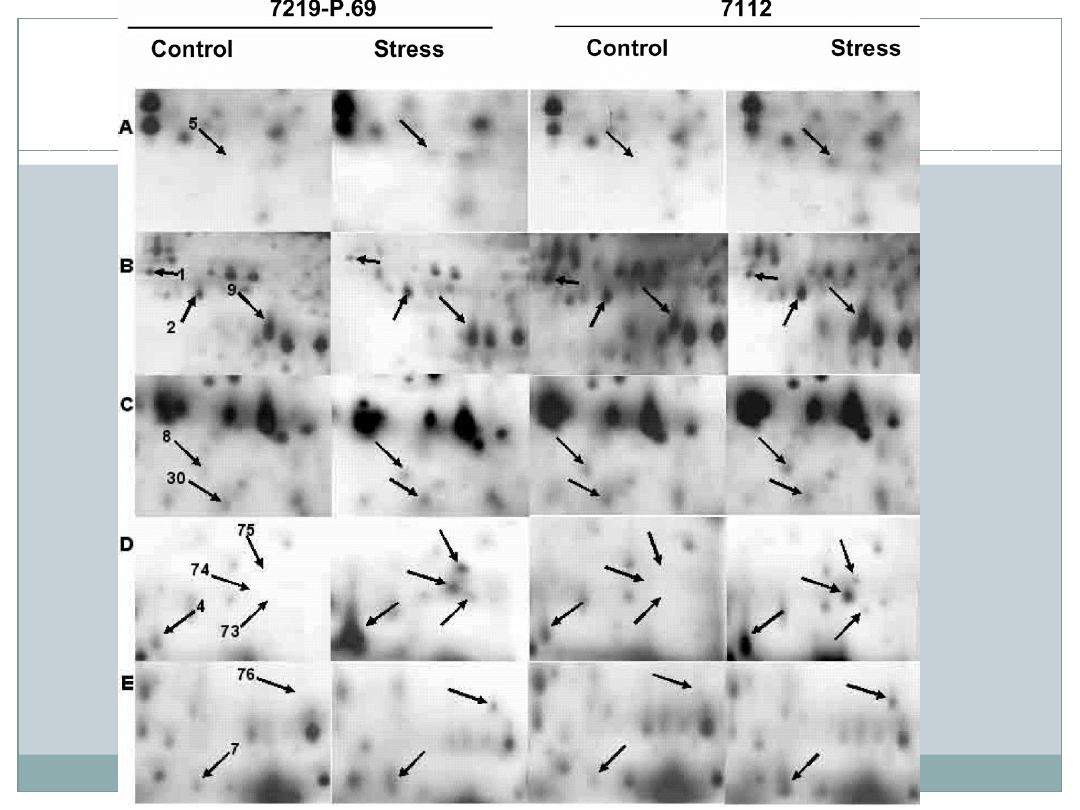

Porównując oba genotypy – 79 białek uległo
zmianie: stężenie 27 białek zwiększyło się;
stężenie 44 zmniejszyło się; 8 białek wykryto
tylko u roślin pod wpływem suszy
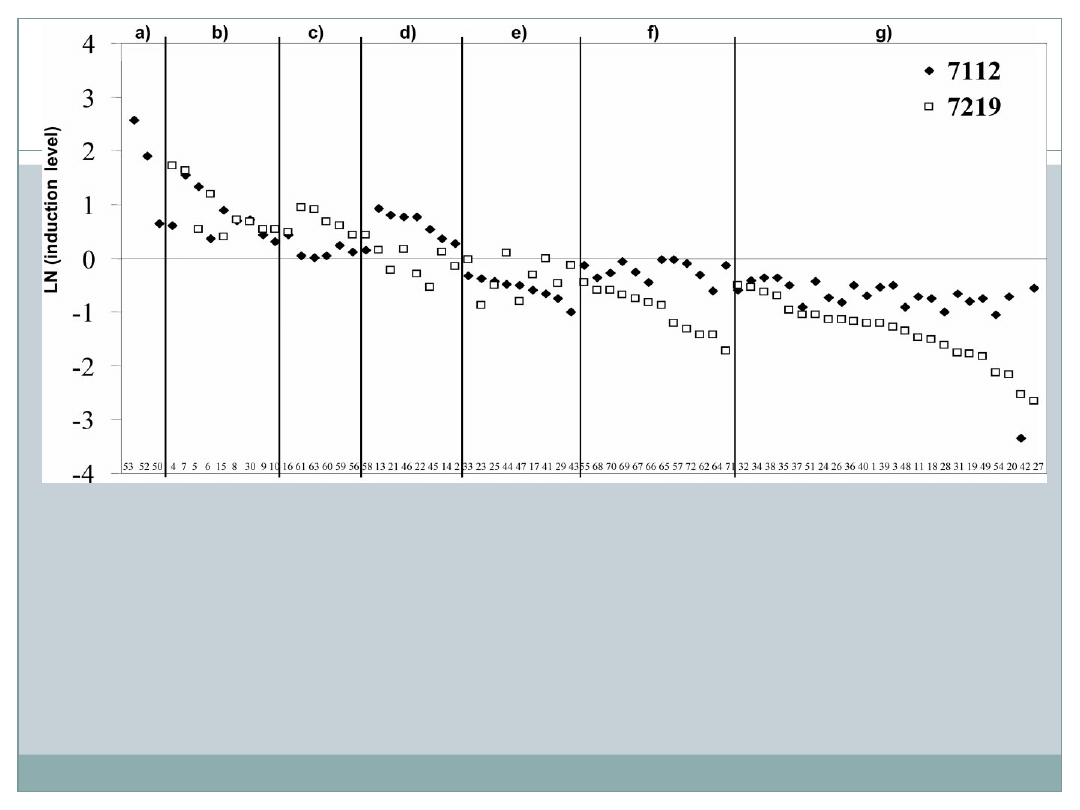
Figure 6. Abundance ratio of 71 individual leaf proteins in drought-stressed and well-
watered plants of 7219-P.69 and 7112 at 157 DAS. The
ratio is expressed as Ln (abundance in stressed plants/abundance in control plants). Abundance
data is from Table 2. Proteins were
grouped according to expression pattern: (a) only detected in 7112 genotype and upregulated
under stress, (b) upregulated in both genotypes,
(c) upregulated in 7219-P.69, (d) upregulated in 7112, (e) down-regulated in 7112, (f)
downregulated in 7219-P.69, (g) downregulated
in both genotypes.
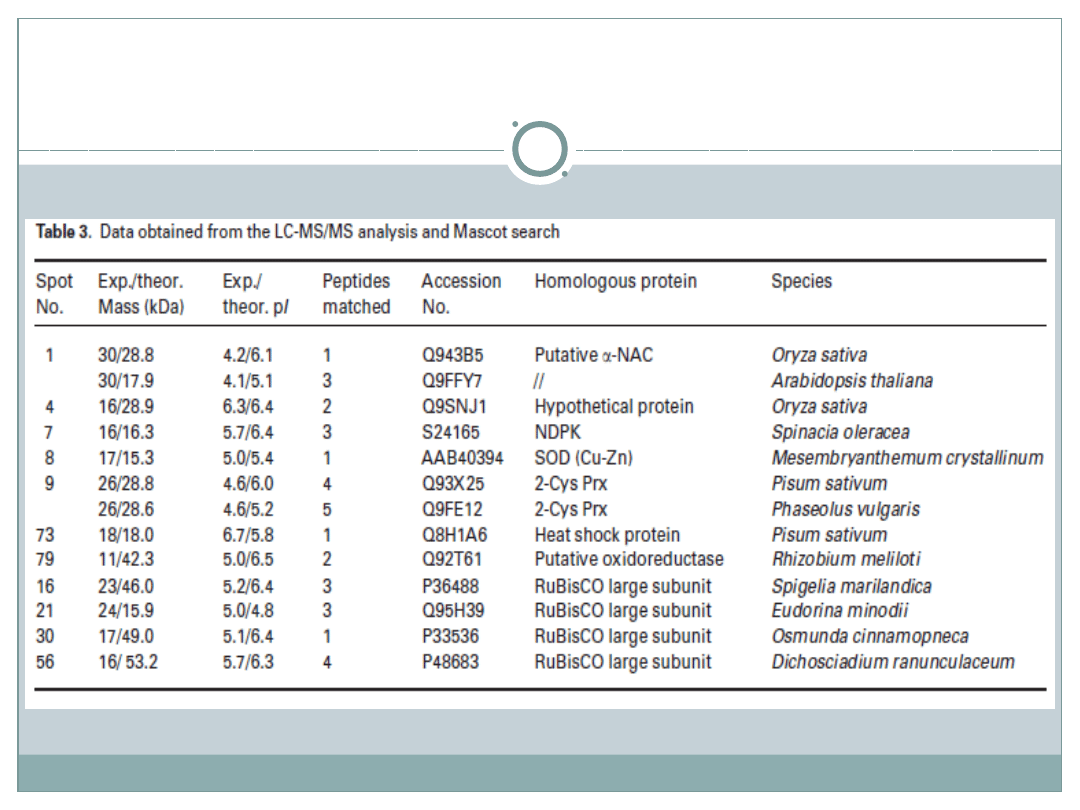
Identyfikacja białek
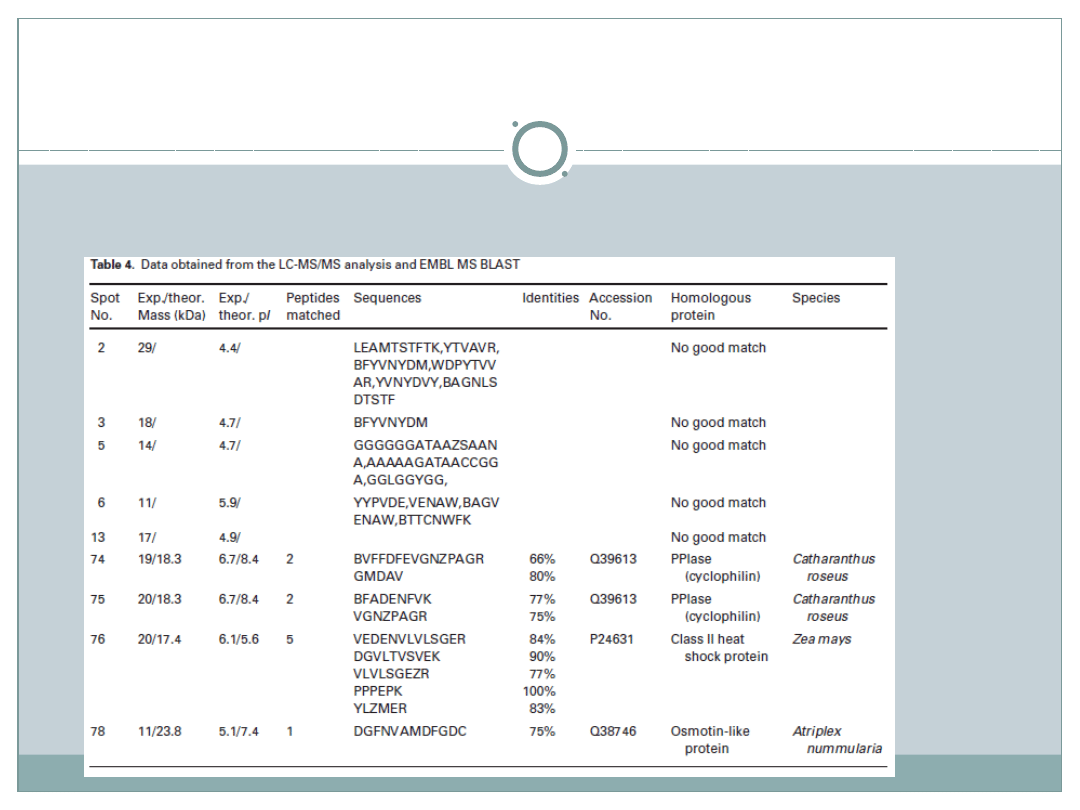
Z 20 białek wysłanych do badania LC-MS/MS
udało zidentyfikować się 11, z czego:
2 białka wykryte tylko w roślinach poddanych stresowi
suszy: białko szoku cieplnego HSP oraz
przypuszczalna oksyreduktaza
8 białek o stężeniu wyższym : 2-cysteino
peroksyredoksyna( 2-Cys Prx), dysmutaza
ponadtlenkowa (SOD), kinaza nukleotydowo 2-
fosforanowa(NDPK), białko hipotetyczne, cztery
fragmenty Rubisco
1 białko o stężeniu niższym: przypuszczalnie
powstający kompleks białkowy α-NAC
Pozostałe 9 białek poddano interpretacji manualnej: detekcję białek uzyskano
dzięki porównaniu ich sekwencji z homologami innych białek
Opracowanie wyników
HSP- białka szoku cieplnego
Zidentyfikowano 2 rodzaje tych białek
Białko to syntetyzowane we wszystkich
tkankach wegetatywnych w odpowiedzi na
odwodnienie rośliny
HSP spełnia różnorodne funkcje w komórce:
działa jako molekularny chaperon, zmniejsza
wewnątrzkomórkowy poziom tlenu
reaktywnego, chroniąc w ten sposób
fotosystem PSII podczas stresu
Enzymy detoksykacyjne- SOD
Niskie stężenie reaktywnych form tlenu(ROS) wpływa
korzystnie na funkcjonowanie komórki, natomiast
podczas ataku patogenu lub suszy poziom ROS
podnosi się i może degradować lipidy, białka,
terpenoidy, węglowodany czy kwasy nukleinowe. Tym
zjawiskom przeciwdziałają enzymy detoksykacyjne
W komórkach buraka cukrowego obu genotypów
wykryto cytoplazmatyczną dysmutazę
ponadtlenkową( Cu-Zn SOD) o stężeniu dużo wyższym
niż w komórkach roślin kontrolnych, co jest
ewidentnym dowodem na to że ten enzym spełnia
ważna rolę w tolerancji suszy.
Enzymy detoksykacyjne- 2-Cys Prx
2-Cys Prx: 2-cysteino peroksyredoksyna jest
detoksykacyjnym enzymem katalizujacym w
chloroplastach nadtlenek wodoru, który dla
nich jest szczególnie niebezpieczny. Enzym ten
działa zarówno w warunkach normalnych jak i
podczas deficytu wody
W komórkach buraka cukrowego grupie roślin
badanych wykryto podwyższone stężenie tego
enzymu co świadczy o odpowiedzi
metabolicznej rośliny na czynnik stresowy.
Cyklofiliny
Cyklofiliny są białkami katalizującymi izomeryzację
cis/trans wiązania peptydowego. Proces ten odgrywa
ważną rolę w zwijaniu białek de novo i izomeryzacji
natywnych protein w licznych systemach komórkowych
związanych z transportem przez błony komórkowe
Jedną z cyklofilin wykrytych w komórkach buraka
cukrowego była izomeraza peptydylo –
prolinowa(PPIaza). Enzym ten występował tylko w
roślinach poddanym stresowi suszy.
Badania nad sorgo wykazały ,że podwyższony poziom
tego enzymu występuje tylko u roślin odpornych na
suszę, a w roślinach tj. sosna, soja czy winogrono,
które są często wystawione na działanie suszy również
zaobserwowano cyklofiliny. Istnieje więc podejrzenie
że PPIaza bierze czynny udział w tolerancji suszy.
NDPK- kinaza nukleotydowo 2-
fosforanowa
Enzym ten utrzymuje, kosztem ATP
wewnątrzkomórkowe stężenie CTP, UTP i GTP. Spełnia
również ważną rolę w odpowiedzi hormonalnej na
szok cieplny, stres suszy, aktywuje kinazę stymulującą
mitozę, bierze pośredni udział w sygnałowaniu,
wzroście oraz rozwoju rośliny.
Badania nad stresem suszy oraz zasolenia na pszenicy,
sorgo i sośnie potwierdziły ogromny udział tego
enzymu w zwielokrotnieniu tolerancji na czynniki
stresowe
W obu genotypach buraka cukrowego zanotowano
wysoką nadekspresję genu kodującego NDPK, co może
świadczyć o roli tego enzymu nad tolerancją suszy.
α-NAC(polypeptide-associated
complex α-chain)
W przeciwieństwie do powyższych białek, białka
α-NAC jest znacząco mniej w roślinach
badanych
Białko to powiązane jest z rybosomami i
uczestniczy w zapobieganiu złej translokacji nowo
powstających polipeptydów oraz chroni przed
przyłączeniem się nieodpowiednich czynników.
Spadek tego stężenia w komórce może być
odzwierciedleniem nieprawidłowej translacji,
translokacji czy proteolizy białek spowodowanej
stresem suszy
Rubisco
W próbce zidentyfikowano 4 fragmenty dużej
podjednostki Rubisco w stężeniu znacznie
wyższym niż w grupie kontrolnej.
To zjawisko tłumaczy się wyższym stężeniem
reaktywnych form tlenu, które degradują
Rubisco
Jednakże badania nad ryżem wykazały, że
zwiększona zawartość podjednostek Rubisco
służy jako rezerwuar azotu.
Uwagi końcowe
Jest to pierwsza praca na temat reakcji buraka cukrowego
na stres suszy w warunkach naturalnych
Różnice w stężeniach tych samych białek w obu
genotypach buraka cukrowego świadczy o istotnych
zmianach w genach ulegających ekspresji podczas stresu
suszy
Przeważająca część z 11 zidentyfikowanych białek
odgrywa ważną rolę w unieszkodliwianiu reaktywnych
form tlenu. Podkreśla to jak ważne jest pozbywanie się
ROS w utrzymaniu homeostazy i funkcjonalności rośliny
Kolejne rozpoznane białka zaangażowane są w poprawne
zwijanie białek i ich stabilność, co również zakłócane jest
przez ROS pod wpływem stresu suszy
Ta informacja sugeruje że białka lub białka o podobnej
funkcji mogą być głównym czynnikiem usprawniającym
tolerancję na stres suszy.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
Wyszukiwarka
Podobne podstrony:
A proteogenomic analysis of Sh flexneri
1998 The influence of sugar beet fibre, guar gum and inulin on
20,000 Leagues Under the Sea Analysis of the?ginning
Prospect theory an analysis of decision under risk
An analysis of the energy efficiency of winter rapeseed biomass under
An%20Analysis%20of%20the%20Data%20Obtained%20from%20Ventilat
A Contrastive Analysis of Engli Nieznany (3)
Analysis of soil fertility and its anomalies using an objective model
Pancharatnam A Study on the Computer Aided Acoustic Analysis of an Auditorium (CATT)
Butterworth Finite element analysis of Structural Steelwork Beam to Column Bolted Connections (2)
Analysis of the Persian Gulf War
Extensive Analysis of Government Spending and?lancing the
Analysis of the Holocaust
7 Modal Analysis of a Cantilever Beam
Illiad, The Analysis of Homer's use of Similes
Analysis of the Infamous Watergate Scandal
Road Not Taken, The Extensive Analysis of the Poem
Analysis of the End of World War I
Night Analysis of the Novel
więcej podobnych podstron