
chemia stosowana I
temat:
wiązania chemiczne
rodzaje wiązań chemicznych
Każdy atom dąży do uzyskania
konfiguracji elektronowej najbliższego
gazu szlachetnego.
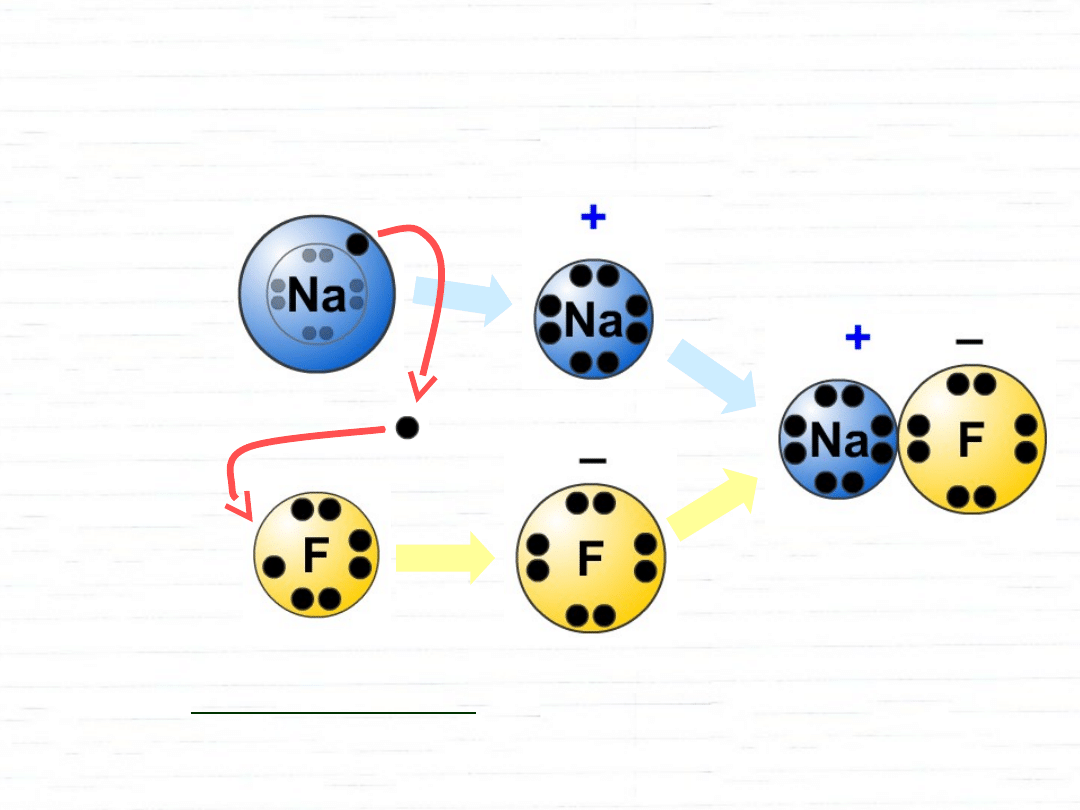
Wiązanie jonowe – para elektronowa przechodzi
całkowicie do jednego z atomów (A• + •B A
+
+ :B
–
),
rodzaje wiązań chemicznych
Każdy atom dąży do uzyskania
konfiguracji elektronowej najbliższego
gazu szlachetnego.
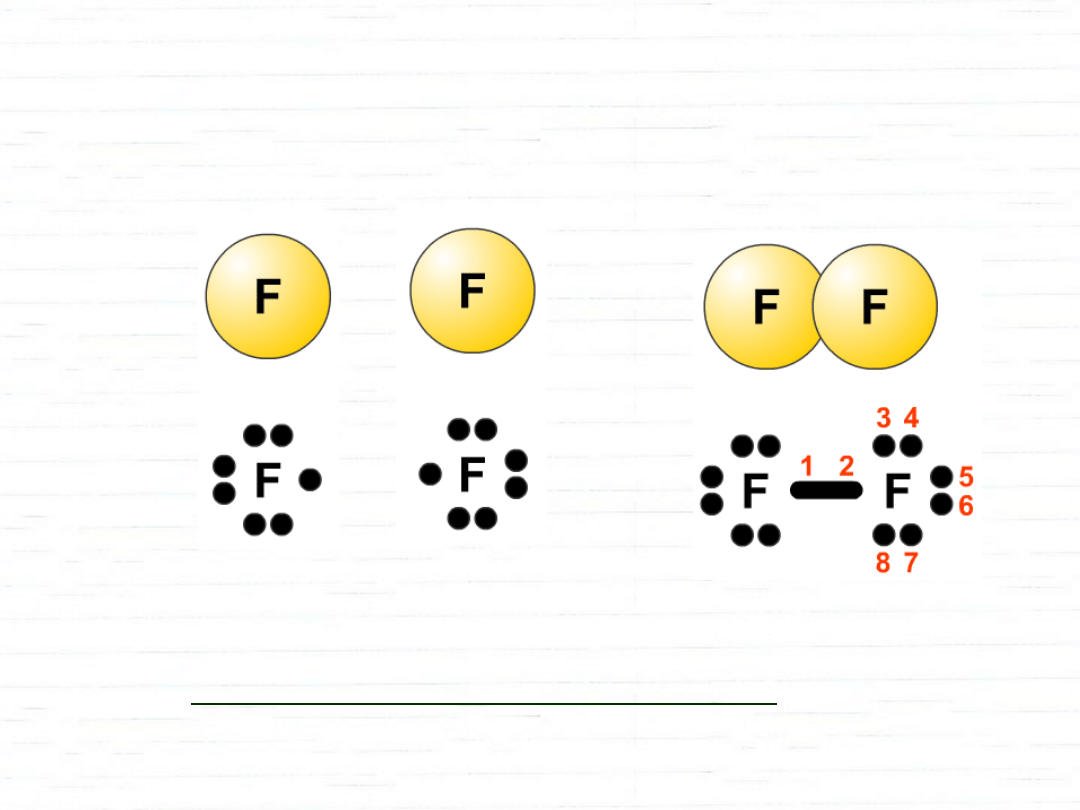
Wiązanie atomowe (kowalancyjne) –
Dwa atomy
mającce niesparowane elektrony uwspólniają parę
elektronową.
rodzaje wiązań chemicznych
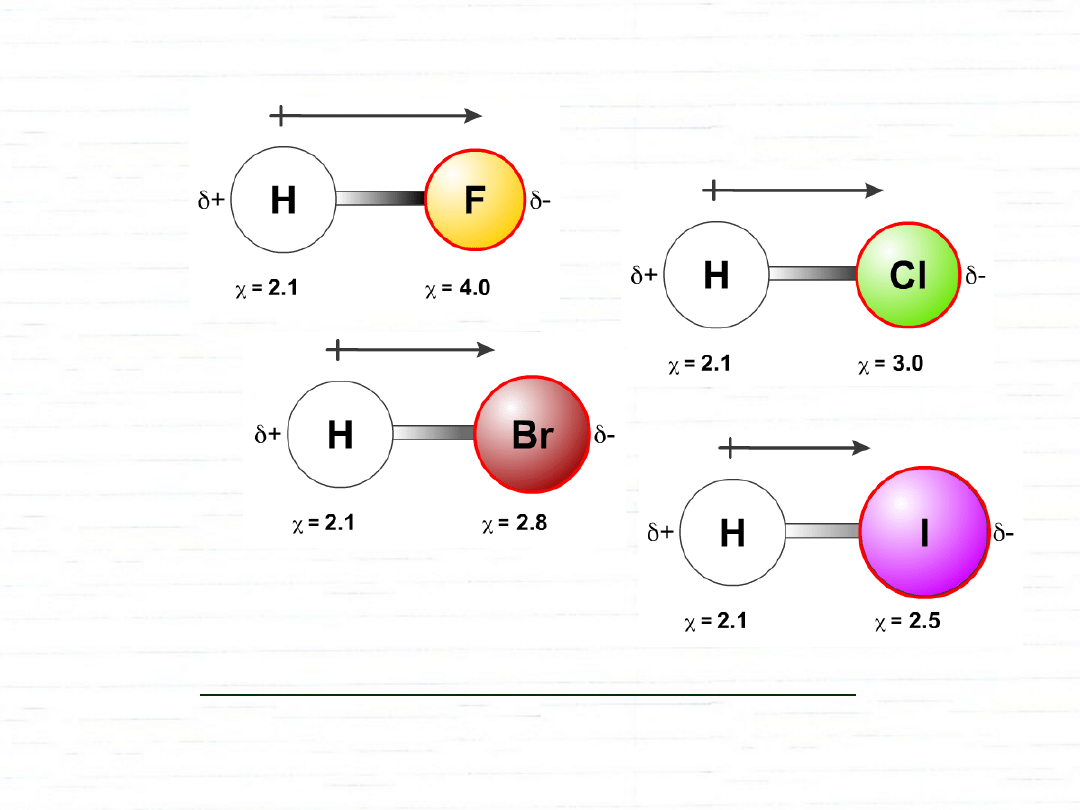
Wiązanie kowalencyjne spolaryzowane – para
elektronowa jest „przesunięta” w kierunku jednego z
atomów.
- elektroujemność

skala elektroujemności wg Paulinga
H
2,1
Li
1,0
Na
0,9
K
0,8
Rb
0,8
Cs
0,7
Fr
0,7
Be
1,5
Mg
1,2
Ca
1,0
Sr
1,0
Ba
0,9
Ra
0,9
La
1,0
Ac
1,1
Sc
1,3
Y
1,2
Ti
1,5
Zr
1,4
Hf
1,3
Rf
V
1,6
Nb
1,6
Ta
1,5
Db
Cr
1,6
Mo
1,8
W
1,7
Sg
Mn
1,5
Tc
1,9
Re
1,9
Bh
Fe
1,8
Ru
2,2
Os
2,2
Hs
Co
1,9
Rh
2,2
Ir
2,2
Mt
Ni
1,9
Pd
2,2
Pt
2,2
Cu
1,9
Ag
1,9
Au
2,4
Zn
1,6
Cd
1,7
Hg
1,9
B
2,0
Al
1,5
Ga
1,6
In
1,7
Tl
1,8
C
2,5
Si
1,8
Ge
1,8
Sn
1,8
Pb
1,9
N
3,0
P
2,1
As
2,0
Sb
1,9
Bi
1,9
O
3,5
S
2,5
Se
2,4
Te
2,1
Po
2,0
F
4,0
Cl
3,0
Br
2,8
I
2,5
At
2,2
He
Ne
Ar
Kr
Xe
Rn
0%
25%
50%
75%
100%
0.0
0.5
1.0
1.5
2.0
2.5
3.0
różnica elektroujemności
u
d
zi
a
ł c
h
a
ra
kt
e
ru
jo
n
o
w
e
g
o
CH
4
H
2
O
NaCl
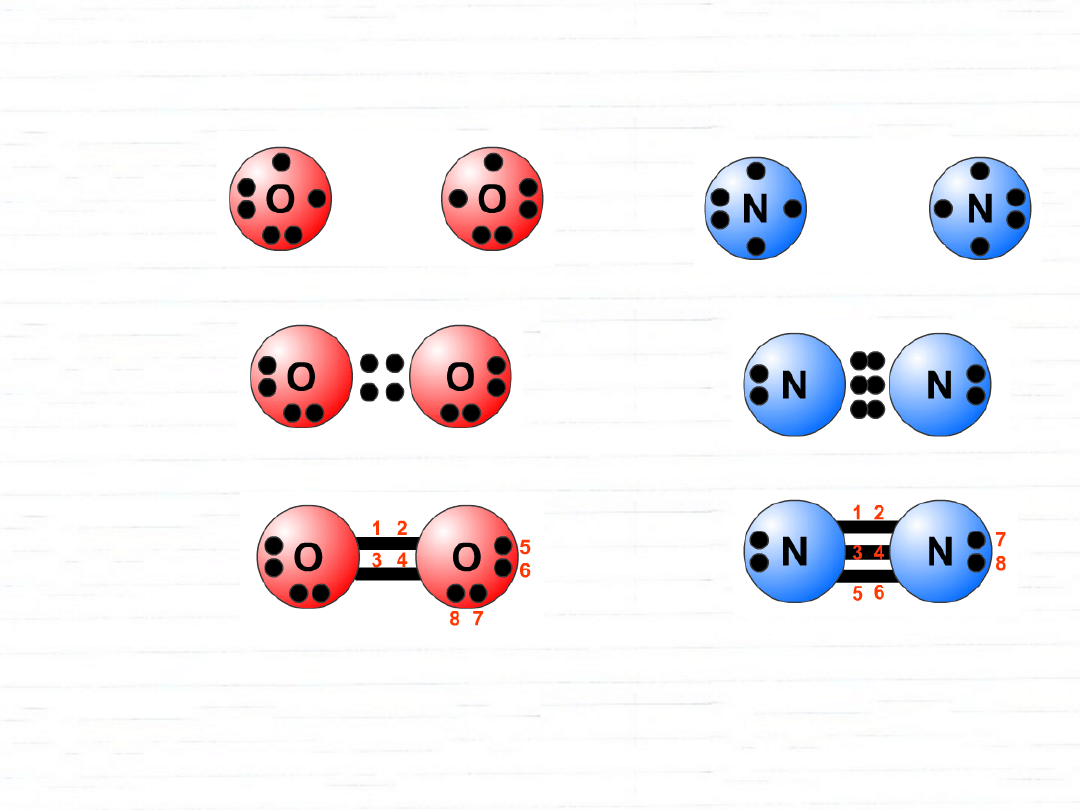
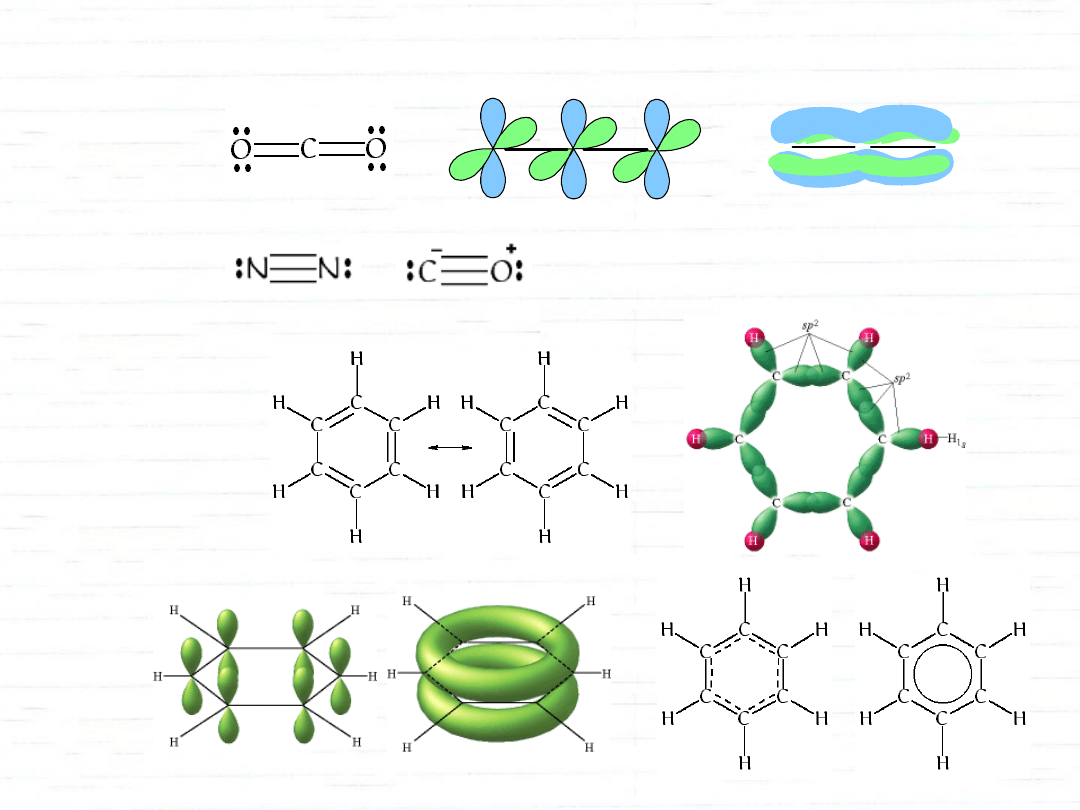
wiązania wielokrotne
pierwsze wiązanie - współosiowe nakładanie orbitali - typ
kolejne wiązania - poprzeczne nakładanie orbitali - typ
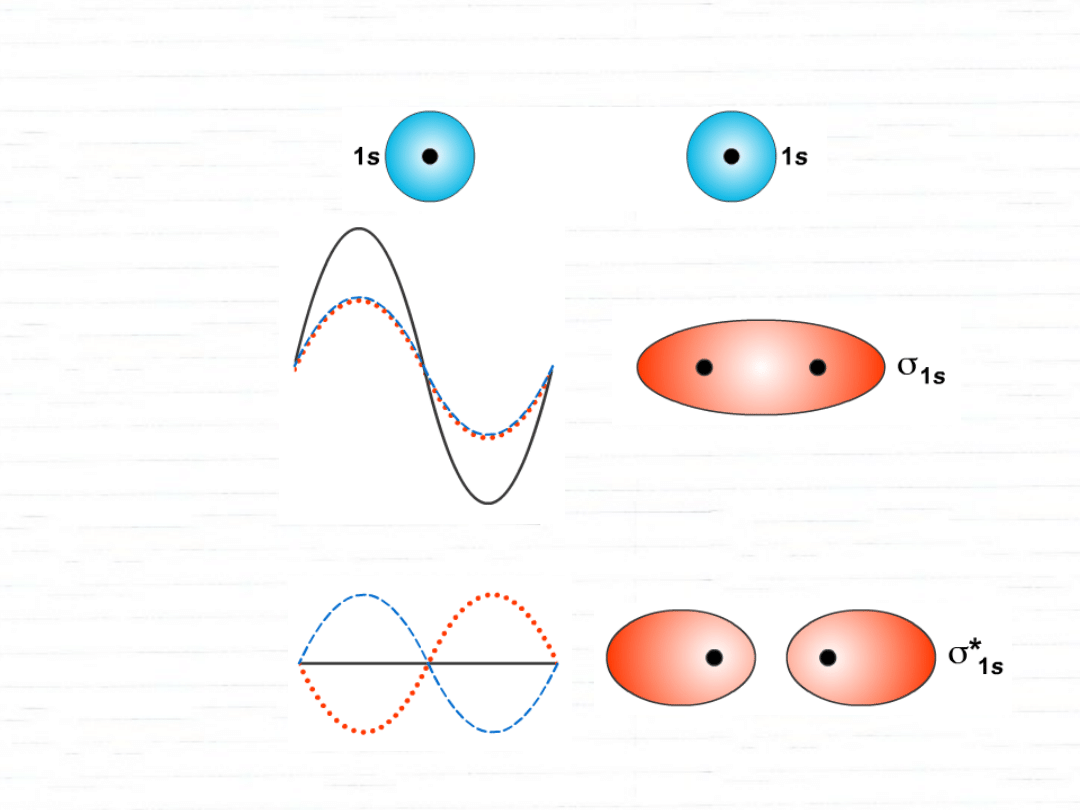
orbitale cząsteczkowe
wzmocnienie fali - orbital wiążący
wygaszenie fali - orbital antywiążący
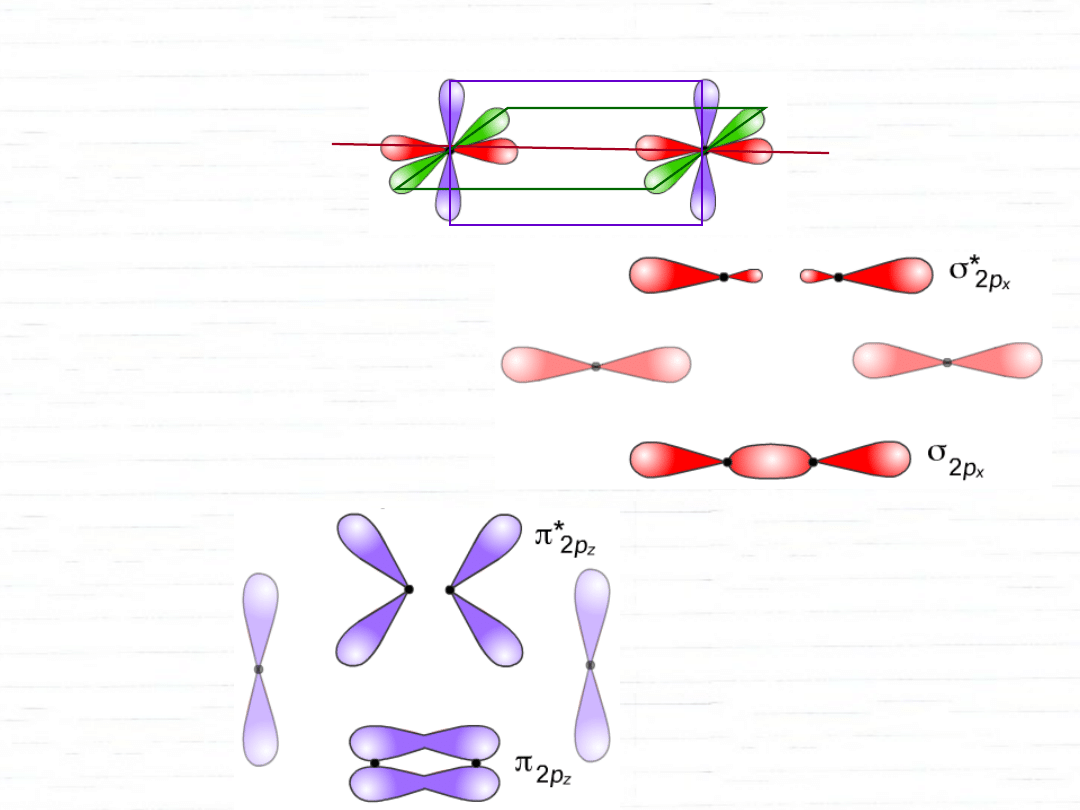
orbitale cząsteczkowe
wiązanie
(współosiowe)
wiązanie
(poprzeczne)
orbital antywiążący
orbital antywiążący
orbital wiążący
orbital wiążący
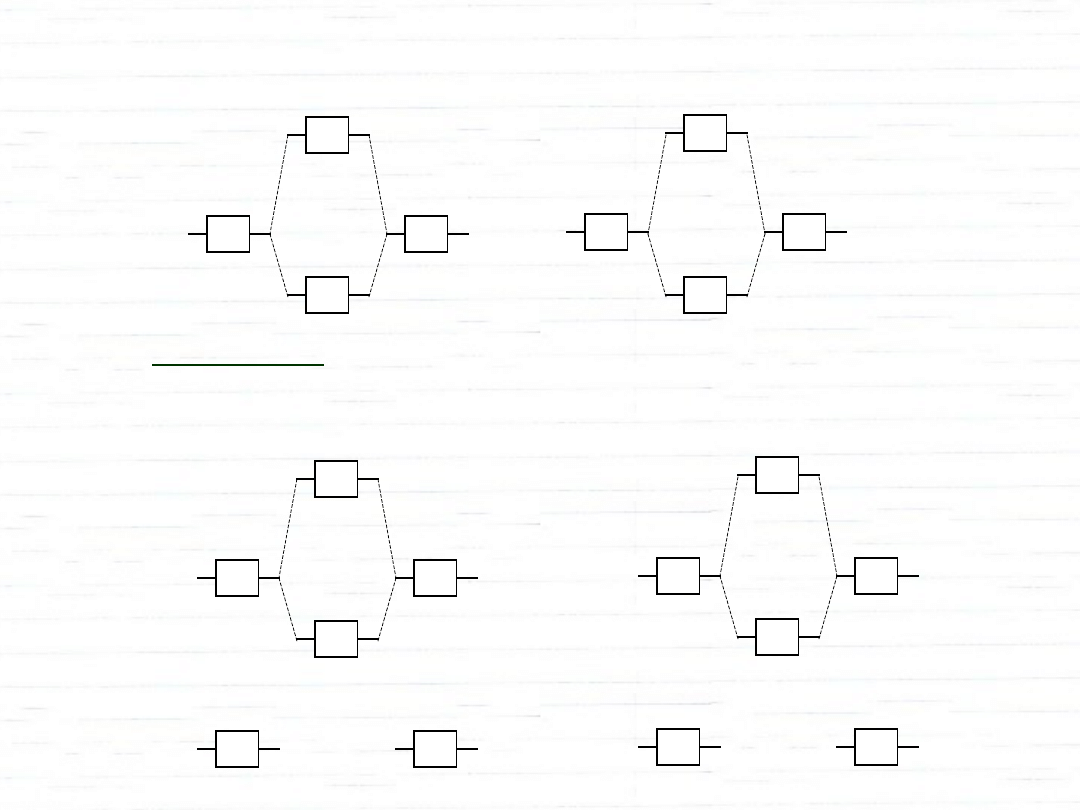
*
2s
2s
2s
2s
1s
1s
*
1s
1s
1s
1s
dwuatomowe orbitale homojądrowe
*
1s
1s
1s
1s
*
2s
2s
2s
2s
1s
1s
H
2
He
2
Li
2
Be
2
He
2
+
trwała
trwała
nietrwała
nietrwała
trwała
rząd wiązania:
1
/
2
Rząd wiązania:
1
/
2
·(ilość e
-
na orbitalach wiążących - ilość e
-
na orbitalach antywiążących)
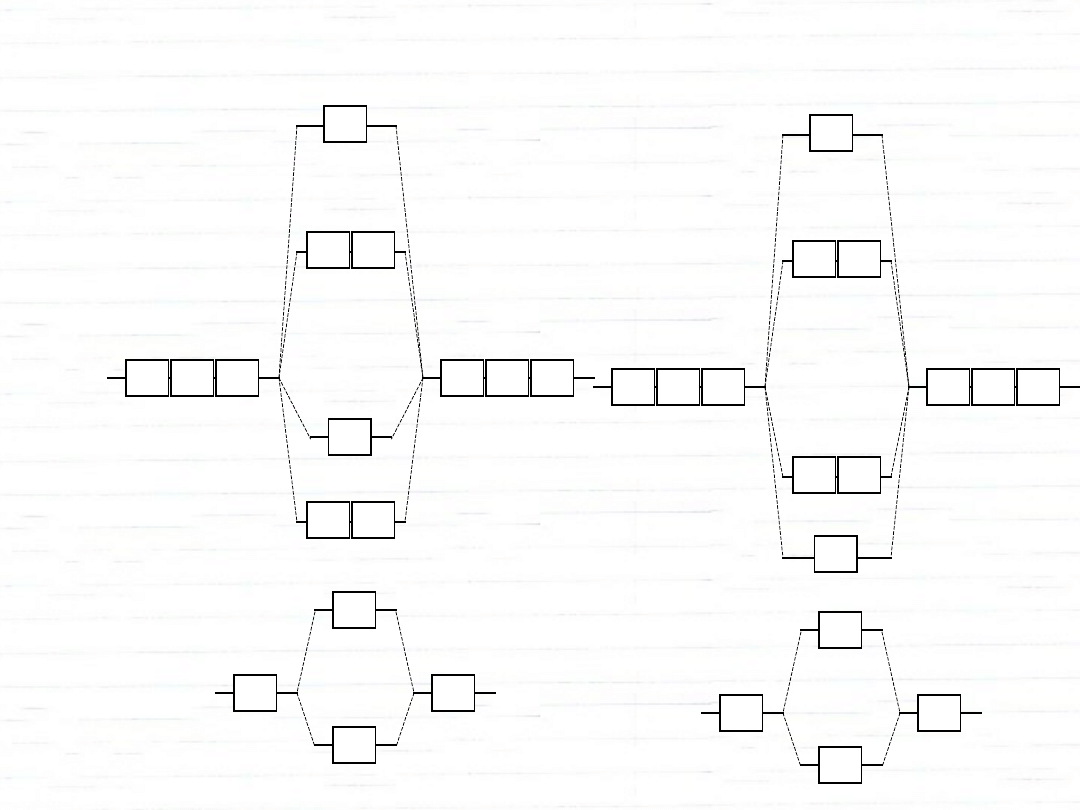
2p
z
2p
y
*
2s
2s
2s
2s
*
2p
x
2p
x
2p
2p
*2p
z
*2p
y
2p
z
2p
y
*
2s
2s
2s
2s
*
2p
x
2p
x
2p
2p
*2p
z
*2p
y
dwuatomowe orbitale homojądrowe
O
2
rząd
wiązania:
2
N
2
rząd
wiązania:
3
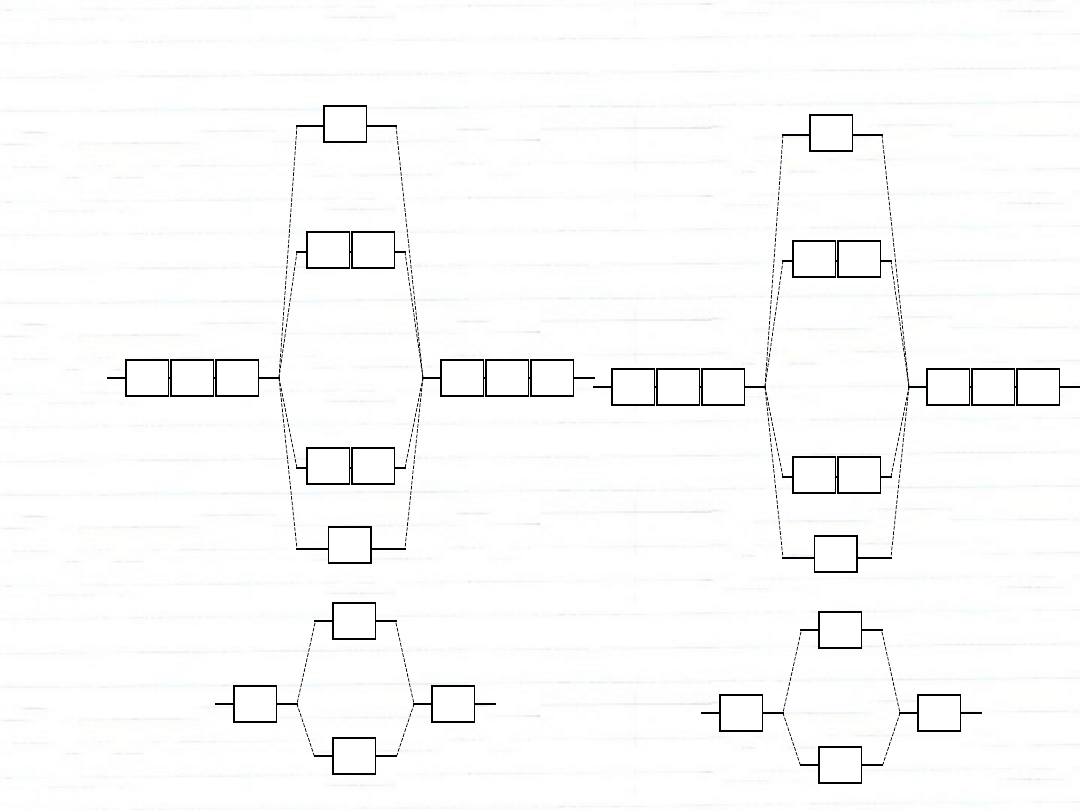
2p
z
2p
y
*
2s
2s
2s
2s
*
2p
x
2p
x
2p
2p
*2p
z
*2p
y
dwuatomowe orbitale homojądrowe
2p
z
2p
y
*
2s
2s
2s
2s
*
2p
x
2p
x
2p
2p
*2p
z
*2p
y
F
2
rząd
wiązania:
1
Ar
2
nietrwała
rząd
wiązania:
0
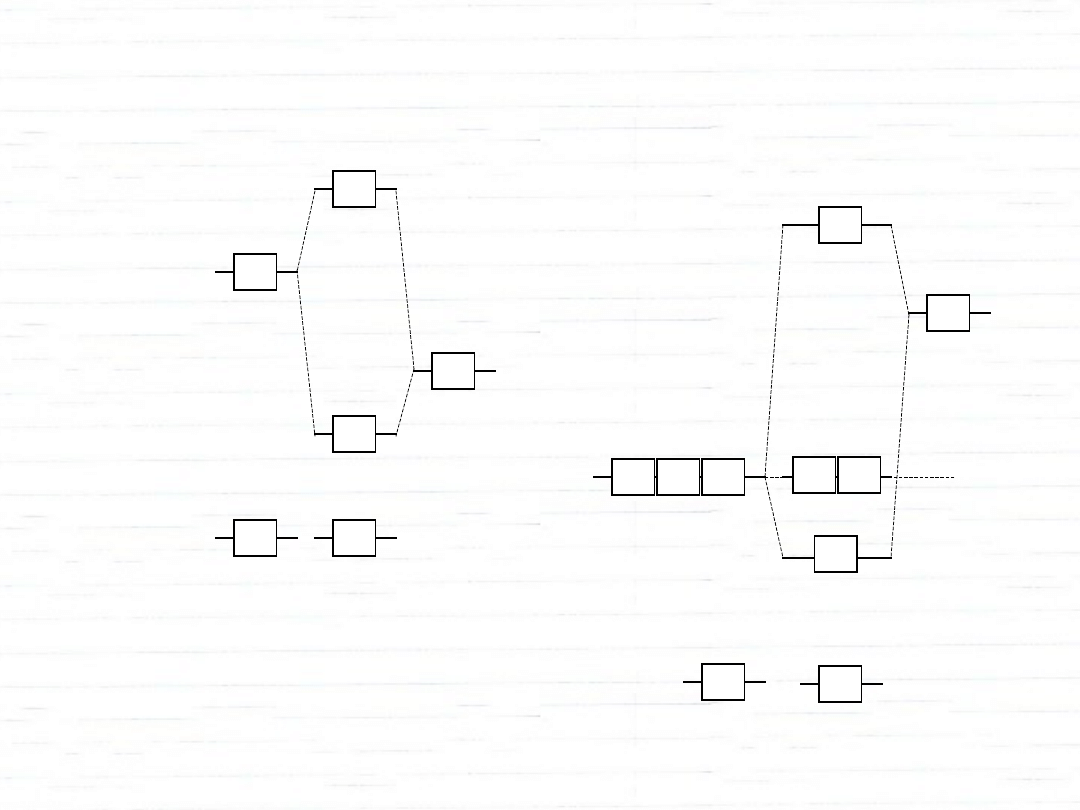
dwuatomowe orbitale heterojądrowe
*
2s
Li
1s
Li
1s
H
LiH
rząd
wiązania:
1
HF
rząd
wiązania:
1
2p
zF
2p
yF
1s
H
2s
F
*
HF
HF
2p
F
2s
F
orbitale
niewiążące
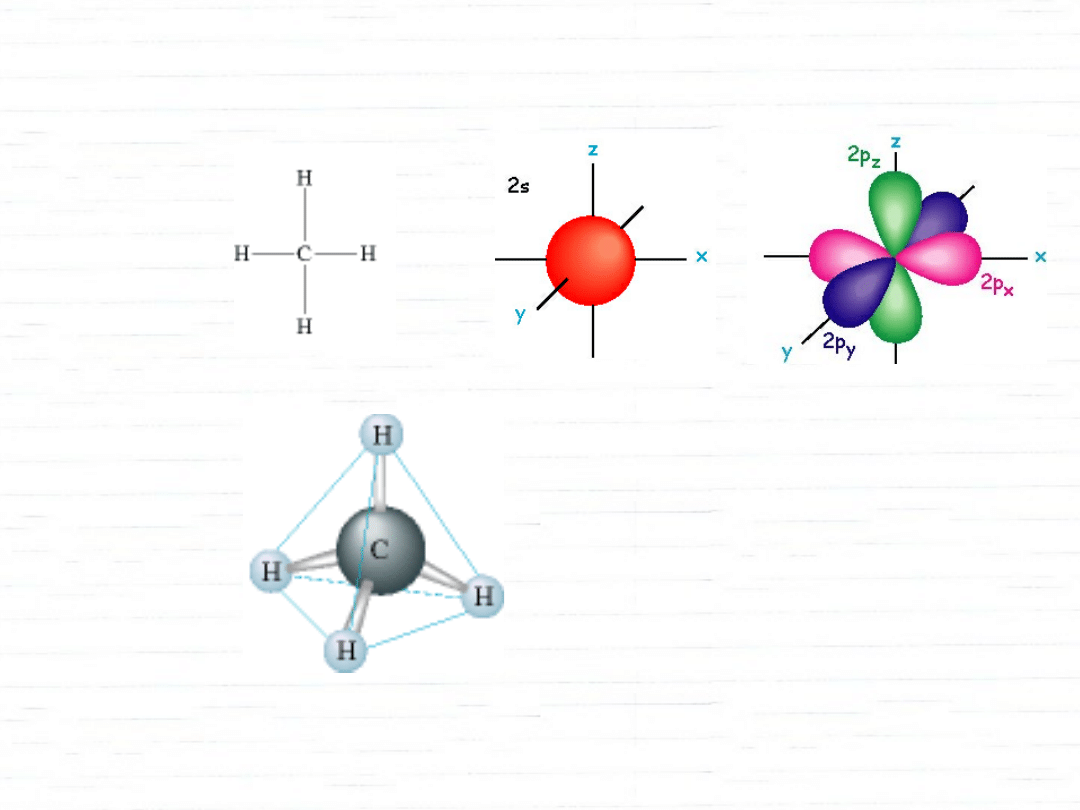
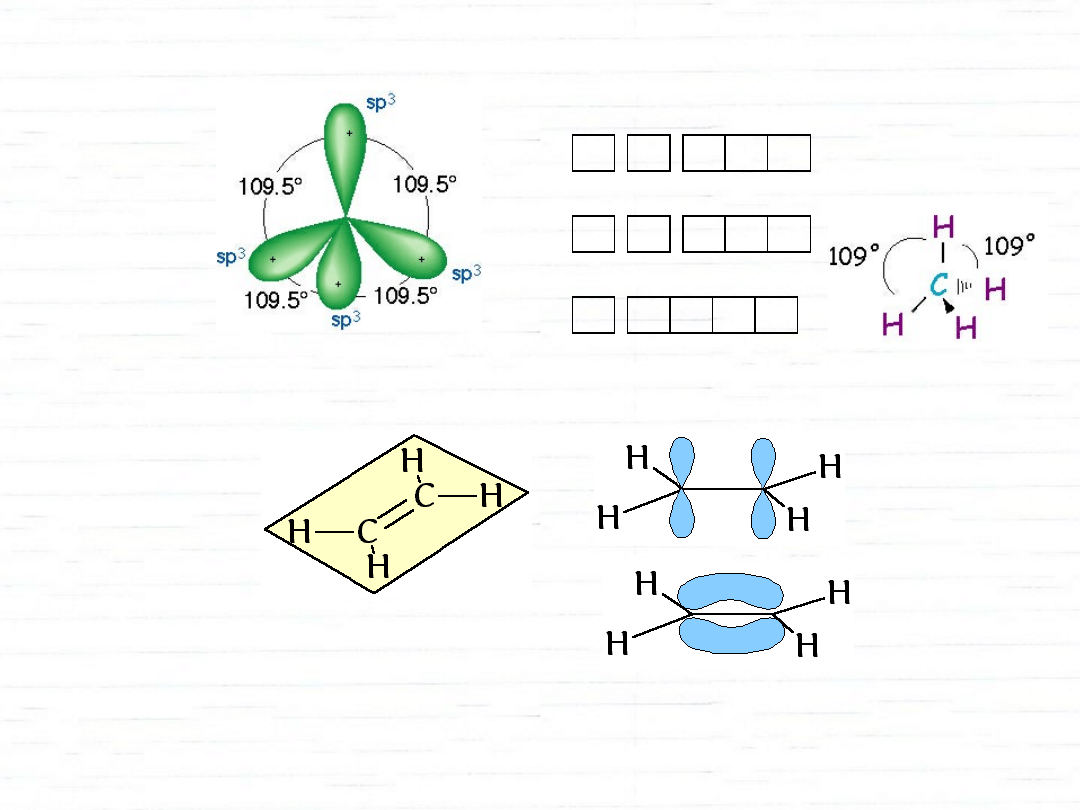
struktura metanu
wszystkie wiązania równej długości
wszystkie kąty równe (109,5°)
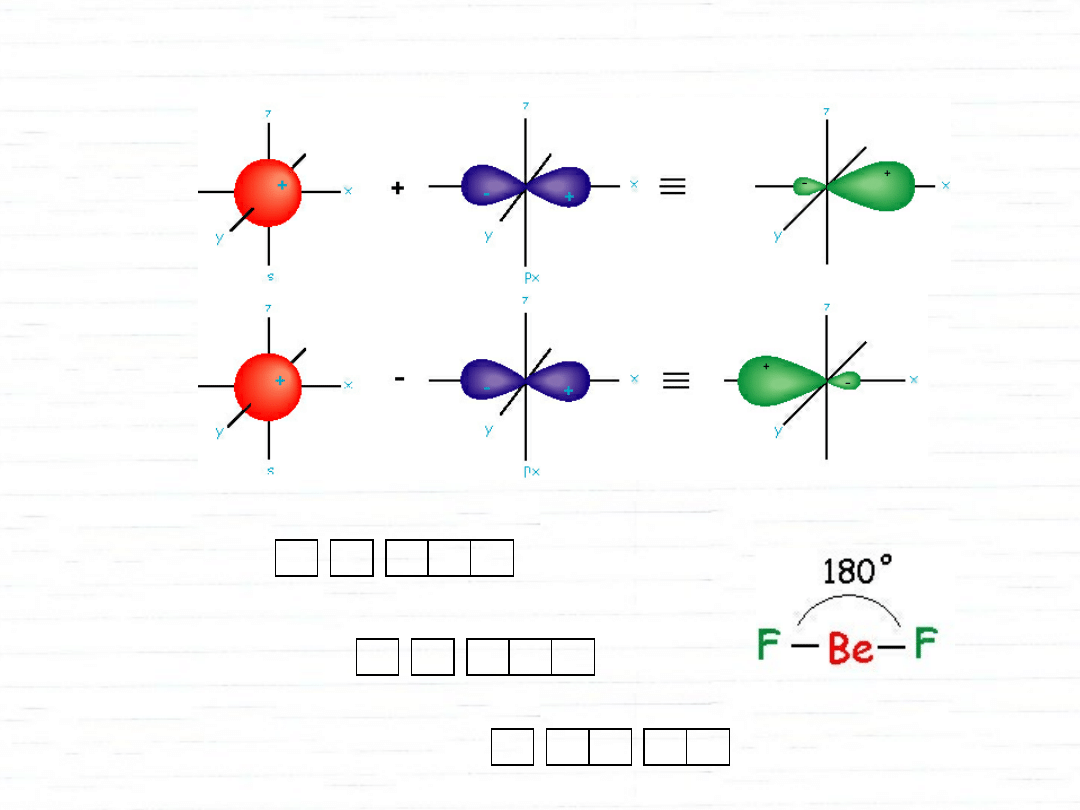
hybrydyzacja orbitali atomowych
1s 2s 2p
Be
1s 2s 2p
Be
1s 2sp
2p
y,z
Be
hybrydyzacja orbitali atomowych
1s 2s 2p
B
1s 2sp
2
2p
z
B
1s 2s 2p
B
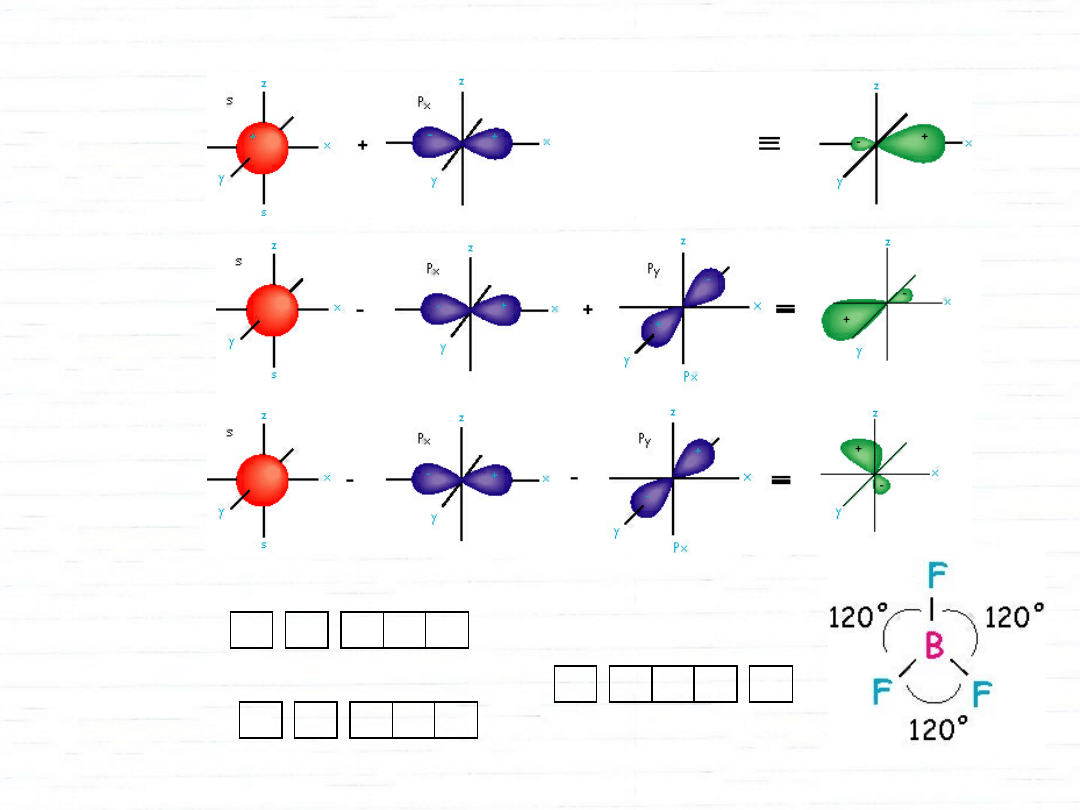
hybrydyzacja orbitali atomowych
1s 2s 2p
C
1s 2s 2p
C
1s
2sp
3
C
etylen
hybrydyzacja sp
2
cząsteczka płaska
metan
hybrydyzacja orbitali atomowych
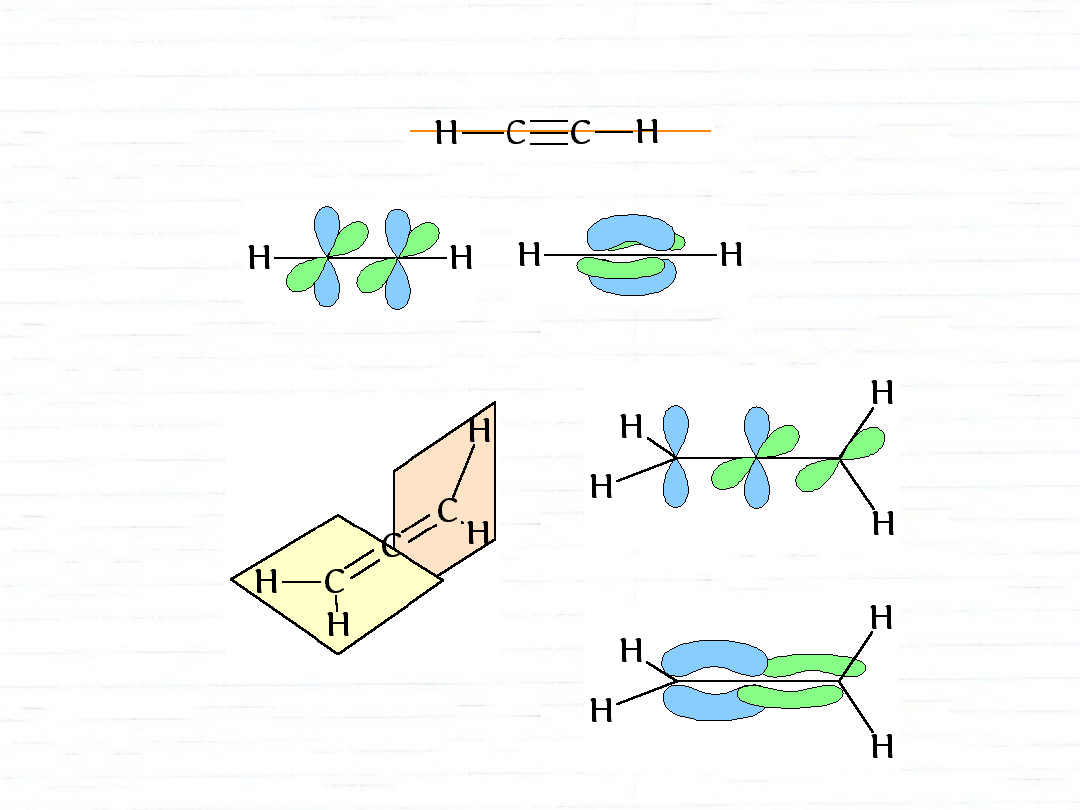
acetylen
hybrydyzacja sp
cząsteczka liniowa
allen
sp
2
sp
sp
2
zwiąki o hybrydyzacji sp
3
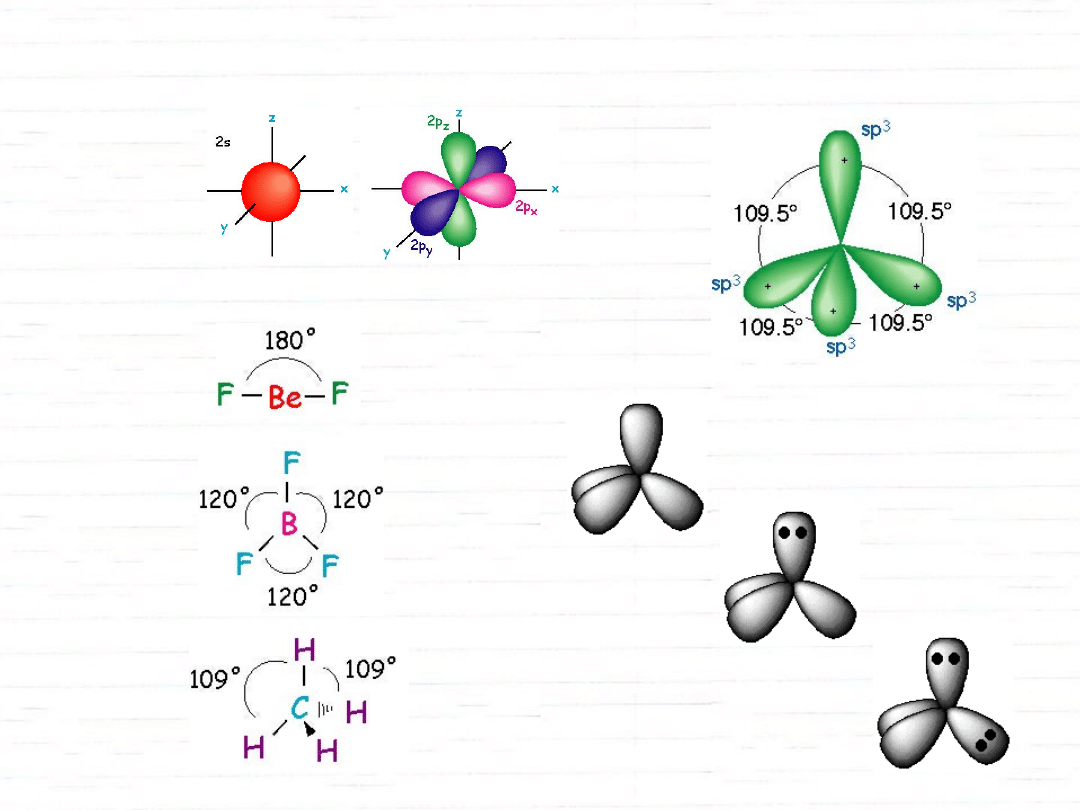
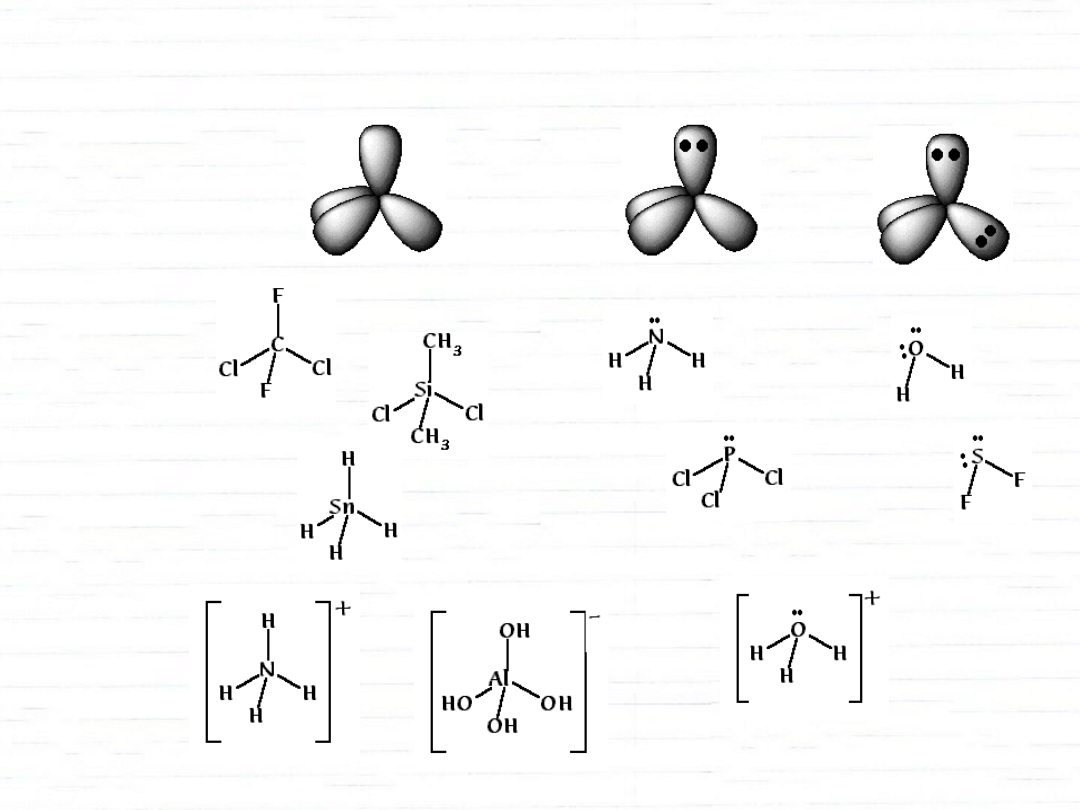
hybrydyzacje orbitali s i p
sp
sp
2
sp
3
C
N
O
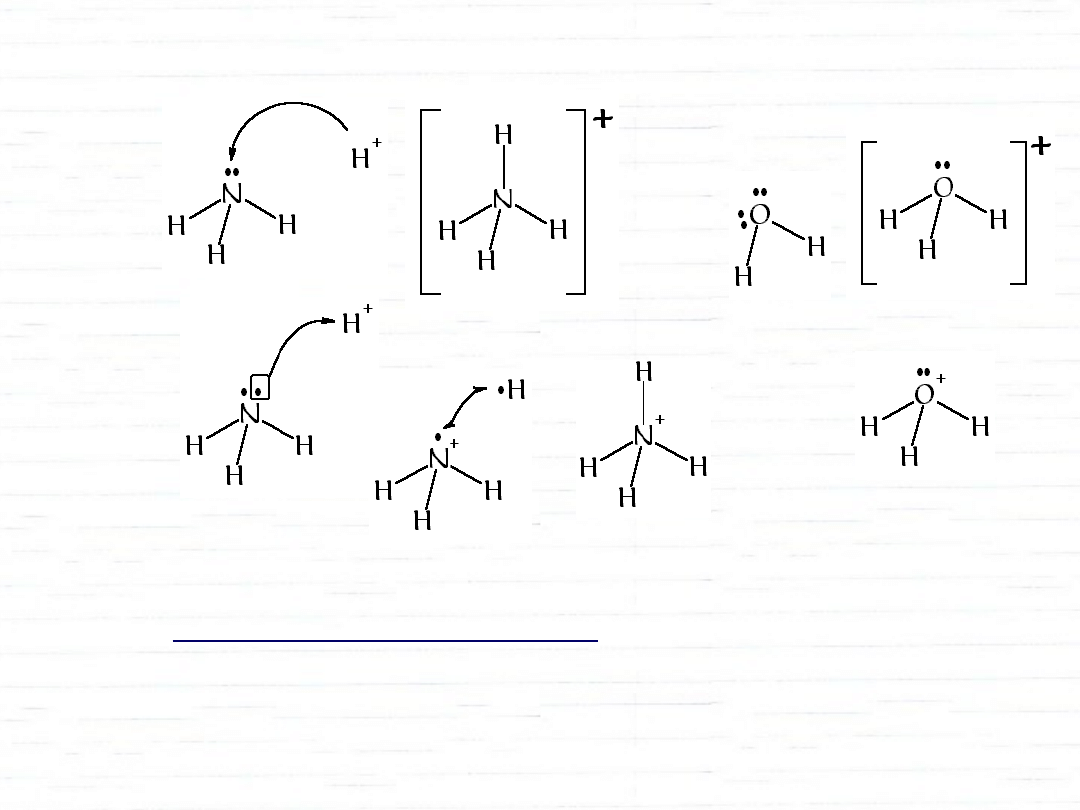
wiązanie koordynacyjne
Ładunek formalny atomu – różnica między ilością
elektronów w stanie wolnym i w cząsteczce związku
chemicznego.
(Elektrony tworzące wiązania dzieli się między związane
atomy)
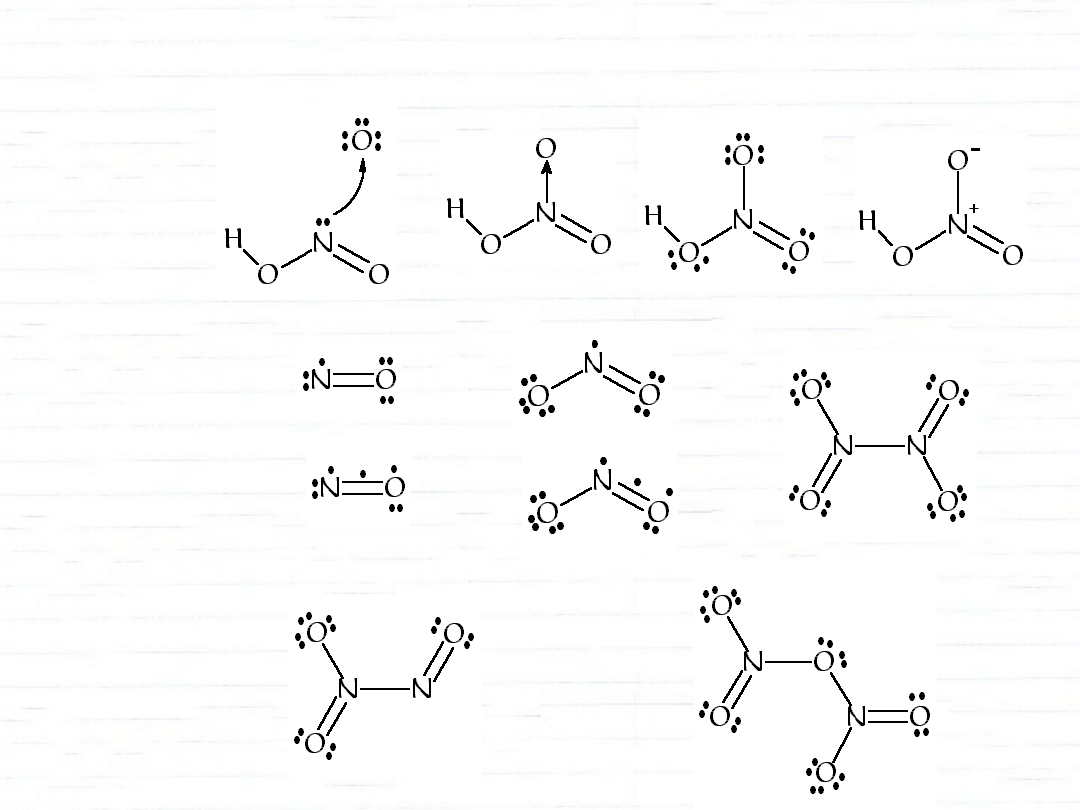
związki azotu z tlenem
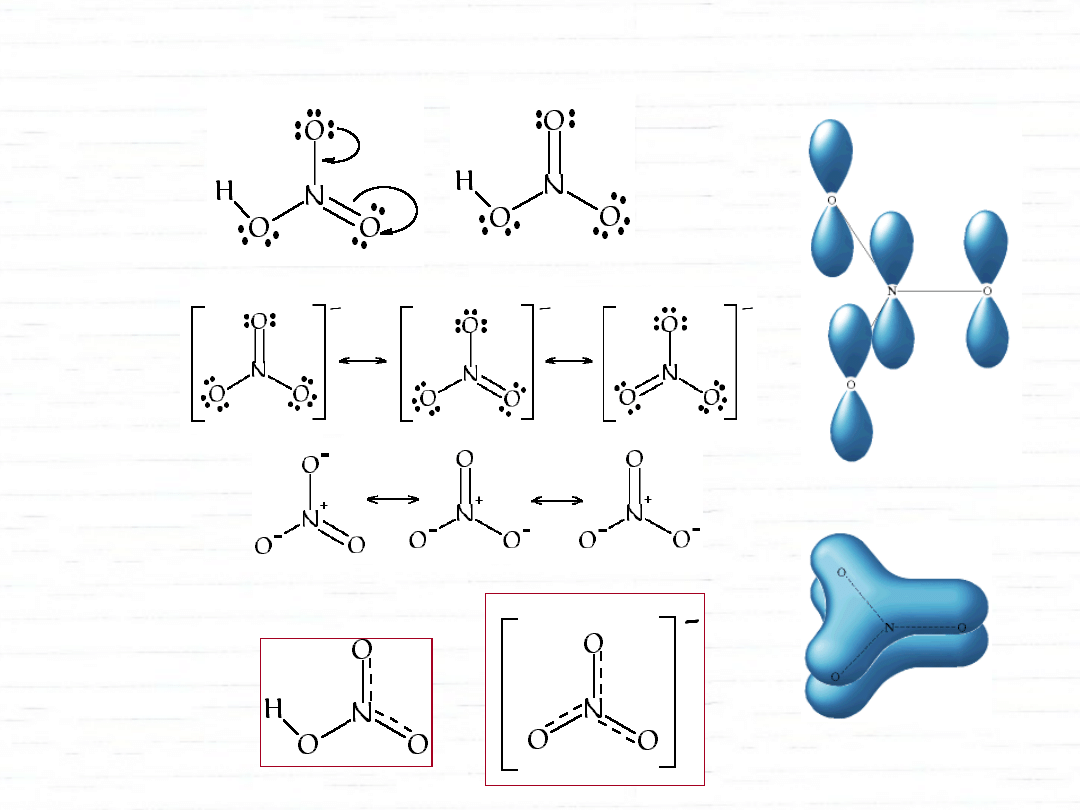
struktury rezonansowe
1
1—
1
2
1—
1
3
1
1—
1
2
1—
1
3
1—
1
3
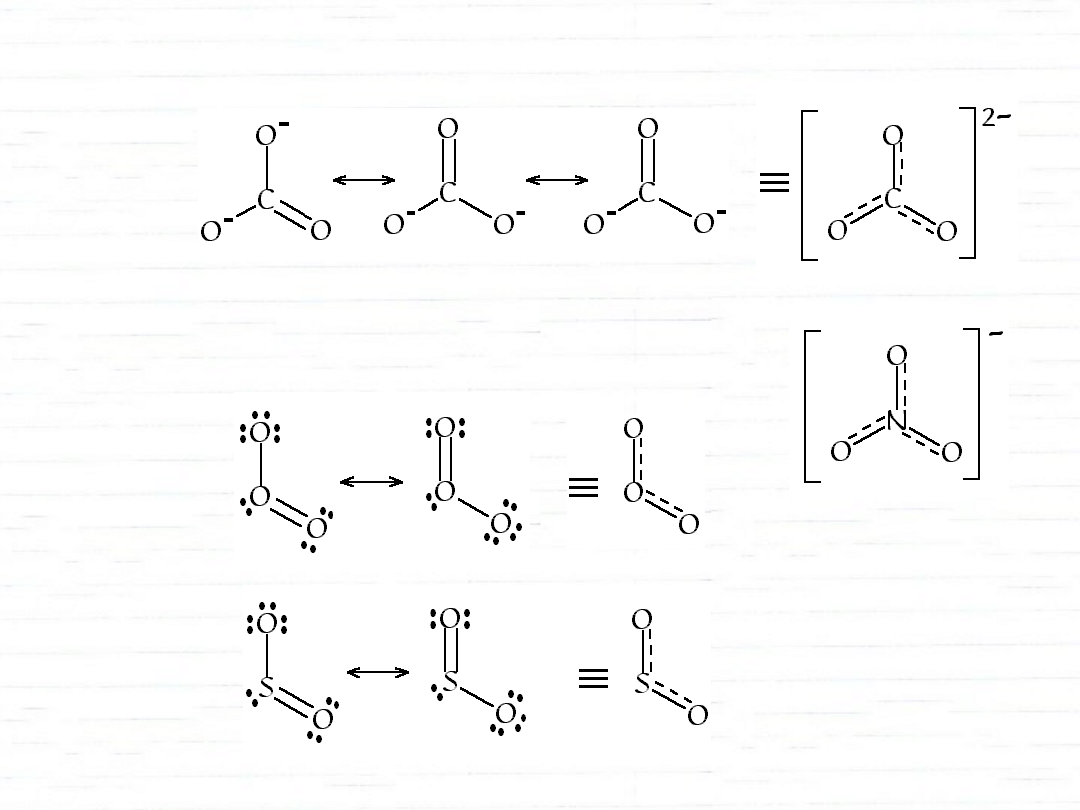
struktury rezonansowe
izoelektronowe
izoelektronowe
1—
1
3
1—
1
2
1—
1
2
1—
1
3
1—
1
3
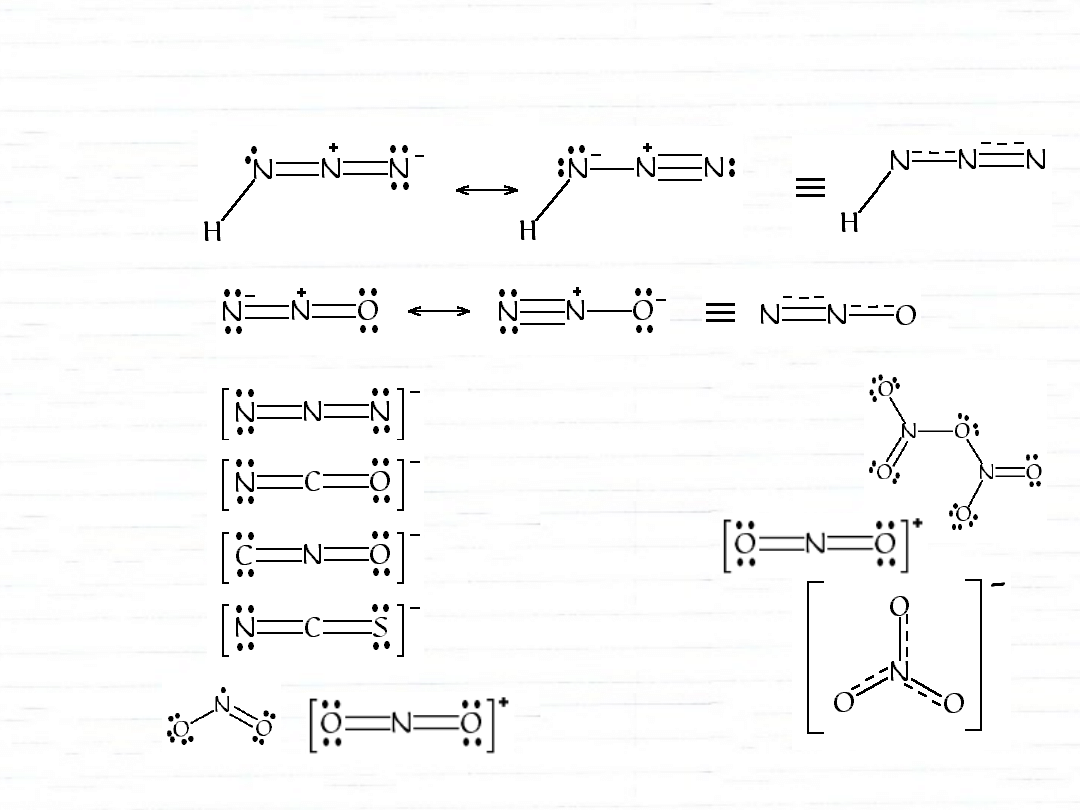
struktury izoelektronowe
1—
1
2
2—
1
2
1—
1
2
2—
1
2
anion azydkowy
anion cyjanianowy
anion piorunianowy
anion rodankowy
kation nitroniowy
stały
N
2
O
5
struktury związków węgla
C
O
O
C
O
O

hybrydyzacje z udziałem orbitali d
3s 3p
P
3s 3p 3d
P
3s 3p
S
3s 3p 3d
S
3s 3p 3d
S
3s 3p
Xe
3s 3p 3d
Xe
3s 3p 3d
Xe
dsp
3
3s 3p 3d
Xe
dsp
3
d
2
sp
3
dsp
3
d
2
sp
3
d
3
sp
3
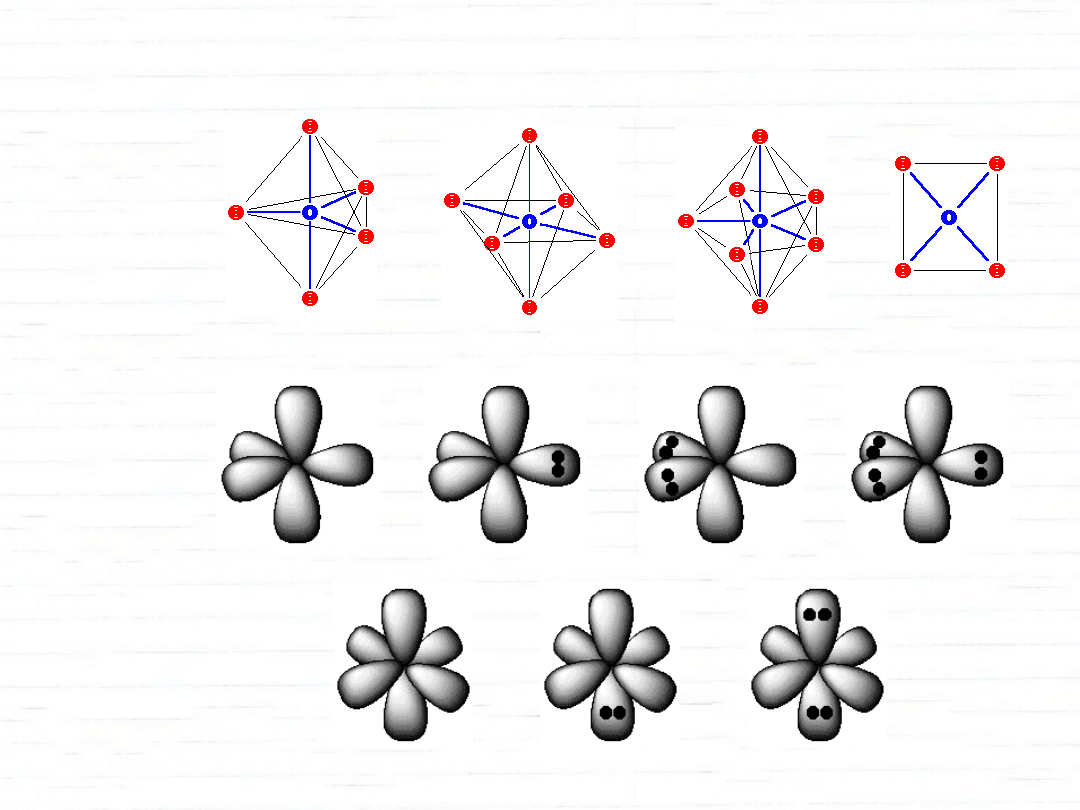
hybrydyzacje z udziałem orbitali d
dsp
3
d
2
sp
3
d
3
sp
3
dsp
2
dsp
3
d
2
sp
3
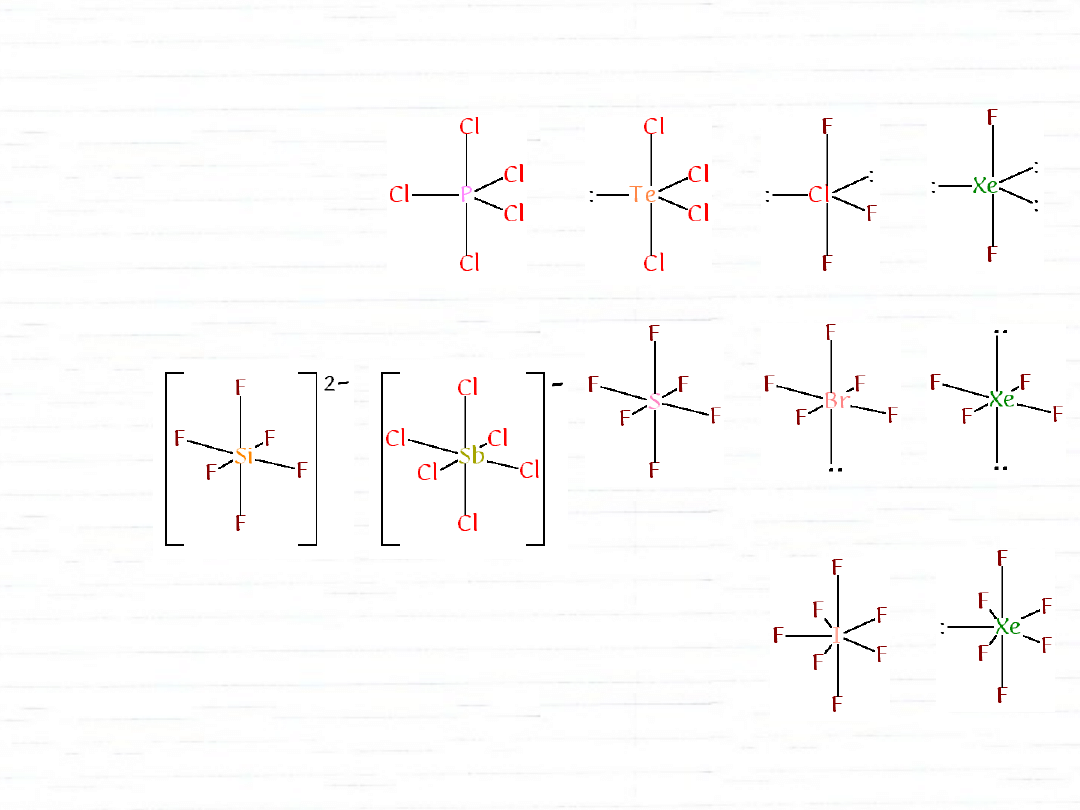
hybrydyzacje z udziałem orbitali d
dsp
3
d
2
sp
3
d
3
sp
3
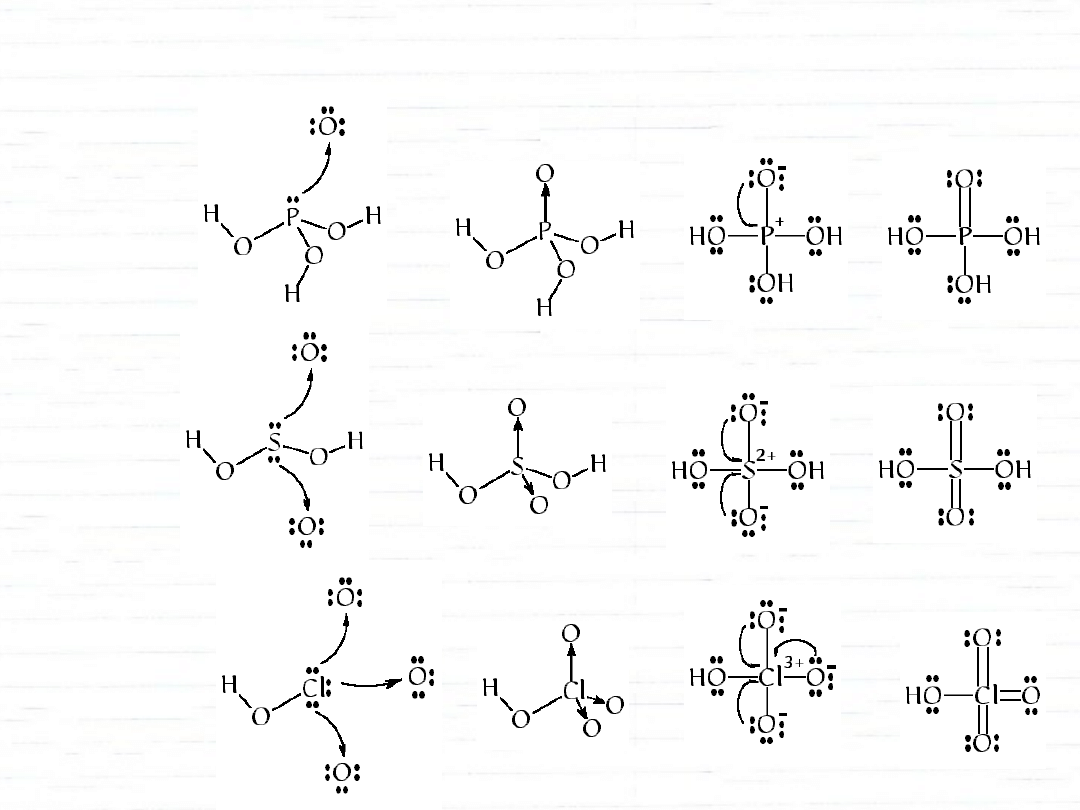
kwasy tlenowe pierwiastków 3 okresu
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
Wyszukiwarka
Podobne podstrony:
Chemia wiązania chemiczne
Chemia V Wiązania chemiczne
Chemia wiązania chemiczne
5 Wiazania chemiczne, Budownictwo PK, Chemia, Chemia nieorganiczna od Marysi
Wiązania chemiczne, chemia(2)
Chemia Atom, cząsteczka, wiązanie chemiczne
Chemia - Budowa atomu i wiązania chemiczne(1), EDUKACJA 35 000 TYS. plików z każdej branży
6 Zależność właściwości substancji od rodzaju wiązania chemicznego, Budownictwo PK, Chemia, Chemia n
wiazania chemiczne, Studia, I rok, I rok, I semestr, Chemia I
Chemia, Chemia - Budowa atomu i wiązania chemiczne, LICZBA ATOMOWA(liczba porządkowa):wielkość chara
Walkowiak, chemia ogólna, wiązania chemiczne
chemia zaleznosc wlasciwosci substancji od rodzaju wiazania chemicznego
Wyklad 4 Wiazania chemiczne w cialach stalych
Wiązania chemiczne (II)
6 wykad WiĄzania chemiczne[F]
Chemia R cje chemiczne
Wykład 1, budowa atomu, wiązania chemiczne
2 Atom i cząstka Wiązania chemiczne klucz
więcej podobnych podstron