
Teoria orbitali
molekularnych
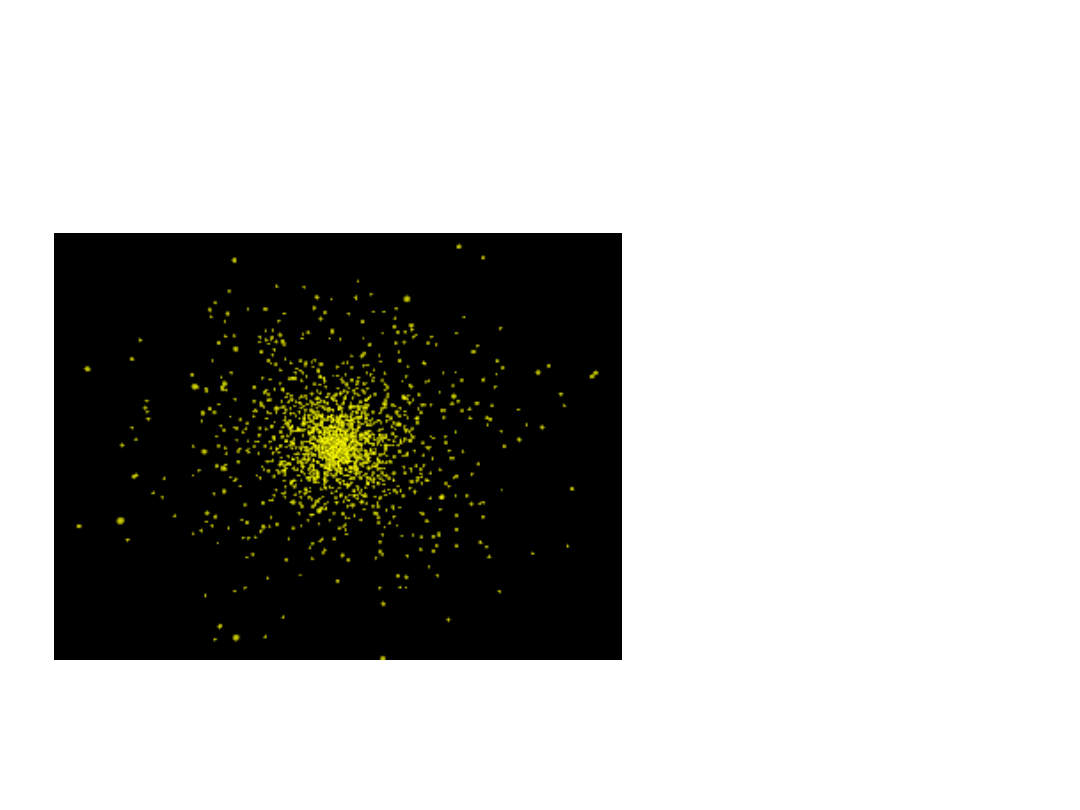
Orbital s
Jak wykorzystać
informacje
o rozkładzie
ładunków
w atomie?
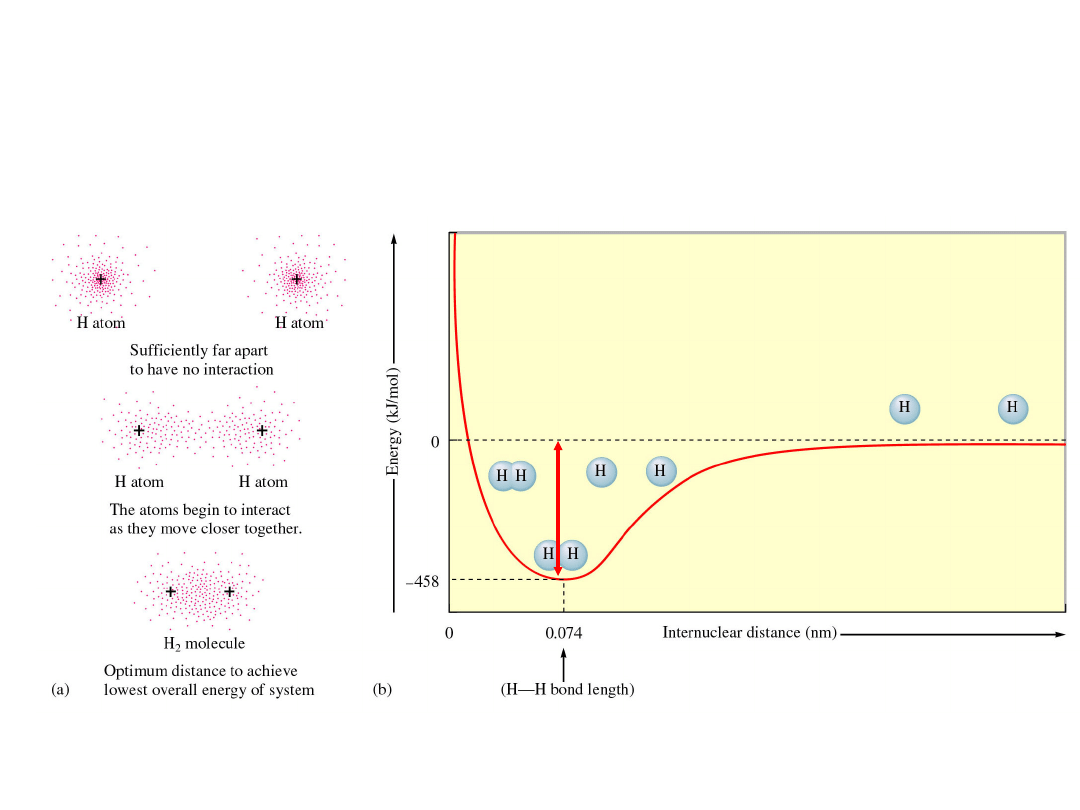
Wiązanie chemiczne 2
Stabilizacja
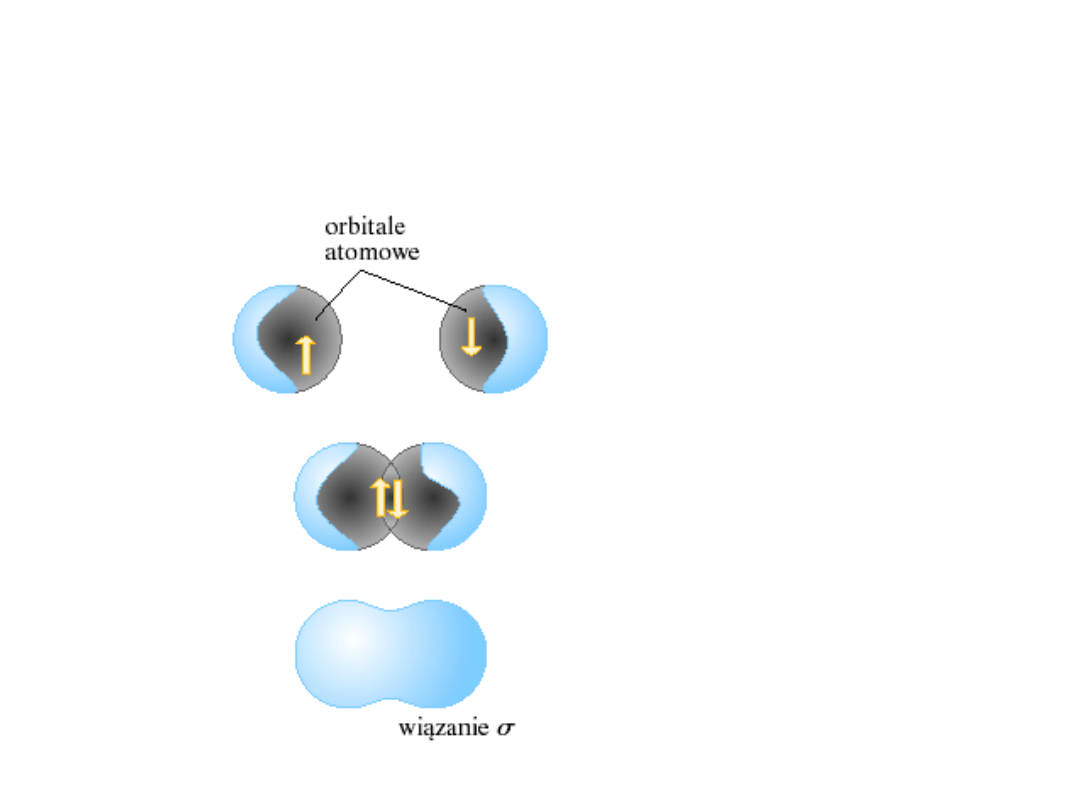
Jak się
tworzy
wiązanie:
Orbitale
Molekularn
e
MO
Cząsteczka
H
2
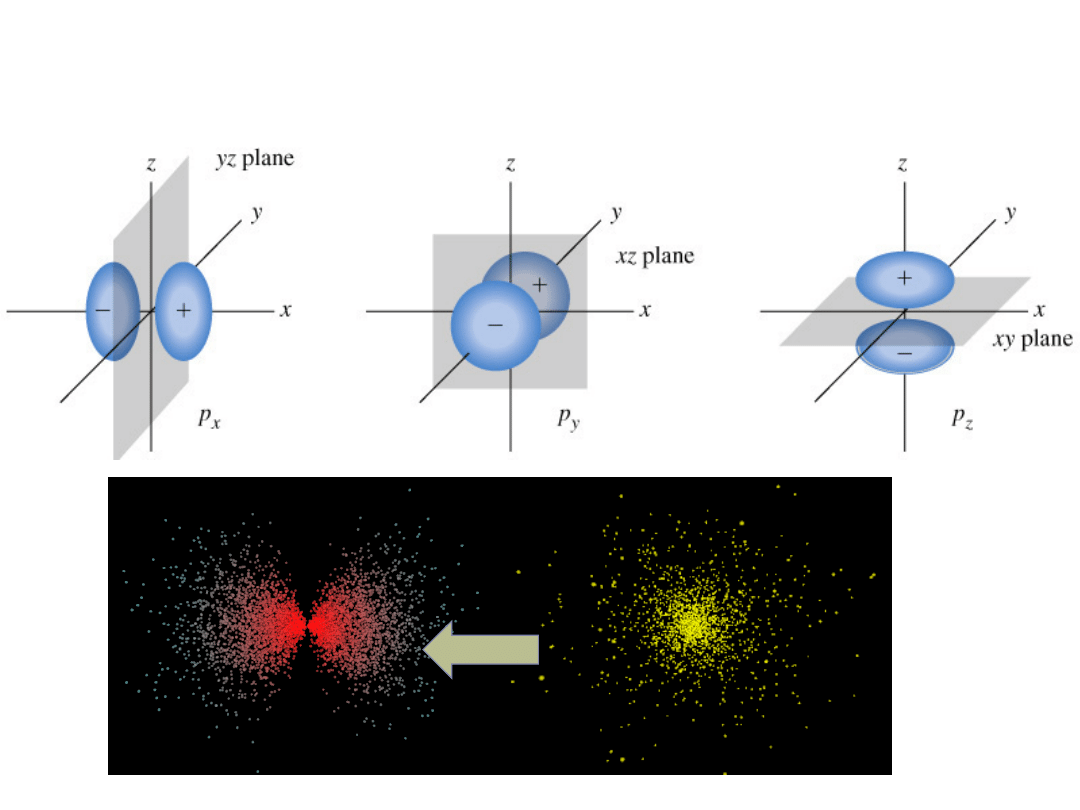
Orbitale p
Orbitale molekularne
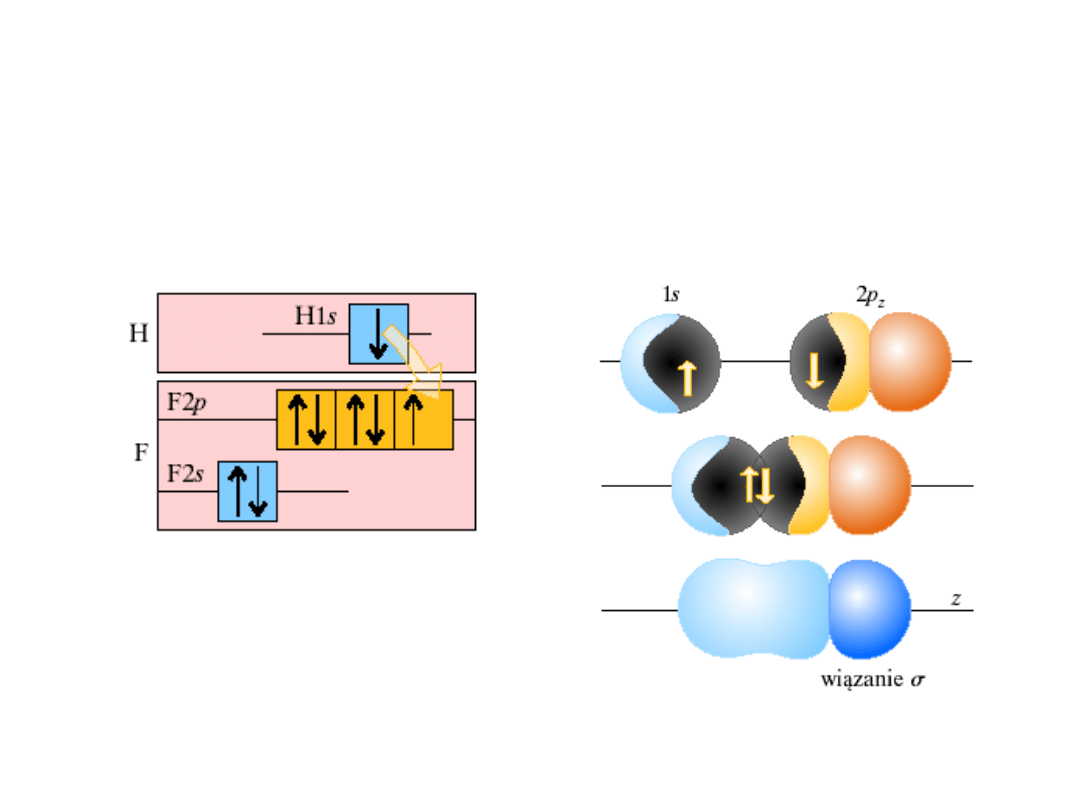
HF

Orbitale molekularne
Orbitale molekularne

Orbitale molekularne
Orbitale

Energia orbitali
molekularnych
energia niższa niż energia
atomowych orbitali tworzących
orbital molekularny:
wiążące
Energia wyższa niż energia
atomowych orbitali tworzących
orbital molekularny:
antywiążące
.

Aby utworzył się orbital
molekularny orbitale
atomowe muszą się
nakrywać dlatego tylko
elektrony walencyjne mogą
go tworzyć
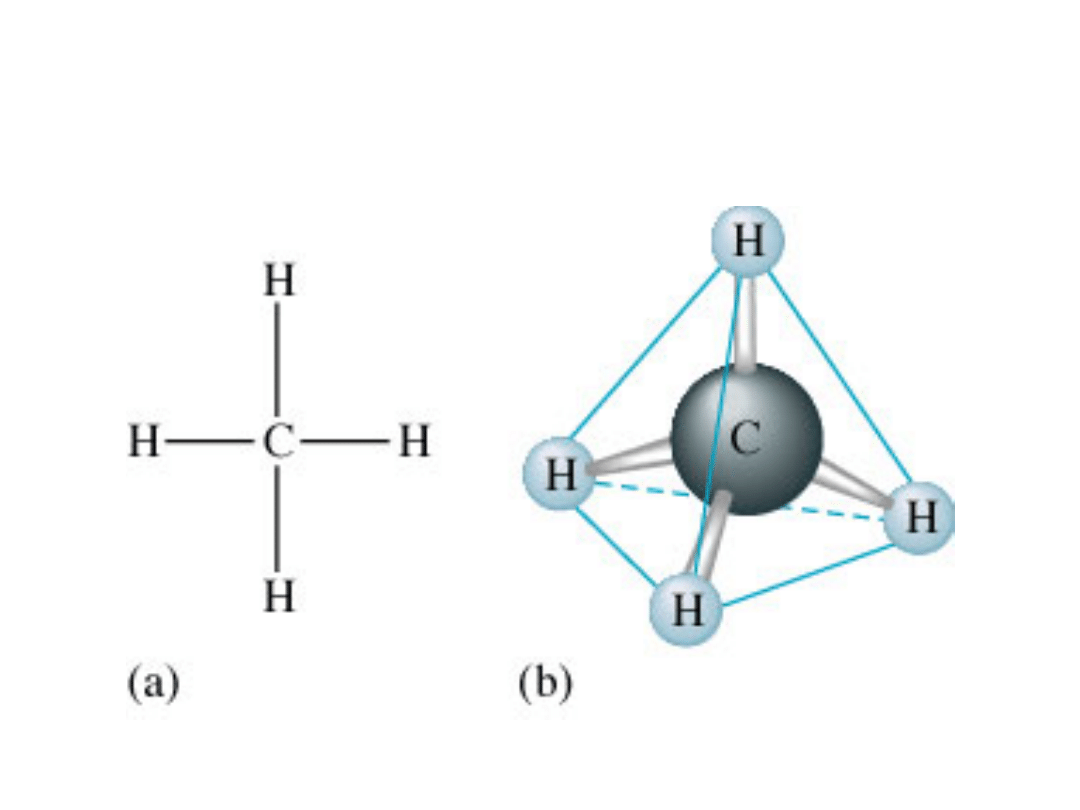
(a) Struktura Lewisa
(b)Doświadczalnie wyznaczona geometria cząsteczki metanu
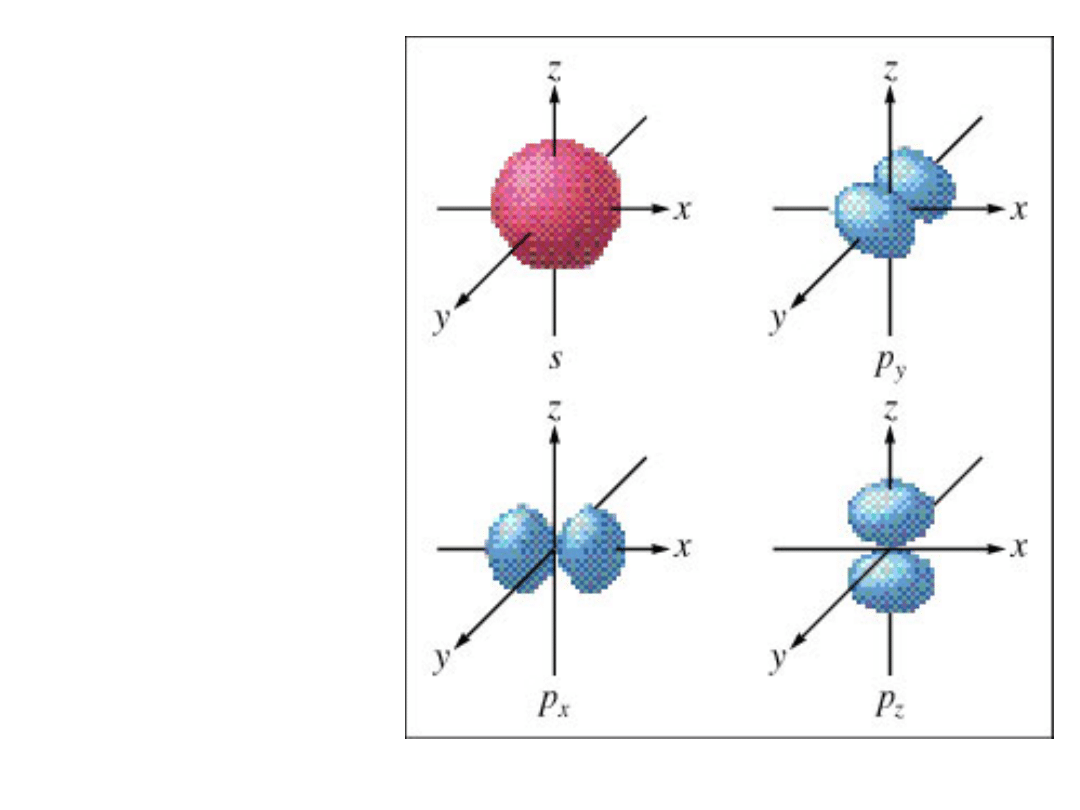
Walencyjne orbitale
atomu węgla
Atom:
2s, 2p
x
, 2p
y
i 2p
z
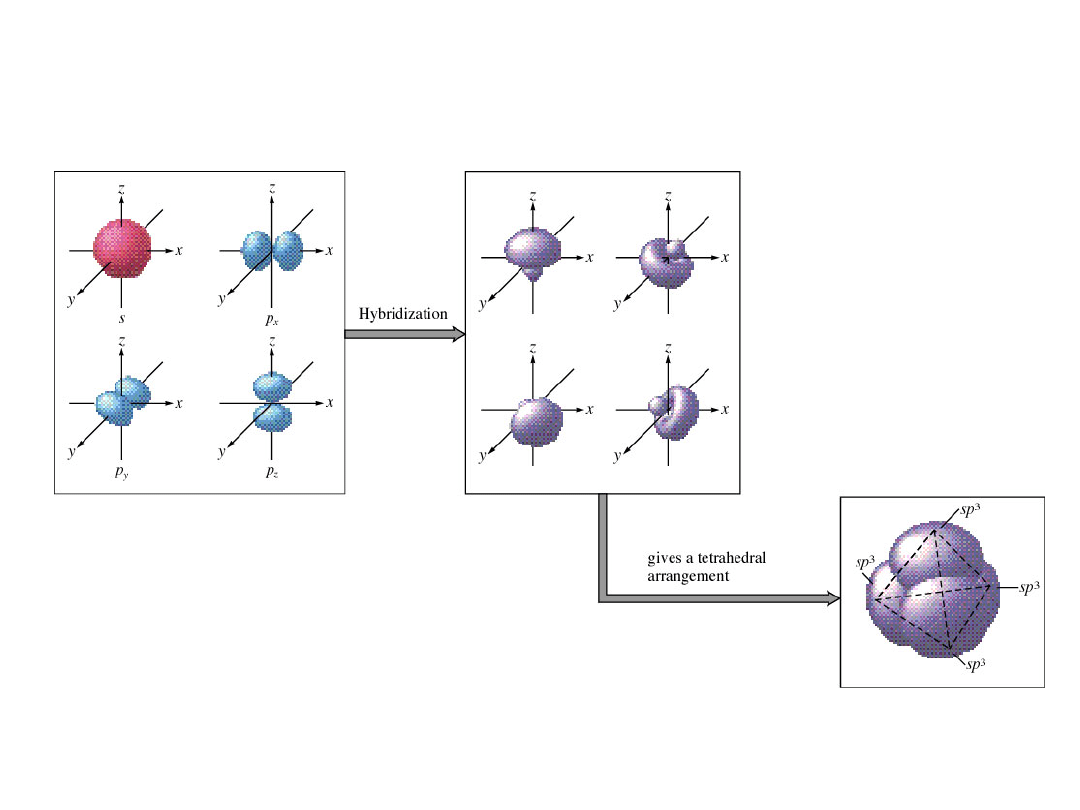
Formowanie orbitali o jednakowej energii:
Orbitale sp
3
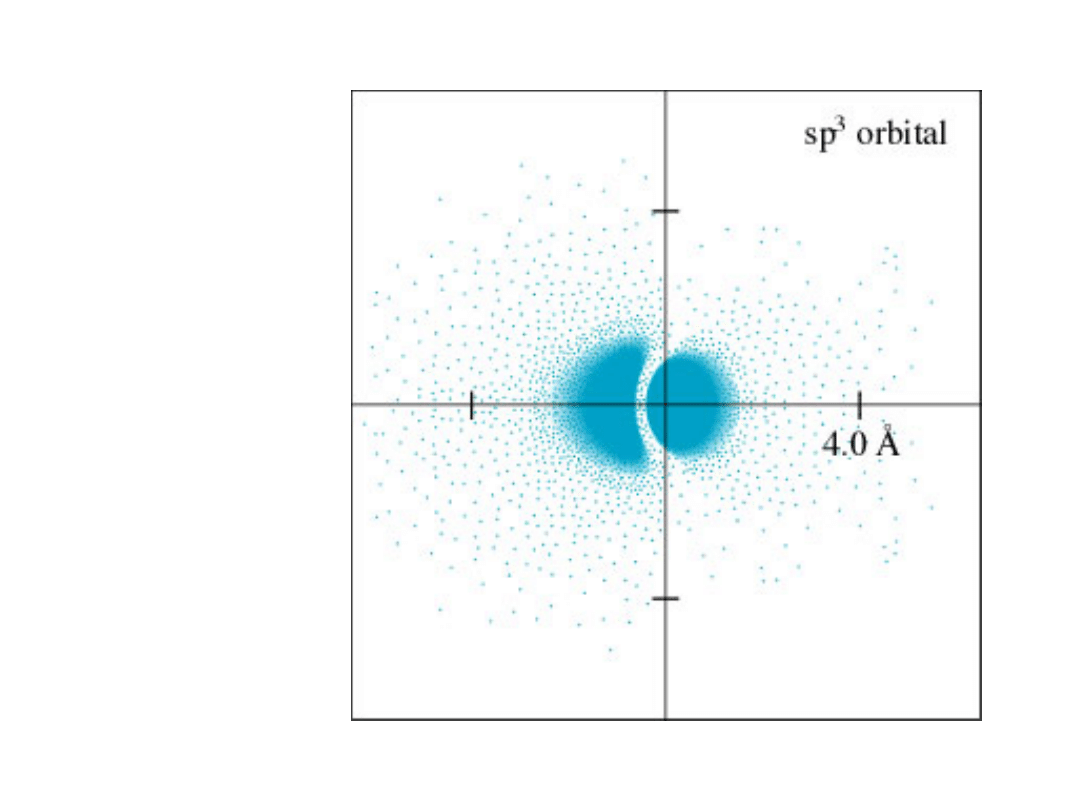
Orbital sp
3
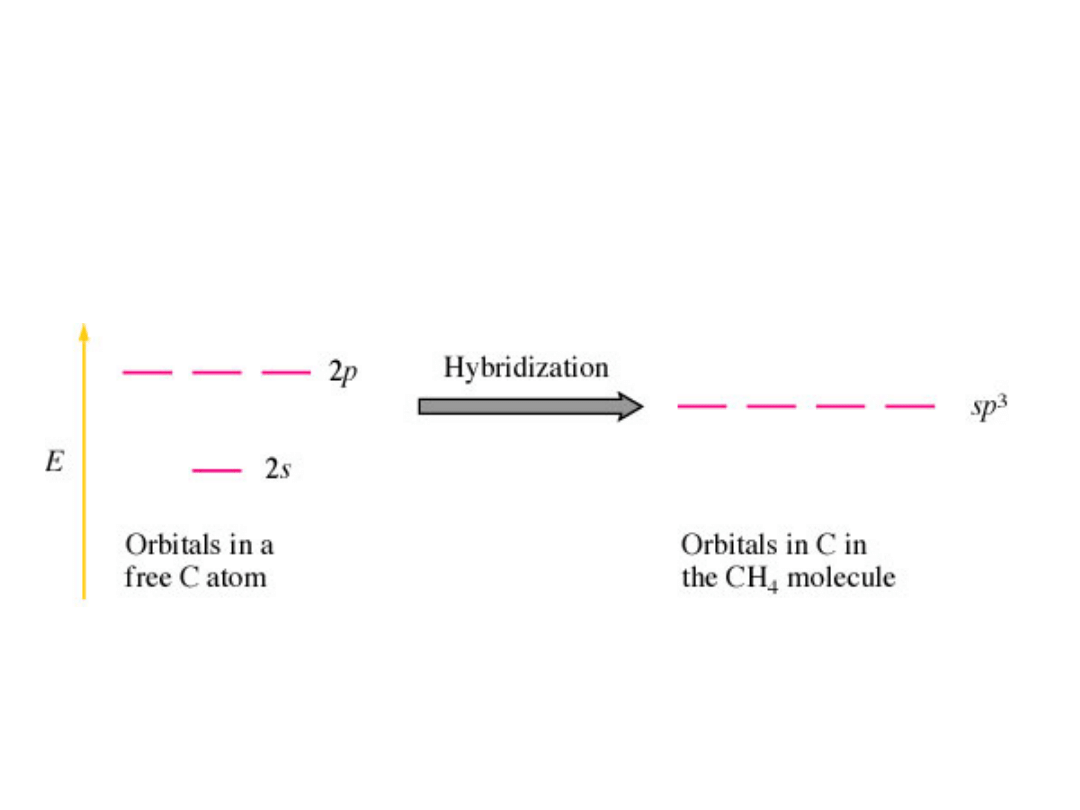
Diagram poziomów energetycznych
pokazujących formację czterech sp
3
Orbitali
Hybrydyzacja
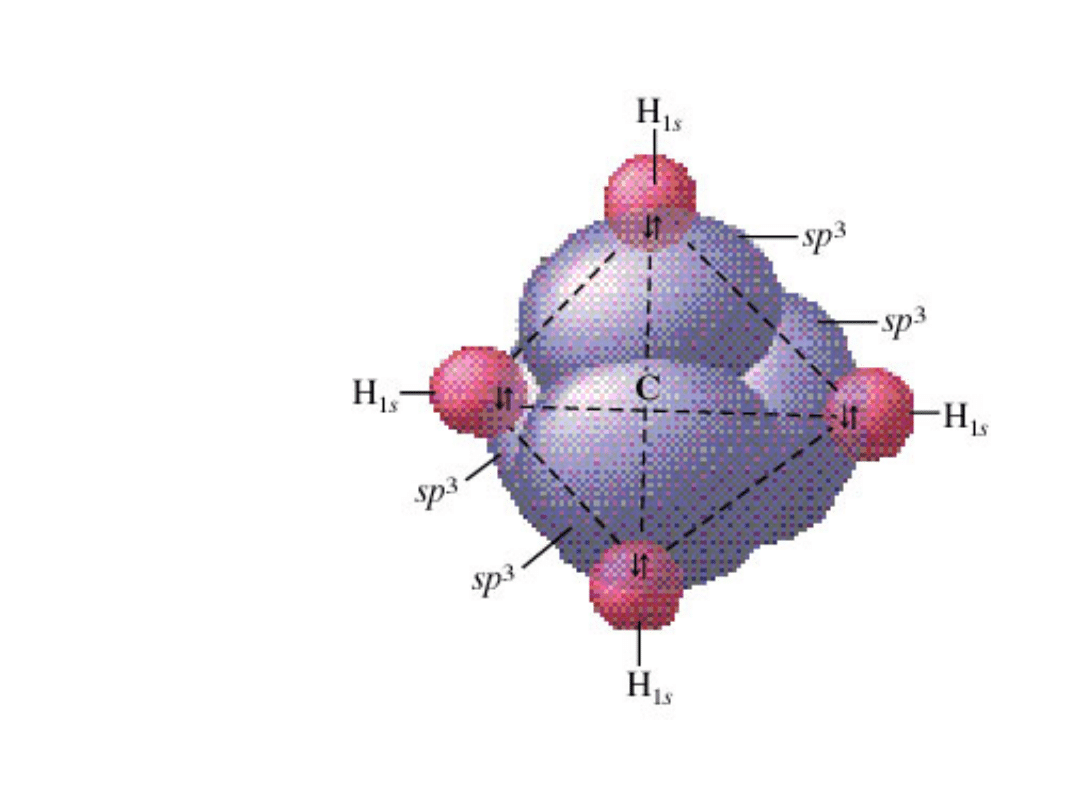
Tetraedryczny
rozkład
czterech
orbitali sp
3
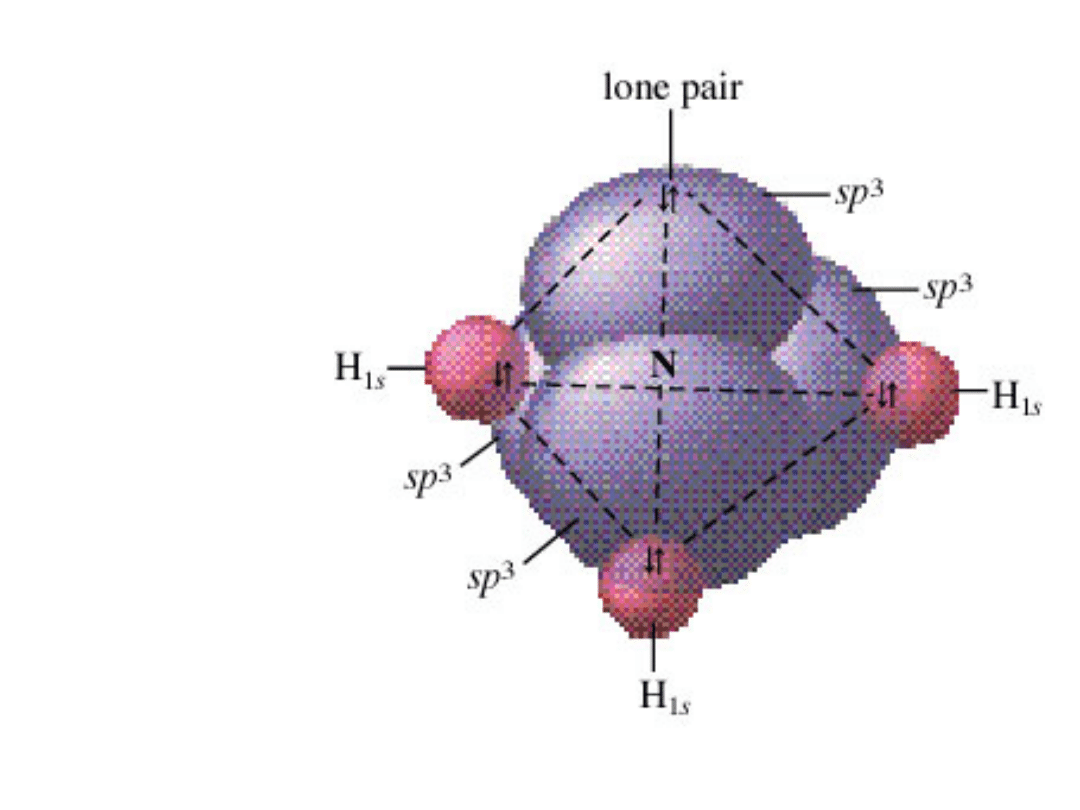
Identyczna
hybrydyzacj
a sp
3
w
cząsteczce
amoniaku
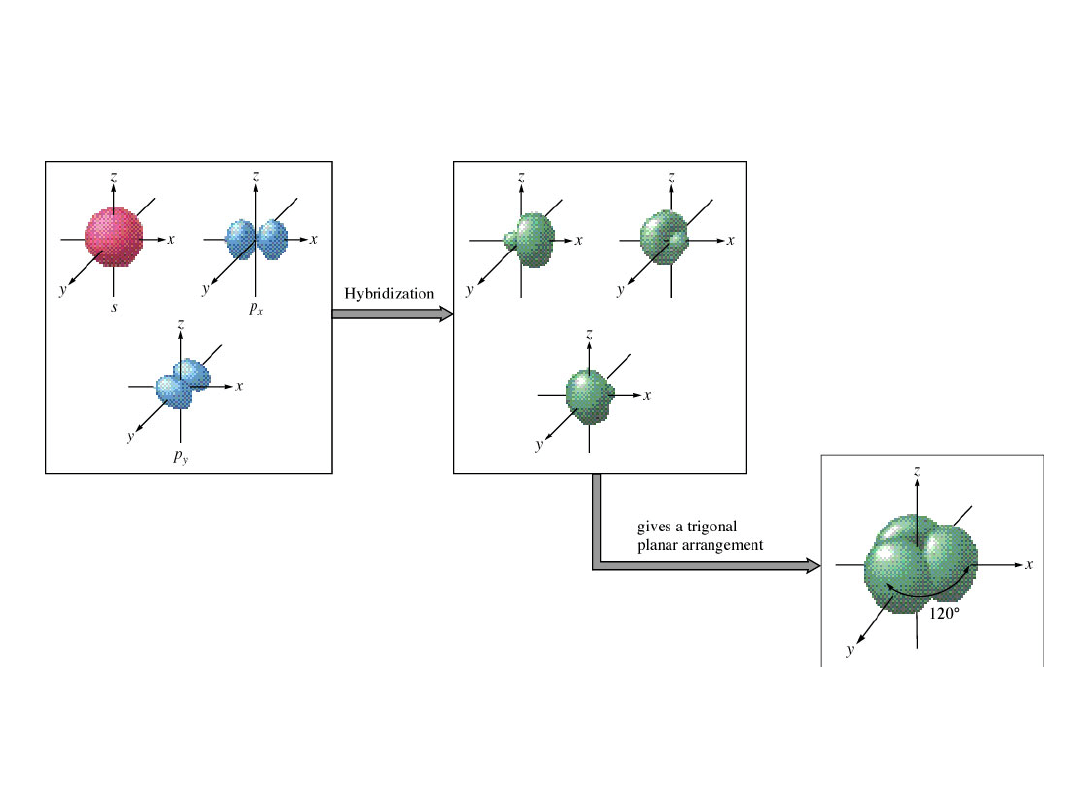
Hybrydyzacja orbitali atomowych: s, p
x
i p
y
Cząsteczka planarna:
trójkąt równoboczny
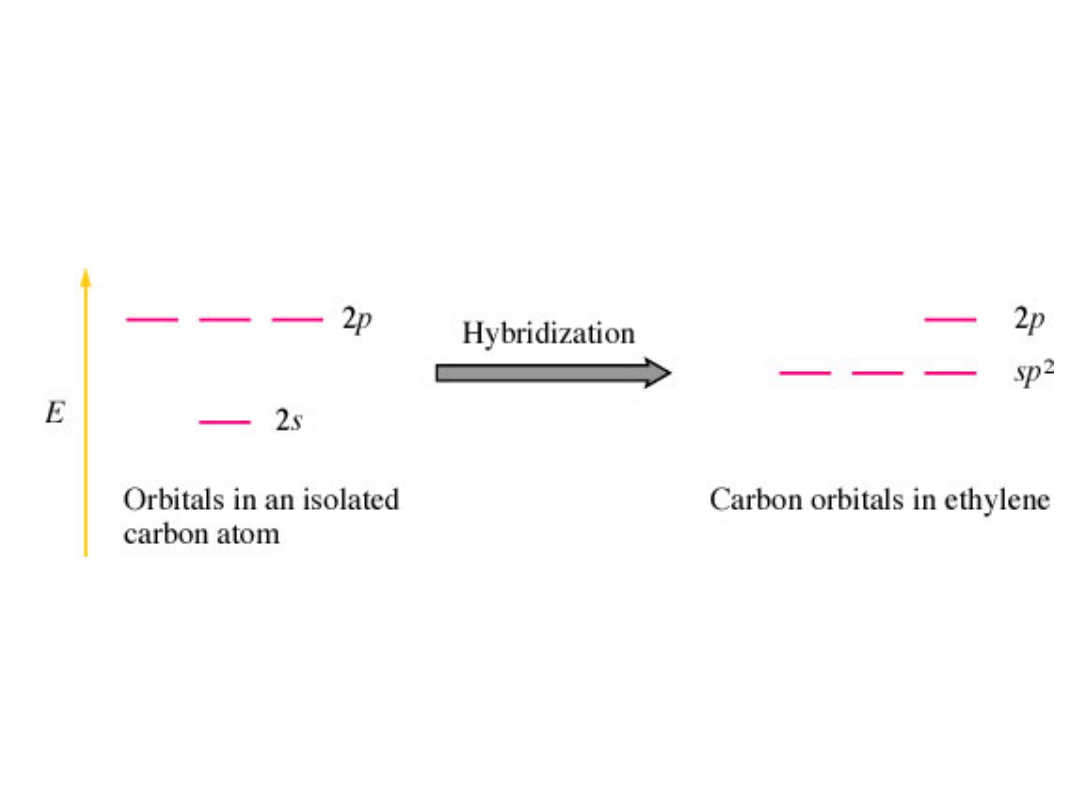
Diagram poziomów energetycznych
pokazujących hybrydyzację
sp
2
etylen
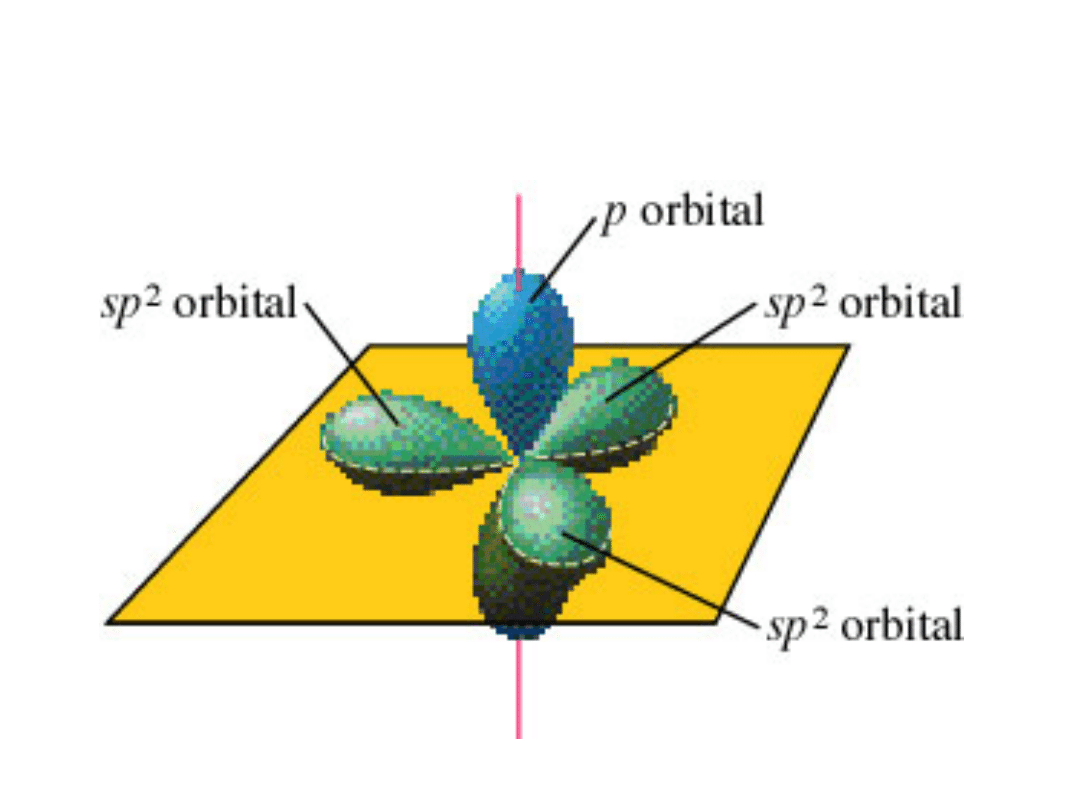
Hybrydyzacja sp
2
atomu węgla
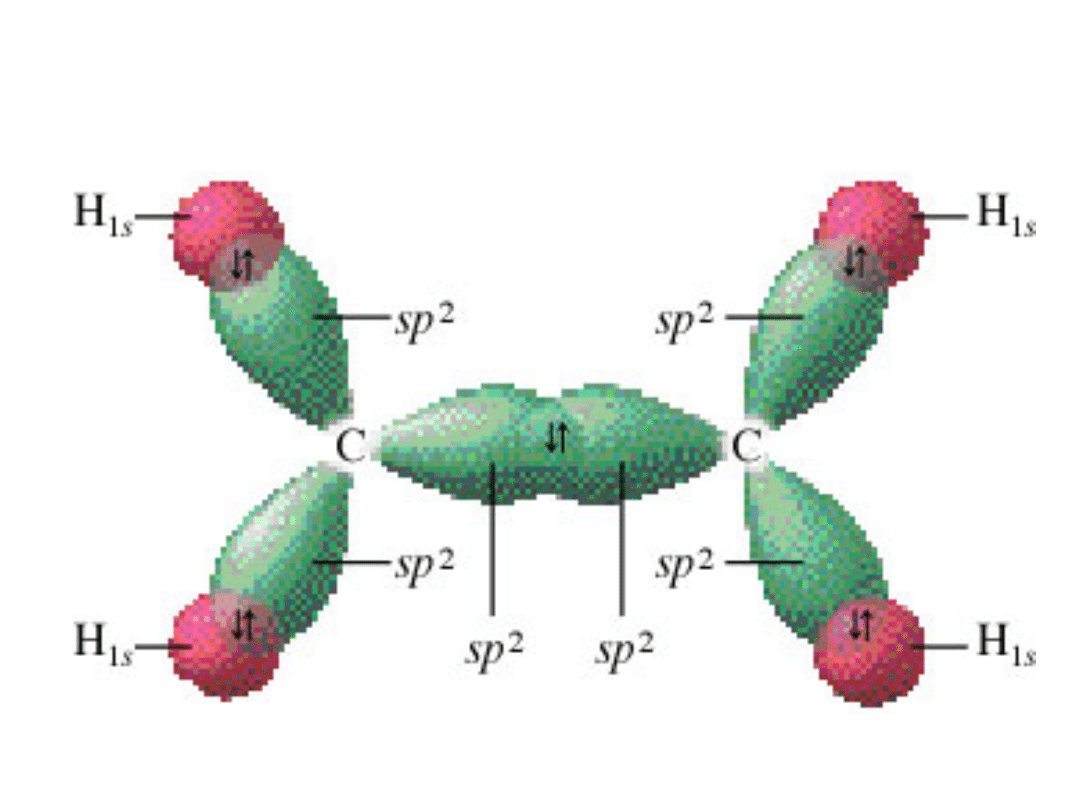
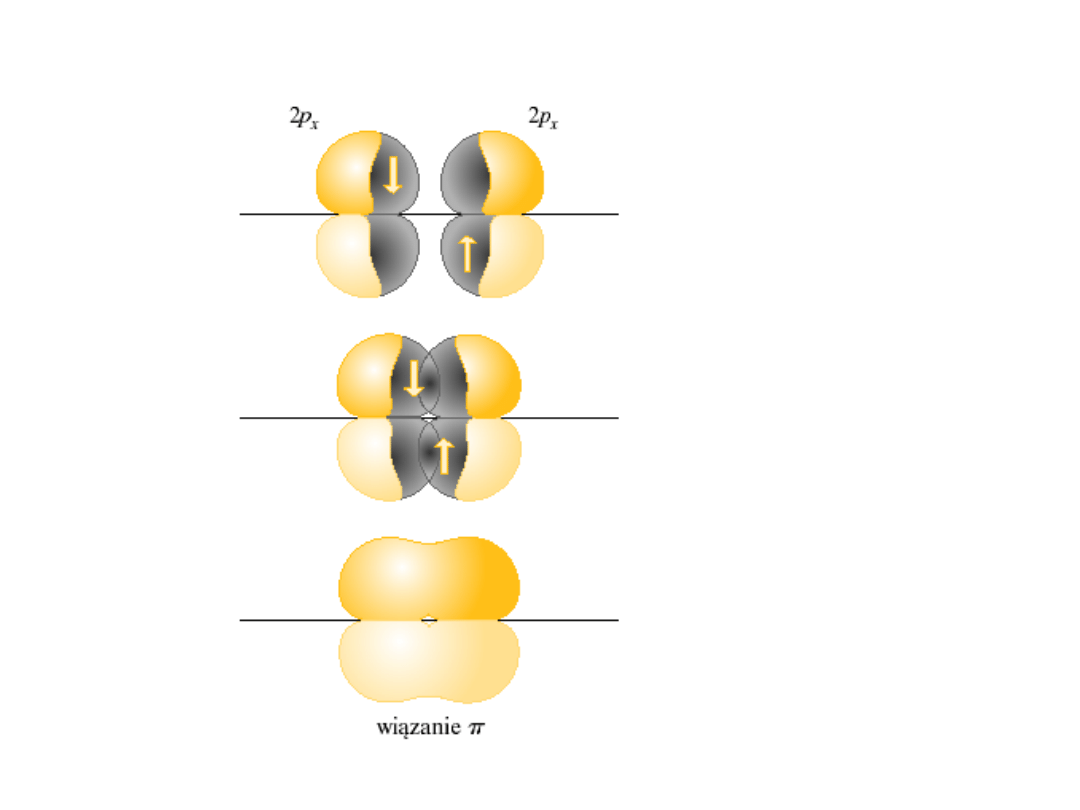
Wiązania w etylenie
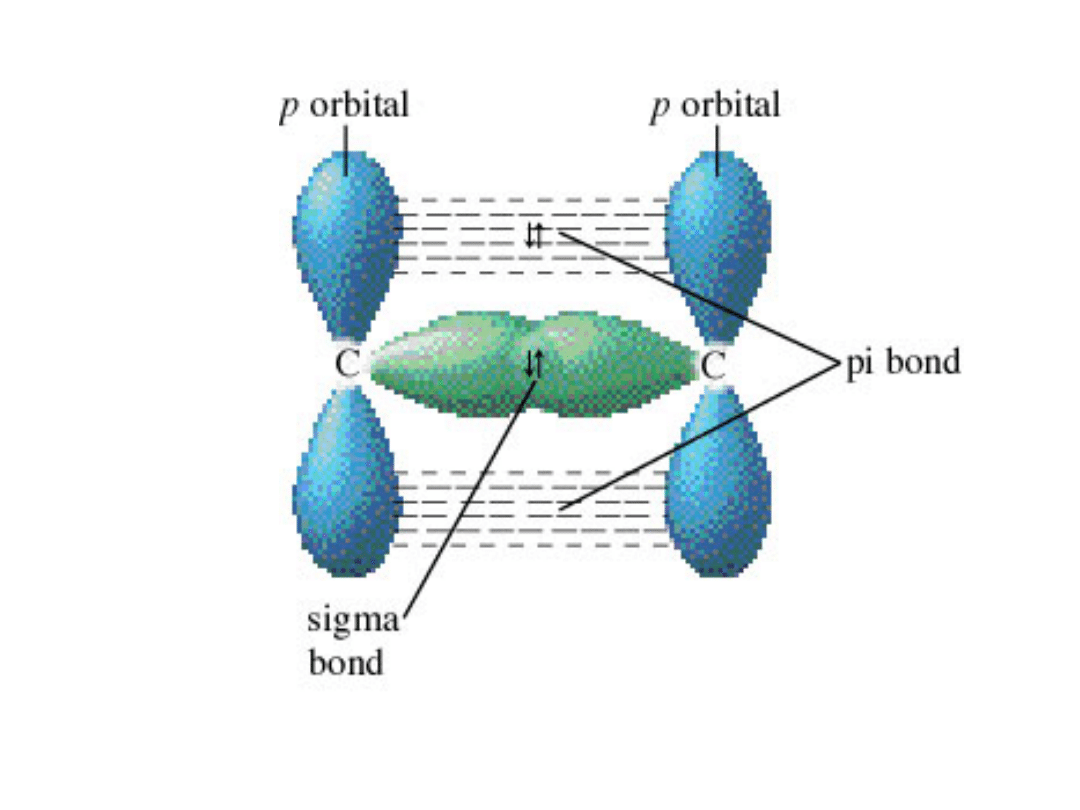
wiązania
Sigma i Pi
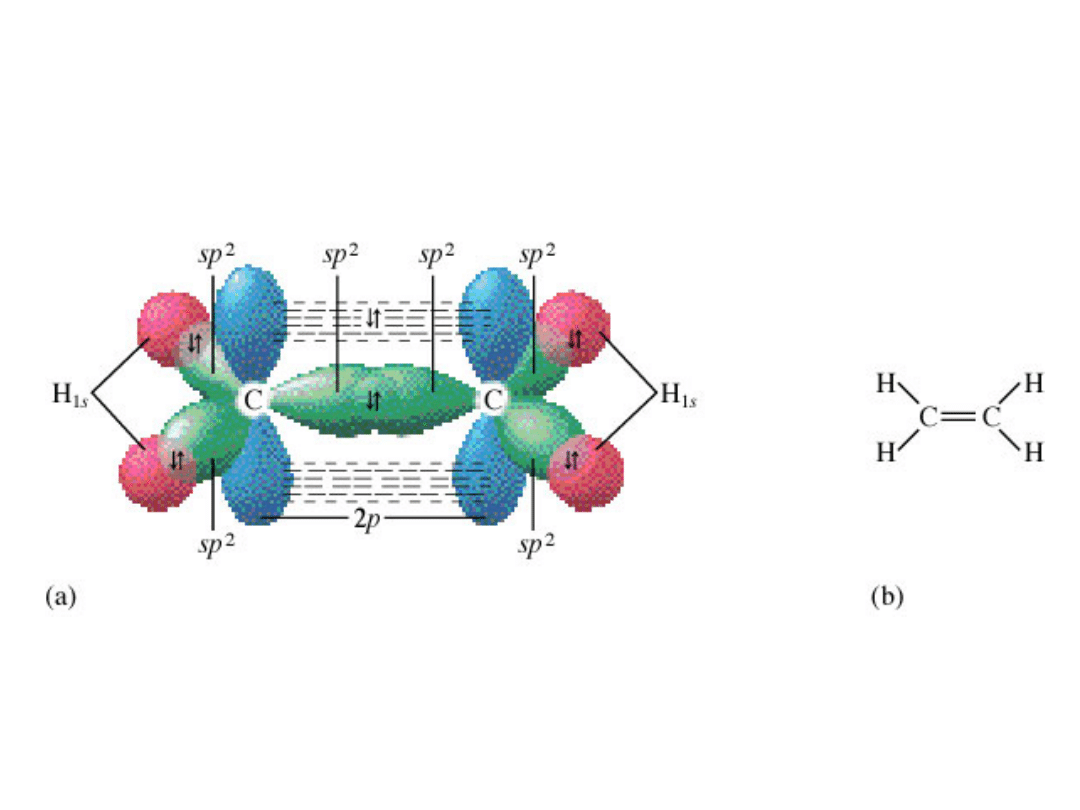
Orbitale molekularne C
2
H
4
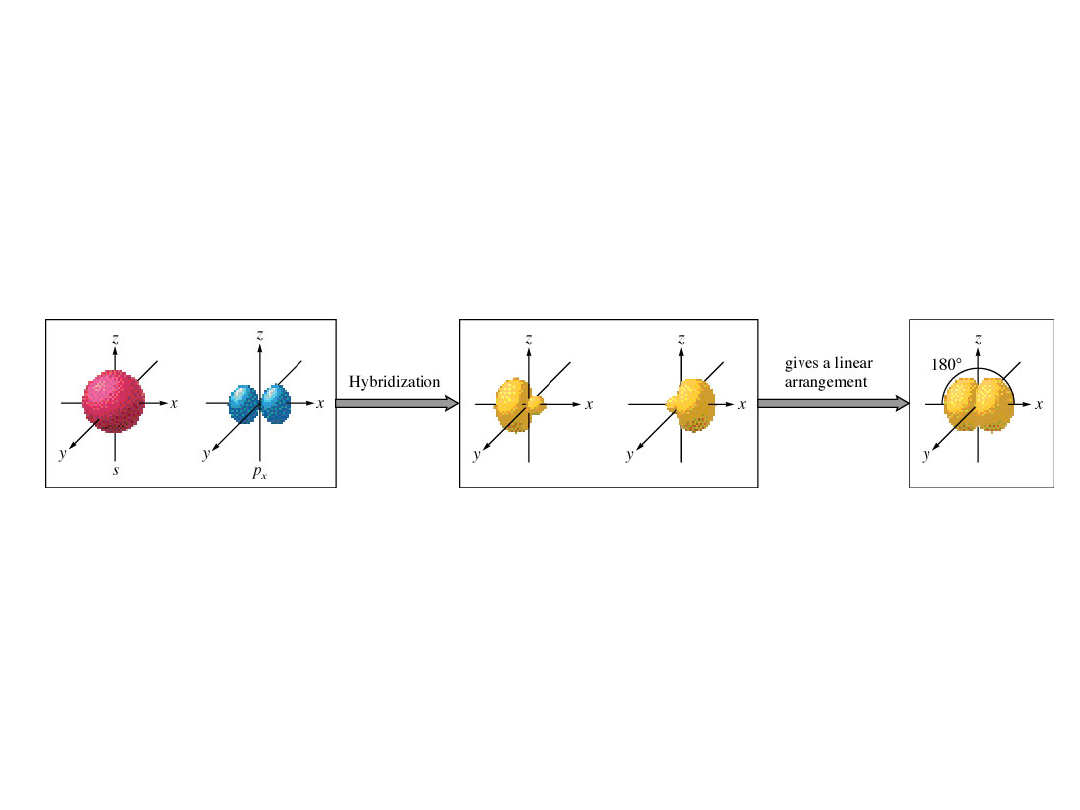
hybrydyzacja sp – cząsteczka liniowa
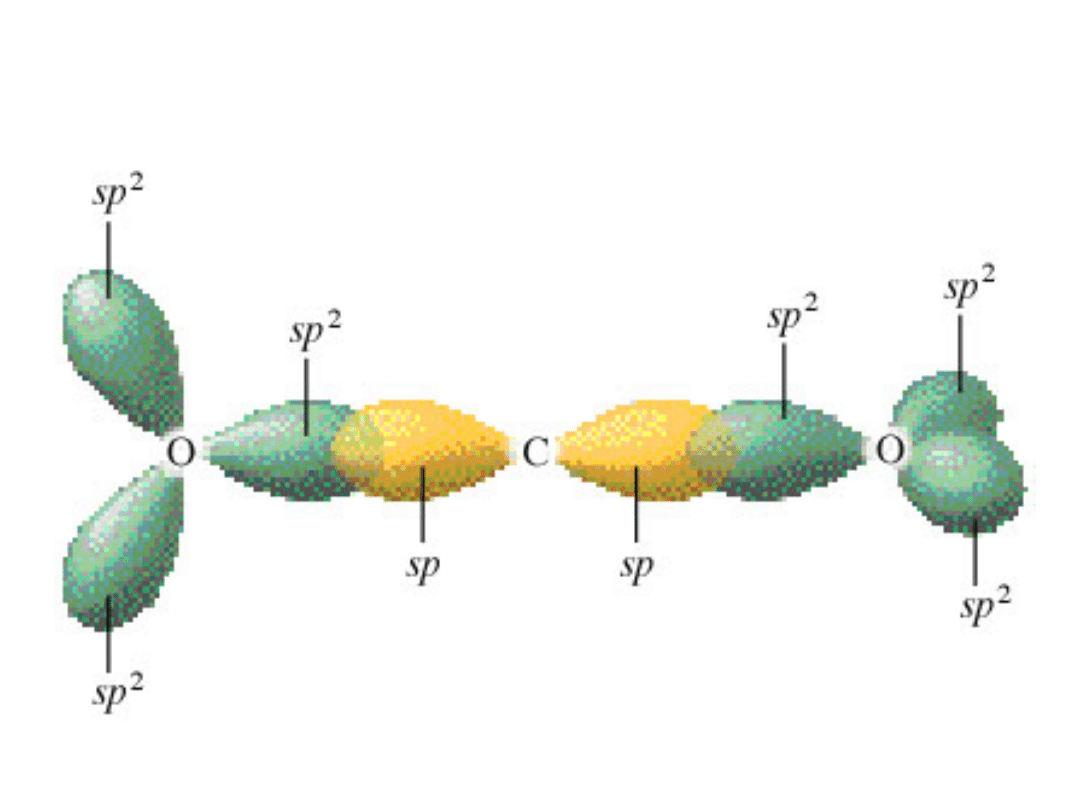
Przykład: cząsteczka CO
2
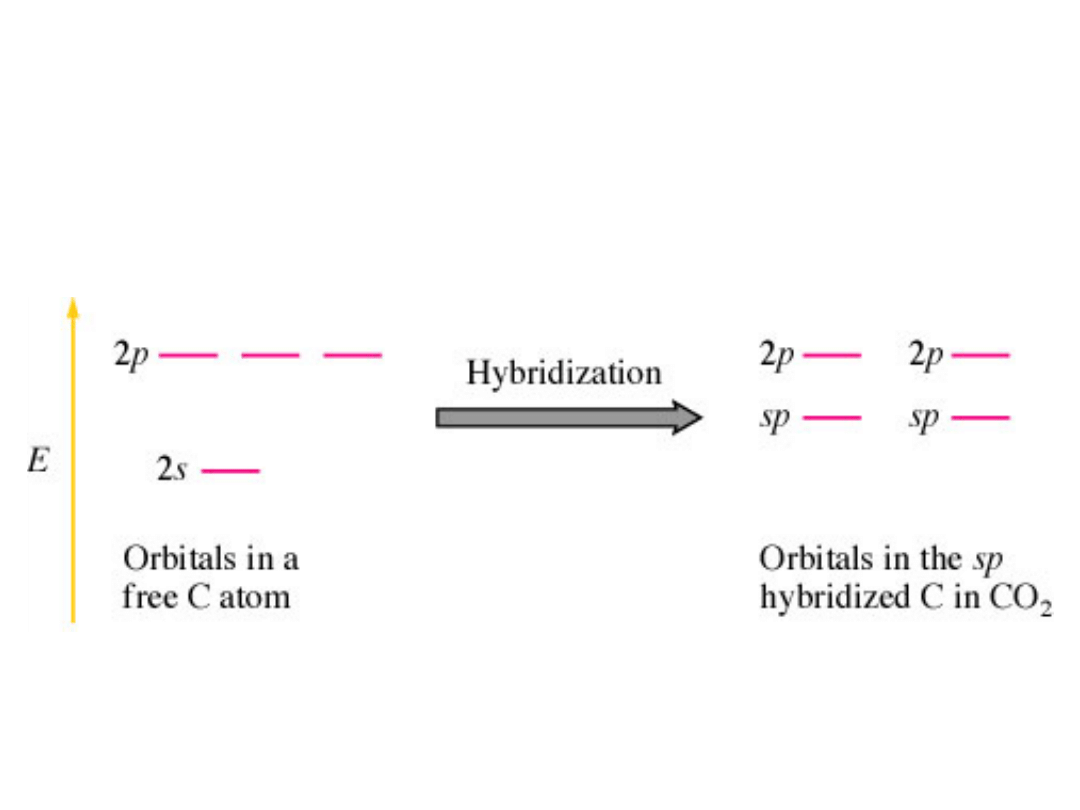
Figure 9.16
Hybrydyzacja sp - atom węgla
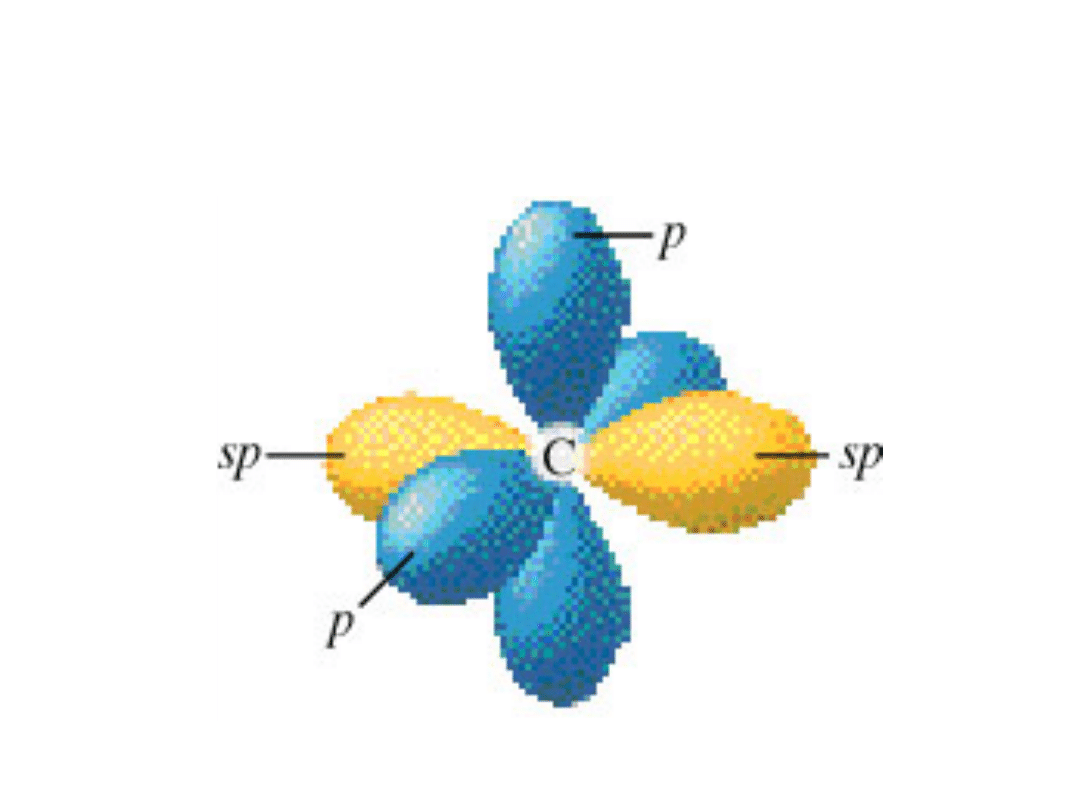
Orbitale sp – atom węgla
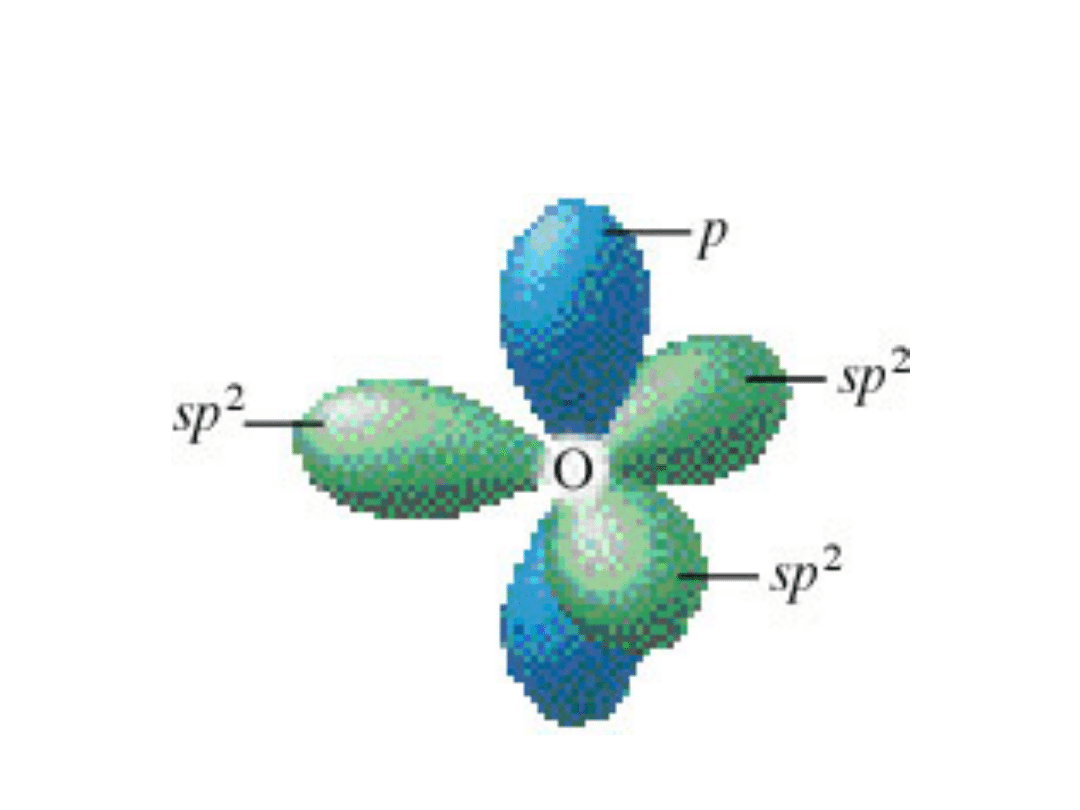
Figure 9.18
The Orbital Arrangement for an sp
2
Hybridized Oxygen Atom
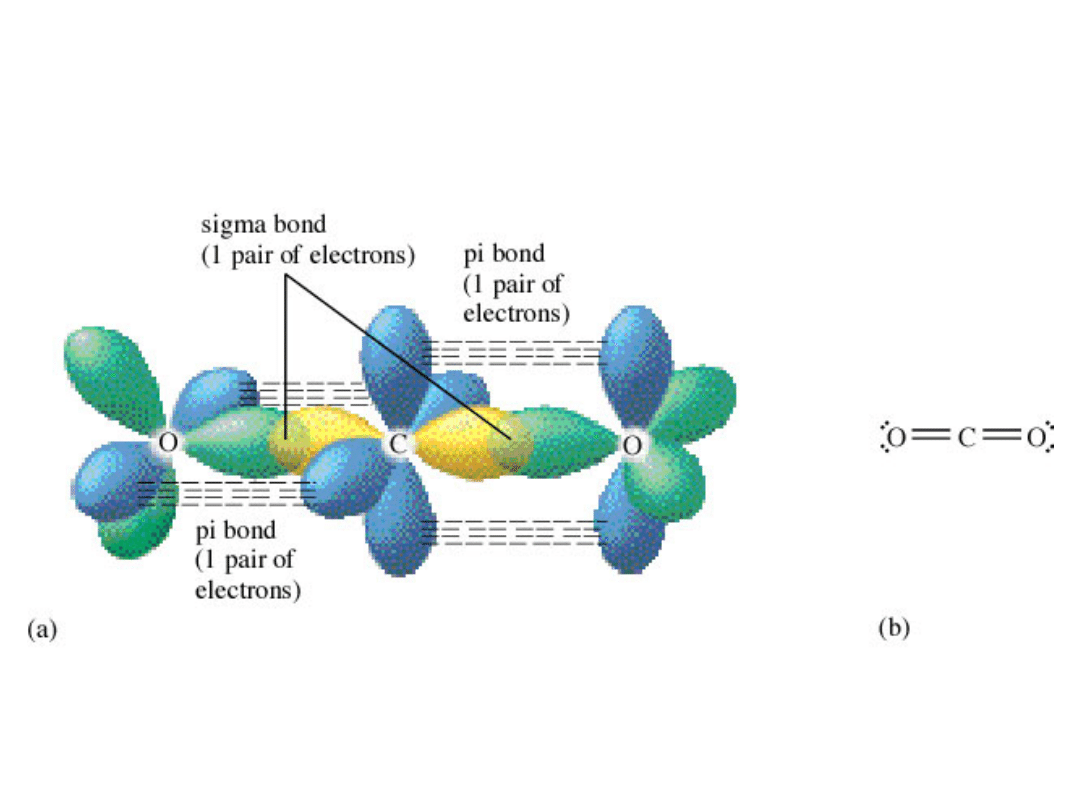
Figure 9.19
The Orbitals for CO
2
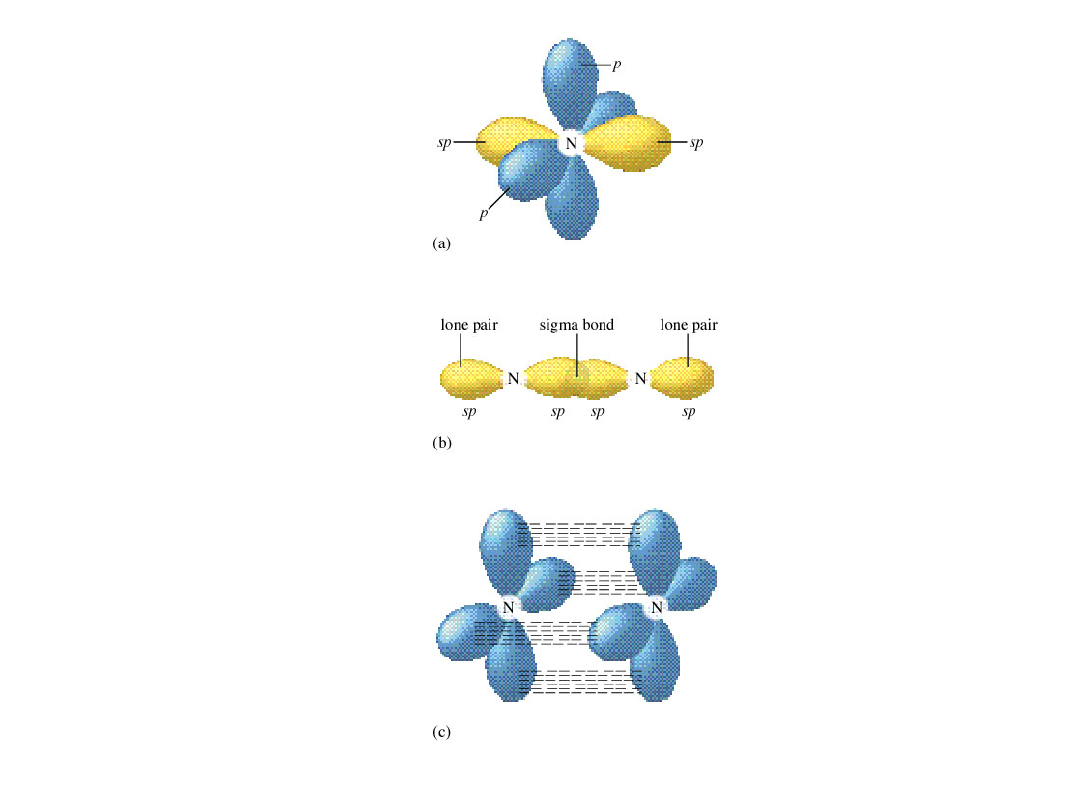
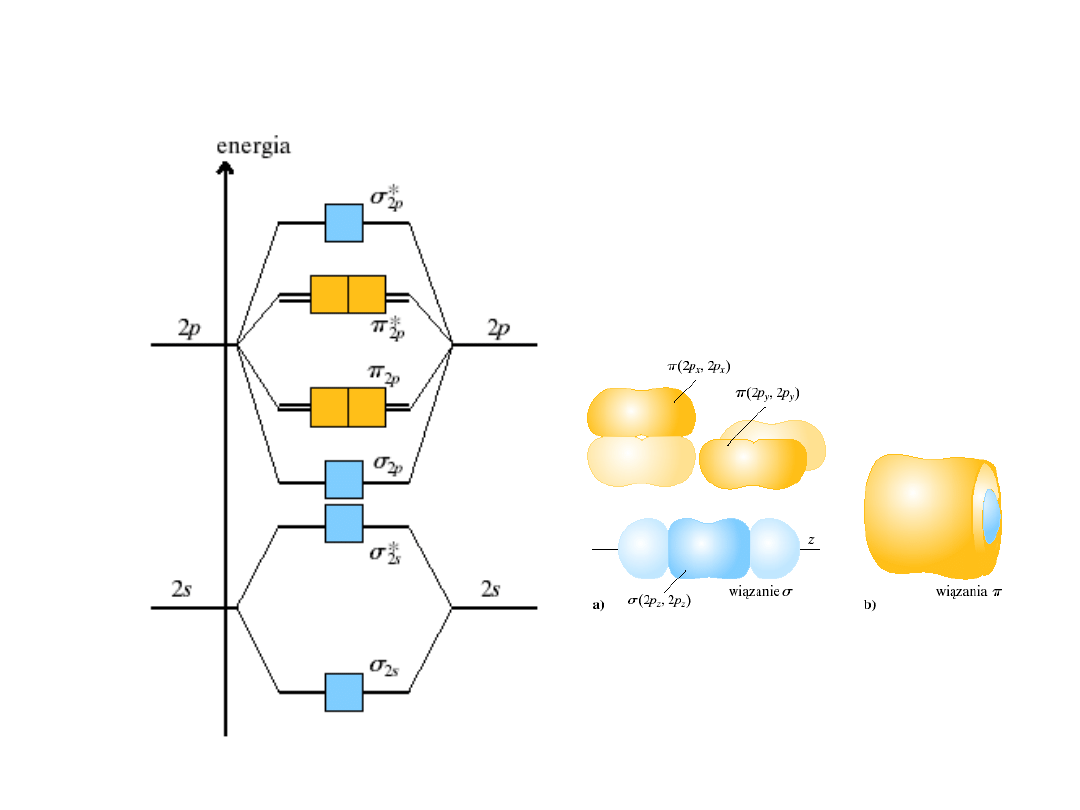
Orbitale
N
2
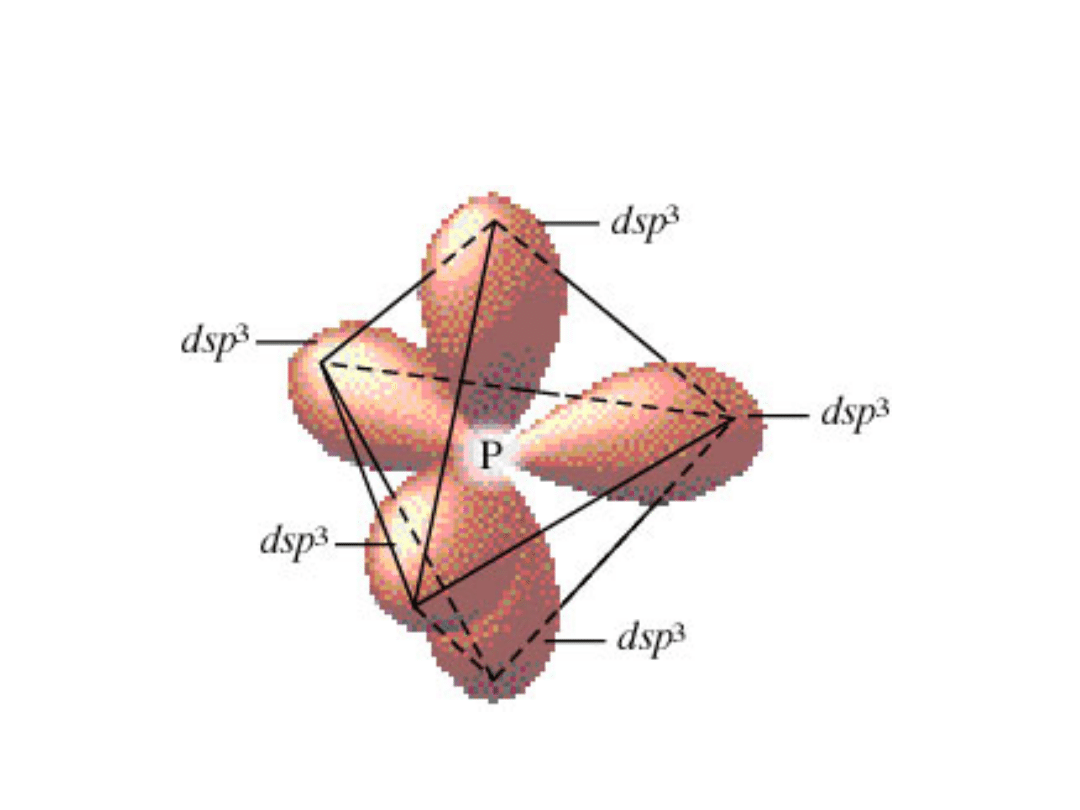
Hybrydyzacja dsp
3
- atom fosforu
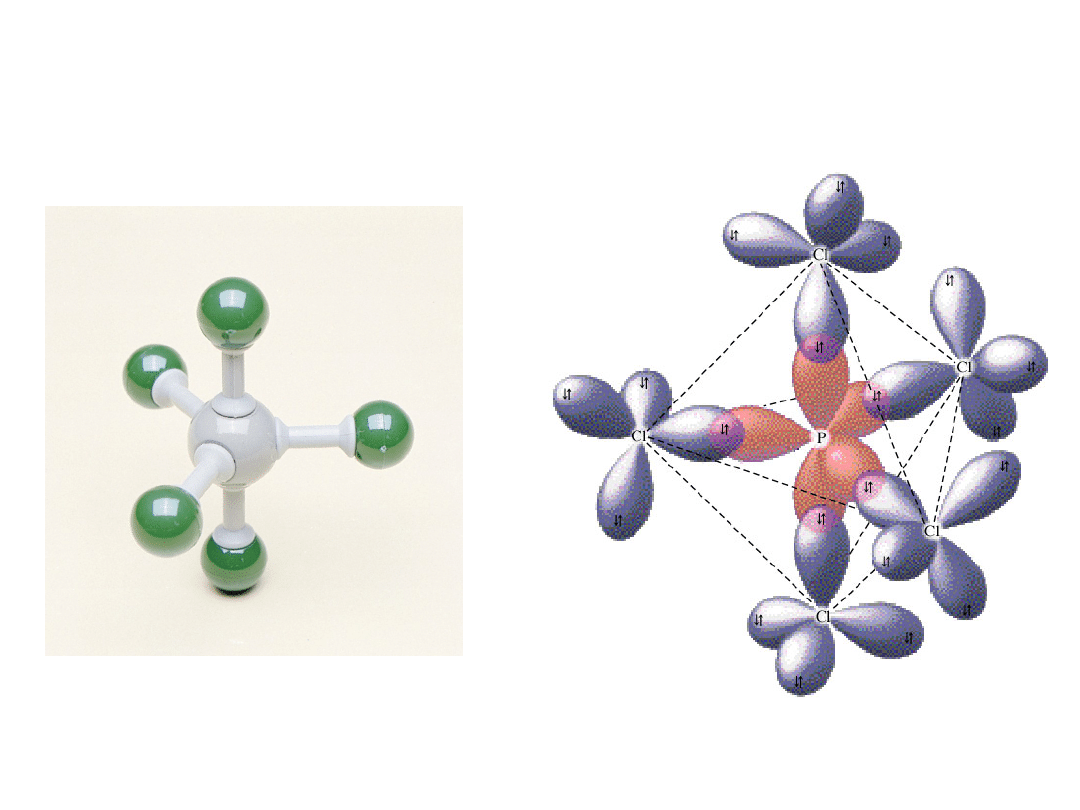
(a) cząsteczka PCI
5
(b) orbitale tworzące wiązania w cząsteczce
PCI
5
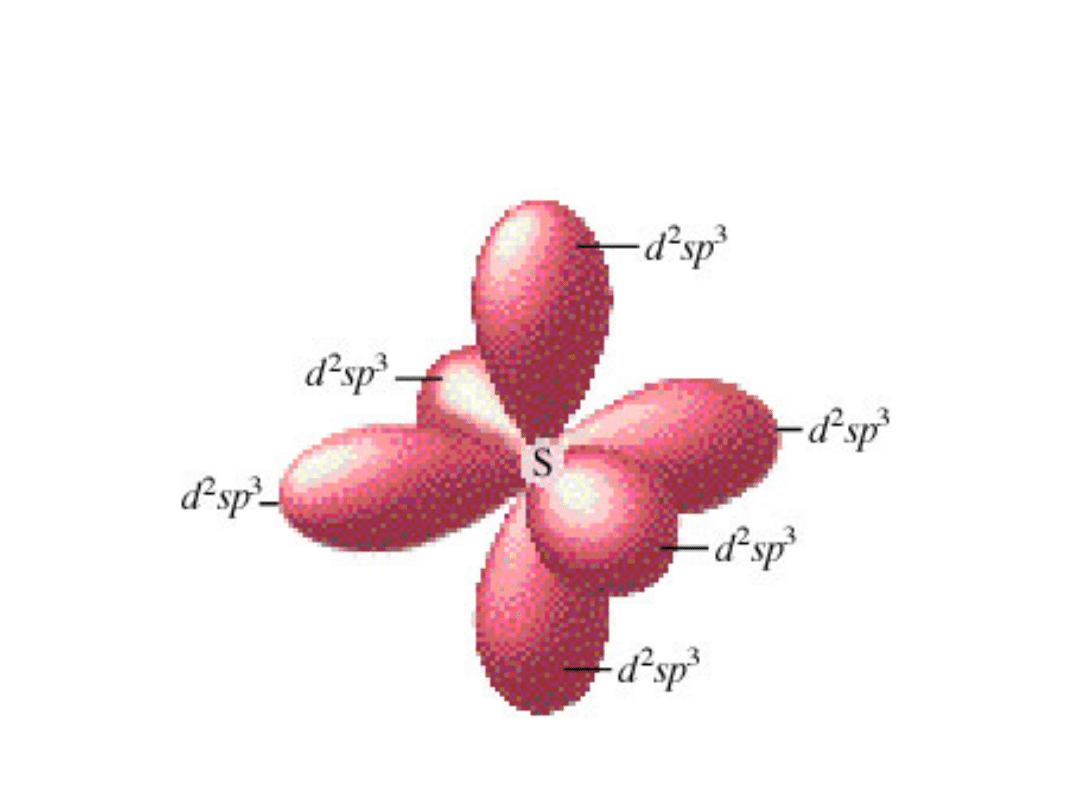
Hybrydyzacja d
2
sp
3
- atom siarki
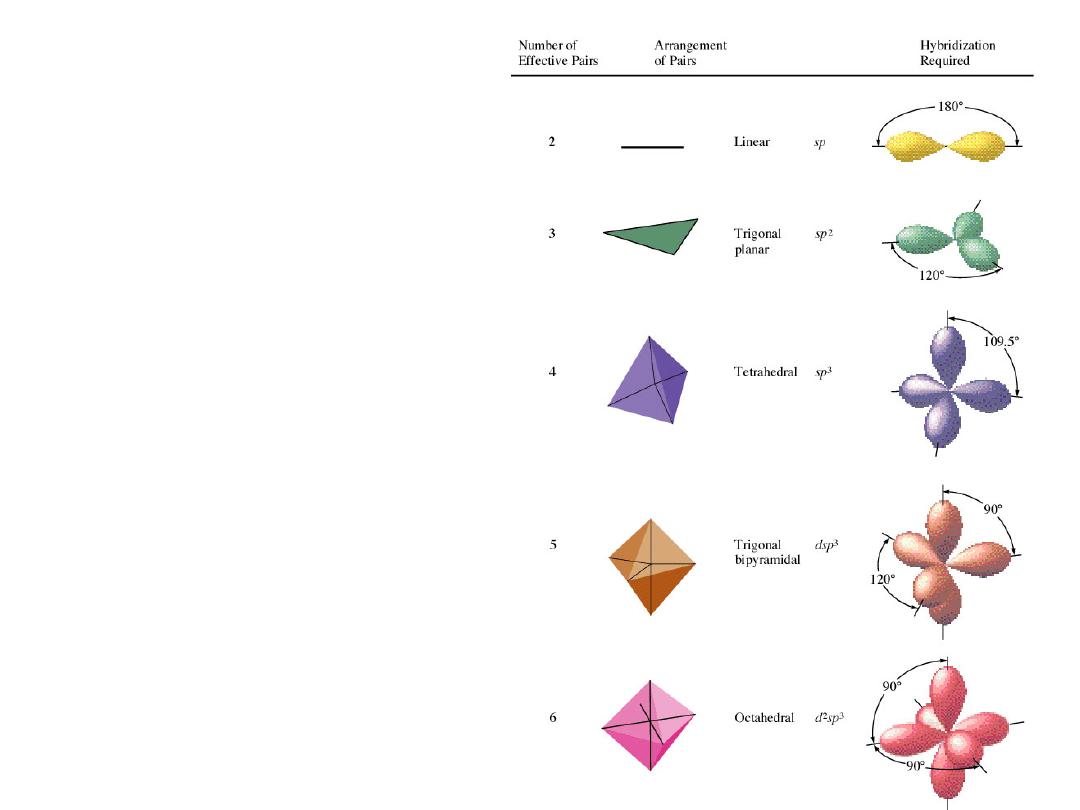
związek pomiędzy ilością
efektywnych par
elektronowych ,
rozkładem w przestrzeni i
zestawem orbitali
hybrydowych

Hybrydyzacja
Mieszanie się orbitali aby utworzyć
wiązania.
Związane jest to z
minimalizacją energii cząsteczki.

Promocja i hybrydyzacja
Promocja: wzbudzenie 1 elektronu
s aby zajął jeden z niezapełnionych
orbitali p
Wyrównanie energii
Dzięki promocji uzyskujemy cztery
równoważne miejsca do utworzenia
wiązań
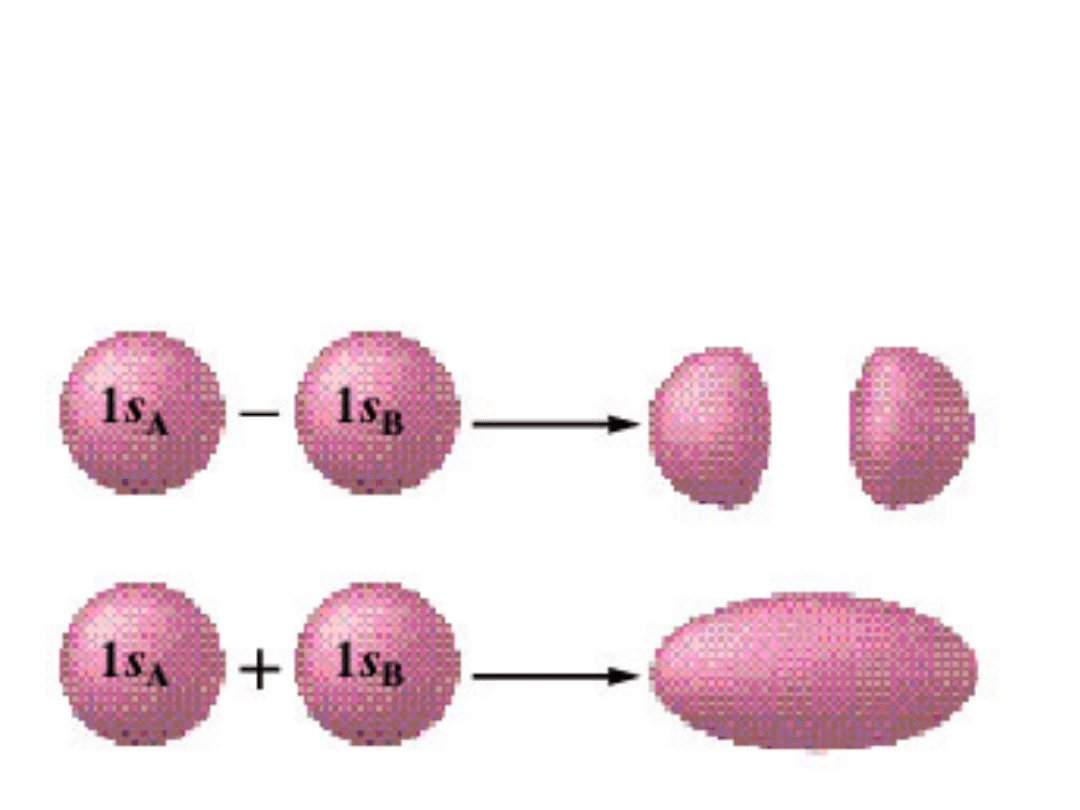
Atom wodoru – orbitale
molekularne
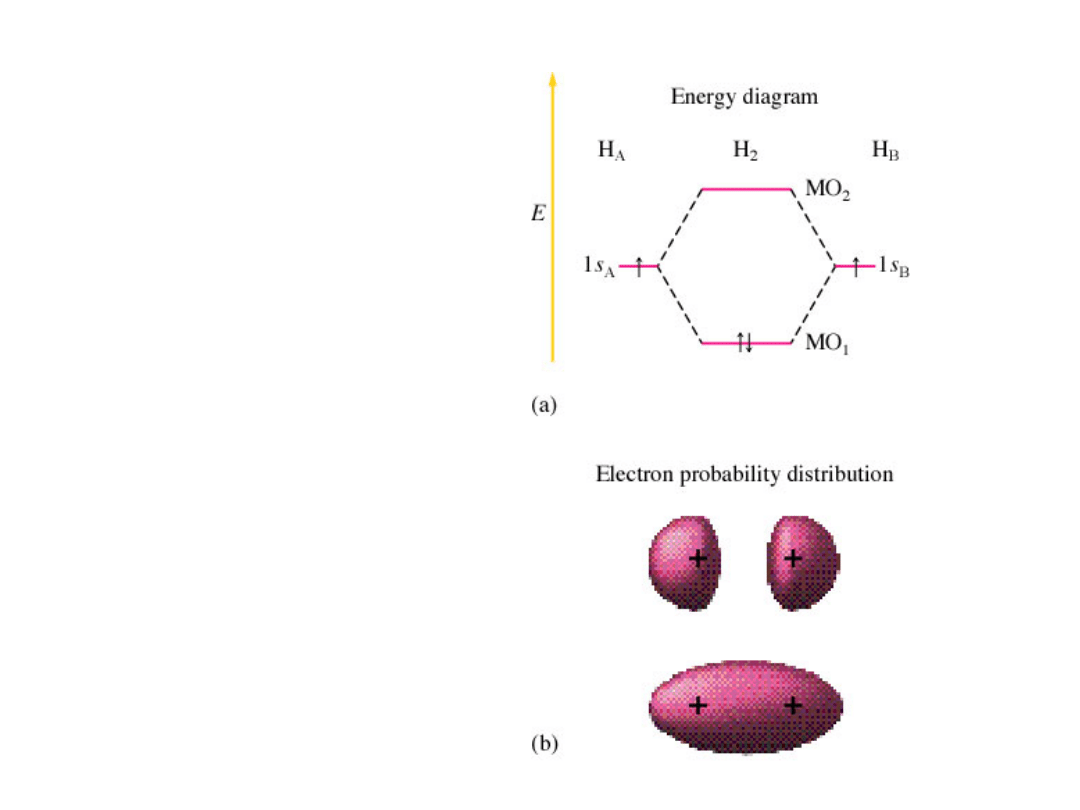
Poziomy energetyczne
dla cząsteczki H
2
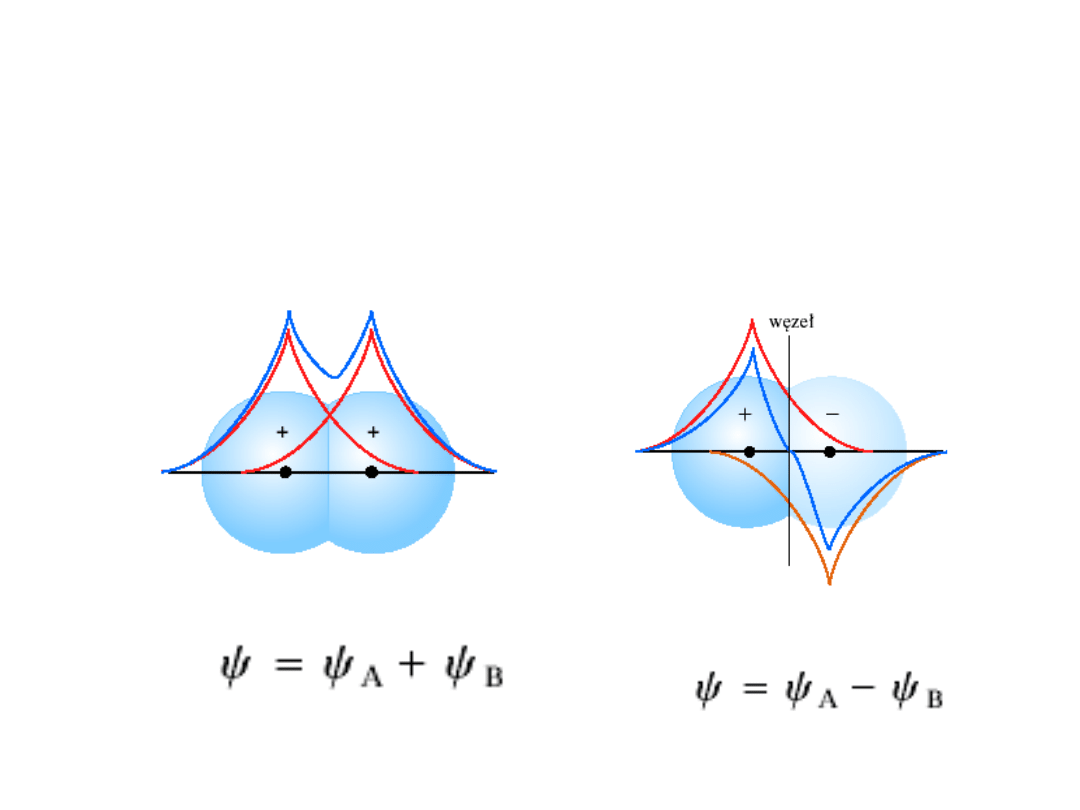
Cząsteczka wodoru
Orbital
wiążący
Orbital
antywiążący

Układy wieloelektronowe
Zjawisko delokalizacji elektronów
Barwniki: chlorofil, rodopsyna
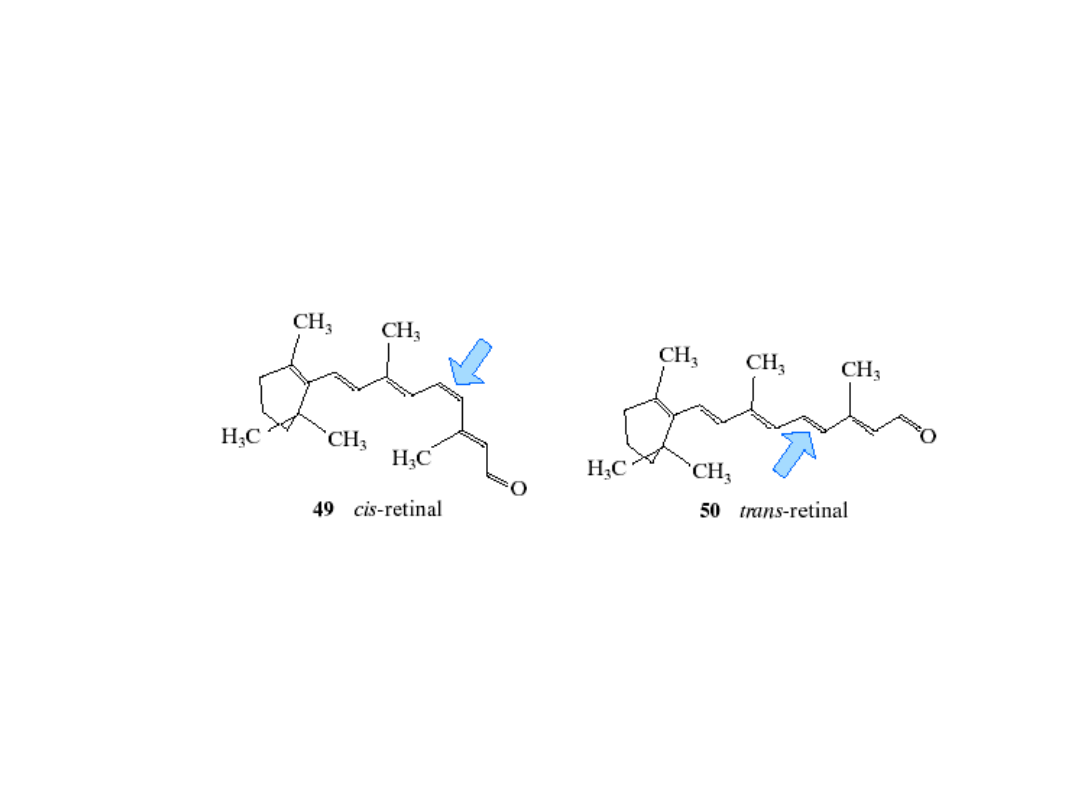
Rodopsyna

Orbitale molekularne
Elektrony zapełniają orbitale molekularne
zgodnie z regułą:
1. Elektrony zapełniają orbitale molekularne
o najniższej energii.
2. Zgodnie z zasadą Pauliego orbital może
być zapełniony tylko przez dwa elektrony
3. Jeżeli dostępne są nieobsadzone orbitale
to elektrony zapełniają orbitale pojedynczo
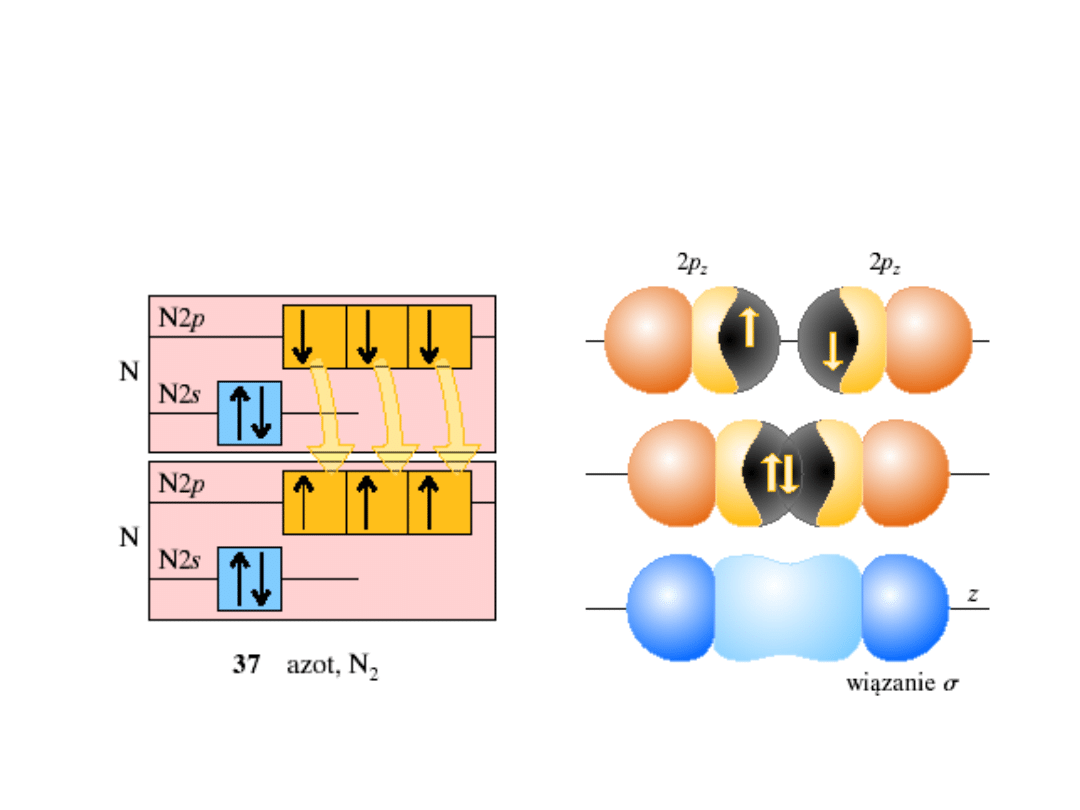
Cząsteczka
N
2

Wiązanie tworzą dwa elektrony
sparowane
Istnieje także możliwość gdy
elektrony nie są sparowane
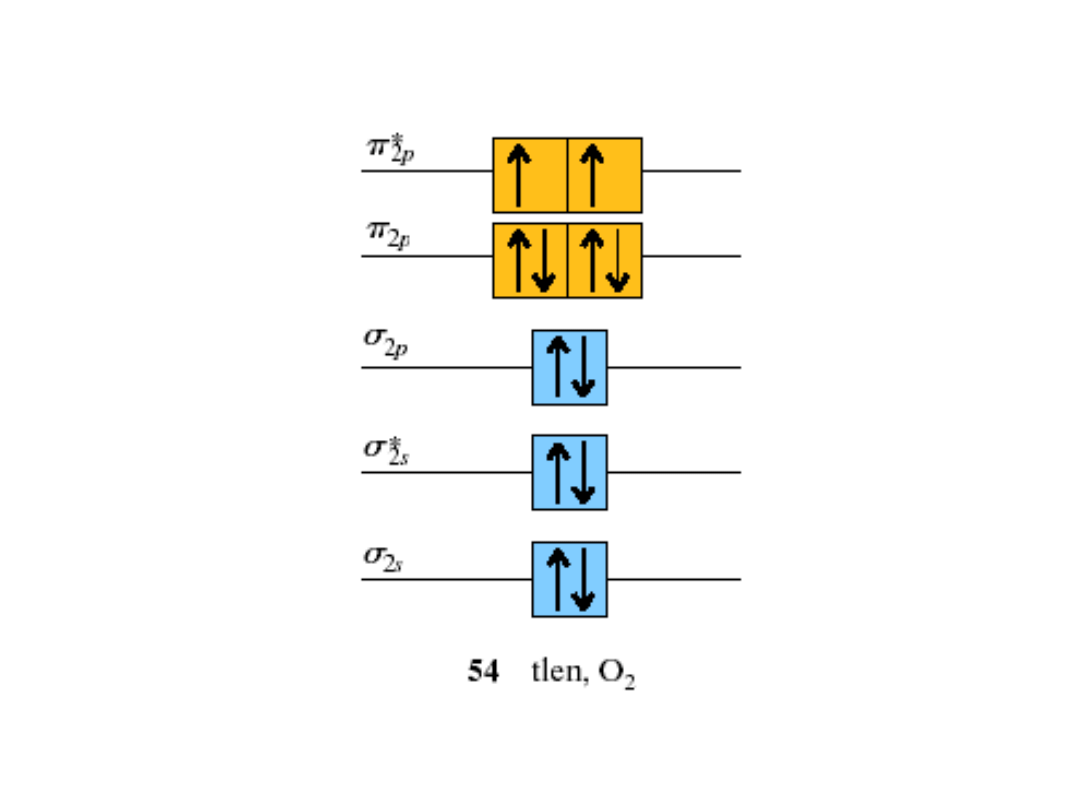

Diamagnetyzm
Wszystkie elektrony sparowane
Diamagnetyki są usuwane z pola
magnetycznego
Efekt znacznie słabszy od
paramagnetyzmu

Paramagnetyzm
niesparowane elektrony
Przyciągane przez zewnętrzne pole
magnetyczne
Efekt znacznie silniejszy niż
diamagnetyzm
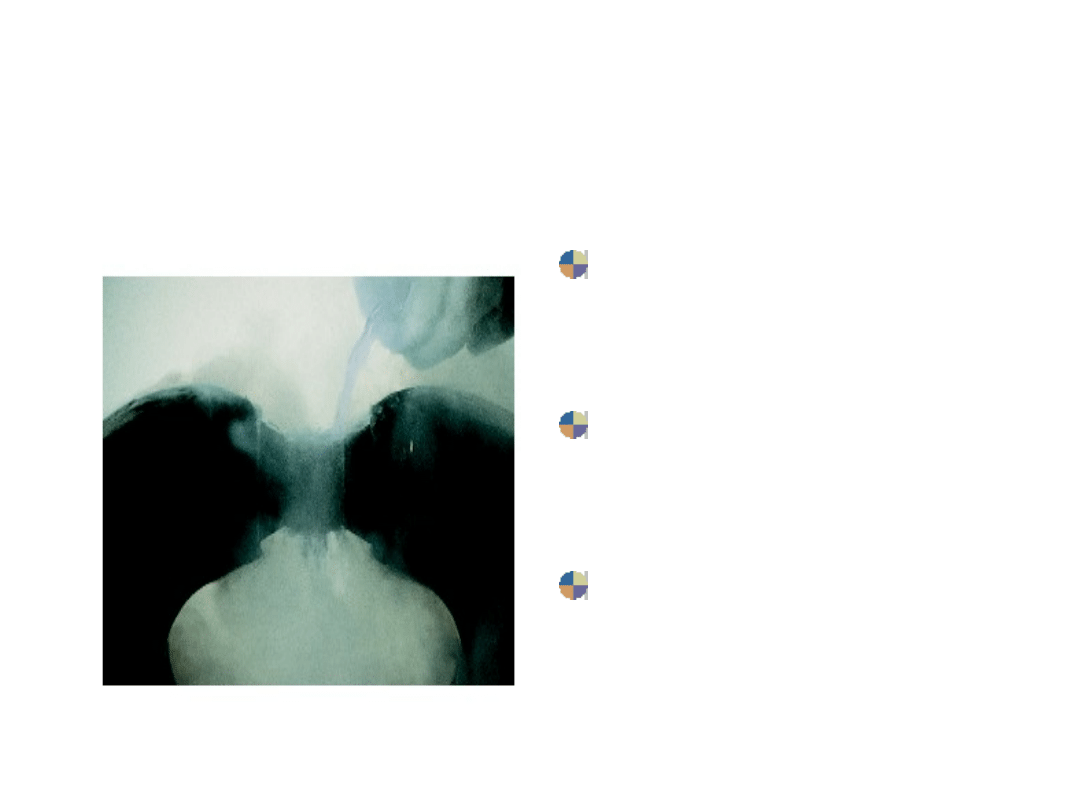
Paramagnetyzm
cząsteczek tlenu
Ciekły tlen
przykleja się do
magnesu.
Paramagnetyki –
niesparowane
elektrony.
Sparowane
elektrony -
diamagnetyki
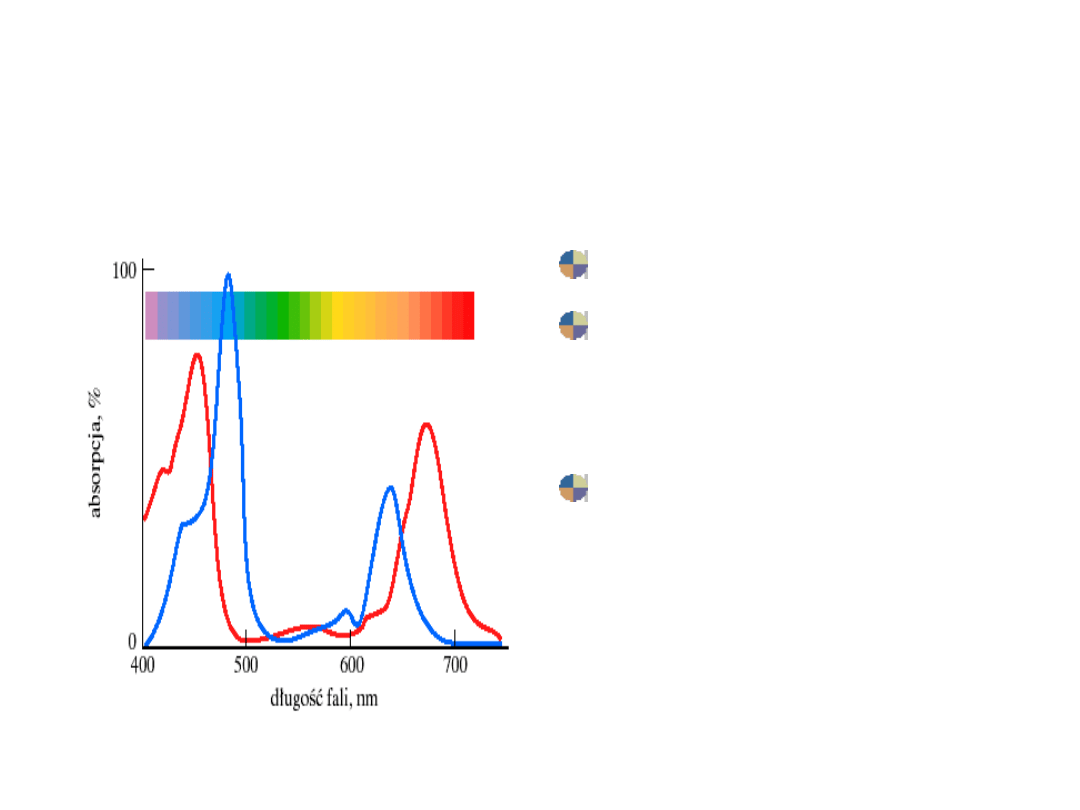
Spektroskopia
Barwniki
Co przypomina
krzywa
zależności?
Widma
absorpcyjne

Siły międzycząsteczkowe
Wiązania pomiędzy atomami –
cząsteczki
Co decyduje o stanie skupienia?
Siły międzycząsteczkowe
Jakie są typy oddziaływań
międzycząsteczkowych?
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 50
- Slide 51
- Slide 52
Wyszukiwarka
Podobne podstrony:
pdf wykład 03 orbitale molekularne i hybrydyzacja 2014
w4 orbitale molekularne hybrydyzacja
2009-11-05, pedagogium, wykłady, Teoria edukacji obronnej i bezpieczeństwa publicznego
Autor opisuje 4 koncepcje psychologiczne człowieka, mteody wykład, teoria wychowania wykłady
Biologia molekularna-wykład 1, 1 semestr, Biologia molekularna, Biologia molekularna, biologia
wykład Teoria Bezpieczeństwa, Sudia - Bezpieczeństwo Wewnętrzne, Semestr I, Teoria Bezpieczeństwa
wykład IV biologia molekularna najwazniejsze o laminach
wyklady teoria metodyki i rekreacji-1, pedagogika czasu wolnego, rekreacja, metodyka rekreacji
zalacznki 01, Wykłady-teoria, Ogólne zasady ruchu oraz piesi
Teoretyczne podstawy wychowania, wyklady z teorii wych, Wykład 3: Teoria jako narzędzie poznawania r
Chemia wykłady, Chemia wykłady-mini, → ORBITALE ATOMOWE WODORU
TEORIA KINETYCZNO MOLEKULARNA BUDOWY MATERII 1 , TEORIA KINETYCZNO MOLEKULARNA BUDOWY MATERII
Jadczak R Badania operacyjne, wyklad teoria podejmowania decyzji
Jadczak R, Badania operacyjne wyklad teoria podejmowania decyzji
więcej podobnych podstron