
Leki hipoglikemizujące

Cukrzyca jest to grupa chorób
metabolicznych charakteryzująca się
hiperglikemią wynikającą z defektu
wydzielania i/lub działania insuliny.
Przewlekła hiperglikemia wiąże się
z uszkodzeniem,
zaburzeniem czynności
i niewydolnością różnych narządów,
szczególnie: oczu, nerek, nerwów,
serca i naczyń krwionośnych.
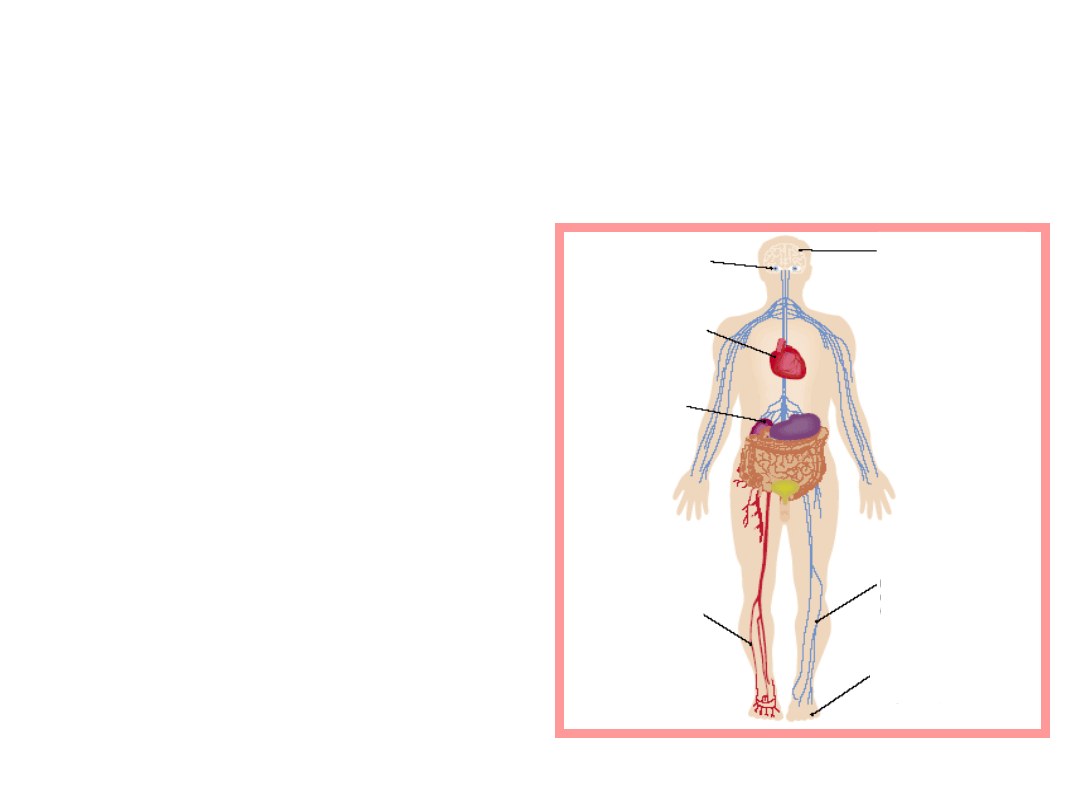
Retinopatia
Choroba
naczyniowa
mózgu
Choroba
niedokrwienna
serca
Nefropatia
cukrzycowa
Neuropatia
Uszkodzenie
naczyń
krwionośnych
Zespół stopy
cukrzycowej
Cukrzyca jest chorobą, która łączy się ze
znaczącym ryzykiem wystąpienia
poważnych
powikłań związanych najczęściej z układem
krążenia i układem nerwowym.
Od 70% do 80% chorych na cukrzycę
umiera
na skutek powikłań sercowo-naczyniowych
Osoby chore na cukrzyce są
dziesięciokrotnie
bardziej narażone na utratę wzroku niż
osoby
zdrowe
Powikłania cukrzycy powodują skrócenie
życie średnio o 16-20 lat u pacjentów z
cukrzyca typu 1 i 4-6 lat z cukrzycą typu 2 .
Części powikłań można zapobiec lub
oddalić
je w czasie poprzez właściwą profilaktykę
i leczenie cukrzycy.
Powikłania cukrzycy
Powikłania cukrzycy
Przewlekłe powikłania cukrzycy
Przewlekłe powikłania cukrzycy
Źródło:
Źródło:
http://www.eatlas.idf.org/Complications/
http://www.eatlas.idf.org/Complications/

•— zmniejszenie masy ciała;
•— wzmożone pragnienie;
•— wielomocz;
•— osłabienie;
•— pojawienie się zmian ropnych na
skórze oraz stanów zapalnych
narządów moczowo-płciowych.

• — prawidłowa glikemia na czczo: 60–99 mg/dl (3,4– –5,5
mmol/l);
• — nieprawidłowa glikemia na czczo (IFG, impaired fasting
glucose): 100–125 mg/dl (5,6–6,9 mmol/l);
• — nieprawidłowa tolerancja glukozy (IGT, impaired
glucose tolerance): w 120. minucie testu tolerancji
glukozy według WHO glikemia 140– –199 mg/dl (7,8–11
mmol/l);
• — stan przedcukrzycowy (prediabetes) — nieprawidłowa
glikemia na czczo i/lub nieprawidłowa tolerancja glukozy;
• — cukrzyca: objawy hiperglikemii i glikemia przygodna ≥
200 mg/dl (≥ 11,1 mmol/l) lub 2-krotnie glikemia na
czczo ≥ 126 mg/dl (≥ 7,0 mmol/l) lub glikemia w 120.
minucie po obciążeniu glukozą według zaleceń WHO ≥
200 mg/dl (≥ 11,1 mmol/l).
•Cukrzyca typu 1 — polega na
destrukcji komórek beta, zwykle
prowadzącej do bezwzględnego
niedoboru insuliny:
•— wywołana procesem
immunologicznym
•— idiopatyczna

• II Cukrzyca typu 2 — dochodzi do rozwoju insulinooporności
ze względnym niedoborem insuliny lub przeważa dominujący
defekt wydzielania połączony z insulinoopornością
• III Inne określone typy cukrzycy:
• — defekty genetyczne czynności komórek beta
• — defekty genetyczne działania insuliny
• — choroby wewnątrzwydzielniczej części trzustki
• — endokrynopatie
• — cukrzyca wywołana przez leki lub inne substancje
chemiczne
• — zakażenie
• — rzadkie postacie wywołane procesem immunologicznym
• — inne zespoły genetyczne, niekiedy związane z cukrzycą
• IV Cukrzyca ciążowa

• Samokontrolę glikemii należy prowadzić u chorych
leczonych wielokrotnymi wstrzyknięciami insuliny
lub przy użyciu ciągłego podskórnego wlewu
insuliny.
• Chorzy ci powinni przynajmniej raz w tygodniu
wykonywać dobowy profil glikemii, obejmujący
oznaczenia stężenia glukozy: rano na czczo, przed i
120 minut po każdym głównym posiłku, przed
snem, o godz. 24.00 oraz między godz. 2.00 a 4.00
rano. Częstość i pory oznaczeń wykonywanych
dodatkowo należy dobierać indywidualnie.

• Chorzy leczeni zgodnie z algorytmem wielokrotnych
wstrzyknięć insuliny — wielokrotne pomiary w ciągu doby
według ustalonych zasad leczenia oraz potrzeb pacjenta.
• Chorzy na cukrzycę typu 2 leczeni dietą — raz w miesiącu
skrócony profil glikemii (na czczo i po głównych posiłkach).
• Chorzy na cukrzycę typu 2 stosujący doustne leki
przeciwcukrzycowe lub analogi GLP — raz w tygodniu
skrócony profil glikemii (na czczo i po głównych posiłkach).
• Chorzy na cukrzycę typu 2 leczeni stałymi dawkami
insuliny — codziennie 1–2 pomiary glikemii, dodatkowo raz
w tygodniu skrócony profil glikemii (na czczo i po głównych
posiłkach) oraz raz w miesiącu pełny profil glikemii.

• 1. Należy dążyć do osiągnięcia wszystkich wartości
docelowych dotyczących gospodarki węglowodanowej,
lipidowej oraz ciśnienia tętniczego.
• 2. U osób w starszym wieku i w sytuacji współistnienia
schorzeń towarzyszących, jeśli prognoza przeżycia nie
osiąga 10 lat, należy złagodzić kryteria wyrównania do
stopnia, który nie pogorszyć jakości życia pacjenta.
• 3. Intensywność dążenia do wartości docelowych należy
indywidualizować. Uwzględnić trzeba stopień ryzyka
hipoglikemii, stopień edukacji pacjenta i relacje korzyści i
ryzyka uzyskania tych wartości. W niektórych sytuacjach
(np. przy obecności zaawansowanych powikłań, w starszym
wieku) należy osiągać je stopniowo, w ciągu 3-6 tygodni

•
Kryterium ogólne:
•
HbA1c (%): 7%:
•
— glikemia na czczo i przed posiłkami (dotyczy również
samokontroli): 70–110 mg/dl (3,9–6,1 mmol/l);
•
— glikemia 2 godziny po posiłku — podczas
samokontroli: < 160 mg/dl (8,9 mmol/l).
•
Kryteria szczegółowe:
•
a) HbA1c (%): 6,5%:
•
— glikemia na czczo i przed posiłkami (dotyczy również
samokontroli): 70–110 mg/dl (3,9– –6,1 mmol/l);
•
— glikemia w 120. minucie po posiłku — podczas
samokontroli: < 140 mg/dl (7,8 mmol/l);
•
— w odniesieniu do cukrzycy typu 1;
•
— w przypadku krótkotrwałej cukrzycy typu 2.

•Wg badań epidemiologicznych w
2030 r. na świecie będzie 360 mln
osób z cukrzycą, z czego ponad 90%
stanowić będą chorzy na cukrzycę
typu 2
•W Polsce – 4% (1,5 mln - 2,0 mln
osób)

•W rozwoju cukrzycy biorą udział 2
mechanizmy – insulinooporność oraz
postępujące zaburzenie komórek beta
wysp trzustkowych
•Hiperglikemia (wzmożone pragnienie,
wielomocz, zmiana masy ciała)
•Następstwa metaboliczne –
hiperlipidemia, zaburzenia
krzepnięcia i fibrynolizy, powikłania
sercowo – naczyniowe.
•Zwiększające wrażliwość tkanek
obwodowych na działanie insuliny
endogennej (pochodne biguanidów i
tiazolidinediony (glitazony))
•Pobudzające wydzielanie insuliny (pochodne
sulfonylomocznika, glinidy oraz inhibitory
dipeptydylopeptydazy4)
•Hamujące wchłanianie węglowodanów w
przewodzie pokarmowym (inhibitory alfa-
glukozydaz)

•Skuteczność obniżania glikemii
•Dodatkowe działania pozaglikemiczne
•Działania niepożądane
•Prosty schemat dawkowania
•Koszt terapii

Pochodne
sulfonylomocznika
• Okryte przypadkowo – 1942 r. Janbon
i wsp. – hipoglikemia u zwierząt
doświadczalnych
• 1-bytylo-3-sulfonylomocznik
(karbutamid) – pierwszy zastosowany
w cukrzycy (wycofany ze względu na
toksyczne działanie na szpik kostny)
• Lata 50. - tolbutamid

Pochodne
sulfonylomocznika
• pobudzają wydzielanie insuliny przez
komórki beta
• zwiększenie stężenia insuliny poprzez
redukcję wątrobowego klirensu
• przy przewlekłym stosowaniu brak efektu
zwiększenia wydzielania insuliny
(zmniejszenie wrażliwości receptorów
powierzchniowych na komórkach beta), a
jedynie obniżenie stężenia glukozy (lepszy
efekt działania insuliny na tkanki
docelowe?)

Pochodne
sulfonylomocznika
• łączą się ze swoistymi receptorami błonowymi,
zlokalizowanymi na komórkach beta wysp
trzustkowych, ale też na komórkach alfa wysp
trzustkowych i miocytach.
• receptory są funkcjonalnie związane z kanałami
potasowymi zależnymi od ATP.
• pobudzenie receptora powoduje zamknięcie
kanałów potasowych, zahamowanie wypływu
jonów potasowych i depolaryzację błony
komórkowej, co powoduje otwarcie kanałów
wapniowych.
• napływ jonów wapnia powoduje aktywację
kaskady wewnątrzkomórkowej i wzrost
wydzielania insuliny.

Pochodne
sulfonylomocznika
• skuteczność podobna do metforminy
– zmniejszają HbA1c o ok. 1,5%
• I generacja – znacznie wyższe ryzyko
hipoglikemii niż II generacji
(szczególnie o osób starszych)
• na początku leczenia obserwuje się
wzrost masy ciała o ok. 2kg

Pochodne sulfonylomocznika –
I generacja
• TOLBUTAMID (Orinase)
• CHLORPROPAMID (Diabinese)
• TOLAZAMID (Tolinase)
• ACETOHEKSAMID (Dymelor)

Pochodne sulfonylomocznika –
II generacja
• GLIKLAZYD (Diaprel, Diabrezide,
Gliazidan, Diazide, Gliclada)
• GLIPIZYD (Antidiab, Glibenese,
Glipizide)
• GLIMEPIRYD (Amaryl, Avaron,
Diaryl, Glibetic, Glidiamid,
GlimeHeksal, Glipid, Symglic)
• GLIKWIDON (Glurenorm)

Pochodne
sulfonylomocznika
• Różnią się szybkością wchłaniania, ale wszystkie
dobrze wchłaniają się z przewodu pokarmowego
• Pokarm i hiperglikemia (hamowanie motoryki
żołądka) mogą zwolnić wchłanianie
• I generacja: okresy półtrwania oraz metabolizm
różne (krótki T1/2, ale np. długi dla aktywnych
metabolitów)
• II generacja: krótki T1/2, ale długotrwały efekt
hipoglikemizujący (12-24h)
• Wszystkie metabolizowane w wątrobie, wydalane
przez nerki (wyjątek: glikwidon)

Pochodne sulfonylomocznika –
działania niepożądane
• rzadko – ok. 4% dla I generacji i nieco mniej dla II
generacji
• hipoglikemia, łącznie ze śpiączką hipoglikemiczną
• zaburzenia żołądkowo-jelitowe (ból brzucha, nudności,
wymioty, niestrawność, biegunka, zaparcia).
• wysypka, świąd, pokrzywka, rumień, wykwity
plamkowo-grudkowe, odczyny pęcherzowe,
• zaburzenia w składzie krwi (anemia aplastyczna i
hemolityczna, leukopenia, małopłytkowość,
granulocytopenia),
• zwiększona aktywność enzymów wątrobowych,
zapalenie wątroby
• hiponatremia (chlorpropamid)
• żółtaczka cholestatyczna

Pochodne sulfonylomocznika –
przeciwwskazania
• cukrzyca typu 1
• ciąża i laktacja
• dla starszych preparatów:
zaawansowana niewydolność nerek i
wątroby

Inhibitory alfa-glukozydazy
• mechanizm działania – blokowanie działania alfa-glukozydaz
rąbka szczoteczkowego jelita cienkiego i redukują jelitowe
wchłanianie skrobi, dekstryn i disacharydów
• najsilniej blokowane jest działanie glukomaltazy, maltazy i
sacharazy, laktaza praktycznie nie jest blokowana
• hamuje i spowalnia końcowy enzymatyczny etap trawienia
polisacharydów, oligosacharydów i niektórych disacharydów
(maltozy, sacharozy). Na tej drodze zmniejsza glikemię
poposiłkową. Nie ma wpływu na wchłanianie glukozy
• z powodu mniejszej poposiłkowej hiperinsulinemii przyczynia
się do zmniejszenia syntezy triglicerydów oraz ich
magazynowania w wątrobie i tkance tłuszczowej
• praktycznie nie wchłania się z przewodu pokarmowego
(<2%).
• stosowana przed głównymi posiłkami

Inhibitory alfa-glukozydazy
• W Polsce jedynym zarejestrowanym lekiem z tej
grupy jest akarboza, będąca
pseudotetrasacharydem, w którym cząsteczka
maltozy jest zastąpiona pseudomaltozą.
• Inne leki blokujące alfa-glukozydazę - miglitol
(przypominający glukozę) i wogliboza nie są
dostępne w naszym kraju.
• Blokowanie hydrolizy oligosacharydów do
monosacharydów powoduje przesunięcie ich
wchłaniania do dalszych odcinków jelita cienkiego,
co jest przyczyną działań niepożądanych w wyniku
powstawania kwasów organicznych.

Inhibitory alfa-glukozydazy
• Całkowicie wydalana z kałem w ciągu ok.
96 h (część wchłonięta z przewodu
pokarmowego w niewielkim stopniu wiąże
się z białkami osocza, nie ulega
metabolizmowi i jest szybko wydalana
przez nerki).
• Mniej skutecznie niż pochodne
sulfonylomocznika i metformina –
zmniejszają HbA1c o ok. 0,5-0,8%

Inhibitory alfa-glukozydazy
• BADANIE STOP-NIDDM – akarboza
istotnie zmniejsza ryzyko wystąpienia
zawału serca (o 91%) i wszystkich
incydentów sercowo – naczyniowych
(o 49%)

Inhibitory alfa-glukozydazy -
wskazania
Cukrzyca typu 2,
zwłaszcza u osób otyłych,
u których stosowanie samej diety i
wysiłku fizycznego okazało się
nieskuteczne.
Może być stosowana jednocześnie z
insuliną i pochodnymi
sulfonylomocznika.

Inhibitory alfa-glukozydazy -
przeciwwskazania
• nadwrażliwość na którykolwiek
składnik preparatu,
• niewydolność nerek (klirens
kreatyniny <25 ml/min),
• ciąża,
• okres karmienia piersią

Inhibitory alfa-glukozydazy –
działania niepożądane
• ze strony przewodu pokarmowego - wzdęcia,
nadmierne oddawanie gazów (powód odstawienia
leku o ok. 25-45% chorych w badaniach
klinicznych), biegunka, bóle brzucha i inne
zaburzenia ze strony przewodu pokarmowego.
• rumień, pokrzywka, osutka,
• niedrożność jelit,
• zwiększenie aktywności enzymów wątrobowych,
zapalenie wątroby i/lub żółtaczka.
• preparat -
Glucobay
Glucobay

Pochodne biguanidu
• mechanizm działania polega na zmianie ładunku
elektrostatycznego błony mitochondrialnej,
spowolnieniu przepływu elektronów na łańcuch
oddechowy i zmniejsza stężenie ATP. Powoduje to
nasilenie glikolizy, hamowanie glukoneogenezy i
zwiększenie stężenia mleczanów (wątroba)
(zmniejszenie produkcji glukozy w wątrobie).
• zwiększanie wrażliwości tkanek na insulinę
(zwiększa obwodowy wychwyt i tkankowe zużycie
glukozy) i hamowanie wchłaniania glukozy i innych
heksoz.
• w komórkach mięśniowych i tłuszczowych - wzrost
liczby i powinowactwa receptorów insulinowych.

Pochodne biguanidu
• Wykazuje też niewielki korzystny wpływ na
stężenie lipidów w surowicy, zmniejszając
stężenie triglicerydów, cholesterolu
całkowitego, LDL i VLDL.
• Metformina może być stosowana u
chorych na cukrzycę typu 2, u których
występuje przynajmniej resztkowe
wydzielanie insuliny i jest szczególnie
korzystna u chorych na cukrzycę ze
współistniejącą otyłością.

Pochodne biguanidu
• dostępność biologiczna leku wynosi 40-60%.
• w niewielkim stopniu wiąże się z białkami osocza.
• t
max
dla postaci o natychmiastowym uwalnianiu
wynosi 2,5 h, dla postaci o przedłużonym
uwalnianiu - 7 h.
• nie jest metabolizowana w wątrobie i w
niezmienionej postaci jest wydalana przez nerki,
głównie przez kanaliki nerkowe, 90% w ciągu 24 h
• niewydolność nerek zmniejsza wydalanie
metforminy proporcjonalnie do klirensu
kreatyniny.

Pochodne biguanidu –
metformina
wskazania
• Niepowikłana cukrzyca typu 2, szczególnie u
osób otyłych (ale obecnie zalecana niezależnie
od masy ciała!), łącznie z dietą cukrzycową
(modyfikacją stylu życia).
• Metformina może być stosowana w
monoterapii (u chorych o niewielkim
niedoborze insuliny), jak również w skojarzeniu
z pochodną sulfonylomocznika, akarbozą,
repaglinidem, nateglinidem, eksenatydem,
wildagliptyną, sitagliptyną, liraglutydem lub
insuliną.

Pochodne biguanidu –
metformina
wskazania
• American Diabetes Association: stosowanie
metforminy w prewencji cukrzycy typu 2 u
osób z grup wysokiego ryzyka:
Osoby otyłe z nasilonym stanem
przedcukrzycowym (IFG i IGT) oraz co najmniej
jednym dodatkowym czynnikiem ryzyka
(wiek>60 r.ż., BMI>35 kg/m2, HbA1c>6%,
nadciśnienie tętnicze, dyslipidemia
aterogenna, obciążający wywiad rodzinny)
• Korzyści mogą odnieść osoby z cukrzycą typu
1 z nadwagą skojarzoną z insulinoopornością

Pochodne biguanidu –
dodatkowe działania
Lek kardioprotekcyjny:
redukcja sercowo-naczyniowych
czynników ryzyka: zmniejszenie masy
ciała (tkanki tłuszczowej trzewnej),
korzystne zmiany profilu lipidowego
(zmniejszenie TCh, LDL, TG, wzrost HDL),
redukcja markerów subklinicznego stanu
zapalnego (CRP) i stresu oksydacyjnego,
przywrócenie zaburzonej równowagi
układu krzepnięcia i fibrynolizy

Pochodne biguanidu –
dodatkowe działania
Lek przeciwnowotworowy:
otyłość, insulinooporność i cukrzyca –
mitogenny efekt i nowotwory
redukcja umieralności i zapadalności na
choroby nowotworowe oraz poprawa
wyników leczenia
przeciwnowotworowego (badania in vitro
i obserwacje kliniczne)
dominujący mechanizm nieznany
brak zaleceń, planowane są badania

Pochodne biguanidu –
metformina
przeciwwskazania
• niewydolność serca, nerek, wątroby, oddechowa
• nadużywanie alkoholu
• przejściowo choroby infekcyjne i okres
okołooperacyjny
• ZASTOSOWANIE METFORMINY U OSOBY Z
PRZECIWWSKAZANIAMI GROZI WYSTĄPIENIEM
KWASICY MLECZANOWEJ
• przed rozpoczęciem leczenia i po 4 tyg. od jego
rozpoczęcia należy oznaczyć stężenie
kreatyniny w surowicy; badanie powtarzać 1-2
razy w roku, o ile w czasie między badaniami nie
wystąpią dodatkowe objawy związane z
niewydolnością nerek.

Pochodne biguanidu –
metformina
działania niepożądane
• kwasica mleczanowa
• u 30% leczonych występuje, najczęściej
przejściowo: biegunka, nudności,
wymioty, wzdęcia, bóle brzucha, brak
apetytu, metaliczny posmak w ustach;
• w przypadku przedłużającej się biegunki
lub wymiotów lek należy odstawić z
uwagi na zagrożenie odwodnieniem

Preparaty:
•Avamina
•Etform
•Formetic
•Glucophage
•Metfogamma
•Metformax
•Siofor

Inkretynomimetyki
Inkrecja – mechanizm insulinotropowy
polegający na stymulacji wydzielania
insuliny w odpowiedzi na bodziec
glikemiczny po spożyciu pokarmu

Inkretynomimetyki
• 1902 r. Bayliss i Starling - pierwsze
obserwacje dotyczące endokrynnego
regulacyjnego wpływu jelita cienkiego na
poposiłkową stymulację przez glikemię
komórek beta
• 1964 r. Mc Intyre i Elrick
• 1986 r. Nauck i wsp. – rola inkrecji w
patogenezie cukrzycy typu II
• 1987 r. izolacja dwóch hormonów
jelitowych: Glucagon-like Peptide 1
(GLP-1) oraz Glucose-dependent
Insulinotropic Peptide (GIP)

Inkretynomimetyki
Glucagon-like Peptide 1 (GLP-1)
Glucose-dependent Insulinotropic Peptide
(GIP)
• fizjologiczne stymulatory komórek beta
działające w okresach poposiłkowych
zwyżek glikemii
• Receptory dla GLP-1 i GIP nie tylko w
komórkach alfa i beta trzustki, ale też w:
• układzie krążenia
• tkance tłuszczowej
• mózgu

Inkretynomimetyki
• 1995 r. – dwupeptydylopeptydaza-4
(DPP-4), enzym katabolizujący GLP-1 i
GIP
• Inhibitory DPP-4 hamują rozpad
naturalnych hormonów GLP-1 i GIP
• Inhibitory DPP-4 = gliptyny

Charakterystyka GLP-1 i GIP
GLP
• Komórki L jelita cienkiego w
końcowej jego części oraz
jelito grube
• Pobudza sekrecję insuliny
zależnie od stężenia glikozy
• Zmniejsza uwalnianie glukozy
z wątroby przez zahamowanie
sekrecji glukagonu
• Zwalnia opróżnianie żołądka
(ograniczanie masy ciała)
• Nasila proliferację oraz
żywotność komórek beta u
zwierząt doświadczalnych
oraz w hodowlach
izolowanych komórek
ludzkich
GIP
• Komórki K dwunastnicy
oraz błony śluzowej jelita
czczego
• Pobudza sekrecję insuliny
zależnie od stężenia
glikozy
• Minimalny efekt na
opróżnianie żoładka, nie
wpływa na uczucie sytości i
masę ciała
• Słabo hamuje sekrecję
glukagonu
• Prawdopodobnie zwiększa
proliferację i przeżycie
komórek beta w hodowlach

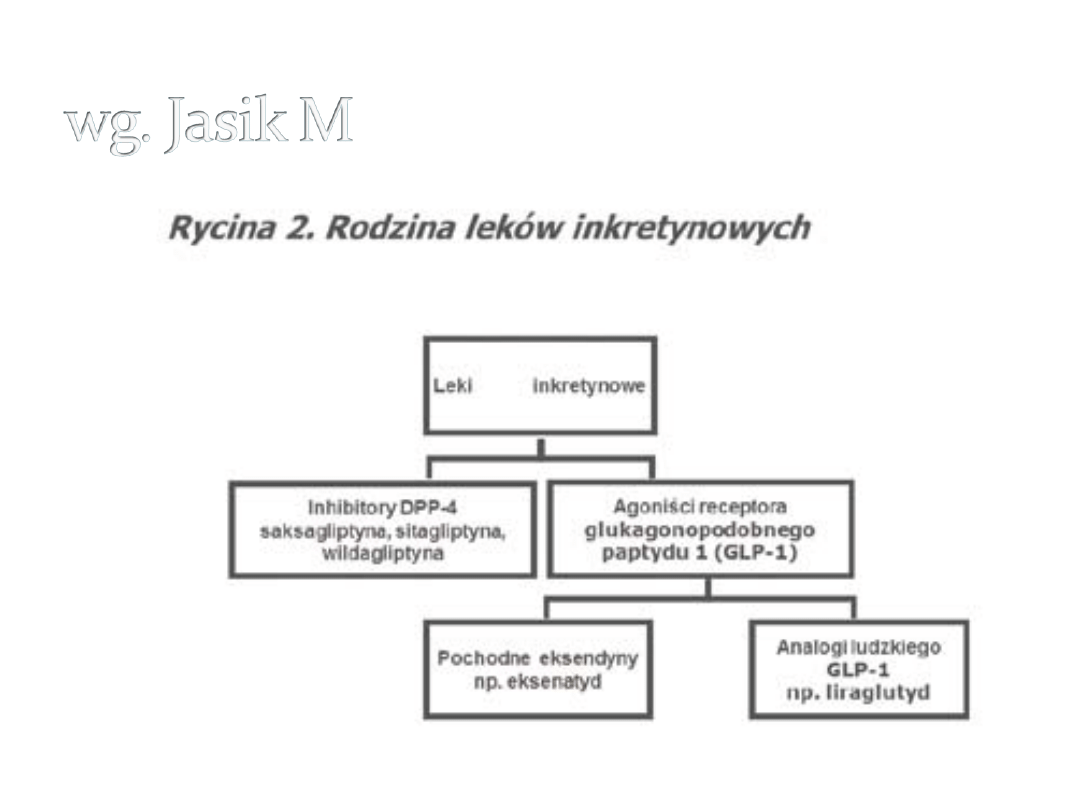
Leki inkretynowe
• Agoniści receptora
glukagonopodobnego peptydu 1
(GLP-1) – pochodne eksendyny
(eksenatyd vel egzenatyd); analogi
ludzkiego GLP-1 (liraglutyd)
• Inhibitory dipeptydylopeptydazy
(DPP-4) (saksagliptyna, sitagliptyna,
wildagliptyna, alogliptyna, inne)

Agoniści receptora dla GLP-
1
• Eksenatyd – pierwszy dostępny na polskim rynku
inkretynomimetyk
• Syntetyczna wersja naturalnego, 39-
aminokwasowego hormonu białkowego (exendin-4),
izolowanego z gruczołów ślinowych amerykańskiej
jaszczurki Gila monster.
• Preparat zarejestrowany przez FDA w 2005 r, w
Europie w 2007 roku jako terapia dodatkowa w
skojarzeniu z metforminą i/lub pochodnymi
sulfonylomocznika u chorych z cukrzycą typu 2, u
których nie udało się uzyskać optymalnej kontroli
glikemii przy stosowaniu tych leków.


Eksenatyd
• Zwiększa wydzielanie insuliny w sposób zależny od stężenia
glukozy, zmniejsza poposiłkowe stężenie glukagonu, które jest
nadmiernie podwyższone w cukrzycy typu 2, spowalnia
opróżnianie żołądka, co warunkuje wolniejsze narastanie stężenia
glukozy w surowicy krwi po posiłku
• W 53% skałd aminokwasowy homologiczny do GLP-1 ssaków,
oporny na DPP-4
• Działania niepożądane – nudności, wymioty, biegunka
• Korzystny wpływ na masę ciała
• T1/2 – 2,4h, czas działania – 10h
• Podawany podskórnie 2xdziennie
• Obniżenie HbA1 o 0,5%-1,0%
• Preparat – Byetta
• Badania III fazy (eksenatyd QW LAR) do podania raz w tygodniu
osobom z niewyrównana cukrzycą typu II

Liraglutyd
• Długodziałający analog GLP-1, częściowo
oporny na działanie enzymu.
• Działanie niepożądane – nudności
• T1/2 10-14 h – podawany podskórnie raz
dziennie
• W badaniach LEAD 1-5 (Liraglutyd Effect
and Action in Diabetes) wykazano
obniżenie HbA1c o 1-1,5% (leczenie
glimepirydem lub metforminą) oraz
redukcję masy ciała o ok. 2-4 kg.

Inhibitory
dipeptydylopeptydazy-4 (DPP-
4)
• Hamują rozpad naturalnie występującego
GLP-1 i tym samym zwiększają jego
aktywność.
• DPP-4 jest enzymem naturalnie
występującym w wątrobie, płucach,
komórkach śródbłonka, rąbku
szczoteczkowym w jelitach i w nerkach.
• DPP-4 aktywuje i inaktywuje peptydy
poprzez uwalnianie proliny lub alaniny od
NH2.

DPP-4
• Substratami są hormony żołądkowo –
jelitowe (GIP i GLP-1), neuropeptydy,
chemokiny, cytokiny.
• Pełni też funkcję receptora oddziałującego z
deaminazą adenozynową (ADA),
glikoproteiną 120 (gp120) otoczki wirusa
HIV, fibronektyną, kolagenem.
• Marker limfocytów, zaangażowany w ich
aktywację; związanie DPP-4 z ADA na
powierzchni limfocytów T hamuje ich
proliferację

Inhibitory DPP-4
• Wiele cech agonistów GLP-1: wpływają na
wydzielanie insuliny i glukagonu
• Aktywują proliferację komórek beta
trzustki oraz hamują ich apoptozę
• Zmniejszają o ok. 80% aktywność DPP w
surowicy
• Nie opóźniają opróżniania żołądka, nie
powodują redukcji masy ciała
• Nie wywołują nudności i wymiotów
• Nie powodują produkcji przeciwciał

Sitagliptyna – działania
niepożądane
• Bóle i zawroty głowy,
• Hipoglikemia,
• Zaparcia
PREPARAT: JANUVIA

Sitagliptyna –
przeciwwskazania
• Nadwrażliwość na którykolwiek
składnik preparatu.
• W leczeniu cukrzycy typu 1, leczenie
cukrzycowej kwasicy ketonowej.
• Umiarkowane lub ciężkie zaburzenia
czynności nerek.
• dzieci i młodzieży do 18. rż.
• Okres ciąży i laktacji

Sitagliptyna –
przeciwwskazania
• Badania na zwierzętach wykazały szkodliwy
wpływ na reprodukcję; potencjalne
zagrożenie dla człowieka nie jest znane.
• Leku nie należy stosować w ciąży.
• Badania na zwierzętach wykazały, że
sitagliptyna przenika do mleka. Nie
wiadomo, czy jest wydzielana do pokarmu
kobiecego, nie należy stosować w okresie
karmienia piersią.

Wildagliptyna
• Dodanie wildagliptyny do metforminy
powoduje redukcję HbA1c o 0,8% po 12 tyg.
leczenia w porównaniu z placebo.
• Wykazano, że skuteczność wildagliptyny w
monoterapii jest porównywalna ze
skutecznością monoterapii
tiazolidynedionami
PREPARAT: GALVUS

Seksagliptyna
PREPARAT: ONGLYZA
Parametr
Agonista rec.
GLP-1
Inhibitor DPP-4
Droga podania
podskórnie
doustnie
Obniżenie
hemoglobiny
glikowanej
1-1,5%
0,5-1%
Funkcja komórek
beta trzustki
Prawdopodobnie
poprawa
Prawdopodobnie
poprawa
Inne korzyści
Obniżenie RR, popr.
param. gosp. lipid
popr. param. gosp.
lipid
Ryzyko hipoglikemii
Bardzo niewielkie
Bardzo niewielkie
Wpływ na masę ciała obniżenie
Brak wpływu
Opróżnianie żołądka
spowolnienie
Brak wpływu
Dz. niepoż. z p.p.
Częste, zależne od
dawki
rzadkie
Inne dział.
niepożądane
Ostre zapal. trzustki
Bóle głowy, infekcje
g.d.o.
Wzrost aktywności
enzymów
wątrobowych

Tiazolidynediony (glitazony)
• Agonisty jądrowego receptora
aktywowanego przez proliferatory
peroksysomów typu gamma (PPAR-γ)
• Receptor PPAR-γ po połączeniu z receptorem
X dla retinoidów staje się czynnikiem
transkrypcyjnym uczestniczącym w translacji
i transkrypcji wielu genów kodujących
enzymy zaangażowane w procesy syntezy,
transportu i wykorzystania glukozy oraz
regulacji metabolizmu kwasów tłuszczowych

Tiazolidynediony (glitazony)
• Obniżają insulinooporność w adipocytach,
miocytach mięśni szkieletowych i hepatocytach
• Zmniejszają zapotrzebowanie na insulinę
endogenną, stężenie WKT, glukozy we krwi
• Redystrybucja tłuszczu z miąższu wątroby –
cofanie się niealkoholowego stłuszczenia,
zmniejszenie stężenia enzymów trzustkowych,
zmniejszenie insulinooporności tkanki wątrobowej
• Redukcja tłuszczu wisceralnego, spowolnienie
lipogenezy i akumulacji tłuszczu
• Zmniejszenie stężenia białek ostrej fazy (CRP)
oraz stężenia cytokin prozapalnych

Tiazolidynediony (glitazony)
• 1997 r. UK, 2000 r. USA – wycofanie
troglitazonu (zapalenie wątroby)
• 2010 r. EMEA – wycofanie
roziglitazonu (niekorzystny wpływ na
niewydolność serca; nie odstawiać
nagle, zawsze w porozumieniu z
lekarzem)

Pioglitazon
• Doustnie 1-2x/dobę, niezależnie od
posiłków
• Nie ma konieczności modyfikacji dawki
u chorych w podeszłym wieku, z
łagodną lub umiarkowaną
niewydolnością nerek
• Przeciwwskazania: nadwrażliwość,
ciąża/karmienie piersią, niewydolność
krążenia obecnie lub w wywiadzie,
niewydolność wątroby

Insulina – rys historyczny
• 1869 r. – Paul Langerhans: obserwacje dotyczące budowy
trzustki
• 1889 r. – Minkowski i von Mering: psy z usuniętą trzustką
rozwijają objawy podobne do cukrzycy u ludzi
• początek XX wieku - Gurg Zuelzer: leczenie wyciągiem z trzustki z
początkową poprawą, ale potem śpiączka i śmierć
• 1911 r. – próba wyizolowania aktywnej substancji z trzustki przez
E.L. Scotta studenta z Uniwersytetu w Chicago: leczenie psów z
cukrzycą alkoholowym ekstraktem z tzrustki
• 1916 – 1920 – Nicolas Paulesco: redukcja zawartości cukru i
ketonów we krwi psów, którym wstrzyknięto wyciąg trzustkowy
• F. Banting i Ch. Best w laboratorium J.R. Macleoda w Toronto:
ekstrakcja insuliny za pomocą alkoholu (nagroda Nobla w 1923 r.)
• Otrzymywanie insuliny w powtarzalny sposób (udział J.B. Collipa –
chemika specjalizującego się w oczyszczaniu adrenaliny)

•Strzykawki
•1985 – peny wielokrotnego użytku
•1989r. – peny jednorazowe
•Pompy osobiste

• niedawno rozpoznana cukrzyca (z
możliwością powrotu do typowego
algorytmu):
• glikemia ≥ 300 mg/dl (16,7 mmol/l) ze
współistniejącymi objawami klinicznymi
hiperglikemii;
• wtórna nieskuteczność leków doustnych
(HbA1c > 7% mimo intensyfikacji terapii
behawioralnej).

• — kilkakrotnym potwierdzeniu utrzymującego się
stanu
hiperglikemii;
• — rozpoznaniu i próbie zlikwidowania potencjalnie
usuwalnych przyczyn hiperglikemii, takich jak:
• • błędy dietetyczne,
• • zbyt niska aktywność fizyczna,
• • nieregularne przyjmowanie doustnych leków
hipoglikemizujących (brak współpracy),
• • infekcje,
• • nieadekwatna dawka leków doustnych.

•— ciąża;
•— cukrzyca typu LADA (latent
autoimmune diabetes in adults);
•— życzenie pacjenta;

• — dekompensacja cukrzycy wywołana
przemijającymi
przyczynami (infekcja, uraz, kortykoterapia itp.);
• — zabieg chirurgiczny;
• — udar mózgu;
• — zabieg przezskórnej wewnątrznaczyniowej
angioplastyki wieńcowej (PTCA, percutaneous
transluminal coronary angioplasty);
• — ostry zespół wieńcowy;
• — inne ostre schorzenia wymagające hospitalizacji
na oddziale intensywnej opieki medycznej

• 1. Insulina o przedłużonym działaniu w jednym
wstrzyknięciu:
• — w wypadku hiperglikemii porannej — wieczorem;
• — w wypadku normoglikemii na czczo i hiperglikemii w
ciągu dnia — rano (do rozważenia wielokrotne
wstrzyknięcia insuliny krótkodziałającej
okołoposiłkowo).
• 2. Dawka początkowa wynosi 0,2 j./kg mc.
• 3. Zaleca się utrzymanie uprzednio stosowanych leków
doustnych, zwłaszcza metforminy lub inhibitorów a-
glukozydazy u osób charakteryzujących się otyłością
lub nadwagą. W wypadku prawidłowej masy ciała
można rozważyć skojarzenie z lekami stymulującymi
wyrzut insuliny (pochodne sulfonylomocznika, glinidy).

• 4. Samodzielna, prowadzona przez chorego (samokontrola)
weryfikacja wyrównania glikemii ze stopniowym zwiększeniem
dawki (4–8 j.) co 2–3 dni, aż do uzyskania pełnego wyrównania.
• 5. W przypadku zapotrzebowania na insulinę powyżej 40 j. na dobę
powinno się zastosować dwa wstrzyknięcia insuliny; należy wziąć
pod uwagę podanie mieszanek insulinowych i odstawić leki
stymulujące wydzielanie insuliny.
• 6. W przypadku zapotrzebowania na insulinę powyżej 80 j. na dobę
trzeba rozważyć wdrożenie algorytmu wielokrotnych wstrzyknięć
(intensywnej insulinoterapii).
• 7. Podczas stosowania wysokich dawek insuliny, czyli > 100 j.
(istnienia insulinooporności), należy poszukiwać przyczyny takiego
zjawiska i, o ile to możliwe, dążyć do jej usunięcia.
• 8. U niektórych chorych na cukrzycę typu 2 można rozważyć model
intensywnej insulinoterapii realizowanej za pomocą wstrzyknięć
podskórnych lub osobistej pompy insulinowej. Dotyczy to
pacjentów relatywnie młodych, aktywnych zawodowo, ze
zmiennym rozkładem dnia.

Farmakoterapia cukrzycy typu 2
powinna: uwzględniać zaburzenia
wydzielania insuliny, występującą
insulinooporność, wywierać wpływ
na poprawę efektu inkretynowego,
wykazywać dobrą skuteczność,
bezpieczeństwo i tolerancję,
uwzględniać koszty leczenia.

•Objawy kliniczne - poliuria, polidypsja,
niewyjaśniony spadek masy ciała
•Glikemia przygodna wyższa niż 200mg/dl
•Glikemia na czczo wyższa niż 126 mg/dl
•Glikemia po 2h po doustnym obciążeniu
glukozą wyższa niż 200mg/dl

•ratuje życie i umożliwia uzyskanie
poprawy zdrowia,
• musi być ciągle i nieustannie
dostosowywane do zmiennych potrzeb
chorego,
• nie powinno wywoływać działań
niepożądanych.
• potrzeby metaboliczne wynikające z indywidualnych
cech patofizjologicznych cukrzycy,
• styl życia chorego,
• indywidualne cele leczenia – u dzieci, młodzieży i osób
młodych dąży się do uzyskania prawie normoglikemii.
U osób w wieku podeszłym wystarczające jest
utrzymanie glikemii poniżej progu nerkowego,
• możliwości techniczne – rodzaj preparatów insuliny,
sprzęt do ich wstrzykiwania,
• stosunek kosztów do korzyści, przy uwzględnieniu
przede wszystkim korzyści medycznych i ludzkich dla
pacjenta.

Jako substytucję bezwzględnego niedoboru wydzielania i w
konsekwencji braku tego hormonu we krwi i w tkankach czyli:
· w cukrzycy typu 1, pierwotnej, wynikającej z
autoimmunologicznej lub idiopatycznej destrukcji komórek B,
· w cukrzycy wtórnej, spowodowanej uszkodzeniem trzustki i –
wtórnie układu wyspowego oraz komórek B przez różne
procesy patologiczne, jak nowotwór złośliwy, choroba
alkoholowa i przewlekłe zapalenie trzustki, inne przyczyny.
Jako przezwyciężenie stanów pierwotnej lub wtórnej
insulinooporności obwodowych komórek i tkanek. Do
uzyskania normalizacji metabolicznych zaburzeń w stanach
insulinooporności konieczne jest wytworzenie wyższego
aniżeli fizjologiczne stężenia insuliny i wyrównanie,
względnego w stosunku do poziomu insulinooporności,
niedoboru regulacyjnego wpływu insuliny na komórki.

•Wytworzone metodą rekombinacji
DNA, szybka przemiana do formy
monomerycznej, szybko wchłaniają
się z tkanki podskórnej (Lispro,
Aspart)
•Lepsza kontrola glikemii poposiłkowej,
niższe ryzyko hipoglikemii
(bezszczytowe)

•Zapewnienie dobrej jakości życia
•Zapobieganie ostrym i przewlekłym
powikłaniom cukrzycy

•Utrzymanie glikemi na poziomie
zbliżonym do normoglikemi wpływa
na zmniejszenie ryzyka:
•Nefropatii o 54%
•Neuropatii o 60%
•Retinopatii o 76%

•RR poniżej 130/80 mmHg
•lipidogram

• Roztworu insuliny neutralnej (regular), krystalicznej
insuliny cynkowej rozpuszczonej w buforze o
obojętnym pH.
• Najszybszy początek działania i najkrótszy czas trwania
• Humulin R, Actrapid, Gensulin R, Maxirapid , Polhumin
R(rozpuszczalne) – jedyne preparaty do podawania
drogą dożylną.
• Powodują poposiłkową hiperglikemię.
• Początek działania po ok. 30min., szczyt po ok. 1-3h,
całkowity czas działania – 6-8 h.
• Muszą być podawane ok. 30 min., przed posiłkiem.

•Dzięki formie monomerycznej są
szybko wchłanialne (3x szybciej).
•Lispro; Aspart
•Humalog; NovoRapid
•Czas działania – 0-15 min po
wstrzyknięciu, maks. Stężenie po 1h;
czas działania tylko 4h.

• Insulina protaminowa (neutral protamine
Hagedron – NPH) – zawiesina kompleksu insuliny z
cynkiem i protaminą w buforze fosforanowym.
(izofanowa)
• Lente – mieszanina insuliny krystalicznej
(ultralente) i bezpostaciowej (semilente) w
buforze octanowym.
• Isophanicum i Lente – czas działania ok. 18-24h,
początek działania po ok. 1-2h, szczyt po 6-12h.
• Monotard HM, Polhumin N, Humilin N i L, Gensulin
N oraz Insulatard HM

•Ultralente oraz zawiesina insuliny
protaminowo –cynkowej
•Protamino – cynkowa – rzadko
używana, w USA wycofana
•Początek działania - 4-6h, szczyt –
14-20h; czas działania do 36h.
•Ultratard HM
•Humulin U

•Rekombinacja DNA - zamiana glicyny na
argininę w pozycji 21 łańcucha A i dodanie 2
cząsteczek argininy w pozycjach B31 i B32
•Wchłania się powoli i równomiernie (brak
szczytu)
•Czas działania 20-30h
•Do podawania podskórnego przed snem (raz
na dobę) dorosłym i dzieciom >6 roku życia.

•Analog długodziałający – przyłączenie
reszty kwasu tłuszczowego (w pozycji
30 łańcucha B aminokwas treoninę
zastąpiono 14-węglowym kwasem
mirystynowym) i poprawienie
łączenia insuliny z białkami osocza.
•Działa krócej niż glargina – 2
wstrzyknięcia na dobę

•Hipoglikemia
•Alergia
•Lipoatrofia
•Miejscowe odczyny alergiczne

• przemiana węglowodanowa: nasilenie dokomórkowego transportu
glukozy (również D-galaktozy, L-arabinozy i D-ksylozy) do komórek
mięśniowych (również m. sercowego), komórek tłuszczowych i
fibroblastów (za pośrednictwem wrażliwych na działanie insuliny
przenośników glukozy GLUT-4), nasilenie wewnątrzkomórkowego
zużycia glukozy, hamowanie resyntezy i zmniejszenie oddawania
glukozy przez wątrobę do krwi, zwiększenie syntezy glikogenu
(głównie w wątrobie i w mięśniach);
• przemiana lipidowa: zwiększenie syntezy kwasów tłuszczowych,
pobudzenie estryfikacji kwasów tłuszczowych do triglicerydów,
hamowanie wewnątrzkomórkowej lipolizy, modyfikowanie
aktywności lipazy lipoproteinowej (przyczynia się do zwiększonego
pobierania kwasów tłuszczowych z chylomikronów i lipoprotein o
bardzo małej gęstości [VLDL] i zmniejszenia stężenia wolnych
kwasów tłuszczowych we krwi);
• przemiana białkowa: zwiększenie dokomórkowego transportu
aminokwasów, pobudzenie syntezy białek, przeciwdziałanie
rozpadowi białka przez hamowanie syntezy glukozy z aminokwasów.

• cukrzyca typu 1,
• cukrzyca typu 2 w przypadkach pierwotnej lub
wtórnej nieskuteczności leków doustnych oraz
przeciwwskazań do ich stosowania,
• ciąża u chorej na cukrzycę, większość przypadków
cukrzycy wtórnej,
• cukrzycowa kwasica ketonowa i sytuacje jej
sprzyjające (zakażenia, zabiegi chirurgiczne), ostra
faza zawału serca i okres okołozawałowy, śpiączka
ketonowa, śpiączka hipermolarna (osmotyczna),
śpiączka mleczanowa oraz inne stany śpiączkowe
w cukrzycy z wyjątkiem śpiączki hipoglikemicznej.

•uczulenie na dany typ insuliny
(substancje dodatkowe)
•hipoglikemia

•Hipoglikemia.
•Miejscowe reakcje alergiczne: rumień,
obrzęk, świąd w miejscu wstrzyknięć, mogą
być przejściowe (od kilku dni do kilku
tygodni) lub trwałe;
•uogólniona reakcja alergiczna: pokrzywka,
duszność, skurcz oskrzeli, spadek ciśnienia
tętniczego, tachykardia, rzadko reakcja
anafilaktyczna; lipodystrofia: lipohipertrofia
lub lipoatrofia.

• Hipoglikemię rozpoznaje się przy obniżeniu
stężenia glukozy poniżej 55 mg/dl (3,0 mmol/l),
niezależnie od występowania objawów klinicznych,
które u części osób, zwłaszcza chorujących od
wielu lat na cukrzycę typu 1, mogą pojawiać się
dopiero przy znacznie niższych wartościach
glikemii. Tak zwana „nieświadomość hipoglikemii”,
określana jako nieodczuwanie patologicznie niskich
(< 55 mg/dl, tj. < 3,0 mmol/l) wartości glikemii jest
istotnym powikłaniem częstego występowania
epizodów hipoglikemii.

• U chorego przytomnego:
• — w zależności od stopnia hipoglikemii doustne podanie
10–20 g glukozy (tabletki zawierające glukozę, żele) lub
napoju słodzonego;
• — 10–20 g glukozy powoduje krótkotrwały wzrost
glikemii po około 10–20 minutach. Aby uniknąć
wystąpienia ponownego incydentu hipoglikemii, należy
spożyć węglowodany złożone, a pomiar glikemii
powtórzyć po 60 minutach;
• — monitorować glikemię;
• — rozważyć podanie glukagonu domięśniowo,
przeszkolić osoby bliskie pacjentowi w zakresie
podawania glukagonu

• U chorego nieprzytomnego lub u osoby mającej
zaburzenia świadomości i niemogącej połykać:
• — podanie dożylnie 20-procentowego roztworu
glukozy (0,2 g glukozy/kg mc.), a następnie wlew 10-
procentowego roztworu glukozy;
• — w sytuacji trudności z dostępem do żył — podanie
domięśniowo lub podskórnie 1 mg glukagonu (0,5 mg
u dzieci < 6. rż.), w przypadku braku poprawy po 10
minutach — ponowne podanie glukagonu;
• — po uzyskaniu przytomności podanie doustnych
węglowodanów do chwili całkowitego ustąpienia
ryzyka
nawrotu incydentu hipoglikemii;

• — uwaga: nie należy podawać glukagonu
chorym na cukrzycę typu 2, a także osobom po
spożyciu alkoholu;
• — u chorych na cukrzycę typu 2 leczonych insuliną i
pochodnymi sulfonylomocznika mogą wystąpić
przedłużające się epizody hipoglikemii, które
czasami wymagają długotrwałego wlewu roztworu
glukozy;
• — w przypadku wystąpienia incydentu ciężkiej
hipoglikemii należy rozważyć hospitalizację chorego
ze względu na stan zagrożenia życia związany z
możliwością rozwoju nieodwracalnych zmian w
ośrodkowym układzie nerwowym.

•Obniżenie hiperglikemii na zasadnicze
znaczenie w zapobieganiu i hamowaniu
postępu przewlekłych powikłań cukrzycy
•Obniżanie hiperglikemii musi uwzględniać
oba mechanizmy patogenetyczne T2DM tj.
insulinooporność i upośledzenie wydzielania
insuliny.
•Leczenie T2DM musi być etapami
dostosowane do postępującego charakteru
schorzenia

• Etap 1. monoterapia: modyfikacja stylu życia w
połączeniu z metforminą (wyjątkowo u osoby bez
nadwagi z zachowaną funkcją komórki beta –
pochodne sulfonylomocznika)
• Etap 2. Opcja 2a dołączenie do metforminy
pochodnej sulfonylomocznika lub glinidu albo
dołączenie insuliny bazalnej
• Opcja 2b: dołączenie do metforminy
inkretynomimetyku lub glitazonu, możliwe jest
dołączenie 3 leku lub insuliny bazalnej
• Etap 3 i 4. Insulinoterapia z ewentualną
kontynuacją metforminy.

Działania niepożądane
insulinoterapii
• Hipoglikemia:
•
Nieodpowiednio duża dawka insuliny, rozbieżność między czasem szczytu uwalniania
insuliny a przyjęciem posiłku, nakładanie dodatkowych czynników zwiększających
wrażliwość na insulinę; im bardziej intensywna terapia tym większy ryzyko hipoglikemii
•
Objawy gdy glikemia 60-80 mg/dL: głód, pocenie, parestezje, kołatanie serca, drżenie,
niepokój….zaburzenia koncentracji, splatanie, osłabienie, senność, uczucie gorąca,
zawroty głowy, nieostre widzenie… utrata przytomności….drgawki, śpiączka
• Zwiększenie masy ciała
• Nadwrażliwość (IgE) i oporność (IgG) na insulinę
• Testy skórne dodatnie u osób z brakiem jakiejkolwiek patologicznej reakcji na
podskórne podanie insuliny
• Jeśli reakcje alergiczne po insulinie wieprzowej to powinna być zastosowana
ludzka
• Zanik i przerost tkanki tłuszczowej
• Zanik jako wynik odpowiedzi immunologicznej, przerost jako wynik
lipogenetycznego działania insuliny
• Głownie przy stosowaniu preparatów zanieczyszczonych
• Przerost przy podawaniu w to samo miejsce; może zaburzać procesy
wchłaniania
• Obrzęk insulinowy
• Retencja sodu oraz zwiększona przepuszczalność naczyń towarzysząca
nieodpowiedniej kontroli metabolicznej
• analogów insuliny długodziałających
• pioglitazonu
• inkretynomimetyków (injekcje)
– Liraglutyd (w Europie 200 000 osób)
– Eksenatyd (w Europie 1 300 000 osób)
• inhibitoru DPP-IV (wildagliptyna,
saksogliptyna, sitagliptyna) (w Europie
5% chorych z cukrzycą typu 2)
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 50
- Slide 51
- Slide 52
- Slide 53
- Slide 54
- Slide 55
- Slide 56
- Slide 57
- Slide 58
- Slide 59
- Slide 60
- Slide 61
- Slide 62
- Slide 63
- Slide 64
- Slide 65
- Slide 66
- Slide 67
- Slide 68
- Slide 69
- Slide 70
- Slide 71
- Slide 72
- Slide 73
- Slide 74
- Slide 75
- Slide 76
- Slide 77
- Slide 78
- Slide 79
- Slide 80
- Slide 81
- Slide 82
- Slide 83
- Slide 84
- Slide 85
- Slide 86
- Slide 87
- Slide 88
- Slide 89
- Slide 90
- Slide 91
- Slide 92
- Slide 93
- Slide 94
- Slide 95
- Slide 97
- Slide 98
- Slide 99
- Slide 100
- Slide 101
- Slide 102
- Slide 103
- Slide 104
Wyszukiwarka
Podobne podstrony:
CH obr handlu zagranicznego og wg krajow I XII 2011 wyn ost
Korale dla mamy - 26.05.2011 ost, Scenariusze - przedszkole
Cukrzyca Kolegium Lekarzy Rodzinnych 2011
egzamin ost, Ogrodnictwo 2011, IV Semestr, ROŚLINY ZIELNE WYKŁADY
CH obr handlu zagranicznego og wg krajow I XII 2011 wyn ost
Cukrzyca 2011
Cukrzyca a ciąża
2011 2 KOSZE
więcej podobnych podstron