
Oddychanie komórkowe i
fosforylacja oksydacyjna

Mitochondrialny łańcuch oddechowy
Reakcje przenoszenia wodoru na tlen cząsteczkowy, którym
towarzyszy magazynowanie energii pod postacią związków
wysokoenergetycznych, zachodzą w mitochondriach. Obecne w
mitochondriach biologiczne układy oksydacyjno-redukcyjne
wiążą atomy wodoru z substratów przemian pośrednich, a
następnie przenoszą ich elektrony na cząsteczkę tlenu. W
wyniku tego następuje redukcja tlenu do jonu tlenkowego O2", a
po przyłączeniu protonów - wytworzenie cząsteczki wody.
Kierunek przenoszenia elektronów w łańcuchu oddechowym jest
wyznaczony przez różnice potencjałów oksydoredukcyjnych.
Transport elektronów odbywa się od układów o wyższych
wartościach ujemnych do układów o wyższych wartościach
dodatnich. W przenoszeniu elektronów od substratu do tlenu
uczestniczą dehydrogenazy, współdziałające z nukleotydami
nikotynamidowymi, flawinowymi oraz z liponianem, a poza tym:
flawoproteiny pośredniczące, ubichinon oraz układ
cytochromowy
.

Dehydrogenazy nikotynamidowe
. Współdziałają one
z NAD i NADP. Tego typu dehydrogenaz jest około 200. Enzymy te
przenoszą odwracalnie jeden atom wodoru i jeden elektron na
utlenioną postać NAD+ lub NADP+, z uwolnieniem protonu.
Większość dehydrogenaz działa specyficznie z NAD, inne działają
specyficznie tylko z NADP. Są również takie dehydrogenazy, które
mogą działać z obydwoma koenzymami. Istnieje możliwość
wymiany wodoru i elektronów między dehydrogenazami o
różnych koenzymach. Reakcje tego typu katalizują transhydro-
genazy.
Dehydrogenazy
współdziałające z flawinami. Białka tych
dehydrogenaz są związane z nukleotydami flawinowymi,
niekiedy zawierają także niehemowe żelazo. Do tego typu
dehydrogenaz należy: dehydrogenaza NADH, która jest białkiem
żelazowo-siarkowym, działającym z FMN, ponadto
dehydrogenaza bursztynianowa, cholinowa lub acylo-CoA
współdziałające z FAD.
Dehydrogenazy współdziałające z liponianem. Wchodzą one w
skład kompleksu enzymów oksydacyjnej dekarboksylacji 2-
oksokwasów. Zredukowany liponian jest następnie utleniany
przez dehydrogenazę liponianową, która współdziała z FAD.

FLAWOPROTEINY
POŚREDNICZĄCE (Fp).
Występują one poza wymienionymi już
dehydrogenazami flawinowymi. Fp zawierają
barwniki flawinowe, bardzo często żelazo
niehemowe, siarkę, a niekiedy cynk.
Metaloflawoproteiny uczestniczą m.in. w działaniu
dehydrogenaz NADH, powodując ich utlenienie.
Niektóre dehydrogenazy współdziałające z
nukleotydami flawinowymi, jak np.
dehydrogenaza acylo-CoA, współdziałają także z
flawoproteinami przenoszącymi elektrony (ETF).
Flawoproteiny pośredniczące prawdopodobnie
uczestniczą w przejściu dwu-elektronowych
reakcji utleniania w reakcje jednoelektronowe.
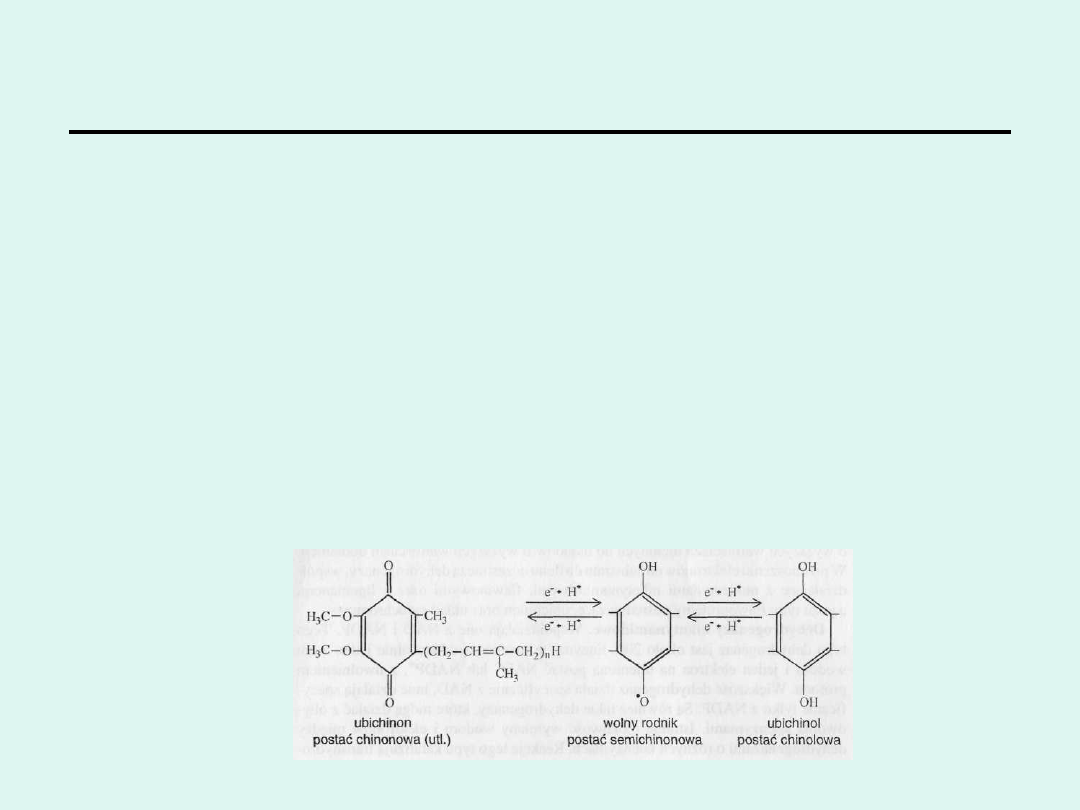
UBICHINON (koenzym Q).
Jest on syntetyzowany w komórkach z tyrozyny. Ubichinon stanowi
ostatnie ogniwo łańcucha oddechowego, do którego dochodzą atomy
wodoru. Dalej przenoszone są już tylko elektrony. Budowa koenzymu
Q jest zbliżona do witamin E i K, przez co może pełnić rolę
antyoksydanta budzącego nadzieję w leczeniu chorób wieku
starczego. W łańcuchu oddechowym występuje on w ilości
proporcjonalnie większej od innych składników. Ubichinon jest
ruchomym elementem łańcucha, zbierającym równoważniki
redukujące z flawoprotein i przekazującym je cytochromom.
CoQ jest także miejscem ich powstawania zgodnie ze schematem
reakcji:

UKŁAD CYTOCHROMOWY
Cytochromy zostały odkryte już w 1866 roku przez McMunna.
Stanowią one układ, w którym każda cząsteczka cytochromu
przenosi jeden elektron na zasadzie zmiany wartościowości żelaza.
Prawdopodobnie pierwszym biorcą elektronów od ubichinonu jest
cytochrom b o masie cząsteczkowej 28 kDa. Może on występować w
postaci polimeru o masie około 4 MDa. Dalszym przenośnikiem jest
cytochrom c1, a następnie cytochrom c.
Cytochrom c1 jest lipoproteiną o masie cząsteczkowej około 360
kDa. Okazało się, że jest to polimer zbudowany z podjednostek o
masie 51 kDa, zawierających po 1 atomie żelaza..
Cytochrom c jest najlepiej poznany ze wszystkich cytochromów.
Masa jego cząsteczki wynosi 13 kDa. Zawiera on 104 reszty
aminokwasowe, znany jest jego skład aminokwasowy oraz struktura
przestrzenna. Cytochrom c jest jedynym cytochromem
rozpuszczalnym i podobnie jak CoQ jest ruchomym składnikiem
łańcucha oddechowego, łączącym jego kompleksy funkcyjne.

Oksydaza cytochromowa
Ostatnie ogniwo łańcucha stanowią cytochromy aa3, nazywane
oksydazą cytochromową. Jest to kompleks 13 podjednostek
polipeptydowych, przy czym właściwości katalityczne są
przypisywane trzem najcięższym podjednostkom kodowanym
przez mitochondrialny DNA. Tym niemniej liczba podjednostek
oksydazy cytochromowej jest zmienna (prokarionty posiadają
ich najmniej). W skład tego enzymu wchodzą dwa układy
żelazoporfiry nowe, z których każdy oprócz żelaza zawiera atom
miedzi. Oksydazą cytochromowa ma duże powinowactwo do
tlenu. Reakcja, którą enzym ten katalizuje, jest nieodwracalna.
W mitochondrialnym łańcuchu oddechowym (rys. 2) w miejscu
działania ubichinonu mogą występować substancje
towarzyszące temu koenzymowi: witaminy K oraz witaminy E.
Od miejsca występowania ubichinonu elektrony są przenoszone
pojedynczo przez układy cytochromów na tlen. Natomiast
protony, uwalniane na etapie koenzymów nukleotydowych oraz
ubichinonu, łączą się bezpośrednio z jonem tlenkowym (O2-),
tworząc cząsteczkę wody.


Fosforylacja oksydacyjna
W procesie fosforylacji oksydacyjnej, związanej bezpośrednio z
łańcuchem oddechowym, zmiany entalpii swobodnej reakcji
przenoszenia elektronów umożliwiają wychwytywanie części
wytwarzanej energii przez cząsteczki ADP, które są ważnymi
składnikami procesu fosforylacji. Dzięki tej energii z ADP przy udziale
fosforanów nieorganicznych jest syntetyzowany ATP.
Przeniesienie 2 elektronów z atomów wodoru na tlen powoduje
wydzielenie 237,6 kJ/mol energii. W warunkach środowiska komórki,
podczas transportu elektronów z NADH na tlen wyzwolona energia
jest równa 220,8 kJ/mol. Z energii tej mogą być wytwarzane
wysokoenergetyczne wiązania ATP przez przyłączanie fosforanów do
cząsteczek ADP. Tego rodzaju wytwarzanie wiązań
wysokoenergetycznych, sprzężone z przenoszeniem w łańcuchu
oddechowym, nosi nazwę fosforylacji oksydacyjnej. Fosforylacja
oksydacyjna zachodzi tylko w mitochondriach. Poza nimi w komórce
nie ma układu tlenowych fosforylacji, wobec czego procesy
utleniania zachodzące z udziałem tlenu nie są sprzężone z syntezą
ATP. Nie związana w ATP energia wykorzystywana jest jako energia
cieplna na utrzymanie temperatury ciała zwierząt stałocieplnych.

Doświadczenia przeprowadzone na oddychających mitochondriach
wskazują, że podczas przenoszenia elektronów w łańcuchu
oddechowym rozpoczynającym się od dehydrogenaz
współdziałających z NAD, na 1/2 mola O2 są zużywane 3 mole
fosforanów nieorganicznych. Jeśli proces rozpoczyna się od
dehydsogenaz flawopro-teinowych, zużycie fosforanów
nieorganicznych na tę samą ilość tlenu wynosi 2 mole. Wskazuje
to, że gdy łańcuch oddechowy rozpoczyna się od zredukowanego
NAD, przy wykorzystaniu 1/2 cząsteczki O2 są syntetyzowane 3
cząsteczki ATP, natomiast jeśli rozpoczyna się od flawoprotein,
powstają tylko 2 cząsteczki ATP.
Energia związana w powstałym makroergicznym wiązaniu
fosforanowym wynosi około 30,6 kJ/mol. Tego rodzaju wiązania w 3
cząsteczkach ATP magazynują około 91,8 kJ/mol energii, co
stanowi około 40% całkowitej wydajności energetycznej łańcucha
oddechowego.
Mechanizm wytwarzania zarówno wysokoenergetycznych wiązań
ATP w procesie fosforylacji oksydacyjnej, jak i miejsce ich
wytwarzania w łańcuchu oddechowym nie zostały dotychczas
wyjaśnione w sposób jednoznaczny. Istnieje wiele teorii, które
usiłują tłumaczyć te zagadnienia.
Najbardziej znane są 3 hipotezy, których założenia zostaną w
skrócie przedstawione, a mianowicie: hipoteza chemiczna,
hipoteza chemiosmotyczna i hipoteza konformacyjna.

Hipoteza chemiczna jest znana jako teoria Slatera.
Według tej teorii w procesie tworzenia
wysokoenergetycznego wiązania ATP bierze udział
przenośnik X o nieznanej budowie oraz nośnik A, którym
może być jeden z układów oksydacyjno-re-dukcyjnych
łańcucha oddechowego. Przenośnik reaguje najpierw ze
zredukowanym nośnikiem, tworząc makroergiczny
kompleks A ~ X, a następnie z ortofosforanem, przenosząc
energię i tworząc kompleks przenośnika z fosforanem X
~(P). W ostatnim etapie następuje przeniesienie
wysokoenergetycznego wiązania fosforanu na ADP i
wytworzenie ATP:
A + X A~X
A~X+(P) X~(P)+A
X~(P) + ADP ATP + X

Zakłada się, że w tym mechanizmie bierze udział także enzym
wytwarzający ATP. Nie udało się jednak dotychczas wydzielić
żadnych intermediantów wysokoenergetycznych tego procesu ani
przenośnika X.
Hipoteza chemiczna sprzęga fosforylację tlenową z określonymi
reakcjami łańcucha oddechowego. Według tej hipotezy fosforylacja
zachodzi w tych miejscach łańcucha oddechowego, gdzie
występuje znaczna różnica potencjałów oksydoredu-kcyjnych
między układami. Im większa jest różnica potencjałów, tym
wydziela się więcej energii. Część tej energii ulega rozproszeniu i
wydziela się w postaci ciepła, część zaś zostaje zmagazynowana w
postaci ATP. Magazynowanie energii chemicznej odbywa się w tych
miejscach łańcucha oddechowego, gdzie różnica potencjałów
wynosi około 160 mV.
Przypuszcza się, że jeśli łańcuch oddechowy rozpoczyna się od
NADH, powstają 3 cząsteczki ATP w następujących miejscach:
- przy przeniesieniu elektronów z koenzymów nikotynamidowych na
flawopro-teiny;
- przy przeniesieniu elektronów z ubichinonu lub z flawoprotein na
cytochro-my c;
- przy przeniesieniu elektronów z oksydazy cytochromowej
(cytochromu a+a3) na tlen.
Na tym ostatnim etapie jest największa różnica potencjałów i
wyzwala się największa ilość energii.

Wiele hipotez uważa błonę mitochondrialną za ważny czynnik
sprzężenia energetycznego. Należy do nich hipoteza
chemiosmotyczna Mitchella, wykluczająca udział pośredników.
Hipoteza ta jest obecnie uznawana za najbardziej zgodną z
różnymi danymi doświadczalnymi i najlepiej tłumaczącą wiele
zagadnień dotyczących fosforylacji tlenowej. Istotną rolę
według tej hipotezy spełnia rozdział ładunków elektrycznych po
obydwu stronach błony mitochondrium. Szczególne znaczenie
ma różnica stężeń protonów w poprzek błony oraz ich wymiana
przez błonę (rys. 1). Wymiana ta odbywa się za pośrednictwem
mechanizmu określonego jako "pompa protonowa" (rys.2).
Według hipotezy chemiosmotycznej łańcuch oddechowy jest
wewnątrz błony mitochondrium zwinięty w 3 pętle
odpowiadające 3 miejscom syntezy ATP (które zakłada
hipoteza chemiczna). 2 elektrony transportowane przez
łańcuch oddechowy
ze zredukowanego NAD na tlen powodują przemieszczenie 6
protonów od wewnętrznej strony błony mitochondrialnej na jej
stronę zewnętrzną, czyli ze środowiska matriks do środowiska
cytosolu.
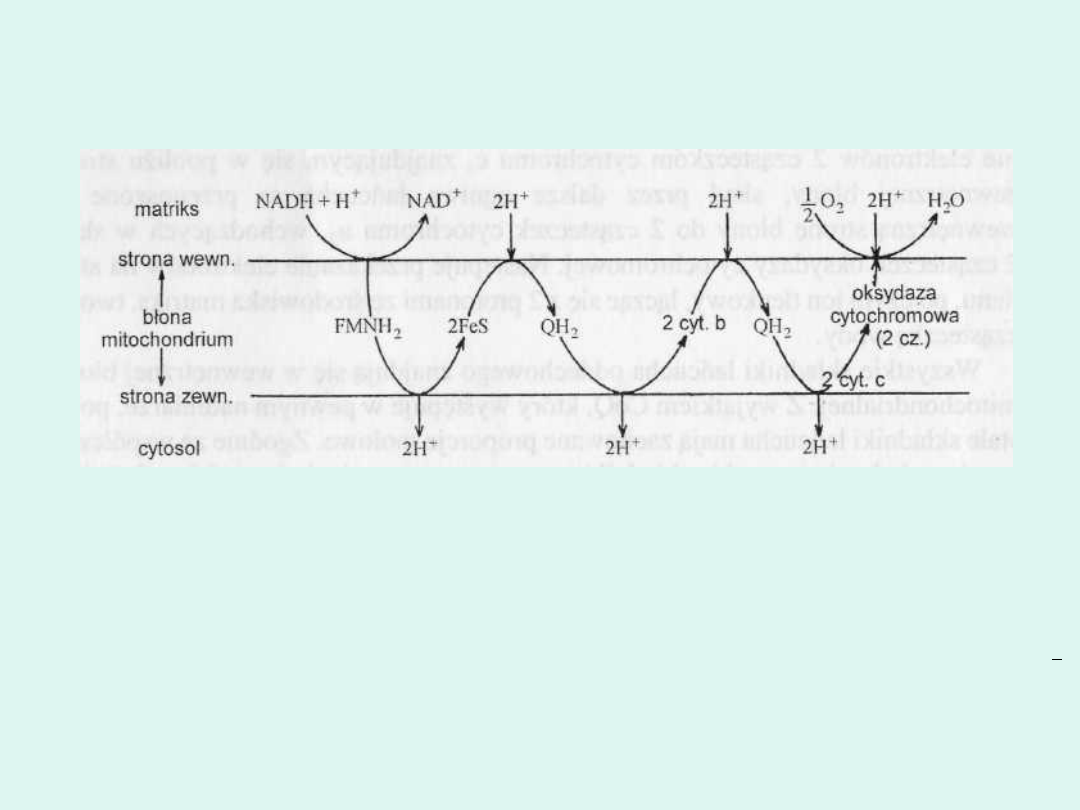
Schemat hipotetycznego ułożenia pętli łańcucha
oddechowego oraz przemieszczania protonów przez błonę mitochondrium.
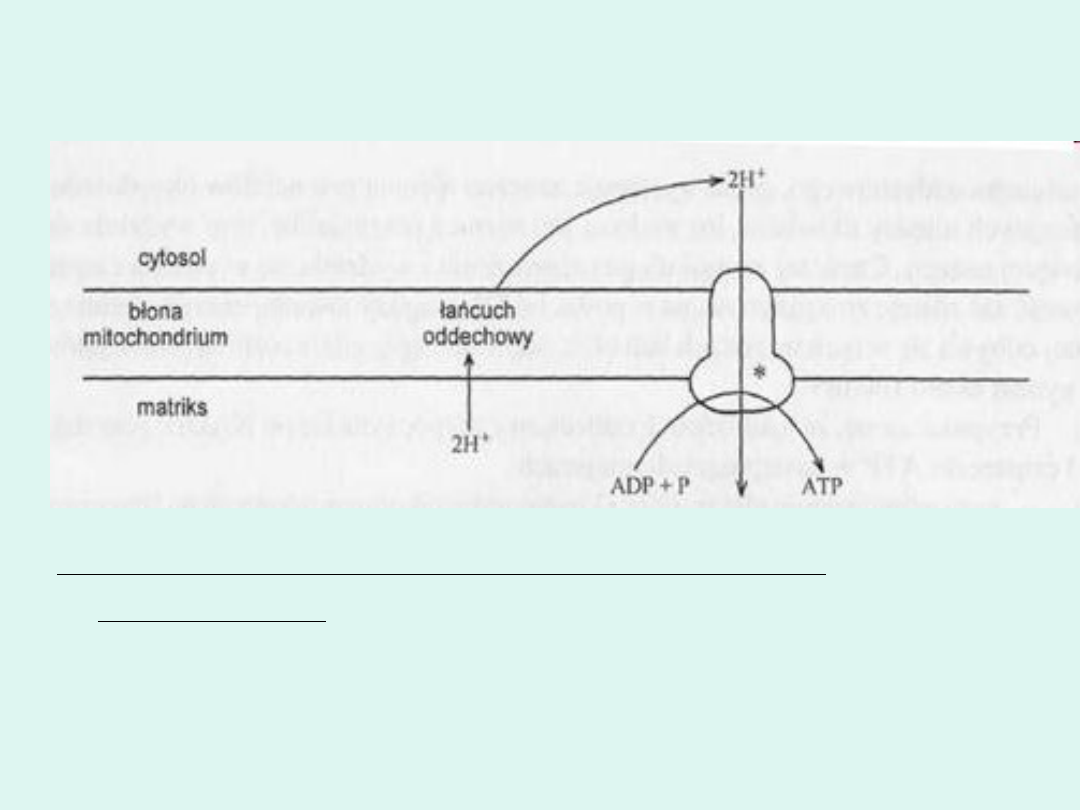
Schemat działania "pompy protonowej"; * syntaza ATP
transportująca H+

Cały proces rozpoczyna się po wewnętrznej stronie błony. Zredukowany NAD
przekazuje 2 elektrony oraz proton znajdującym się wewnątrz błony
flawoprotei-nom zawierającym FMN. Po dołączeniu jeszcze jednego protonu
ze środowiska, FMN ulega przejściu w FMNH2. Kompleks białkowy zawierający
FMNjest tak duży, że styka się z zewnętrzną stroną błony mitochondrium.
Istnieje zatem możliwość uwolnienia do cytosolu pary protonów. Natomiast
elektrony redukują 2 cząsteczki białek żelazowo-siarkowych i dzięki nim
przedostają się do wewnętrznej strony błony, skąd pobiera je cząsteczka
ubichinonu. Po dołączeniu dwóch protonów od strony matriks powstaje QH2,
który jako dobrze rozpuszczalny w tłuszczach łatwo przemieszcza się do
zewnętrznej strony błony. Odłącza do cytosolu 2 protony, natomiast 2
elektrony oddaje 2 cząsteczkom cytochromu b, które przenoszą je na stronę
wewnętrzną błony. Tu następuje przekazanie ich następnej cząsteczce
ubichinonu, który po przyjęciu pary protonów przechodzi w formę QH2,
wędrującą do zewnętrznej strony błony. Po uwolnieniu protonów do cytosolu
następuje przekazanie elektronów 2 cząsteczkom cytochromu c, znajdującym
się w pobliżu strony zewnętrznej błony, skąd przez dalsze ogniwa łańcucha są
przenoszone na wewnętrzną stronę błony do 2 cząsteczek cytochromu a3,
wchodzących w skład 2 cząsteczek oksydazy cytochromowej. Następuje
przekazanie elektronów na atom tlenu, po czym jon tlenkowy, łącząc się z 2
protonami ze środowiska matriks, tworzy cząsteczkę wody.
Wszystkie składniki łańcucha oddechowego znajdują się w wewnętrznej
błonie mitochondrialnej. Z wyjątkiem CoQ, który występuje w pewnym
nadmiarze, pozostałe składniki łańcucha mają zachowane proporcje
molowe. Zgodnie ze współczesnymi poglądami, wszystkie składniki są
zgrupowane w pięciu kompleksach lipidowo-białkowych w celu
pełnienia określonych funkcji:
- kompleks I: oksydoreduktaza NADH : ubichinon,
- kompleks II: oksydoreduktaza bursztynian : ubichinon,
- kompleks III: oksydoreduktaza ubichinon : utleniony cytochrom c,
- kompleks IV: oksydoreduktaza zredukowany cytochrom c : tlen.
Według hipotezy Mitchella, utlenianie przenośników redukujących
powoduje uwalnianie protonów (H+). Od CoQ przez dalsze ogniwa
łańcucha oddechowego biegną już dalej tylko elektrony. Protony, które
na skutek działania łańcucha oddechowego wydostały się na zewnątrz
mitochondrium, wywierają wpływ na wytworzenie różnicy potencjałów
elektrochemicznych po obydwu stronach błony. Różnica ta jest siłą
napędową syntezy ATP. Na powstanie tejże siły napędowej oprócz
protonów wpływają także potencjał błonowy oraz gradient pH po
obydwu stronach błony. Błona mitochondrialna jest nieprzepuszczalna
dla protonów. Za usuwanie protonów na zewnątrz mitochondrium jest
odpowiedzialna pierwotna pompa protonowa. Jako pierwotna pompa
protonowa działają kompleksy: I, III i IV, przemieszczające H+ na
zewnętrzną powierzchnię błony. Wykorzystanie potencjału
elektrochemicznego transmembranowego umożliwia powrót H+ do
mitochondrium, związany z syntezą ATP. Umożliwia to:
- kompleks V: syntaza ATP transportująca H+ (Fl5 Fo).

Funkcja kompleksu V
polega na syntezie ATP z ADP i Pnjeora o Fosforylację
warunkują 2 czynniki białkowe Fj i Fo. Syntaza ATP, transportująca H+, działa jako
wtórna pompa protonowa, przemieszczająca protony (H+) w kierunku odwrotnym
do działania pompy pierwotnej, tj. do wewnątrz mitochondrium.
Oprócz hipotezy chemicznej i najbardziej powszechnej hipotezy
chemiosmotycznej istnieje jeszcze hipoteza konformacyjna. Według tej teorii,
energia pochodząca z utleniania zostaje przekształcona w energię
przechowywaną w stanach konformacyjnych białek mitochondrialnych. Bogaty w
energię stan konformacji może ulegać zmianom, które wyzwalają energię na
potrzeby syntezy ATP.
Błona mitochondrialna oddziela wnętrze mitochondrium od cytoplazmy.
Wewnątrz mitochondrium, oprócz łańcucha oddechowego, zachodzą również
reakcje cyklu Krebsa i beta-oksydacji kwasów tłuszczowych. Wszystkie te procesy
są uzależnione od przepuszczalności błony mitochondrialnej. Błona zewnętrzna
mitochondrium jest przepuszczalna dla większości metabolitów, natomiast
przepuszczalność błony wewnętrznej jest bardzo ograniczona. Dehydrogenazy,
dla których akceptorem atomów wodoru jest FAD, jak np. dehydrogenaza
bursztynianowa - znajdująca się po wewnętrznej stronie błony mitochondrialnej -
może bez przeszkód oddać atomy wodoru na ubichinon, z pominięciem
kompleksu I.
Błona mitochondrialna jest nieprzepuszczalna dla zredukowanego NAD. Może on
być wytwarzany podczas glikolizy zachodzącej w cytozolu. Istnieje sposób
przekazywania równoważników redukcyjnych za pomocą tzw. mostków
substratowych:
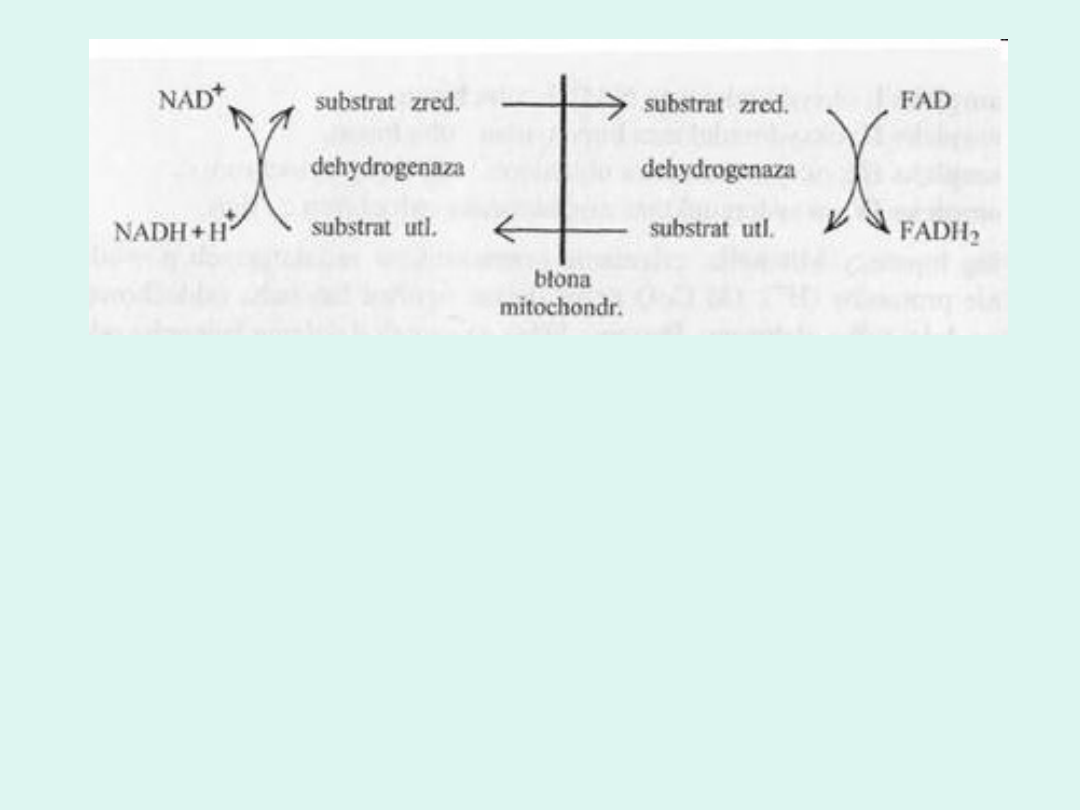
Po obydwu stronach błony występuje taka sama para substratów, która może
przyjąć lub oddać atomy wodom, oraz enzym dehydrogenaza. Przez błonę
mitochondrialną mogą przenikać cząsteczki zredukowanego przez NADH
substratu i wewnątrz mitochondrium przekazać atomy wodoru na FAD.
Powoduje to stratę jednej cząsteczki ATP, ale są inne korzyści metaboliczne.
Parę substratów i enzym mogą stanowić np. glicerolo-3-fosforan i
dihydroksyacetonofosforan oraz enzym dehydrogenaza glicerolo-3-
fosforanowa.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
Wyszukiwarka
Podobne podstrony:
BIOCHEMIA oddychanie komorkowe
12 Biochemia fosforylacja oksydacyjna nowa
Transport elektronów i fosforylacja oksydacyjna, biochemia
6a WYKŁAD Fosforylacja oksydacyjna
FOSFORYLACJA OKSYDACYJNA
FOSFORYLACJA OKSYDACYJNA - PREZENTACJA, Weterynaria rok 1, Biochemia
Łańcuch oddechowy, fosforylacja oksydacyjna
Oddychanie komórkowe
ODDYCHANIE KOMÓRKOWE ZADANIA
Fosforylacja oksydacyjna i mitochondrium, BIOCHEMIA
Oddychanie komórkowe, biologia & chemia
sciaga transport elektronów i fosforylacja oksydacyjna, Biochemia
oddychanie komórkowe
oddychanie komorkowe, INNE KIERUNKI, biologia
biologia, oddychanie komorkowe, Oddychanie komórkowe to proces biologiczny, polegający na utlenianiu
Notatki Medycyna word grafy, ODDYCHANIE KOMORKOWE
więcej podobnych podstron