• Zjawisko eksplozji leków
(nowe leki moczopędne, sulfonamidy,
hipotensyjne, leki psychotropowe,
cytostatyczne, adrenergiczne)
• Zjawisko patologii polekowych
katastrofa z talidomidem,
leki adrenergiczne w aerozolu,
brak badań klinicznych leków
• Nieetyczne eksperymenty na ludziach
(II wojna światowa, lata 60 XX w.)
• Farmakologia kliniczna – 1969 rok WHO
nowa gałąź medycyny (nauki kliniczne)
Farmakologia kliniczna
Farmakologia kliniczna

Farmakologia kliniczna
Farmakologia kliniczna
Dyscyplina obejmująca wszystko, co wiąże się z działaniem
leku u ludzi,
tj. kontrolę skuteczności, mechanizmy działania,
działania niepożądane i toksyczne
1. Prace badawcze
2. Nauczanie
3. Działanie orzecznicze i
konsultacyjne
4. Planowanie i koordynacja
badań
5. Informacja o leku
Zadania farmakologii
Zadania farmakologii
klinicznej
klinicznej
•
Poprawienie opieki nad
Poprawienie opieki nad
pacjentem
pacjentem
(zalecanie stosowania
(zalecanie stosowania
bezpiecznych i skutecznych
bezpiecznych i skutecznych
leków)
leków)
•
Zwiększenie wiedzy o lekach
Zwiększenie wiedzy o lekach
(badania kliniczne leków – na
(badania kliniczne leków – na
ludziach)
ludziach)
•
Świadczenie usług
Świadczenie usług
(farmakokinetyka,
(farmakokinetyka,
farmakodynamika,
farmakodynamika,
informacja o
informacja o
leku, rejestracja działań
leku, rejestracja działań
niepożądanych !)
niepożądanych !)
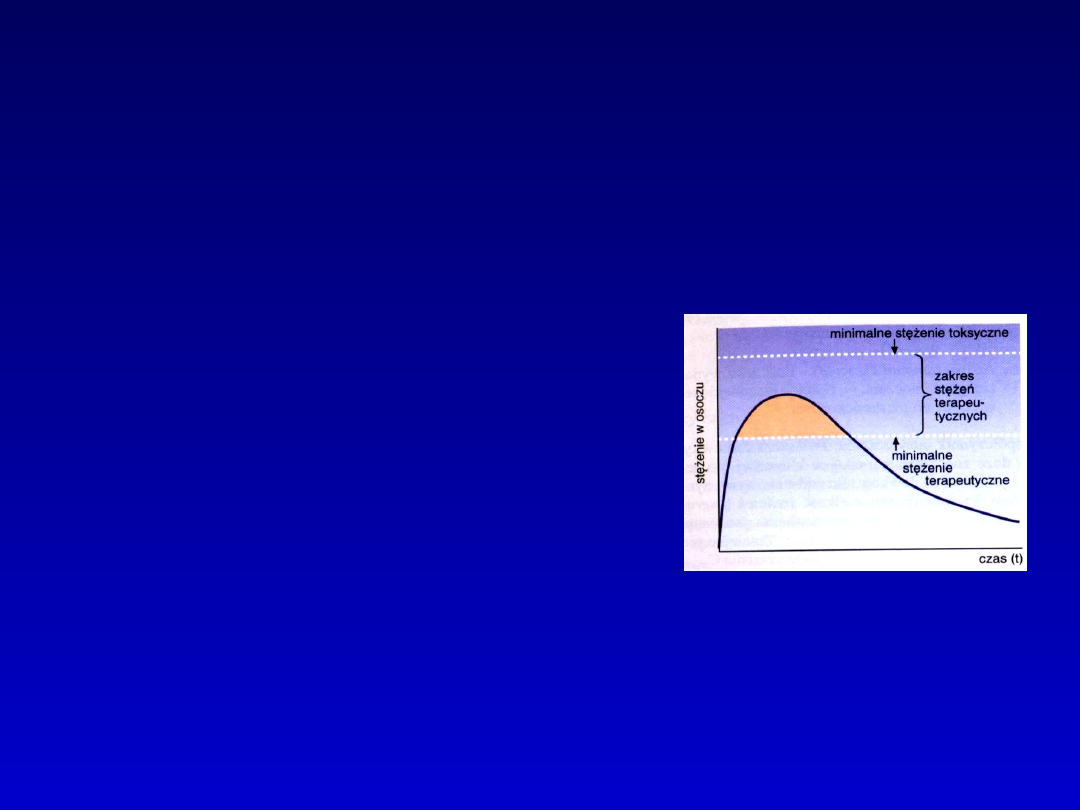
Farmakologia kliniczna
Farmakologia kliniczna

Farmakologia kliniczna -
racjonalizacja farmakoterapii
Indywidualizacja terapii
leczenie pod kontrolą
stężenia leku
we krwi -
terapia
monitorowana
stężeniem
leku w krwi
oznaczanie genotypu /
fenotypu
pacjenta
(farmakogenetyka)
skuteczna farmakoterapia
przeciwdziałanie objawom
niepożądanym

Dziedziny farmakologii klinicznej
Dziedziny farmakologii klinicznej
•
Chronofarmakologia
Chronofarmakologia
(biorytmy w działaniu
(biorytmy w działaniu
leków)
leków)
•
Farmakogenetyka
Farmakogenetyka
•
Poszukiwanie i badanie
Poszukiwanie i badanie
nowych
nowych
leków
leków
•
Farmakoekonomika
Farmakoekonomika
•
Farmakologia społeczna
Farmakologia społeczna
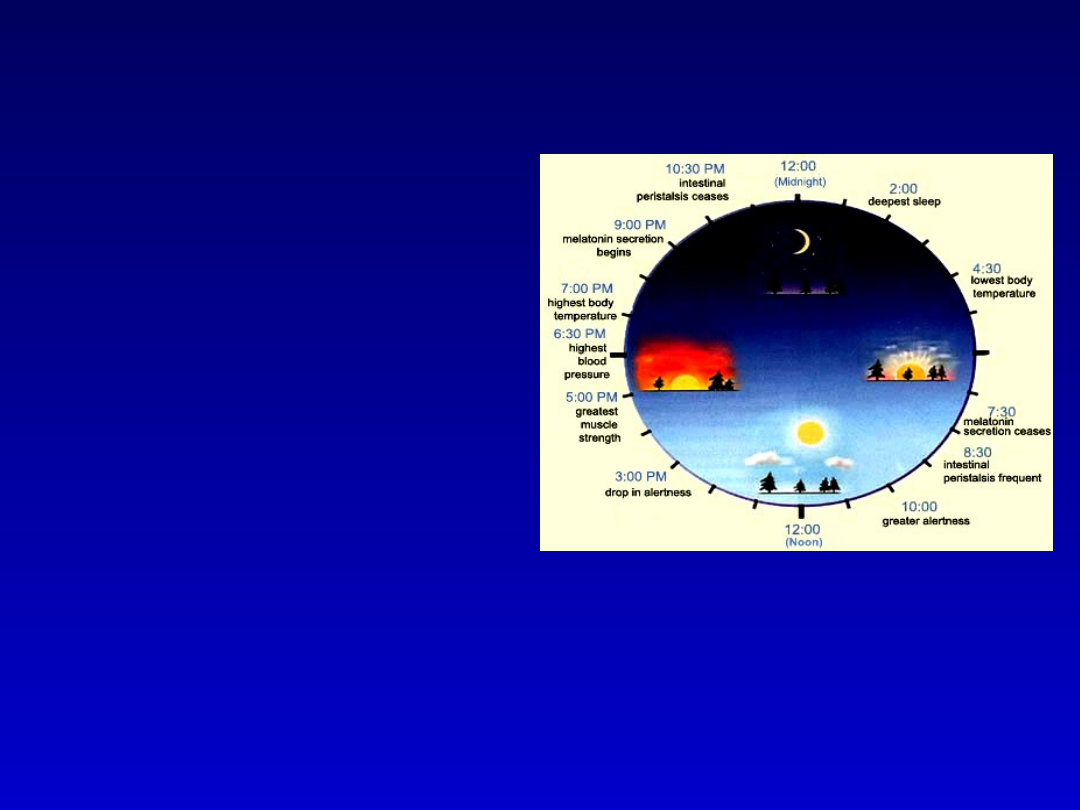
Chronofarmakologia – wpływ
biorytmów
na organizm człowieka
Zmiany dobowe w organizmie
temperatura ciała
częstość skurczów serca
ciśnienie tętnicze krwi
czynność płuc i nerek
stężenie neuroprzekaźników,
hormonów, enzymów, elektrolitów,
glukozy
zmiany chorobowe (np. zawał serca
występuje w godz. porannych 8 -12)
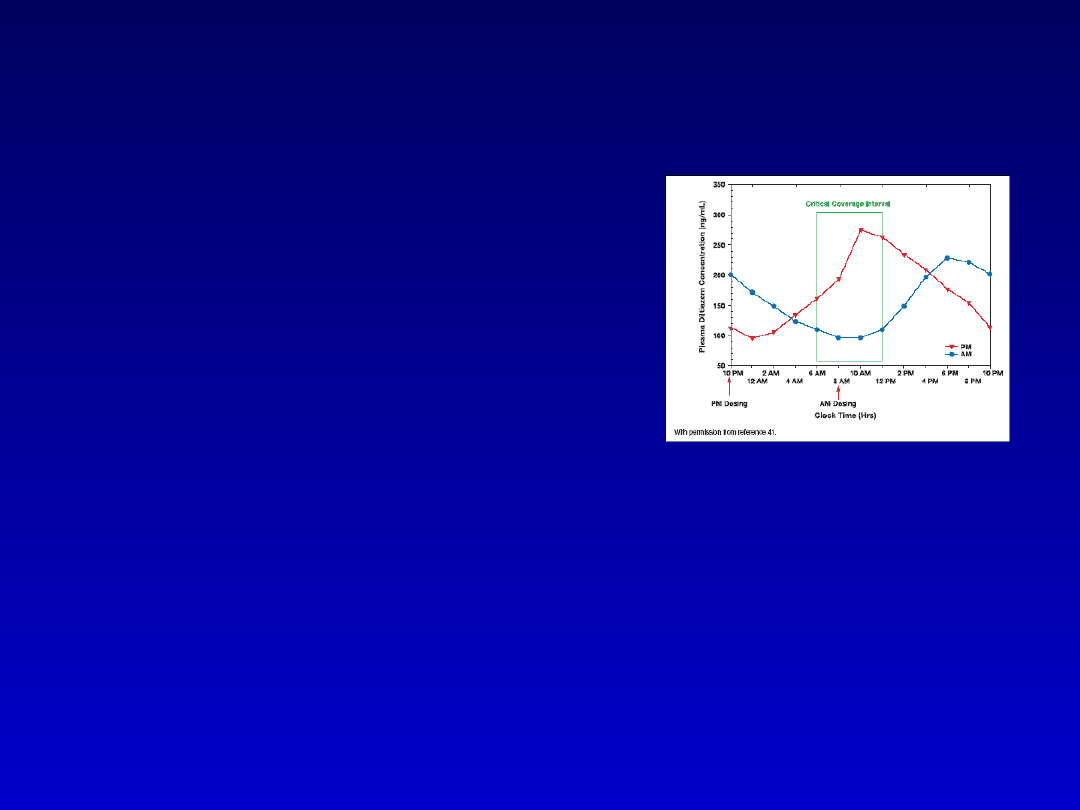
Działanie leków a rytm dobowy
• Leki znieczulające miejscowo i
przeciwbólowe
rano lub w nocy – słabsze działanie,
dłuższe
działanie wczesnym popołudniem
(wydzielanie endogennych endorfin)
• Glikokortykosteroidy
zmniejszenie działań niepożądanych
dostosowując ich podawanie do rytmu
dnia
(kortyzol) – stężenia maks.
rano 6 - 9godz.
(rano i w południe)
• Leki przeciwastmatyczne
napady dychawicy oskrzelowej w nocy
(wieczorem większe dawki)
• Leki przeciwhistaminowe (anty-H2)
podawać tylko 1x wieczorem
(choroba wrzodowa)

Lata obserwacji i doświadczeń na zwierzętach
konieczność badań na ludziach
rozwój medycyny
pytanie
gdzie przebiega granica w dążeniu do postępu
dla dobra chorego miedzy spodziewaną korzyścią
a ryzykiem wyrządzenia mu krzywdy?
• Nieetyczne eksperymenty na ludziach
(II wojna światowa, lata 60 XX w.)
deklaracje międzynarodowe, kodeksy, zbiory zasad
z zakresu bioetyki medycznej – ocena ryzyko/ korzyść
Badania kliniczne leków
Badania kliniczne leków

Deklaracje międzynarodowe (1)
Deklaracje międzynarodowe (1)
I międzynarodowa deklaracja
I międzynarodowa deklaracja
„Kodeks
„Kodeks
Norymberski” (1947r) - 10 zasad
Norymberski” (1947r) - 10 zasad
dopuszczalności doświadczeń na ludziach
dopuszczalności doświadczeń na ludziach
(uzasadnienie wyroku Amerykańskiego
(uzasadnienie wyroku Amerykańskiego
Trybunału Wojskowego - dekalog norymberski)
Trybunału Wojskowego - dekalog norymberski)
Absolutnie konieczna
Absolutnie konieczna
dokładna informacja
dokładna informacja
i dobrowolna zgoda na udział
i dobrowolna zgoda na udział
w eksperymencie
w eksperymencie
(obecny termin: „świadoma zgoda”
ang. informed consent)

Deklaracje międzynarodowe (2)
Deklaracje międzynarodowe (2)
Deklaracja Helsińska I – 1964r
Deklaracja Helsińska I – 1964r
.
.
(
(
Światowe Stowarzyszenie Medycyny -
Światowe Stowarzyszenie Medycyny -
WMA)
WMA)
zbiór zasad, jakimi powinni się kierować lekarze
zbiór zasad, jakimi powinni się kierować lekarze
prowadzący
prowadzący
badania zarówno terapeutyczne, lecznicze,
badania zarówno terapeutyczne, lecznicze,
jak i nieterapeutyczne – tzn. naukowo-badawcze
jak i nieterapeutyczne – tzn. naukowo-badawcze
lekarz
lekarz
ochrona zdrowia, prywatności i
ochrona zdrowia, prywatności i
godności człowieka
godności człowieka
poddanego
poddanego
badaniom
badaniom
konieczność wysokich kwalifikacji
konieczność wysokich kwalifikacji
prowadzącego eksperyment
prowadzącego eksperyment
Bezwzględnie
Bezwzględnie
zasada korzyści nad ryzykiem
zasada korzyści nad ryzykiem

Deklaracje międzynarodowe (3)
Deklaracje międzynarodowe (3)
Deklaracja Helsinki II – 1975r.
Deklaracja Helsinki II – 1975r.
Tokio
Tokio
projekty badań na człowieku powinny
projekty badań na człowieku powinny
być poddane
być poddane
ocenie
ocenie
niezależnej komisji
niezależnej komisji
(obecna nazwa – komisje bioetyczne)
(obecna nazwa – komisje bioetyczne)
powstanie komisji bioetyki medycznej
powstanie komisji bioetyki medycznej
(Rada Międzynarodowych Organizacji
(Rada Międzynarodowych Organizacji
Medycznych –
Medycznych –
CIOMS – opracowanie
CIOMS – opracowanie
wytycznych do pracy
wytycznych do pracy
niezależnych komisji oceniających protokoły
niezależnych komisji oceniających protokoły
doświadczalne do badań na
doświadczalne do badań na
człowieku)
człowieku)

Deklaracje międzynarodowe (4)
Deklaracje międzynarodowe (4)
Europejska Konwencja o Ochronie
Europejska Konwencja o Ochronie
Praw Człowieka i Godności Istoty Ludzkiej
Praw Człowieka i Godności Istoty Ludzkiej
Wobec Zastosowań
Wobec Zastosowań
Biologii i Medycyny – 1997 r.
Biologii i Medycyny – 1997 r.
( opracowana przez Komitet Ministrów Państw
( opracowana przez Komitet Ministrów Państw
Członkowskich Rady Europy, innych Państw i Państw
Członkowskich Rady Europy, innych Państw i Państw
wspólnoty Europejskiej)
wspólnoty Europejskiej)
dokument ten szczegółowo mówi m.in.
dokument ten szczegółowo mówi m.in.
o ochronie osób poddanych badaniom
o ochronie osób poddanych badaniom
naukowym
naukowym
warunkiem badań powinien być brak
warunkiem badań powinien być brak
metody alternatywnej o
metody alternatywnej o
porównywalnej skuteczności
porównywalnej skuteczności
(np.
(np.
zastosowanie placebo, inne zabiegi)
zastosowanie placebo, inne zabiegi)

Badania kliniczne nowych leków
Badania kliniczne nowych leków
Międzynarodowy standard medyczny, etyczny i
Międzynarodowy standard medyczny, etyczny i
naukowy dotyczący
naukowy dotyczący
planowania,
planowania,
prowadzenia, dokumentowania
prowadzenia, dokumentowania
i ogłaszania wyników badań
i ogłaszania wyników badań
„
„
Zasady prawidłowego prowadzenia badań
Zasady prawidłowego prowadzenia badań
klinicznych produktów medycznych w
klinicznych produktów medycznych w
krajach wspólnoty europejskiej” - 1990r.
krajach wspólnoty europejskiej” - 1990r.
(Polska - 1993; USA, Japonia – 1997)
(Polska - 1993; USA, Japonia – 1997)
(nazwa potoczna – „zasady dobrej praktyki
(nazwa potoczna – „zasady dobrej praktyki
klinicznej”
klinicznej”
ang.
ang.
GCP
GCP
–
–
„
„
G
G
ood
ood
C
C
inical
inical
P
P
ractice”
ractice”
)
)

Najważniejsze zalecenia
Najważniejsze zalecenia
badania kliniczne leków
badania kliniczne leków
Ocena etyczna badań (ryzyko korzyść)
komisja bioetyczna
Dokładna informacja dla badanego
Świadoma zgoda osoby biorącej udział
Ubezpieczenie osób uczestniczących w
badaniu
Możliwość rezygnacji w trakcie badania
bez podania przyczyny
Zastrzeżenia
nie można prowadzić badań na osobach
pozostających
w stosunku zależności (np. nieletni,
więźniowie, osoby chore
psychicznie, o
ograniczonej poczytalności)

Badania kliniczne leków - zasady
Badania kliniczne leków - zasady
obowiązujące w Polsce
obowiązujące w Polsce
Terenowa komisja bioetyczna
dokumenty
dokumenty
- protokół badania (CRF)
- protokół badania (CRF)
- wzór pisemnej zgody ochotnika
- wzór pisemnej zgody ochotnika
na udział
na udział
w badaniu
w badaniu
- wzór informacji dla badanego
- wzór informacji dla badanego
- potwierdzenie ubezpieczenia
- potwierdzenie ubezpieczenia
badania
badania
(Zgoda terenowej komisji bioetycznej)
(Zgoda terenowej komisji bioetycznej)
Zgłoszenie badania i uzyskanie zgody
Zgłoszenie badania i uzyskanie zgody
Centralna Komisja Nadzoru nad
Centralna Komisja Nadzoru nad
Dokonywaniem
Dokonywaniem
Badań na Ludziach (Warszawa)
Badań na Ludziach (Warszawa)

Badania przedkliniczne leków
Badania przedkliniczne leków

Fazy badania leku
Fazy badania leku
Badania przedkliniczne
Badania przedkliniczne
– skrining
– skrining
farmakologiczny
farmakologiczny
badania u zwierząt
badania u zwierząt
Krajowa Komisja Etyczna do Spraw
Krajowa Komisja Etyczna do Spraw
Doświadczeń
Doświadczeń
na Zwierzętach
na Zwierzętach
Lokalne komisje do spraw doświadczeń na
Lokalne komisje do spraw doświadczeń na
zwierzętach
zwierzętach
Badania przedkliniczne
Badania przedkliniczne
Badania wstępne i
Badania wstępne i
szczegółowe
szczegółowe
czas trwania od 1-5 lat
czas trwania od 1-5 lat
(średnio 2,6 lat)
(średnio 2,6 lat)
mechanizm działania
mechanizm działania
farmakokinetyka
farmakokinetyka
podanie jednorazowe
podanie jednorazowe
/wielokrotne
/wielokrotne
dawka/toksyczność
dawka/toksyczność

Toksyczność ostra
Toksyczność ostra
LD50, maksymalna dawka. Zazwyczaj co
LD50, maksymalna dawka. Zazwyczaj co
najmniej 2 gatunki,
najmniej 2 gatunki,
dwie drogi podania, pojedyncza dawka leku.
dwie drogi podania, pojedyncza dawka leku.
Toksyczność podostra
Toksyczność podostra
Zazwyczaj trzy dawki leku, 2 gatunki. Czas
Zazwyczaj trzy dawki leku, 2 gatunki. Czas
trwania do 6 miesięcy (zwykle przed
trwania do 6 miesięcy (zwykle przed
rozpoczęciem badań klinicznych). Czas badania
rozpoczęciem badań klinicznych). Czas badania
zależy od przewidywanego czasu klinicznego
zależy od przewidywanego czasu klinicznego
podawania leku.
podawania leku.
Toksyczność przewlekła
Toksyczność przewlekła
1 do 2 lat. Wymagana, gdy przewiduje się
1 do 2 lat. Wymagana, gdy przewiduje się
długotrwałe
długotrwałe
stosowanie leków. Zazwyczaj prowadzone
stosowanie leków. Zazwyczaj prowadzone
równolegle do badań klinicznych.
równolegle do badań klinicznych.
Wpływ na płodność, działanie teratogenne
Wpływ na płodność, działanie teratogenne
Działanie rakotwórcze
Działanie rakotwórcze
Dwa lata, dwa gatunki. Wymagane, gdy
Dwa lata, dwa gatunki. Wymagane, gdy
przewiduje się długotrwałe stosowanie leków.
przewiduje się długotrwałe stosowanie leków.
Działanie mutagenne
Działanie mutagenne
Wpływ na stabilność genetyczną: test
Wpływ na stabilność genetyczną: test
Amesa lub hodowle
Amesa lub hodowle
komórkowe
komórkowe
Badania przedkliniczne
Badania przedkliniczne
Wpływ na układ immunologiczny i ośrodkowy układ nerwowy
Wpływ na układ immunologiczny i ośrodkowy układ nerwowy

Zasady badań klinicznych
Zasady badań klinicznych

Fazy badań klinicznych leków
Fazy badań klinicznych leków
Faza I
Faza I
– wstępne badania kliniczne
– wstępne badania kliniczne
Faza II
Faza II
– wstępne kontrolowane
– wstępne kontrolowane
badania kliniczne
badania kliniczne
Faza III
Faza III
– rozszerzone kontrolowane
– rozszerzone kontrolowane
badania kliniczne
badania kliniczne
Faza IV
Faza IV
– przedłużone badania
– przedłużone badania
kliniczne
kliniczne
(po rejestracji leku)
(po rejestracji leku)
Faza I – III
Faza I – III
- zgoda komisji bioetycznej
- ubezpieczenie badania,
- świadoma zgoda osoby biorącej udział
w badaniach (ochotnicy)

FAZA I
Faza I
wstępne badania
kliniczne
ustalenie reakcji całego
organizmu
na lek, rejestracja działań
niepożądanych
określenie tolerancji osoby badanej na stopniowo
zwiększane
pojedyncze lub wielokrotne dawki
dobowe nowej substancji
badanie dostępności biologicznej i właściwości
farmakokinetycznych
substancji leczniczej
Obserwacja i rejestracja działań niepożądanych
Liczba uczestników 10 – 24 (60) zdrowych osób,
wiek 21-55 lat
Badania lekarskie oraz rutynowe badania
laboratoryjne
(przed i po zakończeniu badania)

Faza II
wstępne
kontrolowane
badania
kliniczne
Randomizowanie
pacjenci dobierani pod względem
wieku, płci, stadium zaawansowania
choroby w każdej z grup
(badanej i kontrolnej)
Ustalenie skutecznych dawek leczniczych, wskazań,
rejestracja działań niepożądanych, wstępne badania
farmakokinetyczne, 3 ośrodki
(10 - 30 osób -100/400 pacjentów
ochotników)
Badania z grupą kontrolną – placebo lub lek standardowy
Badania podwójnie ślepe, potrójnie ślepe
FAZA II

Placebo
Placebo
Placebo – (łac.) –
Placebo – (łac.) –
placere –
placere –
podobać się
podobać się
terminologia farmakologiczna
terminologia farmakologiczna
substancja podobna do leku, nie
substancja podobna do leku, nie
zawierająca
zawierająca
składników leczniczych,
składników leczniczych,
podawana dla osiągnięcia
podawana dla osiągnięcia
skutku
skutku
psychologicznego
psychologicznego
1 zastosowanie placebo w medycynie przez
1 zastosowanie placebo w medycynie przez
Linda –
Linda –
1747 r. próby
1747 r. próby
leczenia szkorbutu
leczenia szkorbutu
słownik lekarski – 1787r.
słownik lekarski – 1787r.
placebo
placebo
– „lek bez efektów farmakologicznych
– „lek bez efektów farmakologicznych
stosowany w celu
stosowany w celu
uspokojenia chorego i zrobienia
uspokojenia chorego i zrobienia
na nim wrażenia przez pewien czas”
na nim wrażenia przez pewien czas”
Placebo
Placebo
narzędzie farmakologiczne w
narzędzie farmakologiczne w
randomizowanych
randomizowanych
badaniach
badaniach
kontrolowanych (II i III fazy) przy
kontrolowanych (II i III fazy) przy
użyciu podwójnie ślepej próby
użyciu podwójnie ślepej próby

Placebo
Placebo
Cel stosowania placebo
Cel stosowania placebo
dążenie do
dążenie do
obiektywizacji badań
obiektywizacji badań
poprzez uniezależnienie
poprzez uniezależnienie
wyników badania od
wyników badania od
czynników nie związanych
czynników nie związanych
ze swoistym działaniem nowej
ze swoistym działaniem nowej
badanej substancji
badanej substancji
leczniczej
leczniczej
(np. reakcja psychiczna chorego)
(np. reakcja psychiczna chorego)
Stosowanie placebo krytykowane z punktu widzenia
Stosowanie placebo krytykowane z punktu widzenia
prawnego i etyczno-moralnego
prawnego i etyczno-moralnego
pozbawia chorego korzyści standardowego
pozbawia chorego korzyści standardowego
leczenia
leczenia
nie jest używane w codziennej praktyce
nie jest używane w codziennej praktyce
klinicznej
klinicznej
stosowanie placebo powinno być
stosowanie placebo powinno być
niedozwolone u chorych
niedozwolone u chorych
na zakażenia,
na zakażenia,
nowotwory, z rozpoznaniem depresji
nowotwory, z rozpoznaniem depresji
endnogennej, psychoz schizofrenicznych
endnogennej, psychoz schizofrenicznych
w psychogeriatrii, w wielu ciężkich
w psychogeriatrii, w wielu ciężkich
stanach
stanach
chorobowych
chorobowych

Proponowane rozwiązania
Proponowane rozwiązania
problemów etycznych
problemów etycznych
związanych z placebo
związanych z placebo
rezygnacja z badań z użyciem placebo
rezygnacja z badań z użyciem placebo
proponowanych przez firmy
proponowanych przez firmy
farmaceutyczne
farmaceutyczne
stosowanie innych bezpiecznych
stosowanie innych bezpiecznych
metod obiektywizacji
metod obiektywizacji
wyników nowej
wyników nowej
terapii przez porównanie wyników
terapii przez porównanie wyników
badań klinicznych w grupie, której
badań klinicznych w grupie, której
zastosowano nowy lek z grupą, której
zastosowano nowy lek z grupą, której
zastosowano standardową
zastosowano standardową
konwencjonalną uznaną dotychczas za
konwencjonalną uznaną dotychczas za
najlepszą farmakoterapię
najlepszą farmakoterapię

Faza III
rozszerzone
kontrolowane badania
kliniczne
Określenie związku pomiędzy bezpieczeństwem
a skutecznością podczas krótkotrwałego i
przewlekłego stosowania preparatu
Porównanie działania badanego leku z działaniem
terapeutycznym leku
zarejestrowanego lub placebo
Wiele ośrodków (500 – 12 000 pacjentów - ochotników)
Ocena jakości życia pacjentów
Statystyczna ocena leku (meta - analiza)
FAZA III

Faza IV
przedłużone
badania kliniczne (po
rejestracji leku)
Powtórna ocena wskazań do stosowania
leku
(również nowych wskazań)
Ocena przedawkowania i innych działań
niepożądanych, postępowanie
Interakcje leków
Ocena leku u ludzi w wieku podeszłym,
dzieci,
kobiet w ciąży, chorych z
niewydolnością
nerek lub wątroby
FAZA IV
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
Wyszukiwarka
Podobne podstrony:
prel sem zimowy 2010
test 2 dla IIIr sem letni 2010-11-kopia, Giełdy z farmy
parazytologia sem letni 2010 11 3 rok
Egzamin botanika sem ll 2010 wersja 1,2odp, 1
plan elektroradiologia dzienna sem 2 2009 2010
Informatyka I sem II 2010 (Egza Nieznany
zal IV dla IV roku w sem letnim 2010-11, 4 rok, farmakologia, Dzielska-Olczak
prel sem zimowy 2010
prel sem letni 2010
1.14test z farmakologii dla IV r. sem zim 2010-2011, 4 rok, farmakologia, Dzielska-Olczak
prel sem zimowy 2010
test 2 dla IIIr sem letni 2010-11-kopia, Giełdy z farmy
pytania interna zal 4 sem rok 2010 termin 1
sem letni 2010 2011
sluzby i uslugi spoleczne definicje 2010 skrot
W 15h Region tur sem lato 2010
więcej podobnych podstron