Historyczny rys
rozwoju pojęcia-
budowa materii
atomu

Historia atomu od
starożytności do
dzisiaj
Ogień jest "kłujący", więc wg
starożytnych Greków atom
ognia był kanciasty, z
ostrymi rogami, zatem
musiał mieć kształt
czworościanu foremnego...

Od najdawniejszych czasów zadawano
sobie pytanie, czym jest materia, jaka
posiada budowę i co stanowi jej skład.
Greccy filozofowie przyrody pierwsi
stworzyli podwaliny do teoretycznego
ujęcia faktów. Oni pierwsi wysunęli
koncepcję tzw. pramaterii, czyli
pierwiastka, elementu, żywiołu, z którego
powstał istniejący świat.
Tales z Miletu (ok.620 - ok.540 p.n.e.)
dowodził, że tym pierwiastkiem
pierwotnym jest woda, Heraklit z Efezu
(ok.540 - ok.480 p.n.e.) upatrywał go w
ogniu, zaś Anaksymenes z Miletu (ok.585
- ok.525 p.n.e.)- w powietrzu
.

Natomiast Leukippos i jego
uczeń Demokryt głosili
teorię atomową. Leukippos
urodził się przypuszczalnie w
Milecie ok.480 r.p.n.e. Osiadł
w południowej Tracji, gdzie
założył szkołę filozoficzną.
Był nauczycielem Demokryta.
Demokryt pochodził z Abdery
i tam umarł w późnej starości
(ok.460 - ok.370 p.n.e.).
Stworzyli najpełniej
rozbudowany system
materialistyczny
starożytności.

Demokryt przyznał atomom dwie cechy
wielkość i kształt, inny filozof, Epikur przypisał
im jeszcze trzecią, ciężar. Przeciwnikiem
Demokryta był Platon, filozof grecki, który
chciał spalić pisma Demokryta. Empedokles
nauczał o tzw. żywiołach, elementach,
pierwiastkach, stanowiących według niego tzw.
"korzenie wszechrzeczy".
Do żywiołów tych zaliczał: ziemię, wodę,
powietrze i ogień, które reprezentowały
cztery stany skupienia materii: stały, ciekły,
gazowy i "ognisty". Pogląd Arystotelesa filozofa
ze Stagiry żywioł "ziemia" był synonimem nie
tylko zwykłej ziemi, lecz określał stan materii:
"ziemię" czyli drewno, kamień, tlenek metalu.
"Woda" oznaczała stan ciekły. Określano różne
gatunki wód, kwasy, roztwory. "Powietrze" było
nazwą dla gazów, par i ciał lotnych.

W okresie Odrodzenia pod wpływem
Teofrastusa Paracelsusa (1493 - 1541)
pogląd arabskiego alchemika, że
podstawowymi pierwiastkami, z których
składają się metale, takie jak złoto, srebro,
miedź, ołów, cyna i żelazo, jest rtęć i siarka
przekształcił się w teorię trzech
pierwiastków, zwanych po łacinie "tria
prima"
Giordano Bruno, jeszcze w
minionym wieku zastanawiał się nad
rzeczywistym istnieniem
przyrodniczych, czyli fizycznych
"minima", tj. najmniejszych drobin

.Pierwszy, który wprowadził ja do
eksperymentalnej chemii, był Holender
Daniel Sennert (1572 - 1637), później
Joachim Jung, (1578 - 1665), Pierre
Gassendi (1592 - 1655) i Robert Boyle
(1627 - 1691). Filozof Pierre Gassendi
swój kult nauk empirycznych
manifestował w wyniesieniu dyscyplin
przyrodniczych ponad spekulatywne.
Uważał świat fizyczny jako zbiór atomów
poruszających się w próżni i rządzonych
prawami mechaniki.

Izaak Newton (1642 - 1727) traktował atomy
jako materialne punkty umieszczone w
przestrzeni i podlegające grawitacji oraz, że
przypisywał im określone masy. Przedstawione
odkrycia i konstatacje naukowe spowodowały, że
na przełomie XVIII i XIX wieku chemia odrzuciła
cały sofistyczny i spekulatywny balast i
przekształciła się w naukę ścisłą.

Nową teorię atomistyczną w początkach XIX w.
Był John Dalton angielski fizyk który opublikował
cztery założenia dotyczące istnienia i
właściwości atomów:
- każda substancja zbudowana jest z trwałych i
niepodzielnych cząsteczek,
-Atomy tak jak i pierwiastki które reprezentują
są niezniszczalne i zachowują swoją
identyczność we wszystkich przemianach
chemicznych,
-Istnieje tyle różnych atomów ile jest
pierwiastków chemicznych,
-Pierwiastki łączą się w związki chemiczne
zawsze w najprostszy możliwy sposób tworząc
połączenie AB
Teoria t miała duży wpływ na innych uczonych.

W latach dwudziestych XX w poznano szczegóły
budowy powłok elektronowych: okazało się że
dzielą się one na podpowłoki i orbitale.
Jednocześnie na podstawie badań
promieniowania wysyłanego przez ogrzany do
wysokiej temp Niels Bohr stworzył w 1913 r
kwantową teorię budowy powłok elektronowych.
W tym samym czasie Frederick Soddy odkrył
izotopy a w 1914 Henry Moseley podał
nowoczesną koncepcję liczby atomowej jako
ilości protonów w jądrze danego pierwiastka.
W 1932 roku odkryto neutron co spowodowało
szybki rozwój fizyki doprowadził do odkrycia
wielu nowych cząstek. Znamy ich obecnie kilka
tysięcy. Większość z nich to cząstki nietrwałe -
ulegają one rozpadowi na inne cząstki.
BUDOWA ATOMU
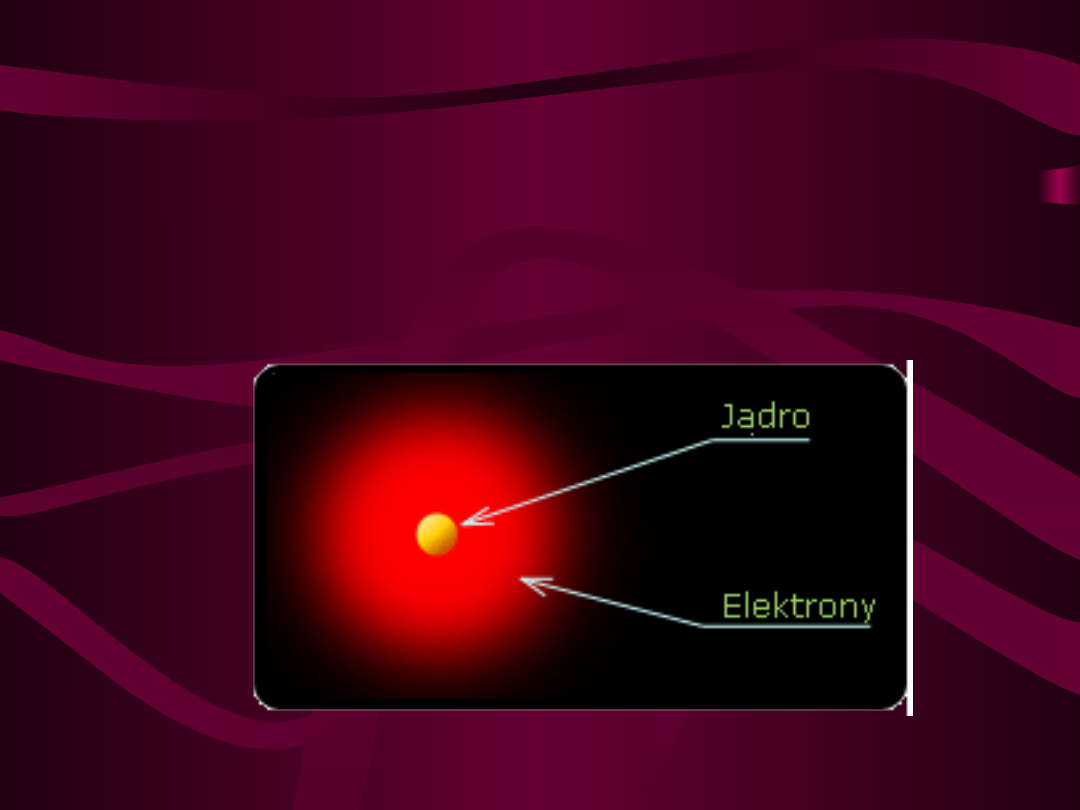
Atom każdego pierwiastka składa się z jądra
oraz krążących wokół niego elektrycznie
ujemnych elektronów odpowiadających ilości
protonów w jądrze. Jądro atomu składa się z
dodatnio naładowanych protonów i obojętnych
elektrycznie neutronów, nazywanych wspólnie
nukleonami.

Prawdziwe atomy w pierwszym spojrzeniu
można uważać za kulki. Jednak nie są to idealne
twarde kulki, a raczej dość elastyczne „okrągłe
baloniki”. Pod wpływem oddziaływań z zewnątrz
atomy mogą się rozciągać, odkształcać, lub
zmieniać inne swoje właściwości (np.
elektryczne, magnetyczne). Atomy wyraźnie
reagują na działania skierowane wobec nich
przez siły zewnętrzne.

Atomy mają bardzo małe rozmiary – przeciętnie
jest to około jednej dziesięciomiliardowej metra
(tę jednostkę nazywa się często „angstremem” i
oznacza literą A z kółeczkiem na górze - Å).
H
Rn
Na rysunku przedstawione są
rozmiary atomów wodoru i
radonu w tej samej skali
(powiększenie wynosi ok. 100
milionów razy)

Atomy są niezwykle lekkie. Jest to oczywiste, skoro w
byle okruszku jest ich miliardy miliardów. Dlatego
masy atomów najczęściej wyraża się nie w gramach
czy kilogramach. W tych jednostkach masa
pojedynczych atomów byłyby bardzo małymi
ułamkami.
Wzorcem masy atomowej, jest
1/12 masy atomu izotopu węgla
C
12
1 u (ajm, jma) = 10
-3
kg∙mol
-
1
/N
A
= 1,6605402∙10
-27
kg

IZOTOPY
Atomy tego samego pierwiastka występują w
kilku odmianach zwanych izotopami. Wszystkie
izotopy tego samego pierwiastka (np. wszystkie
izotopy tlenu) mają identyczną liczbą protonów
w jądrze, ale różnią się "dodatkiem" neutronów.
Izotopy tego samego pierwiastka nie różnią się
(prawie, bo minimalne różnice się zdarzają)
właściwościami chemicznymi i fizycznymi.
Wyjątkiem od tej reguły jest jedna cecha -
promieniotwórczość. Z zasady duża część
izotopów jest promieniotwórcza, co oznacza, że
izotopy te mają tendencję do samorzutnego
rozpadania się i emitowania przy tym cząstek
promieniowania.

Gęstość jądra atomu
Jądro składa się z 1 protonu i 1 neutronu:
Wtedy
masa jądra = = 2 *
0,000000000000000000000000167 gram
(1.67 x 10
-24
gram) =
0,000000000000000000000000334
gram (3.34 x 10
-24
gram)
średnica jądra = 0,00000000000001 m (1 x
10
-14
m)
promień jądra r = 1 x 10
-14
m/2 =
0,000000000000005 m (0.5 x 10
-14
m)
objętość jądra = (4/3)p(r)
3
= 5.24 x 10
-43
m
3
gęstość = masa/objętość = 3.32 x 10
-24
g/5.24 x 10
-43
m
3
= 6.34 x 10
18
g/m
3

Oznacza to, że 1 cm
3
materii
składającej się tylko z neutronów i
protonów będzie miał masę - 6,34 x
10
18
g/m
3
) * (1 x 10
-6
m
3
) =
634000000000 g (6.34 x 10
12
g)
czyli sześć miliardów kilogramów,
lub sześć milionów ton

MODELE BUDOWY
ATOMU

KONIEC
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
Wyszukiwarka
Podobne podstrony:
budowa materii i wiazania chem, Chemia, Gimnazjum, kl1, Budowa atomu
Duchowość - próba zdefiniowania pojęcia, Rozwój Osobisty Dobre materiały
Cząsteczkowa budowa materii
pdf wykład 02 budowa materii, podstawowe prawa chemiczne 2014
O duchowości, Rozwój Osobisty Dobre materiały
Budowa materii wykład 2
Budowa materii id 94290 Nieznany (2)
Wewnętrzna budowa materii GRUPA A
hist-wer2, Powtórzenie z historii - wersja II, „Powtórzenie materiału do egzaminu z HISTORII G
BUDOWA MATERIAŁÓW KOMPOZYTOWYCH
Historii Maniaków streszczenie, Notatki, opracowania, materiały na kolokwia
Materiały budowlane - pojecia wyjasnienie, materialy budowlane
Budowa materiałów
Wewnętrzna budowa materii GRUPA B
Budowa materi Chemia
Jedyna rzecz nad którą całkowicie panujesz, Rozwój Osobisty Dobre materiały
więcej podobnych podstron