
WYMIANA JONOWA -
OCZYSZCZANIE WÓD
PRZEMYSŁOWYCH

WYMIANA JONOWA
proces wymiany jonów na inne jony tego samego znaku zachodzący na ciele stałym lub polimerze zawierającym odpowiednie
grupy funkcyjne, obejmuje:
- transport jonu z roztworu do powierzchni ziarna jonitu, a następnie do miejsca wymiany,
- reakcję podwójnej wymiany,
- transport wypartego jonu wewnątrz ziarna jonitu od miejsca wymiany do powierzchni ziarna jonitu a następnie do roztworu.
Jeżeli ciało stałe lub polimer jest używane w sposób wykorzystujący zjawisko wymiany jonowej, wówczas taki materiał nazywa
się wymieniaczem jonowym lub jonitem.

REAKCJE WYMIANY JONOWEJ:
-
Dla wymiany kationitów:
RX
(n-)
+ nAY ↔ R(XA)n + nY
-
-
Dla wymiany anionitów:
RX
(n+)
+ mBZ ↔ R(XZ)m + mB
+
gdzie: R - szkielet polimeryczny,
X - trwale związane ze szkieletem grupy
jonoczynne,
A, B - ruchliwe kationy,
Y, Z - ruchliwe aniony,
n, m - odpowiednie wartościowości kationitu i
anionitu

JONITY (INACZEJ: ŻYWICE
JONOWYMIENNE)
są to polimery, w
których łańcuchy
wbudowane są grupy
funkcyjne. Od
charakteru tych grup
zależą własności
danego jonitu. Jako
polimer bazowy, tzw.
matrycę, stosuje się
przede wszystkim
polistyren (żywice
styrenowe), a także
polimery akrylowe.

KRYTERIA PODZIAŁU JONITÓW:
Podział ze względu na pochodzenie:
organiczne (naturalne, półsyntetyczne, syntetyczne);
nieorganiczne (naturalne, syntetyczne,
półsyntetyczne);
Podział ze względu na grupy funkcyjne:
jednofunkcyjne;
dwufunkcyjne;
wielofunkcyjne.
Podział ze względu na wymianę ładunku:
kationity (wymieniają z roztworem kationy);
anionity (wymieniają z roztworem aniony).

KATIONITY I ANIONITY
Kationity dzieli się na:
obojętne lub słabo kwaśne Kt
s
(-COOH; -OH; -SH; -CH
2
SH),
silnie kwaśne Kt
m
(-SO
3
H, -CH
2
SO
3
H).
Anionity dzieli się na:
słabo zasadowe An
s
(aminy I, II i III-rzędowe),
silnie zasadowe An
m
(aminy IV-rzędowe)
PODZIAŁ ZE WZGLĘDU NA STOPIEŃ DYSOCJACJI GRUP
FUNKCYJNYCH

CYKL PRACY JONITÓW SKŁADA SIĘ Z:
przygotowanie jonitu do pracy (pęcznienie),
właściwy cykl pracy jonitu - wymiana jonowa do
punktu przebicia (czas pracy użytecznej jonitu),
regeneracji złoża, która wymaga:
spulchniania złoża,
regeneracji właściwej,
płukania złoża.

CZYNNIKI WPŁYWAJĄCE NA PRZEBIEG
WYMIANY JONOWEJ:
ładunek jonów (ładunek rośnie – energia wymiany rośnie),
wielkość jonów (większe jony organiczne są szybciej wiązane,
związki nieorganiczne - siła rośnie w miarę zwiększania się
liczby atomowej pierwiastka),
hydratacja jonu (im promień jonu jest mniejszy tym silniej
jest on wiązany przez jonit),
charakter grup funkcyjnych,
stopień usieciowania jonitu (stopień usieciowania wzrasta-
zmniejsza się zdolność jonitu do wiązania większych jonów),
stężenie roztworu,
temperatura oczyszczanych roztworów i ich pH.

ZASTOSOWANIE WYMIANY JONOWEJ:
- oczyszczanie wody do celów przemysłowych -
zmiękczanie i demineralizacja wody;
- uzdatnianie wody do celów konsumpcyjnych;
- oczyszczanie powietrza z zanieczyszczeń kwaśnych
i zasadowych;.
W Polsce wymiana jonowa nie jest stosowana w
zakładach uzdatniania wody przeznaczonej do
zaopatrzenia ludności.

JONITOWE OCZYSZCZANIE WODY DO
CELÓW PRZEMYSŁOWYCH
Zmiękczanie wody,
Demineralizacja i odsalanie
Usuwanie fosforanów i azotanów,
Usuwanie azotu amonowego i metali,
Usuwanie zanieczyszczeń organicznych,

ZMIĘKCZANIE WODY
czyli pozbawienie jej częściowo lub całkowicie
składników powodujących twardość, tj. soli wapnia i
magnezu.
Twardość niewęglanowa jest wynikiem
obecności w wodzie chlorków, siarczanów,
krzemianów, azotanów, fosforanów wapnia i
magnezu.
Twardość węglanowa wynika z obecności w
wodzie wodorowęglanów wapnia i magnezu.
Twardość ogólna jest sumą twardości
węglanowej i niewęglanowej.

ZMIĘKCZANIE WODY
- w zależności od wymaganego stopnia zmniejszenia twardości
wody oraz rodzaju usuwanej twardości stosuje się wymianę
jonową:
a) w cyklu wodorowym na kationitach słabo
kwaśnych – usuwanie twardości węglanowej,
kationit słabo kwaśny
2Kt-H + Ca(HCO
3
)
2
Kt
2
-Ca + 2H
2
O + 2CO
2
2Kt-H+ Mg(HCO
3
)
2
Kt
2
-Mg + 2H
2
O + 2CO
2
Kt-H+ NaHCO
3
Kt
-Na + H
2
O + CO
2
w czasie regeneracji
Kt
2
-Ca + 2HCl 2Kt-H + CaCl
2
Kt
2
-Mg + 2HCl 2Kt-H
+ MgCl
2
Wymiana jonowa przebiega zgodnie z poniższymi reakcjami:

ZMIĘKCZANIE WODY
b) w cyklu sodowym lub wodorowym na kationitach
silnie kwaśnych – usuwanie twardości węglanowej i
niewęglanowej
,
Wymiana jonowa w cyklu sodowym:
kationit silnie kwaśny (regenerowany
NaCl)
2Kt-Na + MgCl
2
Kt
2
-Mg + 2NaCl
2Kt-Na + CaSO
4
Kt
2
-Ca + Na
2
SO
4
2Kt-Na + Ca(HCO
3
)
2
Kt
2
-Ca + 2NaHCO
3
Wymiana jonowa w cyklu wodorowym:
kationit silnie kwaśny (regenerowany HCl)
2Kt-H + Ca(HCO
3
)
2
Kt
2
-Ca + 2H
2
O + 2CO
2
2Kt-H+ Mg(HCO
3
)
2
Kt
2
-Mg + 2H
2
O + 2CO
2
2Kt-H+ CaCl
2
Kt
2
-Ca + 2HCl
2Kt-H+ MgSO
4
Kt
2
-Mg + H
2
SO
4
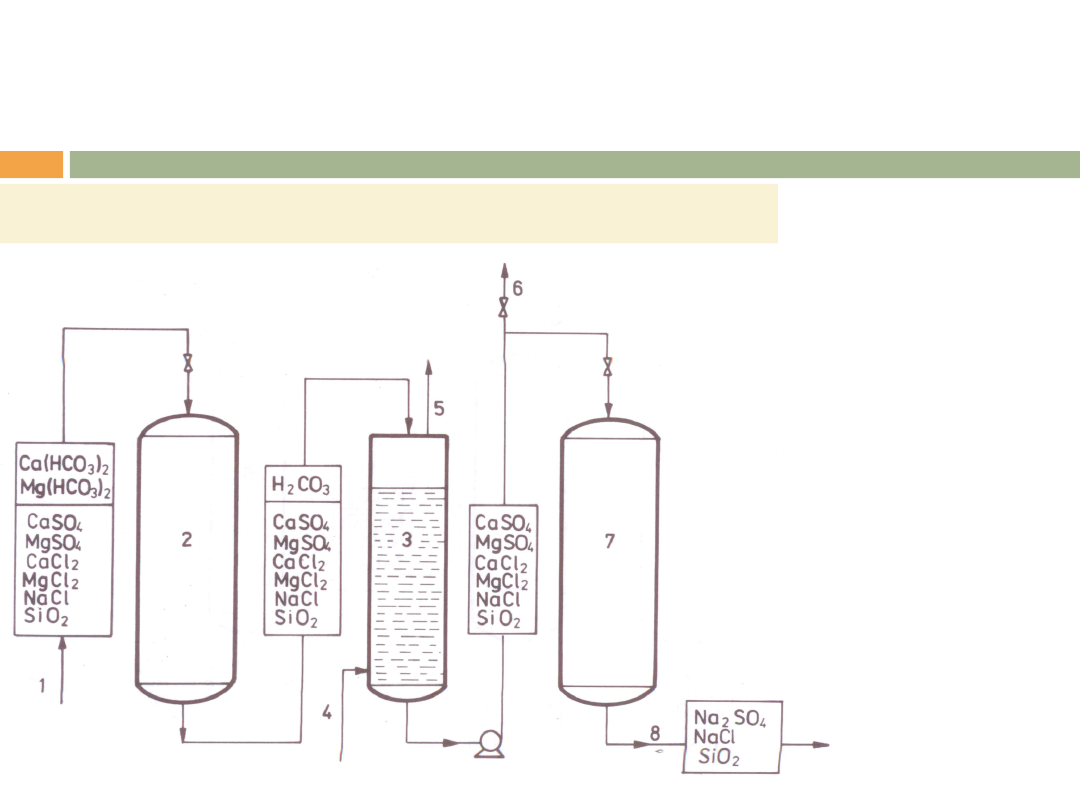
ZMIĘKCZANIE WODY
c) w cyklu wodorowym (słaby lub silny kationit) i cyklu
sodowym (silny kationit) – usuwanie twardości
węglanowej i niewęglanowej,
Szeregowy układ wymienników sodowego i wodorowego.
1-woda surowa,
2-wymiennik wodorowy
kationit słabo
kwaśny,
3-odgazowywacz,
4-doprowadzenie
sprężonego powietrza,
5-odprowadzeni CO
2
,
6-odprowadzenie wody
zdekarbonizowanej do
celów ruchowych,
7-wymiennik sodowy,
kationit silnie
kwaśny
8-woda zmiękczona.
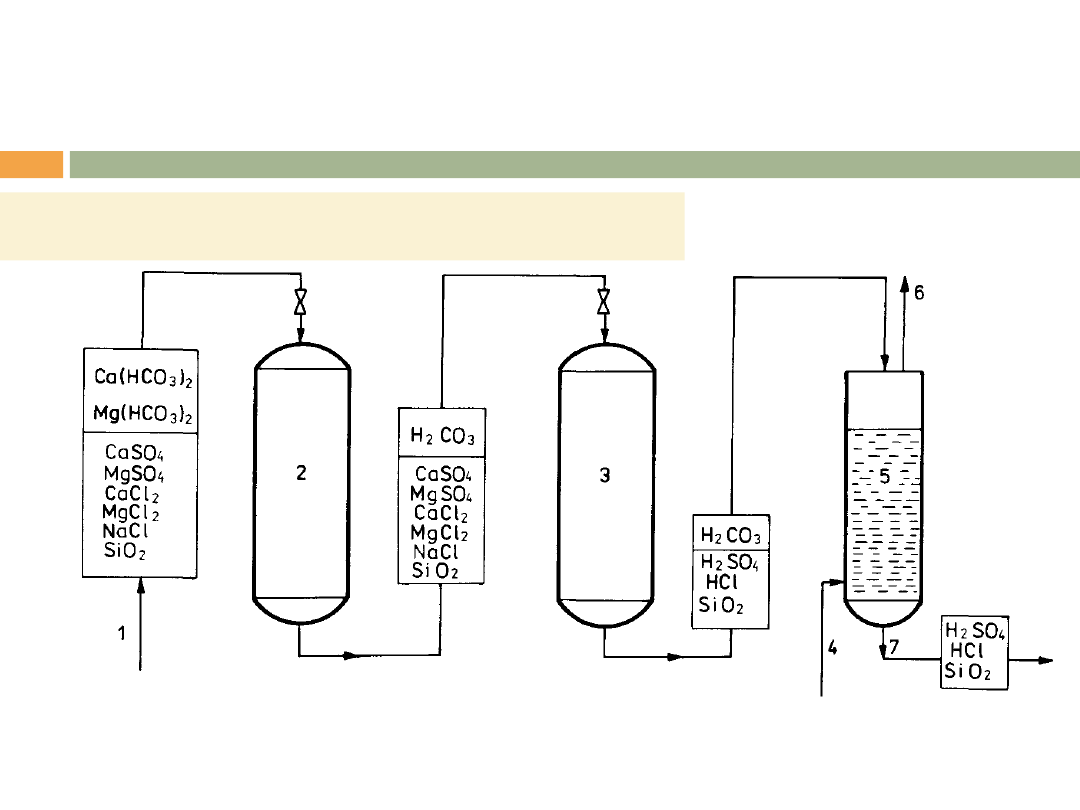
ZMIĘKCZANIE WODY
d) w cyklu wodorowym (kationit słabo kwaśny–
dekarbonizacja), kationit silnie kwaśny – usuwanie twardości
węglanowej i niewęglanowej),
Szeregowy układ wymienników wodorowych.
1-woda surowa, 2-kationit słabo kwaśny, 3-kationit silnie kwaśny, 4-
doprowadzenie sprężonego powietrza, 5-odgazowywacz, 6-odprowadzenie CO
2
,
7-woda zdekationizowana.

ZMIĘKCZANIE WODY
e)
dekarbonizacja i dekationizacja na układzie, który stanowi
silnie kwaśny kationit pracującym w cyklu sodowym i silnie
zasadowy anionit pracujący w cyklu chlorkowym.
Wymiana jonowa w cyklu sodowym:
Wymiana jonowa w cyklu chlorkowym:
NaHCO
3
+ An-Cl An-HCO
3
+ NaCl
anionit silnie zasadowy
kationit silnie kwaśny
2Kt-Na + MgCl
2
Kt
2
-Mg + 2NaCl
2Kt-Na + Ca(HCO
3
)
2
Kt
2
-Ca + 2NaHCO
3
DEMINERALIZACJA WODY
- polega na usunięciu z niej wszystkich kationów i
anionów.
Na kationicie usuwane są z wody wszystkie kationy,
zastępując je kationem wodorowym:
Ca
2+
+ 2Kt-H → Ca(Kt)
2
+ 2H
+
Mg
2+
+ 2Kt–H → Mg(Kt)
2
+ 2H
+
Na
+
+ Kt–H → NaKt + H
+
K
+
+ Kt–H → KKt + H
+
Wymianę jonów zapewnia układ technologiczny
obejmujący dekationizację i deanionizację.

Następnie woda przechodząc przez masę anionitową,
wymienia zawarte w wodzie aniony na jon wodorotlenowy:
HCO
3-
+ An-OH → An-HCO
3
+ OH
-
SO
42-
+ 2An-OH → An
2
SO
4
+ 2OH
-
Cl
-
+ An-OH → AnCl + OH
-
NO
3-
+ An-OH → AnNO3 + OH
-
Kationy i aniony osadzają się na masach jonitowych, a
wydzielające się jony tworzą cząsteczkę wody:
H
+
+ OH
-
→
H
2
O
Po wyczerpaniu zdolności wymiennej żywic jonitowych,
poddaje się je procesowi regeneracji. Żywice kationitowe
regeneruje się kwasem takim jak HCl lub H
2
SO
4
, a żywice
anionitowe przy pomocy ługu sodowego NaOH.
DEMINERALIZACJA WODY
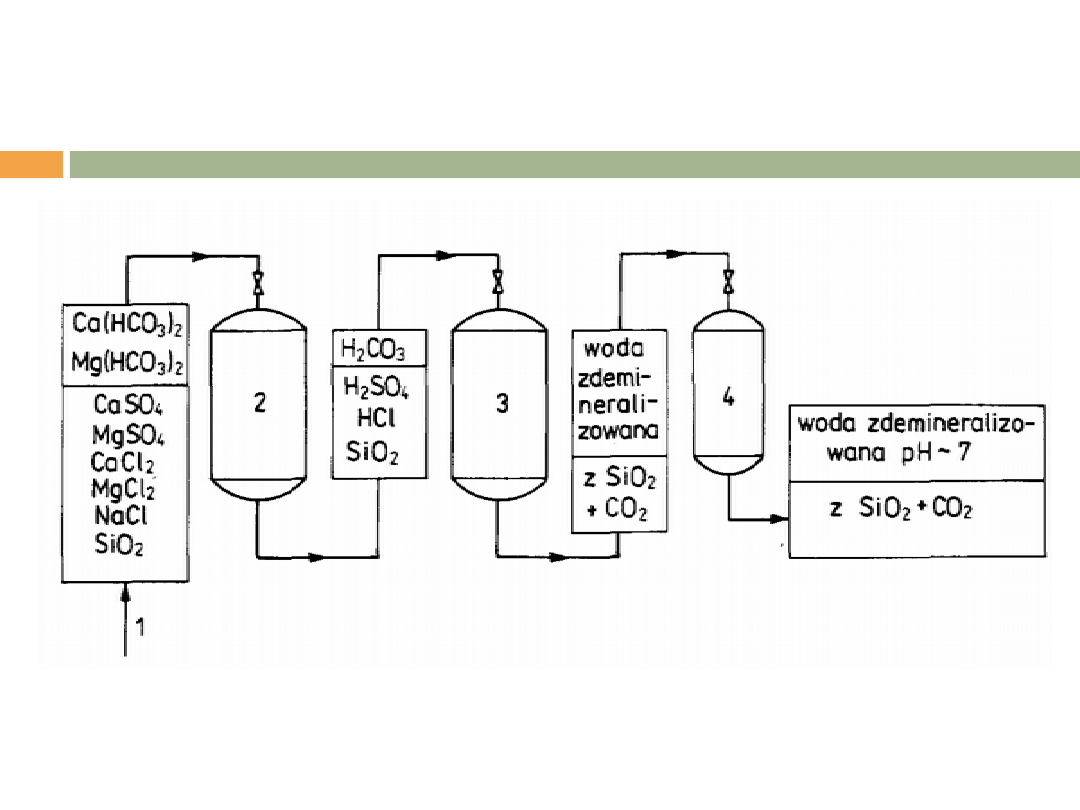
UKŁAD DEMINERALIZACJI WODY BEZ
ODKRZEMIANIA
1-woda surowa, 2-kationit wodorowy silnie kwaśny, 3-anionit słabo zasadowy
pracujący w cyklu wodorotlenowym, 4-wymiennik dwujonitowy (kationit+ anionit).
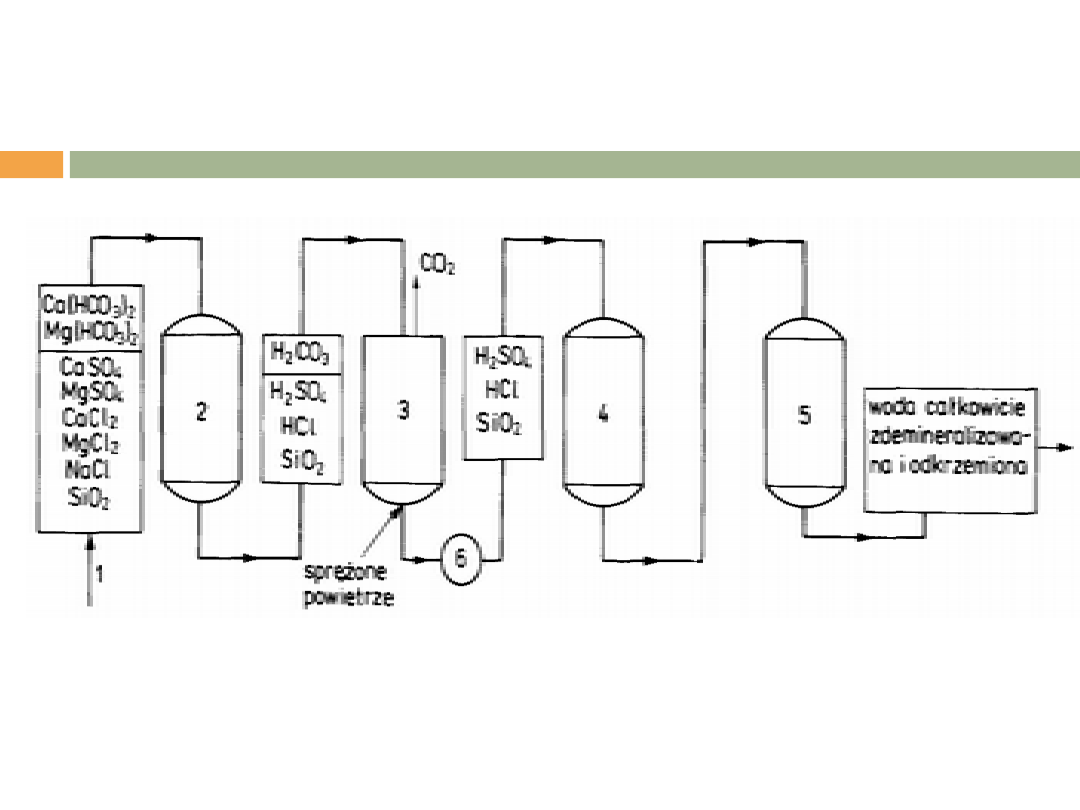
UKŁAD PEŁNEJ DEMINERALIZACJI WODY Z
ODKRZEMIANIEM
1-woda surowa, 2-silnie kwaśny kationit wodorowy, 3-odgazowywacz, 4-silnie
zasadowy anionit wodorotlenowy, 5-wymiennik dwujonitowy (kationit + anionit), 6-
pompa.
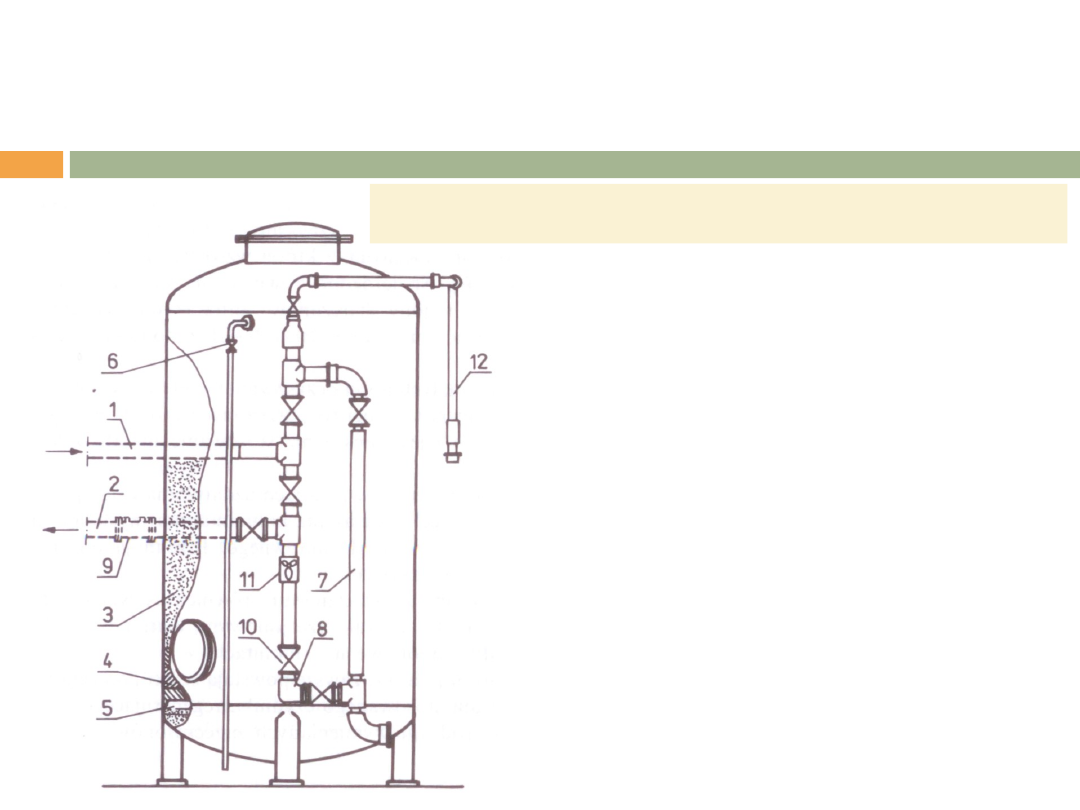
URZĄDZENIA DO JONITOWEGO
UZDATNIANIA WODY
1-dopływ wody,
2-odpływ wody po wymianie jonowej,
3-złoże jonitu,
4-warstwa podtrzymująca,
5-drenaż,
6-odpowietrzenie,
7-odprowadzenie wody po płukaniu,
8-spust,
9-wodomierz,
10-miernik przepływu,
11-kurek probierczy,
12-doprowadzenie czynnika
regenerującego
Schemat standardowego wymiennika jonowego.

Opracowano na podstawie:
A.L. Kowal, M. Świderska-Bróz „Oczyszczanie
wody”, Wrocław 1996.

Dziękuję za uwagę
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
Wyszukiwarka
Podobne podstrony:
sciaga moja+wymiana jonowa, 4 Stopnie oczyszczania ścieków:
6 Ozn zdoln wody do odmineralizowania wymiana jonowa, Ścieki przemysłowe, Sprawozdania- Scieki przem
11 WYMIANA JONOWAid 12683 ppt
10 Wymiana jonowa
Oczyszczanie sciekow przemyslowych na wybranym przykladzie, ochrona środowiska UTP bydgoszcz
Systemy oczyszczania wód i ścieków
wymiana jonowa lab
Efektywne oczyszczanie, ciek w przemys owych
Technologia wody - odmineralizowanie; wymiana jonowa, Materiały na IŚ, Projekty, referat itp
5 Wymiana Jonowa
sorpcja, Polibuda, II semestr, Techologia oczyszczania wód i ścieków, laboratorium
Podstawowe procesy oczyszczania wód, hydrobiologia, Inżynieria środowiska
WYMIANA JONOWA wersja 2
WYMIANA JONOWA
protokoldefosfatacja, Polibuda, II semestr, Techologia oczyszczania wód i ścieków, laboratorium
odwadnianie ver.1 - 29.04.09, Polibuda, II semestr, Techologia oczyszczania wód i ścieków, laborator
więcej podobnych podstron