Podstawy chemii
kwantowej
Układ okresowy pierwiastków
1887 - 1961
1887 - 1961
Ernest
Schrödinger
Ernest
Schrödinger
e
e
B
v
m
h
MECHANIKA FALOWA
(KWANTOWA)
MECHANIKA FALOWA
(KWANTOWA)
rok 1926
rok 1926
2
Spróbujemy opisać ruch elektronu, zakładając, że zachowuje się
on jak UMOWNA fala de Broglie’a, która jest związana z
poruszającym się elektronem

Ponieważ
atom
jest
układem
STACJONARNYM,
to
znaczy
nie
zmieniającym się w czasie, trzeba przyjąć,
że fala związana z elektronem w atomie jest
FALĄ STOJĄCĄ
E. Schrödinger
E. Schrödinger
lata 1925 - 1927
3
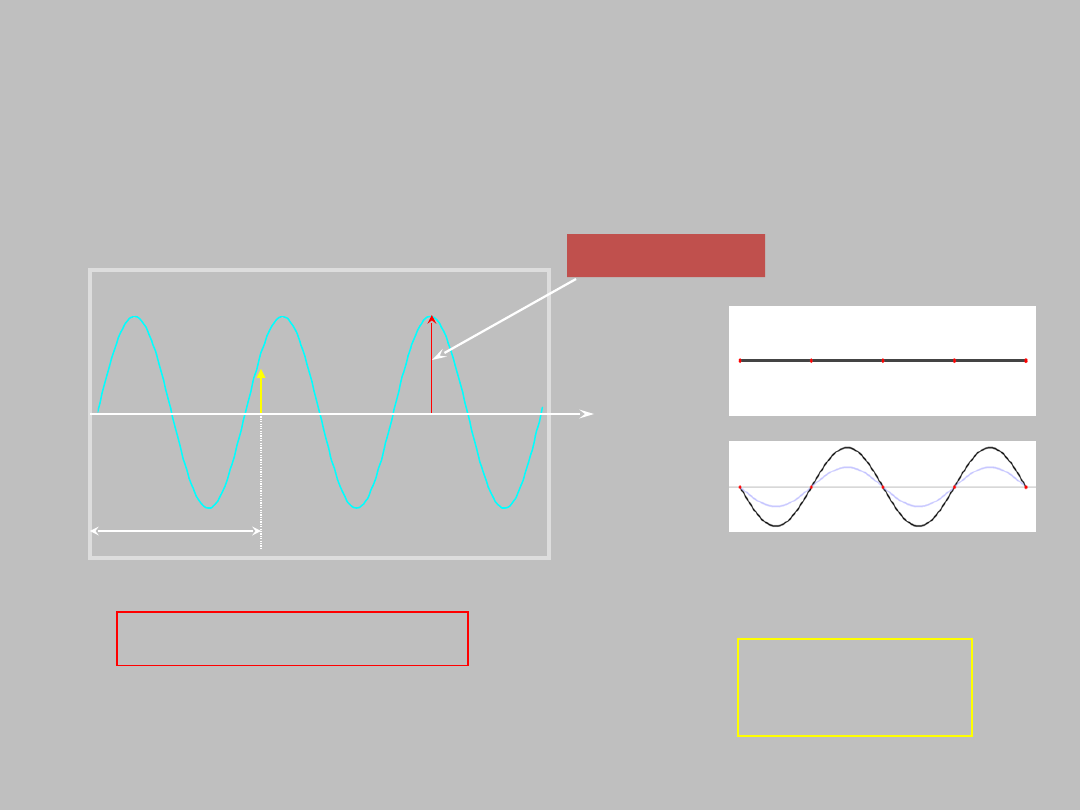
Obecność fali w jakiejkolwiek przestrzeni oznacza drganie
elementu w każdym punkcie tej przestrzeni czyli odchylanie
się elementu o Da od tak zwanego POŁOŻENIA RÓWNOWAGI
(PR)
Da
A
Da = F(x,t)
PR
*)
dla fali stojącej Da także nazywa się amplitudą
Funkcja falowa:
x
x
fala
stojąca:
Da = F(x)
*)
amplituda
4

W ujęciu mechaniki kwantowej elektron w przestrzeni
wokół jądra atomu reprezentowany jest przez falę
stojącą, która zadana jest FUNKCJĄ FALOWĄ Y(x,y,z)
x
y
z
x
0
y
0
z
0
P(x
0
,y
0
,z
0
)
odchylenie
od
położenia
równowagi (amplituda) tego co
drga w fali de Broglie’a w
punkcie P...
odchylenie
od
położenia
równowagi (amplituda) tego co
drga w fali de Broglie’a w
punkcie P...
5
Da(P) = Y(x
0
,y
0
,z
0
)

Energia „ukryta” w fali znajdującej się w jakimś
ośrodku jest wprost proporcjonalna do natężenia
fali, które z kolei jest wprost proporcjonalne do
kwadratu amplitudy fali
E(x,y,z) ~ Y
2
(x,y,z)
E(x,y,z) ~ Y
2
(x,y,z)
6
..czas przypomnieć sobie o dualizmie
korpuskularno-falowym - fala, o której
mówimy musi czasem ujawnić swoje
korpuskularne właściwości....

Przyjmijmy,
że...
.. natężenie fali de Broglie’a
elektronu w jakiejś przestrzeni
jest związane z ...
...PRAWDOPODOBIEŃSTWEM
zaobserwowania elektronu jako
cząstki...
...PRAWDOPODOBIEŃSTWEM
zaobserwowania elektronu jako
cząstki...
7
W tych miejscach przestrzeni, gdzie jest większe
natężenie
fali
-
tam
jest
też
większe
prawdopodobieństwo napotkania elektronu jako
cząstki*
*) tzw. interpretacja kopenhaska
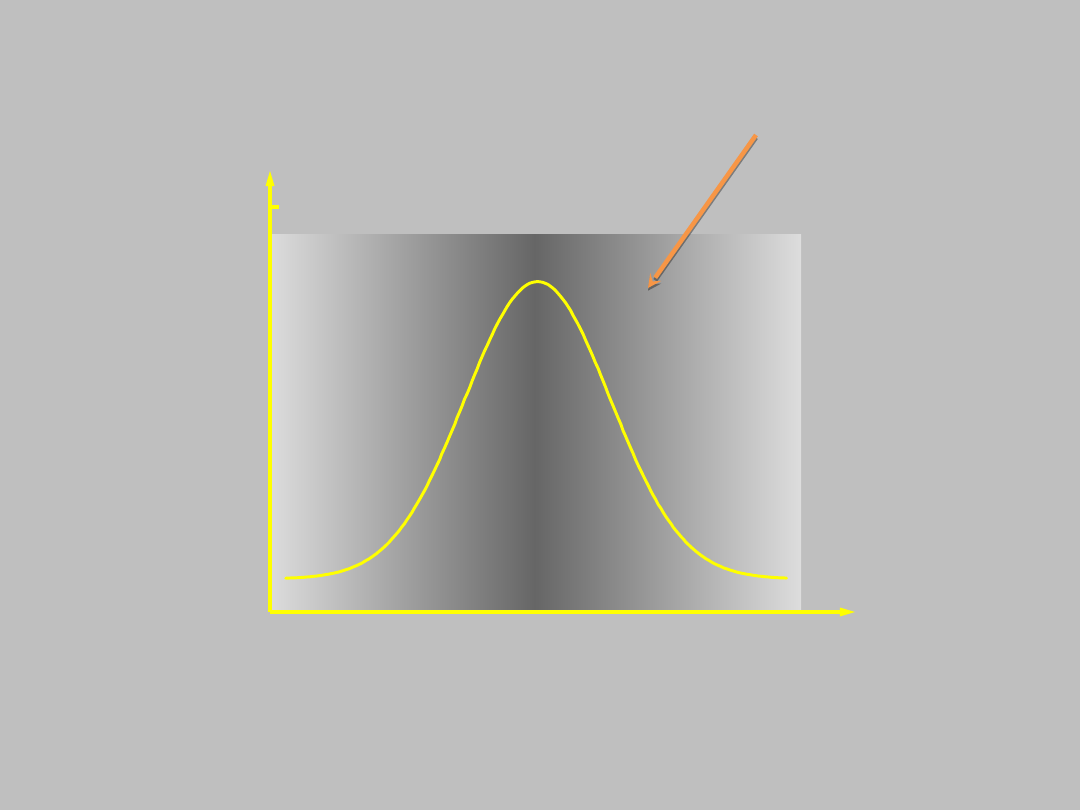
Rozważmy przykład...
..
im ciemniej tym większe
natężenie fali
elektronowej
Pr
a
w
d
o
p
o
d
o
b
ie
ń
st
w
o
x
1
8
x
y
z
Dx
Dy
Dz
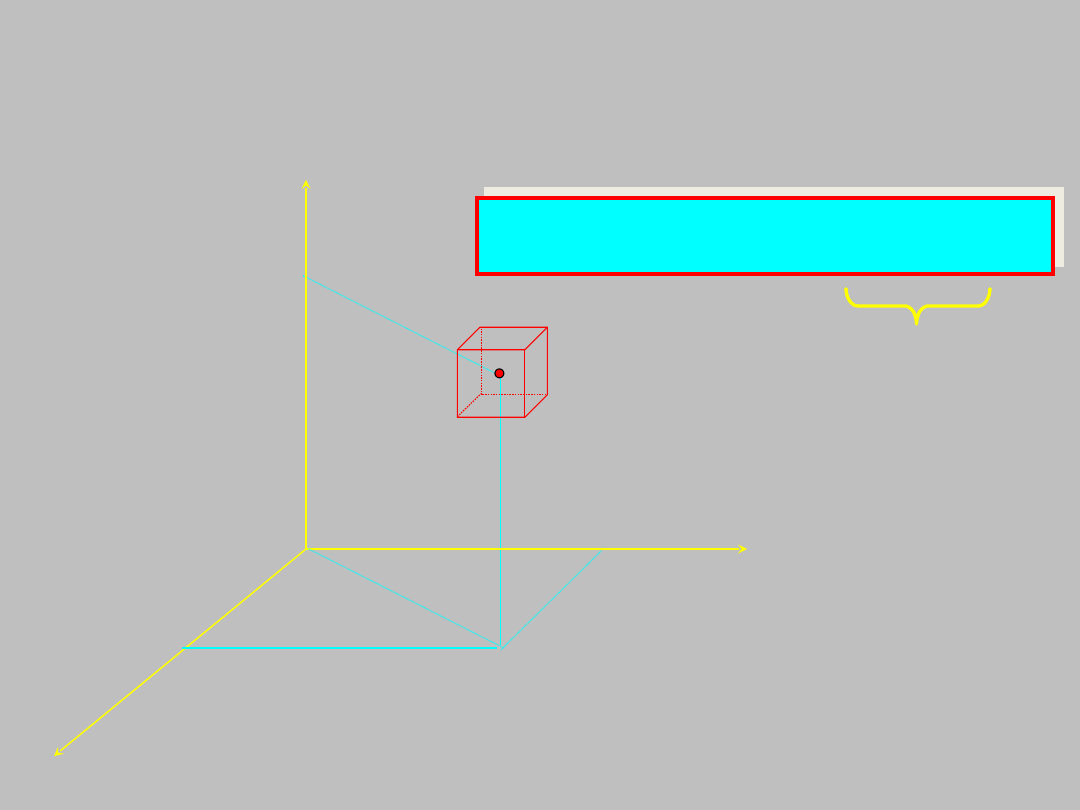
Prawdopodobieństwo P napotkania elektronu w
otoczeniu punktu (x
0
,y
0
,z
0
)
x
0
y
0
z
0
P ~ Y
2
(x
0
,y
0
,z
0
)DxDyDz
P ~ Y
2
(x
0
,y
0
,z
0
)DxDyDz
DV
9

Erwin Schrödinger
1887-1961
Erwin Schrödinger
1887-1961
1926
Austria
10
Jak znaleźć funkcję falową elektronu
Y(x,y,z) w atomie wodoru?
Jeżeli umiemy napisać wyrażenie
na całkowitą energię elektronu E
c
w atomie wodoru, to można
zbudować równanie różniczkowe,
którego
rozwiązaniem
jest
poszukiwana
funkcja
falowa
Y(x,y,z).
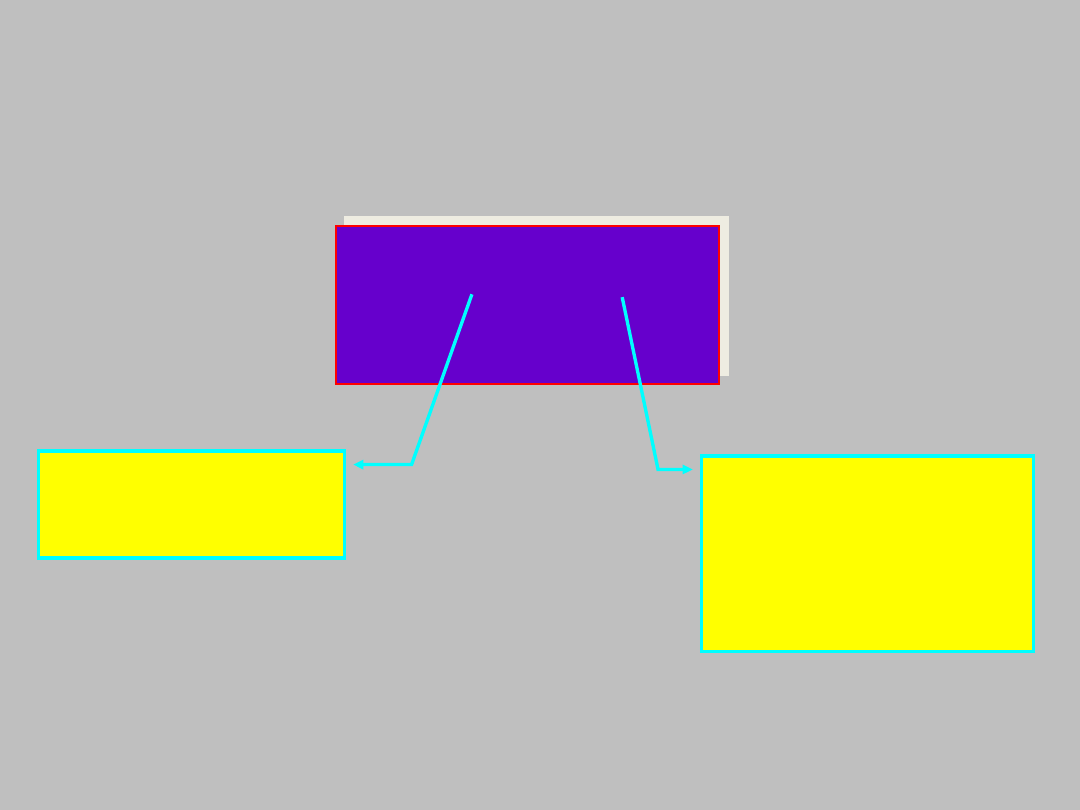
E
c
= E
kin
+
E
pot
E
c
= E
kin
+
E
pot
związana z ruchem
elektronu
związana z
oddziaływaniami
elektrostatycznymi i
magnetycznymi
11
ENERGIA CAŁKOWITA ELEKTRONU W
ATOMIE WODORU

Już w 1925 roku George
Uhlenbeck i Samuel
Goudsmit...
G. Uhlenbeck
G. Uhlenbeck
S. Goudsmit
S. Goudsmit
stwierdzili, że elektron posiada własne pole magnetyczne zachowując
się jak elementarny magnes i cechę tą nazwali
SPINEM
elektronu
...okazało się, że także proton i neutron posiadają spin,
zatem zachowują się jak elementarne magnesy...
12
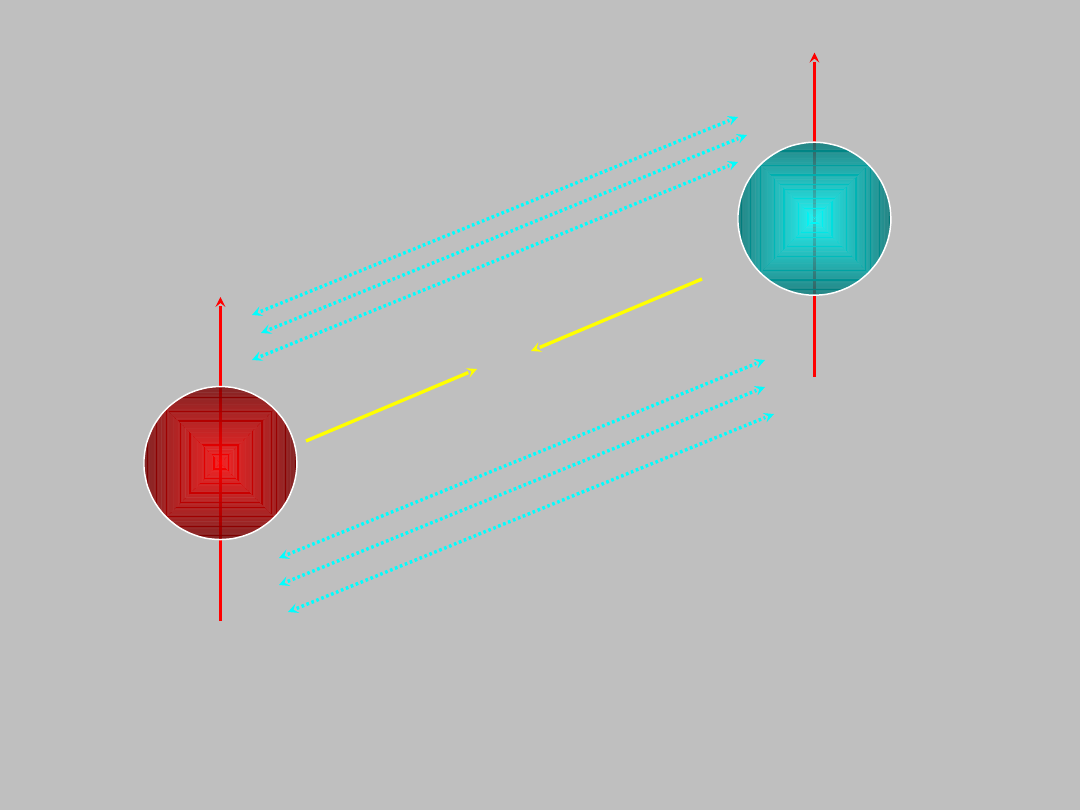
N
S
+
proton
N
S
-
odd
ział
ywa
nie
elek
tros
taty
czn
e
odd
ział
ywa
nie
ma
gne
tycz
ne
odd
ział
ywa
nie
ma
gne
tycz
ne
..z każdym z tych
oddziaływań wiąże się
wkład do energii atomu
....
elektron
13
energia potencjalna E
pot

H
^
HY(x,y,z) = E
c
·
Y(x,y,z)
^
-
operator Hamiltona (hamiltonian), którego postać
jest jednoznacznie określona przez wyrażenie na
energię całkowitą elektronu E
c
^
HY = E
c
·
Y
w
uproszczeniu:
14
RÓWNANIE SCHRÖDINGERA

15
RÓWNANIE SCHRÖDINGERA DLA ATOMU
WODORU
^
HY = E
c
·
Y
Rozwiązać powyższe równanie, to znaczy
znaleźć takie funkcje Y(x,y,z) i takie
wartości E
c
, dla których równanie to jest
spełnione

Przyjmijmy (zgodnie z prawdą), że rozwiązano
równanie Schrödingera, czyli znaleziono funkcję
Y(x,y,z) spełniającą to równanie, a wraz z nią
znaleziono wartości E
c
.
lub skrótowo:
16
Rozwiązania równania Schrödingera dla
atomu wodoru
Jakie cechy ma ta funkcja?
Funkcja ta zależy od czterech parametrów
liczbowych
n, l, m, s
co
zanotujemy jako:
Y
nlms
(x,y,z)
Y
nlms
Co to znaczy, że funkcja zależy od
parametrów?
weźmy przykład:
1
log(k)
n k
nk
n
y
z
f (x,y,z)
1 x
-
�
=
-
Przy ZADANYCH wartościach n i k ZMIENIAMY
wartości x, y i z
Aby funkcja f
nk
(x,y,z) miała sens:
n > 0 n > k
k > 0
zmienne
niezależne
parametry
17

Parametry n, l, m, s (LICZBY KWANTOWE) nie
mogą być dowolne jeżeli funkcja Y
nlms
ma mieć
sens
Parametry n, l, m, s (LICZBY KWANTOWE) nie
mogą być dowolne jeżeli funkcja Y
nlms
ma mieć
sens
n = 1, 2, 3......
n = 1, 2, 3......
główna liczba kwantowa
l = 0, 1, 2...... (n-1)
l = 0, 1, 2...... (n-1)
orbitalna liczba kwantowa
-l m l
-l m l
magnetyczna liczba kwantowa
s = ±
1/2
spinowa liczba kwantowa
18
Parametry n, l, m,s w funkcji falowej dla
atomu wodoru
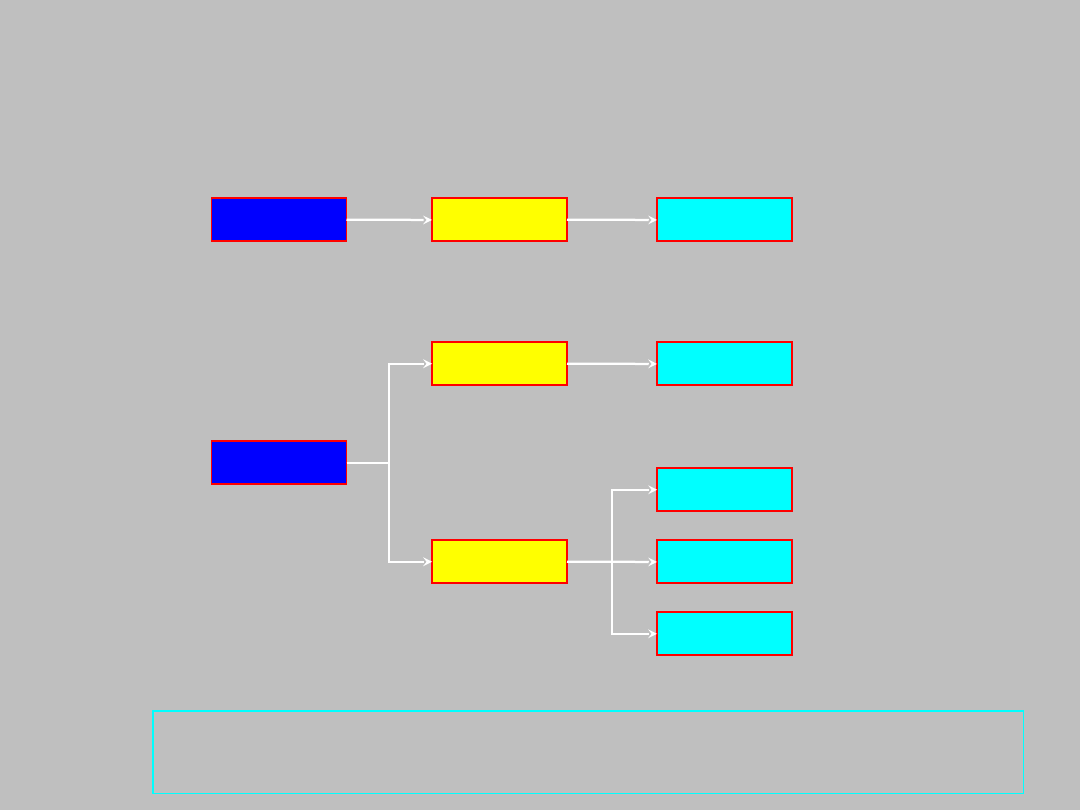
Zatem przykładowe dozwolone zestawy liczb
kwantowych kształtują się następująco:
n = 1
l = 0
m = 0
n = 2
l = 0
l = 1
m = 0
m = -1
m = 0
m = 1
dla każdego zestawu n, l, m liczba s może przyjąć dwie
wartości: ±1/2
19

Nowa notacja i nazewnictwo
Funkcję falową Y
nlm
opisującą rozkład prawdopodobieństwa
napotkania elektronu w jakimkolwiek atomie nazywamy:
ORBITALEM ATOMOWYM
nowa notacja:
Y
nlm
h nl
ind
n - główna liczba kwantowa podana cyfrą arabską
l - orbitalna liczba kwantowa oznaczona literą wg klucza: 0 - s, 1 - p, 2
- d, 3 - f
ind - indeks związany z wartością magnetycznej liczby kwantowej m,
dodawany tylko wtedy, gdy jest to konieczne
20
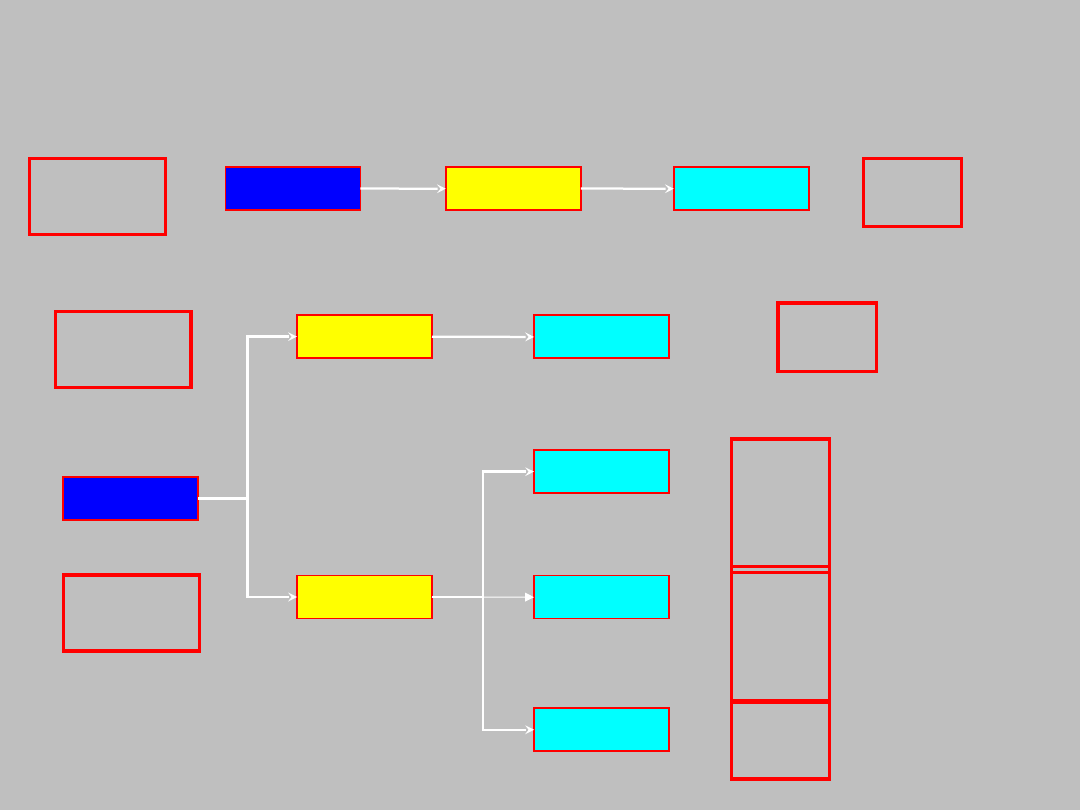
Nowa notacja orbitali:
n = 1
l = 0
m = 0
n = 2
l = 0
l = 1
m = 0
m = -1
m = 0
m = 1
Y
100
1s
Y
200
2s
Y
210
2p
x
2p
y
2p
z
21

n = 3
l = 0
m = 0
l = 1
m = -1
m = 0
m = 1
Y
300
3s
Y
31m
l = 2
m = -2
m = -1
m = 0
m = 1
m = 2
2
2
2
xy
xz
yz
z
x y
3d
3d
3d
3d
3d
-
3p
x
3p
y
3p
z
Y
32m
22
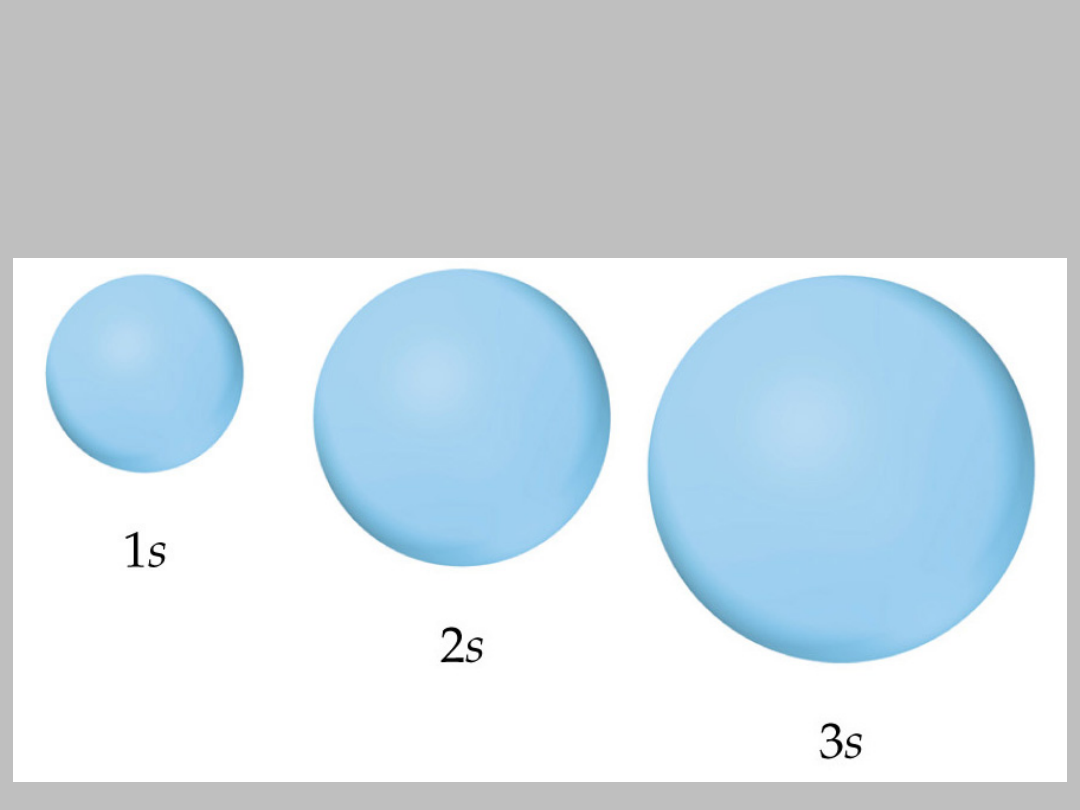
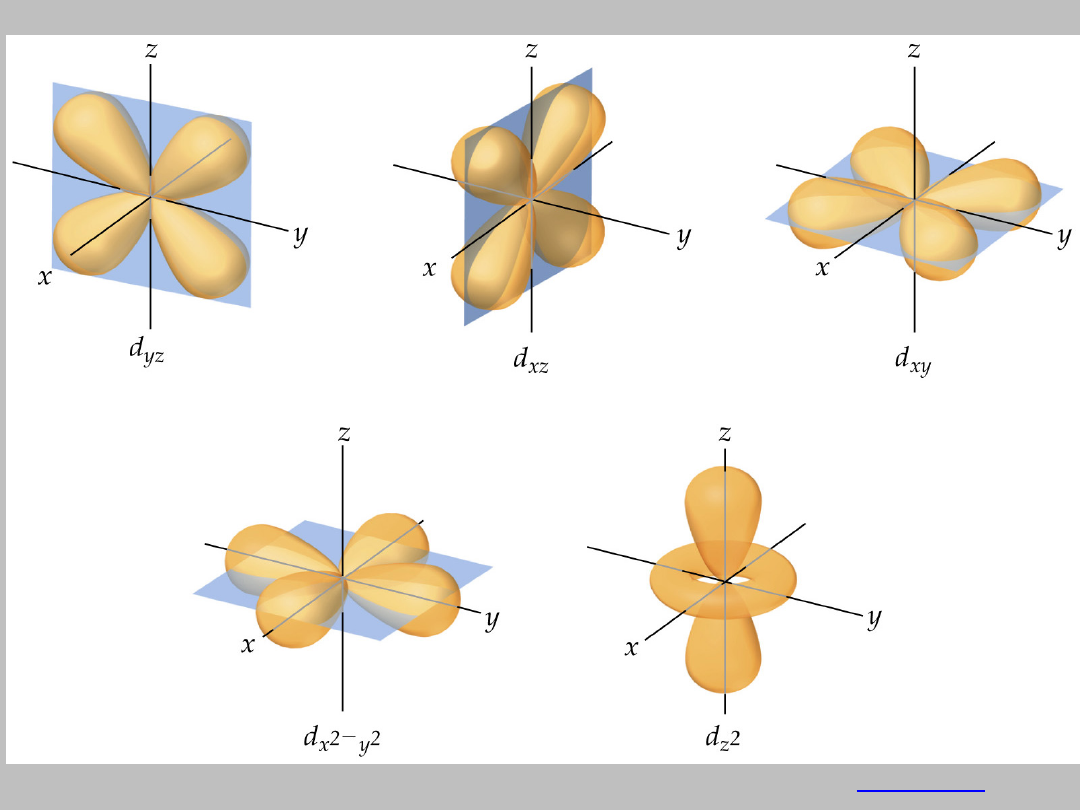
orbitale typu s
Reprezentacja geometryczna orbitali

Orbitale typu p
Reprezentacja orbitali

Jak zmienia się energia E
c
orbitalu Y
nlms
w zależności od
wartości liczb kwantowych
n,l,m,s?
H
H
Y = E
c
·
Y
^

1 2 3 4 5 6
7
s s s s s s
s
p p p p p
p
d d d
d
f f
główna liczba kwantowa
n
o
rb
it
a
ln
a
l
ic
z
b
a
k
w
a
n
to
w
a
l
..można też przedstawić to inaczej..
Kolejność energetyczna orbitali atomowych
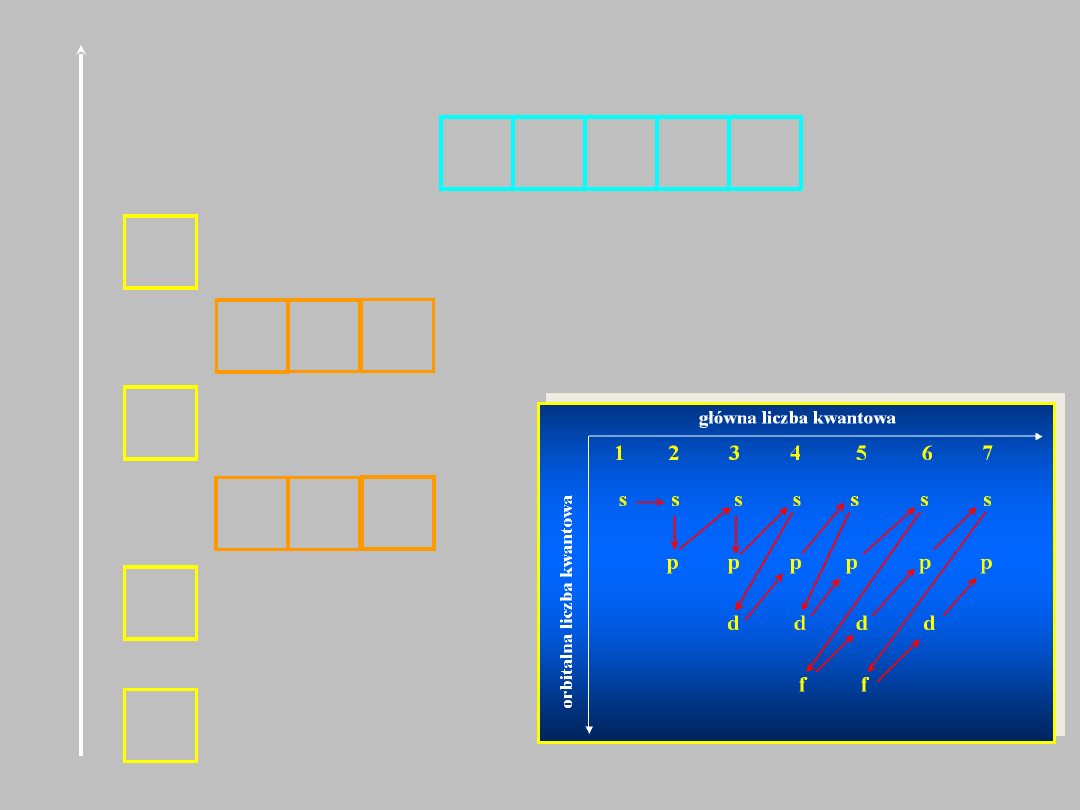
E
1s
2s
2p
3s
3p
4s
3d
zapis
„klatkowy”

Jesteśmy przygotowani do przedstawienia
struktury elektronowej atomów....
..wystarczy wiedzieć, że:
Liczba elektronów w obojętnym atomie jest równa jego liczbie
atomowej
Elektrony w atomie w stanie podstawowym „starają się”
przyjmować jak najniższe energie
Każdy orbital atomowy opisuje zachowanie dwóch elektronów
różniących się spinową liczbą kwantową (zakaz Pauliego)
Jeżeli elektrony opisywane są różnymi orbitalami o tej samej energii
to zajmują je tak aby liczba niesparowanych spinów była jak
największa
(reguła Hunda)

E
n
e
rg
ia
1s
2s
2p
3s
3p
4s
3d
konfiguracja
elektronowa atomu:
wodoru
(Z=1)
H: 1s
1
E
1s
2s
2p
3s
3p
4s
3d
konfiguracja
elektronowa atomu:
He: 1s
2
helu (Z=2)
E
1s
2s
2p
3s
3p
4s
3d
konfiguracja
elektronowa atomu:
Li: 1s
2
2s
1
litu (Z=3)
Li: He2s
1
E
1s
2s
2p
3s
3p
4s
3d
konfiguracja
elektronowa atomu:
Be: 1s
2
2s
2
berylu
(Z=4)
Be: He2s
2
E
1s
2s
2p
3s
3p
4s
3d
konfiguracja
elektronowa atomu:
B:
1s
2
2s
2
2p
1
boru (Z=5)
B: He2s
2
2p
1
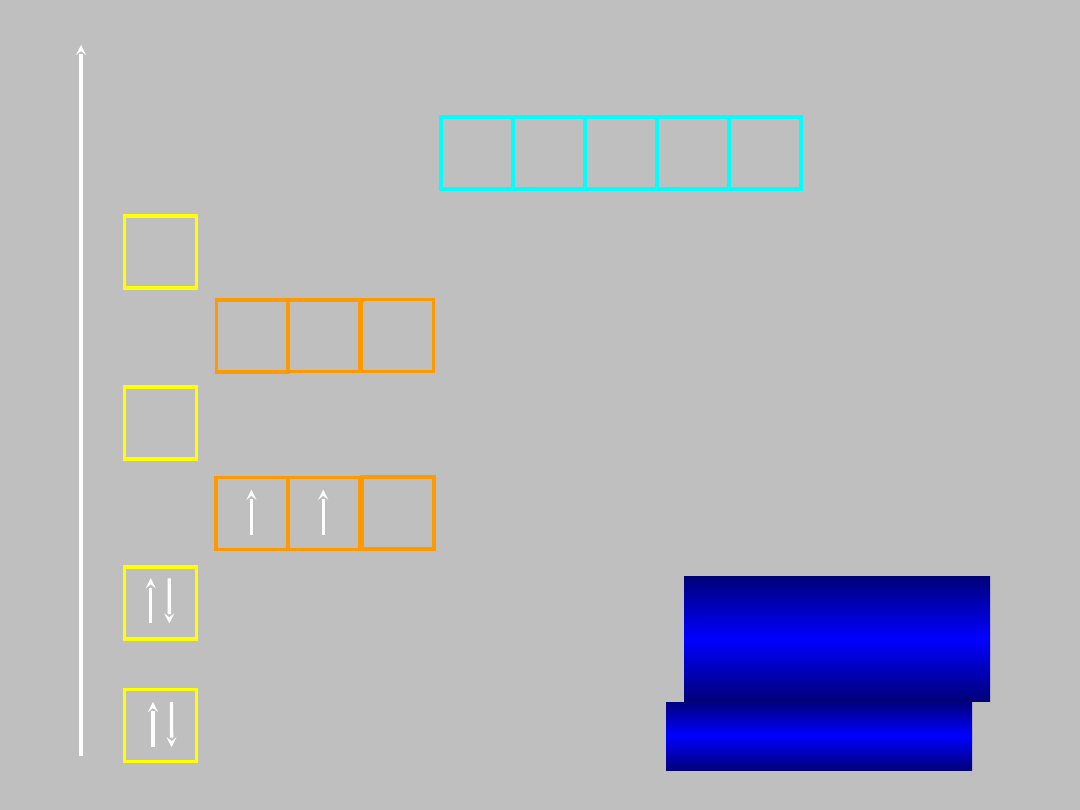
E
1s
2s
2p
3s
3p
4s
3d
konfiguracja
elektronowa atomu:
C:
1s
2
2s
2
2p
2
węgla (Z=6)
C: He2s
2
2p
2
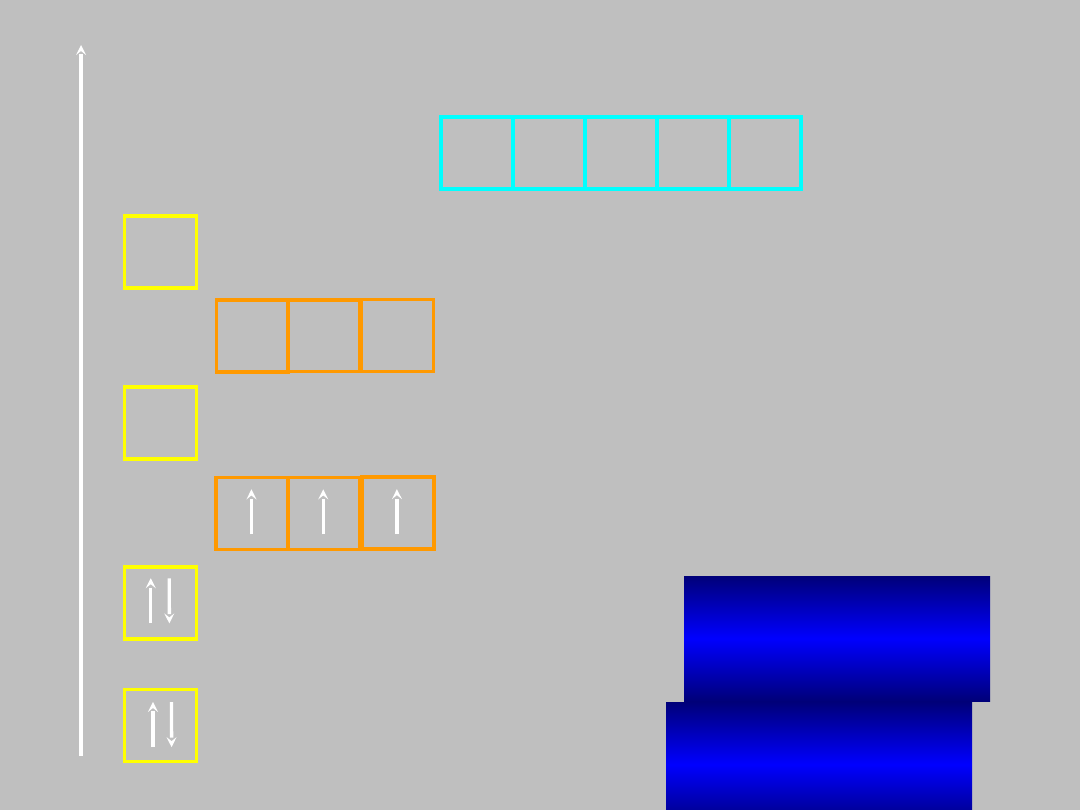
E
1s
2s
2p
3s
3p
4s
3d
konfiguracja
elektronowa atomu:
N:
1s
2
2s
2
2p
3
azotu (Z=7)
N:
He2s
2
2p
3
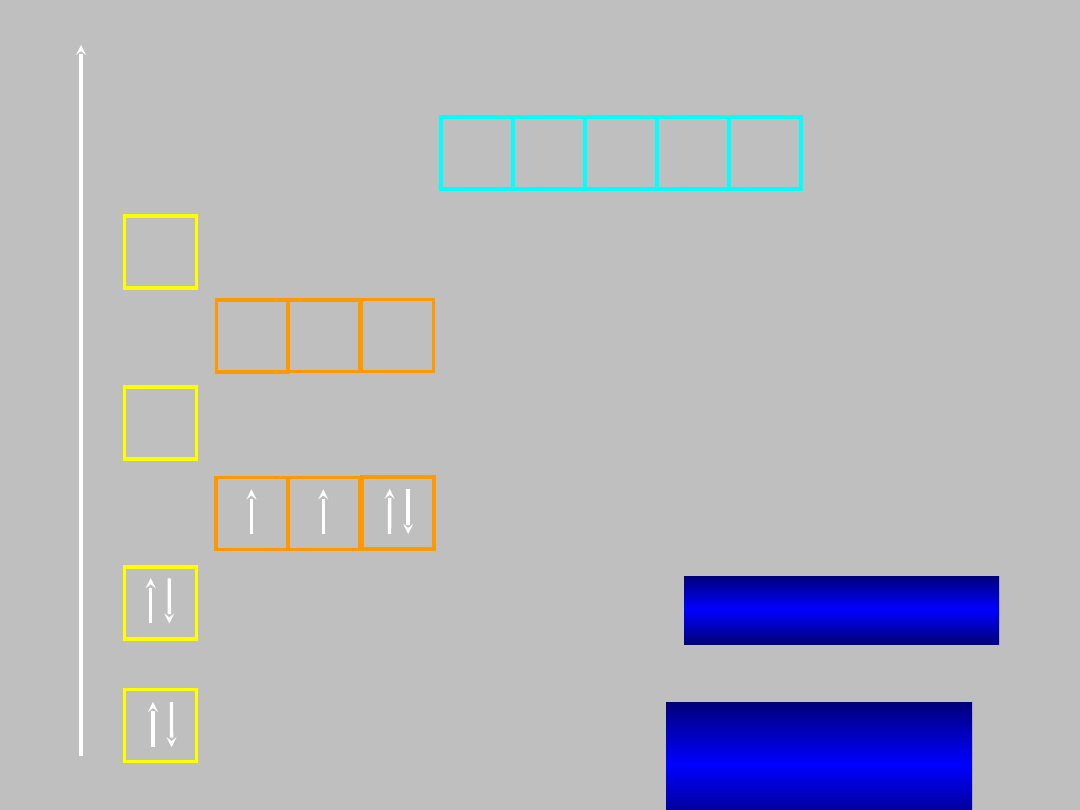
E
1s
2s
2p
3s
3p
4s
3d
konfiguracja
elektronowa atomu:
O: 1s
2
2s
2
2p
4
tlenu (Z=8)
O:
He2s
2
2p
4
Należy pamiętać, że istnieje szereg wyjątków
od przedstawionego schematu zapełniania
poziomów energetycznych przez elektrony w
atomach
przykładowo dla pierwiastków 4 okresu
:
K: Ar4s
1
Ca: Ar4s
2
Sc: Ar4s
2
3d
1
Ti: Ar4s
2
3d
2
V: Ar4s
2
3d
3
Cr: Ar4s
1
3d
5
Mn: Ar4s
2
3d
5
Fe: Ar4s
2
3d
6
Co: Ar4s
2
3d
7
Ni: Ar4s
2
3d
8
Cu: Ar4s
1
3d
10
Zn: Ar4s
2
3d
10
Im wyższa jest energia elektronów, tym bardziej
maksimum prawdopodobieństwa ich napotkania
oddala się od jądra
pozwala to podzielić elektrony w atomie na dwie grupy:
rdzeń
atomowy
rdzeń
atomowy
elektrony
walencyjne
elektrony
walencyjne
Na: 1s
2
2s
2
2p
6
3s
1
przykład:
Analizując konfiguracje elektronowe POWŁOK WALENCYJNYCH
atomów, łatwo zauważyć, że konfiguracje te powtarzają się co
2, 8, 18 lub 32 pierwiastki
Analizując konfiguracje elektronowe POWŁOK WALENCYJNYCH
atomów, łatwo zauważyć, że konfiguracje te powtarzają się co
2, 8, 18 lub 32 pierwiastki
ns
1
1
H
3
Li
11
Na
19
K
37
Rb
55
Cs
87
Fr
1s
1
He2s
1
Ne3s
1
Ar4s
1
Kr5s
1
Xe6s
1
Rn7s
1
2
8
8
1
8
1
8
3
2

Możemy zatem ułożyć tablicę
pierwiastków, kierując się następującymi
zasadami:
Ustawiamy pierwiastki w ciąg
rosnących liczb atomowych
Ciąg ten „zawijamy” tak, aby pierwiastki o
podobnych konfiguracjach elektronowych
powłoki walencyjnej znalazły się w tych
samych kolumnach
...wynik jest następujący....
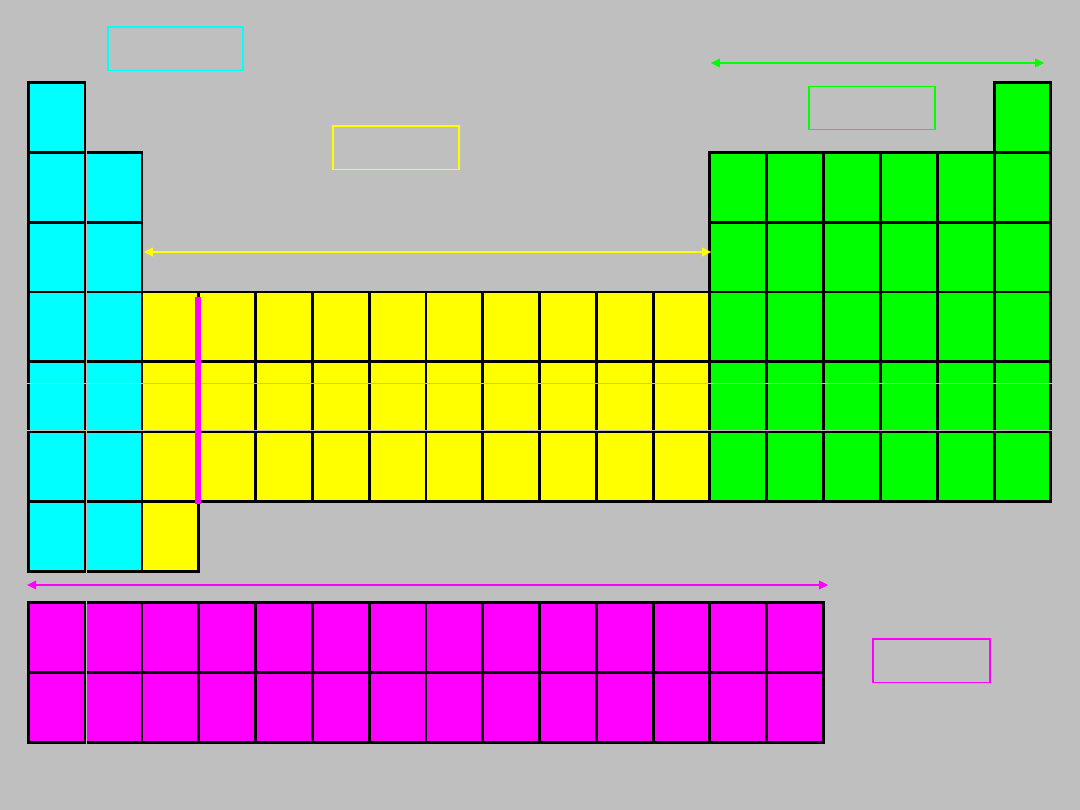
1
2
H
He
3
4
5
6
7
8
9
10
Li
Be
B
C
N
O
F
Ne
11
12
13
14
15
16
17
18
Na Mg
Al
Si
P
S
Cl Ar
19
20
21
22
23
24
25
26
27
28
29
30
31
32
33
34
35
36
K
Ca Sc
Ti
V
Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr
37
38
39
40
41
42
43
44
45
46
47
48
49
50
51
52
53
54
Rb Sr
Y
Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te
I
Xe
55
56
57
72
73
74
75
76
77
78
79
80
81
82
83
84
85
86
Cs Ba La Hf Ta W Re Os Ir
Pt Au Hg Tl
Pb Bi
Po At Rn
87
88
89
Fr Ra Ac
58
59
60
61
62
63
64
65
66
67
68
69
70
71
Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu
90
91
92
93
94
95
96
97
98
99
100
101
102
103
Th Pa
U
Np Pu Am Cm Bk Cf
Es Fm Md No Lr
ns
1
ns
2
ns
2(1)
(n-1)d
x
ns
2
p
y
ns
2
(n-1)d
0(1)
(n-2)f
z
blok s
blok d
blok p
blok f
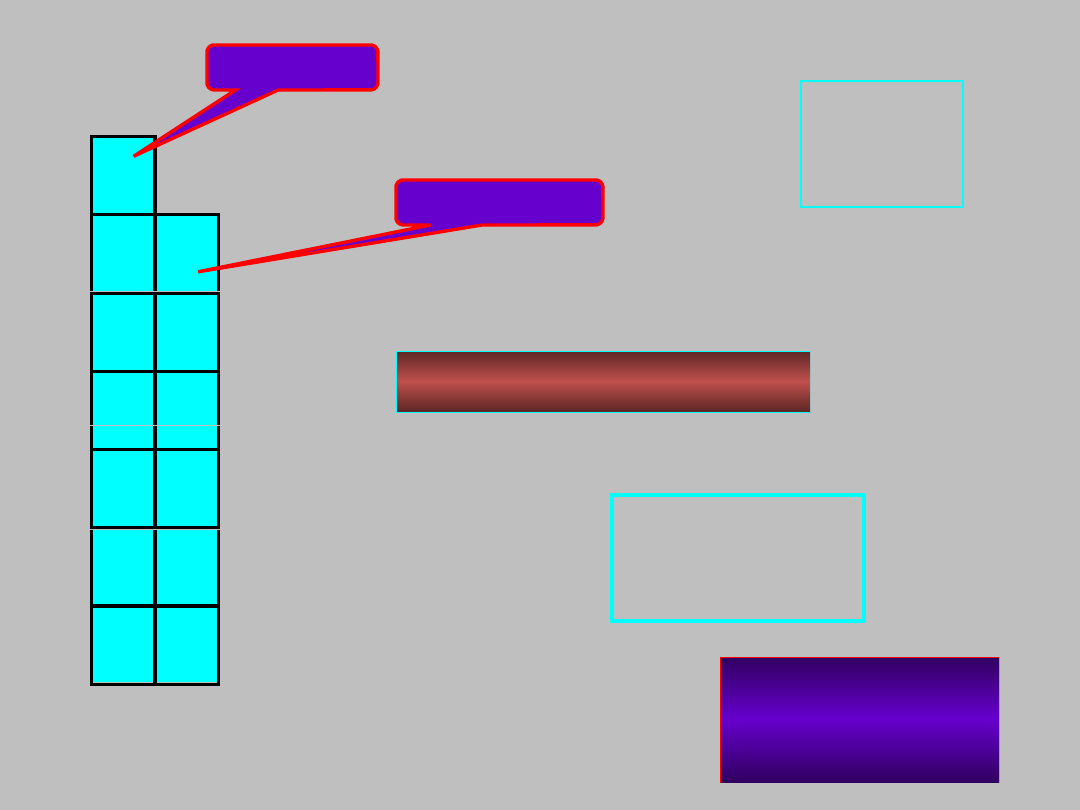
1
H
3
4
Li
Be
11
12
Na Mg
19
20
K
Ca
37
38
Rb Sr
55
56
Cs Ba
87
88
Fr Ra
blok
s
ns
1
ns
2
n = 1 do
7
13 pierwiastków
1
2
3
4
5
6
7
litowce
berylowce
grupy 1 i
2
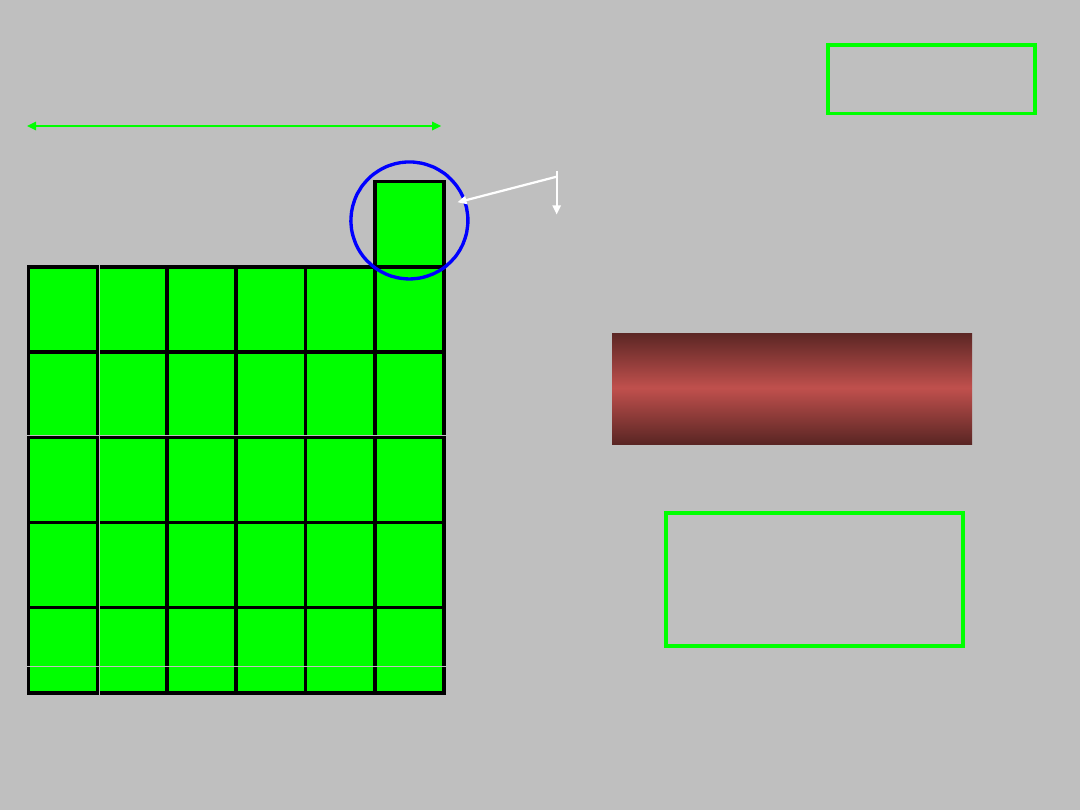
2
He
5
6
7
8
9
10
B
C
N
O
F
Ne
13
14
15
16
17
18
Al
Si
P
S
Cl Ar
31
32
33
34
35
36
Ga Ge As Se Br Kr
49
50
51
52
53
54
In Sn Sb Te
I
Xe
81
82
83
84
85
86
Tl
Pb Bi
Po At Rn
blok p
ns
2
p
y
30+1
pierwiastków
n = 2 do 6
y = 1 do 6
wyjątek 1s
2
2
3
4
5
6
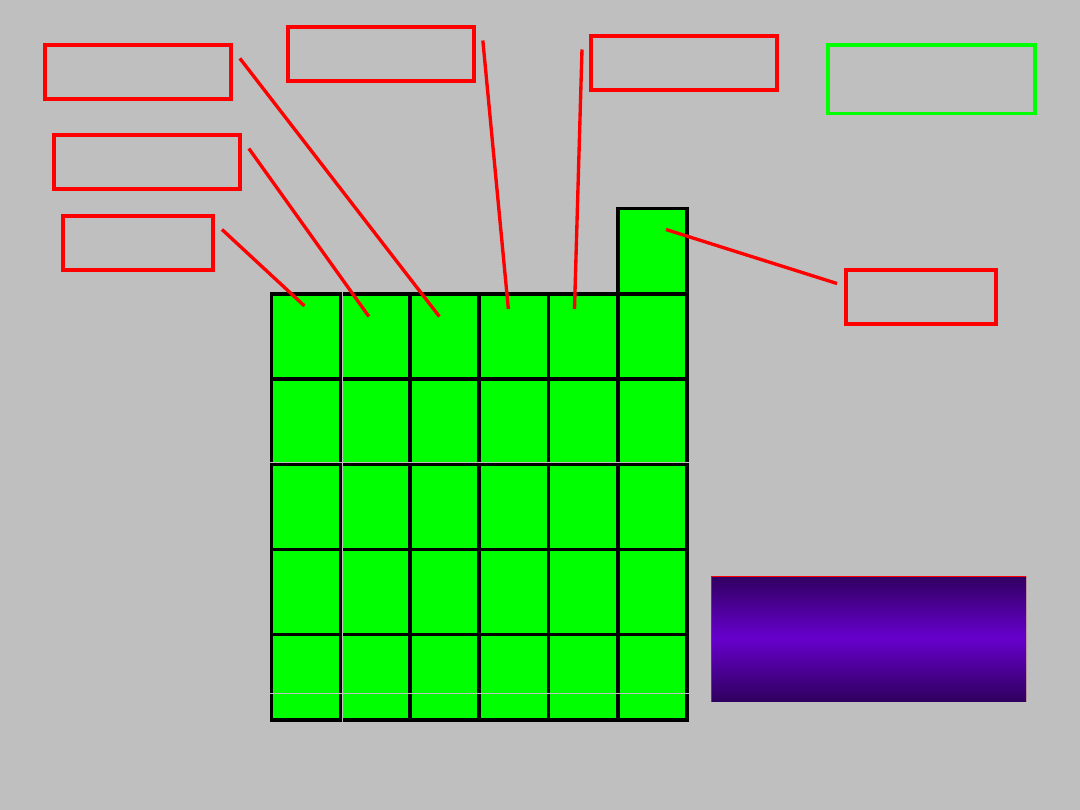
2
He
5
6
7
8
9
10
B
C
N
O
F
Ne
13
14
15
16
17
18
Al
Si
P
S
Cl Ar
31
32
33
34
35
36
Ga Ge As Se Br Kr
49
50
51
52
53
54
In Sn Sb Te
I
Xe
81
82
83
84
85
86
Tl
Pb Bi
Po At Rn
blok p
borowce
węglowce
azotowce
tlenowce
fluorowce
helowce
grupy 13-
18

21
22
23
24
25
26
27
28
29
30
Sc
Ti
V
Cr Mn Fe Co Ni Cu Zn
39
40
41
42
43
44
45
46
47
48
Y
Zr Nb Mo Tc Ru Rh Pd Ag Cd
57
72
73
74
75
76
77
78
79
80
La Hf Ta W Re Os
Ir
Pt Au Hg
89
Ac
ns
2(1)
(n-
1)d
x
blok d
31+?
pierwiastków
n = 4 do 7
x = 1 do 10
....... są już dalsze...
grupy 3-
12
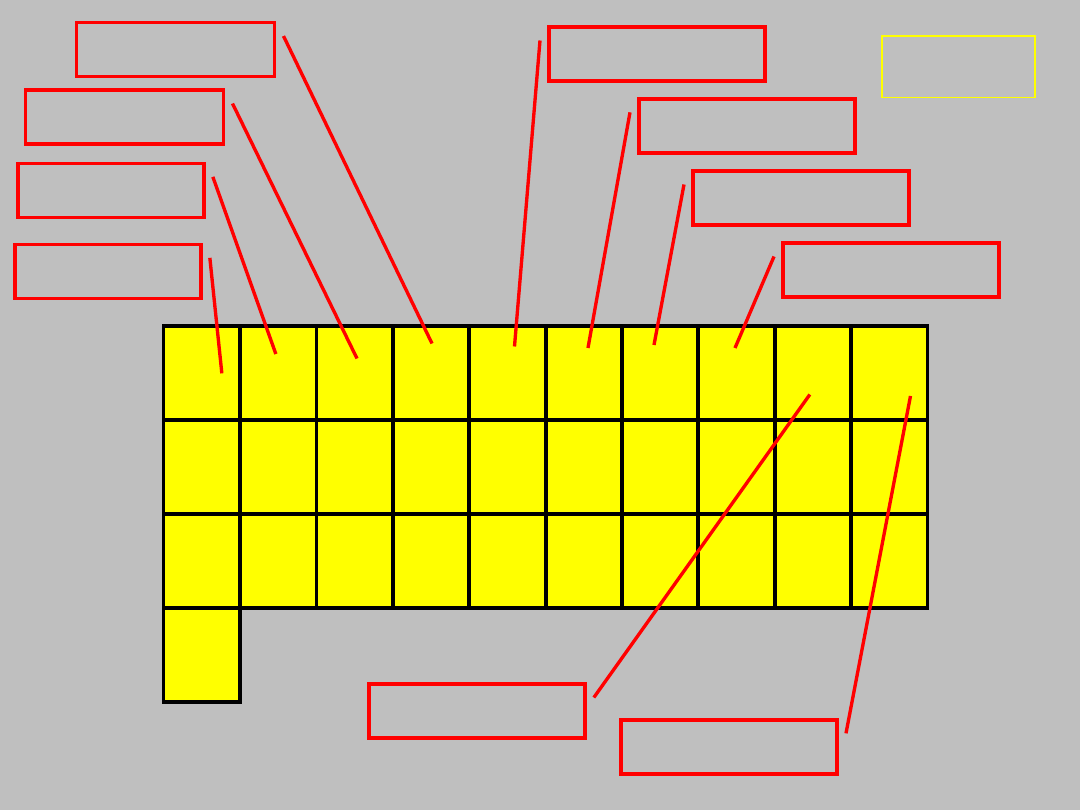
21
22
23
24
25
26
27
28
29
30
Sc
Ti
V
Cr Mn Fe Co Ni Cu Zn
39
40
41
42
43
44
45
46
47
48
Y
Zr Nb Mo Tc Ru Rh Pd Ag Cd
57
72
73
74
75
76
77
78
79
80
La Hf Ta W Re Os
Ir
Pt Au Hg
89
Ac
blok d
skandowce
tytanowce
wanadowce
chromowce
manganowce
żelazowce
kobaltowce
niklowce
miedziowce
cynkowce
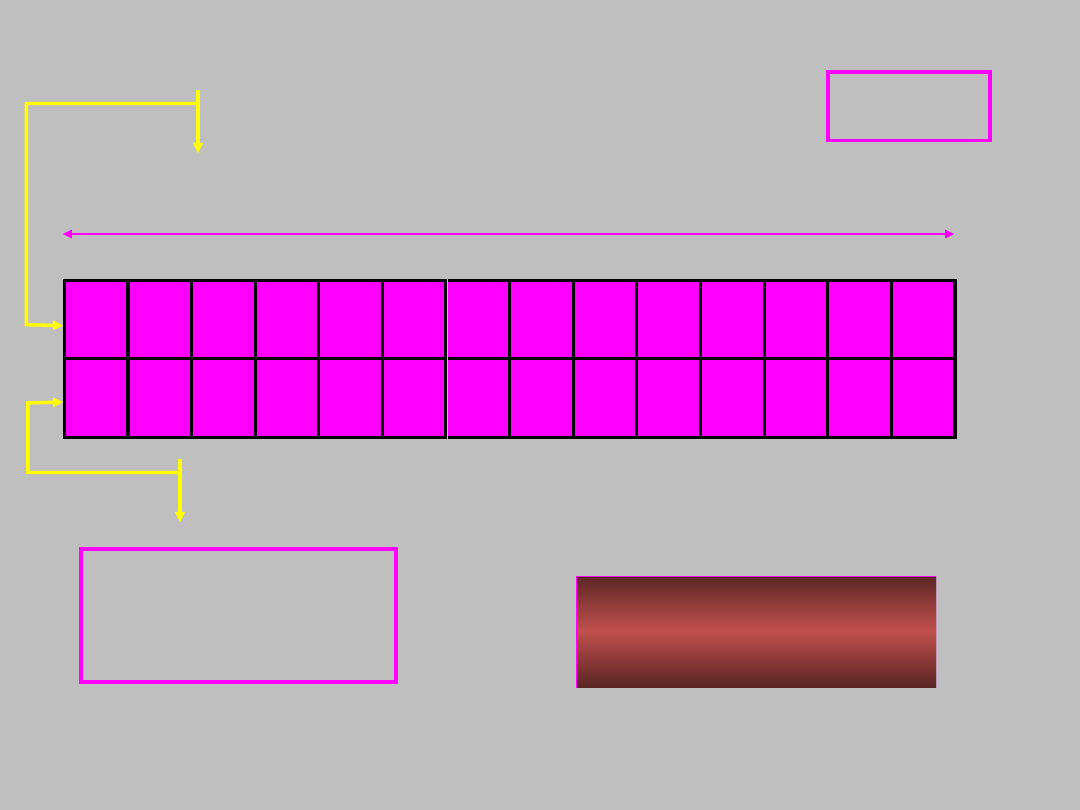
58
59
60
61
62
63
64
65
66
67
68
69
70
71
Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu
90
91
92
93
94
95
96
97
98
99
100
101
102
103
Th Pa
U
Np Pu Am Cm Bk Cf
Es Fm Md No Lr
blok f
ns
2
(n-1)d
0(1)
(n-2)f
z
6
7
n = 6 lub 7
z = 1 do 14
28
pierwiastków
aktynowce
lantanowce

Podsumowanie:
Współczesna teoria budowy atomu
wyjaśniła PRAWO OKRESOWOŚCI
UKŁAD OKRESOWY PIERWIASTKÓW jest
pochodną konfiguracji elektronowej
atomów
Dzisiaj NIC JUŻ NIE WYNIKA z układu okresowego - to
układ okresowy WYNIKA ze współczesnej teorii budowy
atomu

•promienie atomowe
•gęstości pierwiastków
•potencjału jonizacyjne
pierwiastków
przykładowo
omówimy:
Popatrzmy jak kształtują się wybrane
wielkości fizyczne w zależności od
położenia pierwiastka w układzie
okresowym i od jego liczby atomowej
Z
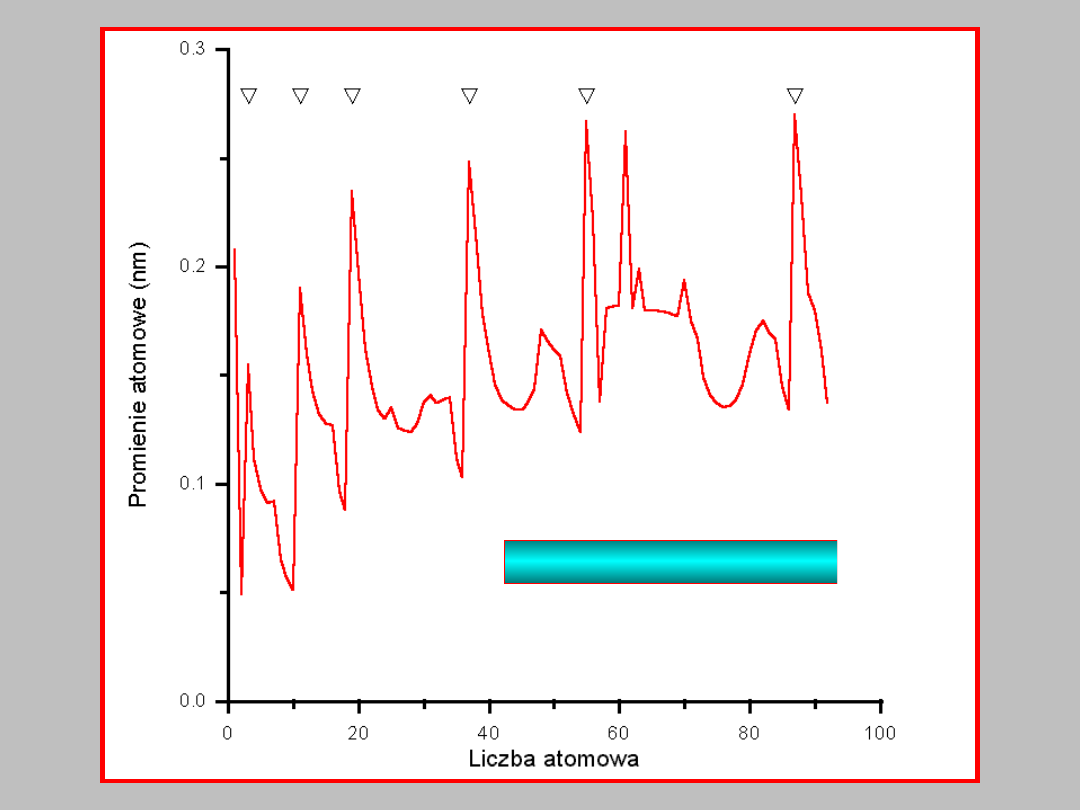
32
8
8
18
18
promienie atomowe
87
Fr
3
Li
11
N
a
19
K
37
Rb
55
Cs
Figure
7.6
PROMIENIE ATOMOWE
PROMIENIE ATOMOWE
10
-10
m

32
8
8
18
18
87
Fr
55
Cs
37
Rb
19
K
11
N
a
gęstość
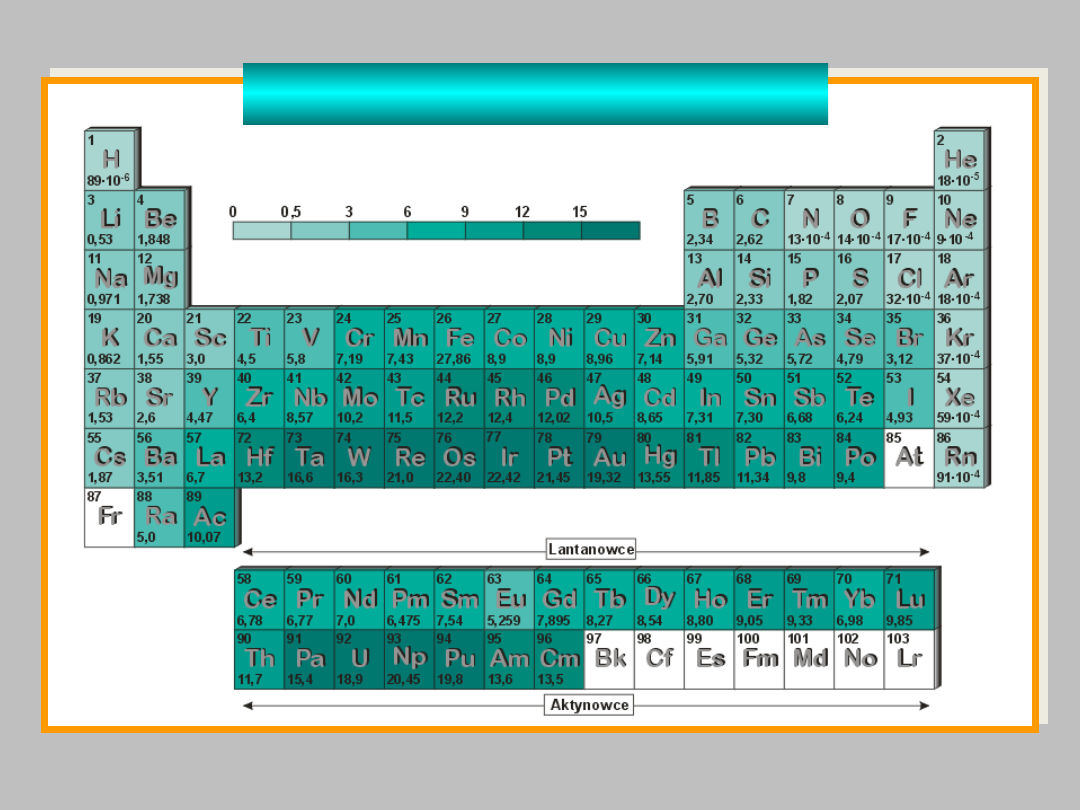
g/cm
3
GĘSTOŚĆ PIERWIASTKÓW
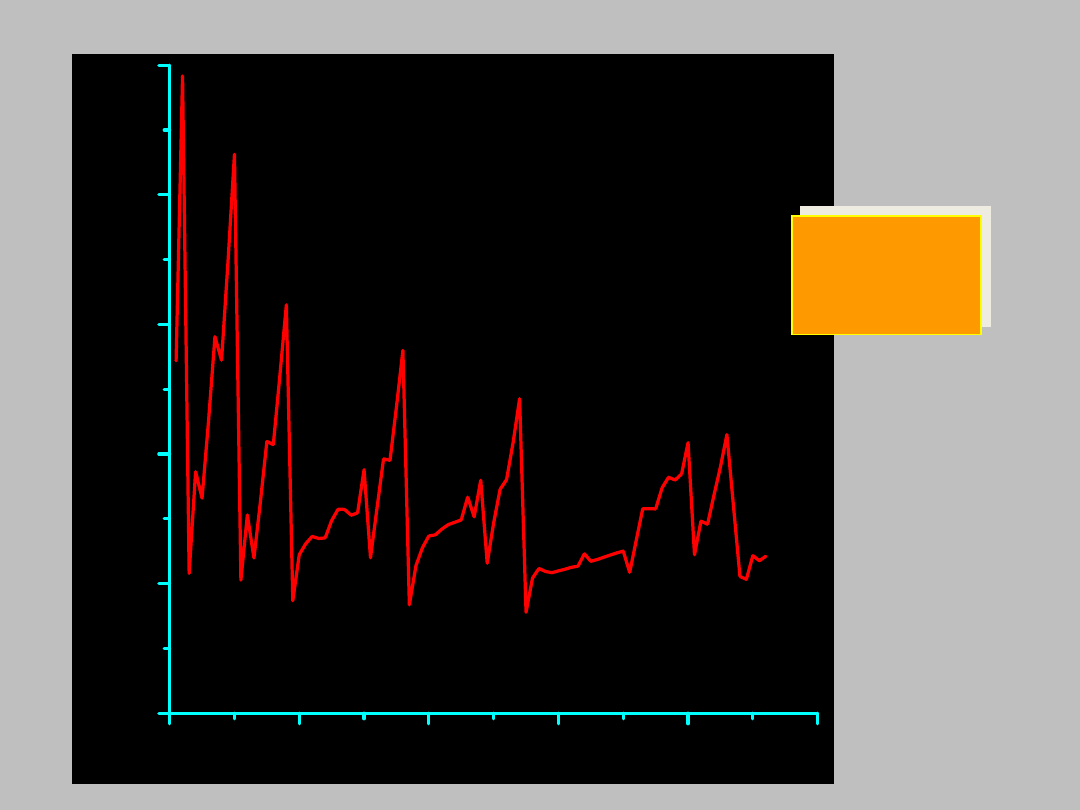
0
2 0
4 0
6 0
8 0
1 0 0
L ic z b a a to m o w a
0
5
1 0
1 5
2 0
2 5
P
ot
en
cj
ał
y
jo
ni
za
cj
i a
to
m
ów
(
V
)
N e
H e
A r
K r
X e
R n
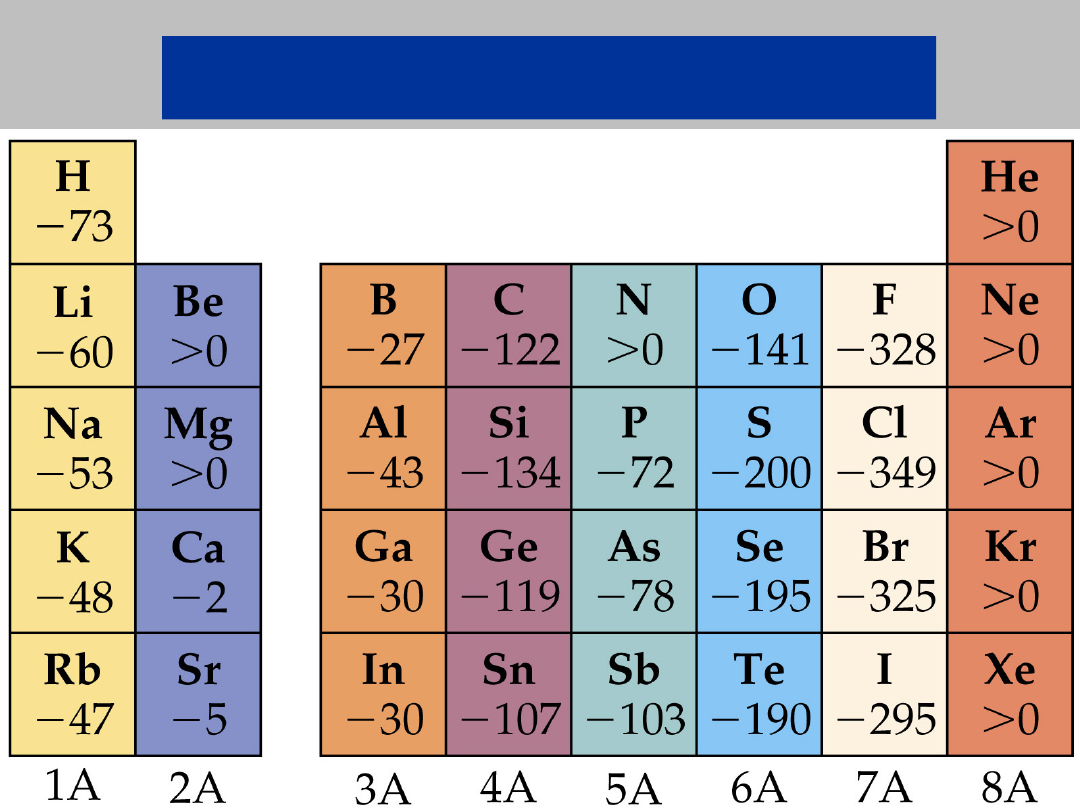
POTENCJAŁY JONIZACJI I
W =
q
e
·I
W =
q
e
·I
praca W potrzebna do usunięcia elektronu z atomu
Elektroujemność
• Elektroujemność
jest przeciwna do energii
jonizacji
• Elektroujemność
: zmiana energii gdy atom
przyłącza elektron tworząc jon:
Cl(g) + e
-
Cl
-
(g)
• Elektroujemność
może być egzo- lub
endoenergetyczna:
Ar(g) + e
-
Ar
-
(g)
Elektroujemność

Właściwości metali
alkalicznych
Grupa 1: Metale alkaliczne

Group Trends for the Active
Metals
Grupa 2: Metale ziem alkalicznych
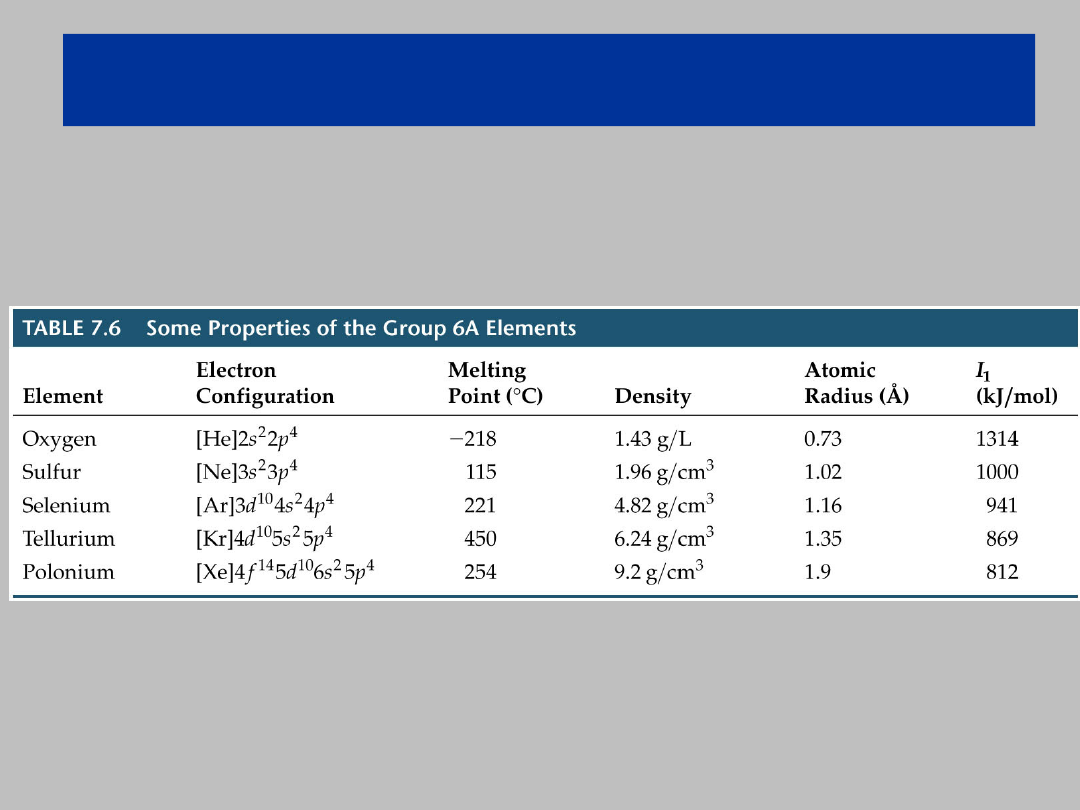
Właściwości wybranych
niemetali
Grupa 16: Tlenowce
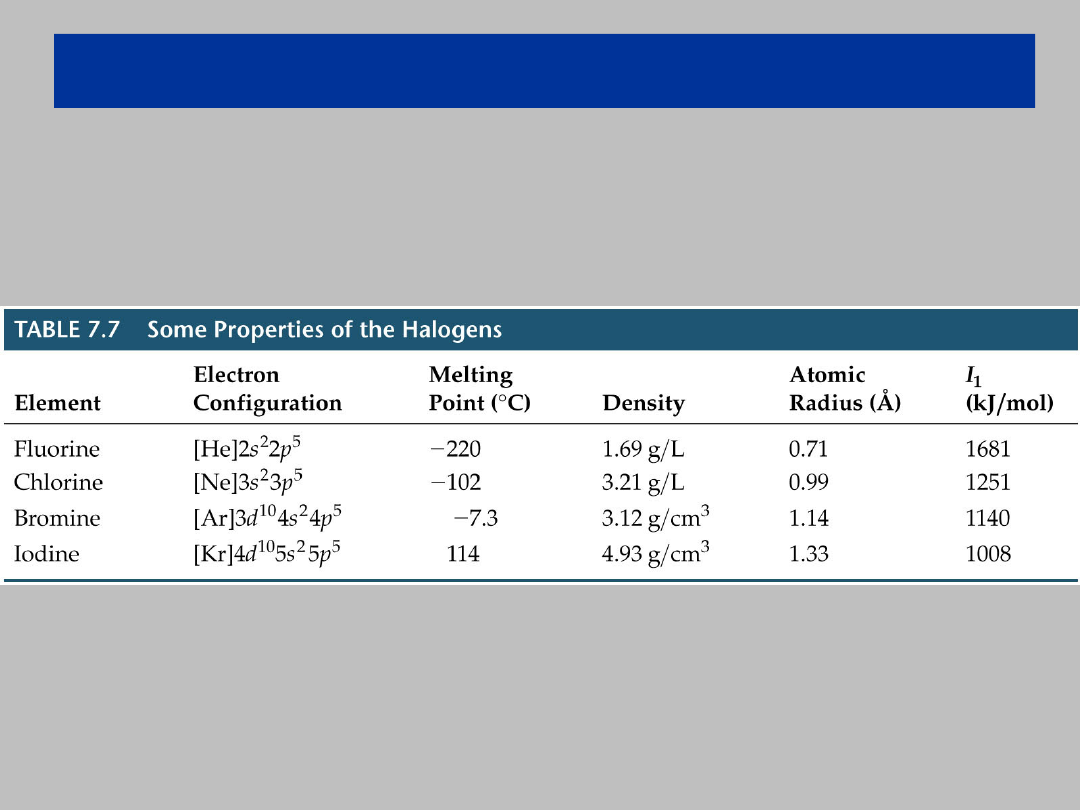
Właściwości niemetali
Grupa 17: Halogenki

Właściwości metali
alkalicznych
Grup 1A: Metale alkaliczne
• Wszystkie metale alkaliczne są miękkie.
• Chemia jest zdeterminowana przez utratę
elektronu s:
M M
+
+ e
-
• Reaktywność wzrasta gdy przesuwamy się w
dół grupy.
• Metale alkaliczne reagują z wodą tworząc
wodorotlenek MOH i gazowy wodór:
2M(s) + 2H
2
O(l) 2MOH(aq) + H
2
(g)
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 50
- Slide 51
- Slide 52
- Slide 53
- Slide 54
- Slide 55
- Slide 56
- Slide 57
- Slide 58
- Slide 59
- Slide 60
- Slide 61
- Slide 62
- Slide 63
Wyszukiwarka
Podobne podstrony:
podstawy chemii kwantowej id 36 Nieznany
podstawy chemii kwantowej
Podstawowe idee nieempirycznych metod obliczeniowych chemii kwantowej
Podstawowe idee nieempirycznych metod obliczeniowych chemii kwantowej
Podstawowe idee nieempirycznych metod obliczeniowych chemii kwantowej
Podstawy i metody chemii kwantowej wyklady NALEWAJSKI
zestaw51 04, WIiTCH, semestr I, podstawy chemii, zestawy obliczenia chemiczne
(), podstawy chemii fizycznej Ć , przemiany gazowe przykładowe zadaniaid 736
aminy otrzymywanie, podstawy chemii organicznej
lista7, 1. PODSTAWY CHEMII, Konwersatorium, Listy zadań z konwerek
podstawy chemii wyklad05
11 Podstawy chemii organicznej Profesor Boduszek
podstawy chemii ogolnej temat 5
Zadania z chemii kwantowej 2 kolo, Chemia kosmetyczna
Podstawy chemii analitycznej La Nieznany
więcej podobnych podstron