
FIZYKA CZĄSTECZKOWA I TERMODYNAMIKA
Fizyka
‐
cząsteczkowa
Dział fizyki badający budowę i własności materii przy założeniu, że
każde ciało składa się z dużej liczby bardzo małych cząsteczek. Czą‐
steczki te znajdują się w ciągłym chaotycznym ruchu, którego inten‐
sywność zależy od temperatury.
Termodynamika
‐
Bada jedynie makroskopowe własności ciał oraz makroskopowe zja‐
wiska, nie interesuje się ich obrazem mikroskopowym. Podstawą
termodynamiki są zasady termodynamiki.
Wielkości stosowane do opisu atomów i cząsteczek
(Względna) Masa ‐
atomowa,
r
A
Stosunek masy atomu danego pierwiastka do 1/12 masy atomu
12
C.
(Względna) Masa ‐
cząsteczkowa,
r
M
Stosunek masy cząsteczki danej substancji do 1/12 masy atomu
12
C.
Fizyka cząsteczkowa i termodynamika 1

Wielkości stosowane do opisu atomów i cząsteczek, cd.
Atomowa
‐
jednostka masy,
j
m
Jednostka masy równa 1/12 masy atomu
12
C.
27
1,66 10
kg 1D
j
m
−
=
⋅
=
(dalton)
1D
≈ masa atomu wodoru.
Mol
‐ Ilość substancji zawierająca taką samą liczbę cząstek co 0,012 kg izo‐
topu
12
C. Wielokrotności i podwielokrotności: kilomol (kmol), mili‐
mol (mmol), mikromol (μmol).
Liczba
‐
Avogadra,
A
N
‐
Liczba cząstek w molu substancji.
23
1
6,022 10 mol
A
N
−
=
⋅
Masa molowa,
μ
‐ Masa mola substancji.
A
r
j
N A m
μ
=
A
r
j
N M m
μ
=
Fizyka cząsteczkowa i termodynamika 2

Stan układu
Układ
‐ Zbiór rozważanych ciał.
Stan równowagi
‐
Termodynamicznej
(stan równowagowy)
Stan, w którym układ może znajdować się dowolnie długo. W
tym stanie wszystkie parametry stanu mają określone wartości
i nie zmieniają się.
Parametry stanu
‐ Parametry fizyczne jednoznacznie określające stan równowagi
termodynamicznej.
Stan
‐
nierównowagowy
Stan, w którym niektóre parametry stanu nie mają określonej
wartości.
Jeżeli na osiach układu współrzędnych odkładamy wartości pewnych dwóch parametrów, to
każdy stan równowagi układu jest reprezentowany na wykresie przez punkt.
Fizyka cząsteczkowa i termodynamika 3

Przemiana
Przemiana
‐
(proces)
Przejście układu z jednego stanu do drugiego (na ogół przez
ciąg stanów nierównowagowych).
Przemiana
‐
równowagowa
(kwazistatyczna,
odwracalna)
Przemiana składająca się z ciągłego zbioru kolejnych stanów
równowagi. Rzeczywiste przemiany mogą być uważane za
równowagowe, o ile zachodzą odpowiednio powoli.
Wszystkie ilościowe rozważania termodynamiki dotyczą stanów równowagi i procesów od‐
wracalnych.
Fizyka cząsteczkowa i termodynamika 4

Energia wewnętrzna układu
Energia
‐
wewnętrzna
ciała
Całkowita energia tego ciała z wyłączeniem jego energii kinetycznej
jako całości oraz energii potencjalnej w zewnętrznych polach.
Stanowi sumę energii oddziaływań międzycząsteczkowych i we‐
wnątrzcząsteczkowych układu oraz energii ruchu cieplnego cząste‐
czek.
Energia wewnętrzna układu ciał jest równa sumie energii wewnętrznych każdego z tych ciał
oraz energii oddziaływania między elementami układu. Energia wewnętrzna jest funkcją sta‐
nu układu.
Funkcja stanu ‐
układu
Za każdym razem, gdy układ jest w danym stanie, funkcja stanu ma
tę samą wartość, niezależnie od historii układu.
Energię wewnętrzną oznaczamy literą .
U
Fizyka cząsteczkowa i termodynamika 5
Zmiany energii wewnętrznej
Energia wewnętrzna może się zmieniać w wyniku dwóch procesów:
‐ wykonywania pracy
przez układ nad ciałami zewnętrznymi,
W
‐ dostarczania do układu ciepła .
Q
Wykonywanie pracy wiąże się z przemieszczaniem ciał zewnętrznych oddziaływujących na
układ.
Ciepło
‐ Przepływ energii wywołany nieuporządkowanymi ruchami cząsteczek oto‐
czenia lub przyczyniający się do wzmożenia takich ruchów w otoczeniu.
Ilość energii przekazywanej przez jedno ciało drugiemu określamy pracą
lub ilością ciepła
, w zależności od rodzaju zjawisk odpowiedzialnych za transport energii.
W
Q
Fizyka cząsteczkowa i termodynamika 6
Pierwsza zasada termodynamiki
(zasada zachowania energii)
2
1
U
U
Q W
−
= −
2
1
Q U
U
W
=
−
+
Pierwsza zasada termodynamiki
Ciepło dostarczone do układu jest zużywane na przyrost energii wewnętrznej tego
układu i na wykonywanie przez układ pracy nad zewnętrznymi ciałami.
Ilość ciepła można wyrażać tymi samymi jednostkami, co pracę i energię. W układzie SI
jednostką ciepła jest dżul (J). (1 J = 0,24 cal, 1 cal = 4,18 J).
Q
W postaci różniczkowej pierwsza zasada termodynamiki zapisywana jest jako
dQ
dU
dW
=
+
Fizyka cząsteczkowa i termodynamika 7
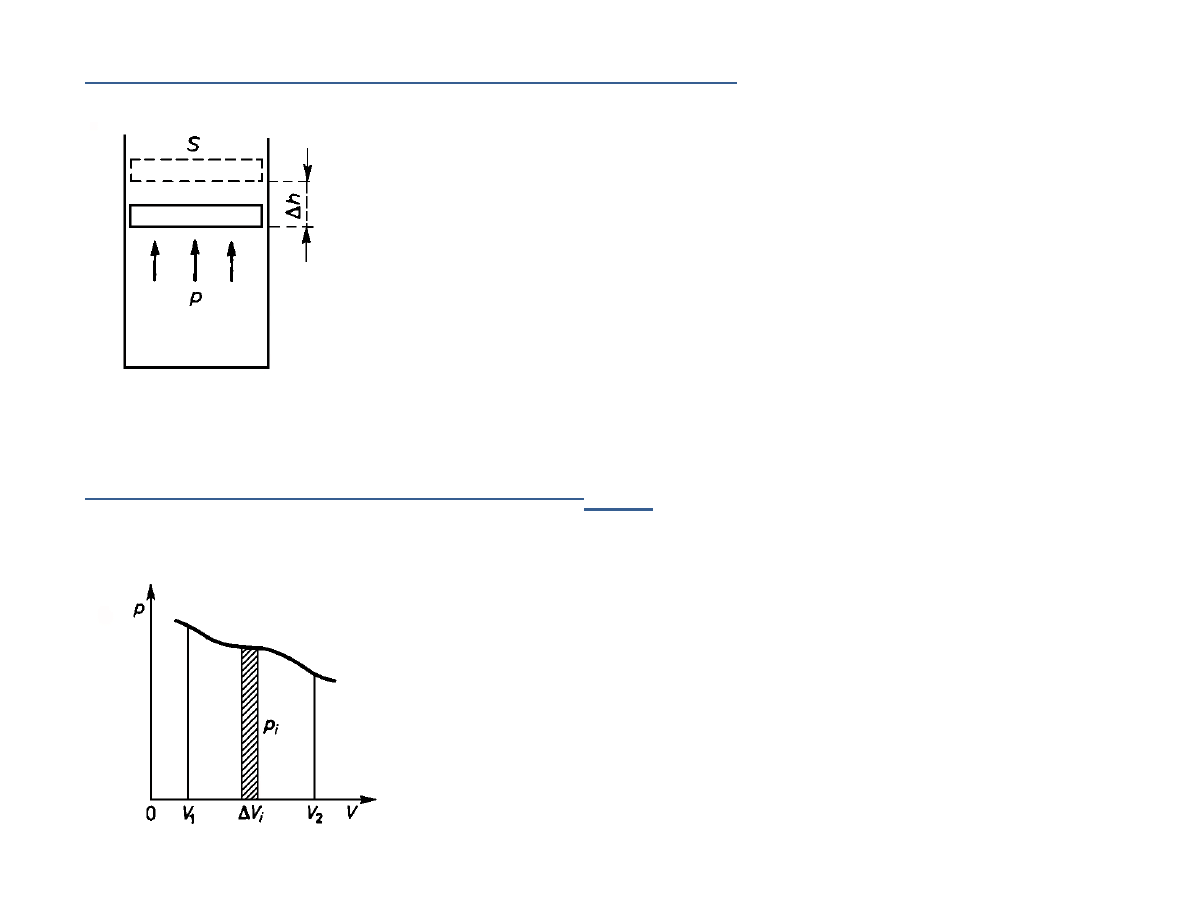
Praca wykonana przez ciało w przypadku zmiany objętości
Infinitezymalne przesunięcie tłoka odpowiada pracy:
W
F h
p S h
p V
Δ = Δ =
Δ = Δ
W postaci różniczkowej:
dW
p dV
=
Przy stałym ciśnieniu:
12
2
1
(
)
W
p V
V
=
−
Ogólnie, dla dowolnych przemian:
2
1
12
V
V
W
p dV
=
∫
Przedstawienie zmian objętości na wykresie
( , )
p V
Praca przy zmianie objętości od do
jest liczbowo równa
polu ograniczonemu osią , krzywą
)
1
V
2
V
V
(
p
f V
=
oraz prostymi
i .
1
V
2
V
dQ
dU
p dV
Inna forma I zasady termodynamiki:
=
+
Fizyka cząsteczkowa i termodynamika 8

Równanie stanu gazu doskonałego (równanie Clapeyrona)
Równanie stanu ‐ Równanie wiążące parametry stanu
Gaz doskonały
‐ Gaz, w którym oddziaływania międzycząsteczkowe są pomijalnie ma‐
łe. Każdy gaz rzeczywisty pod odpowiednio małym ciśnieniem ma
własności zbliżone do gazu doskonałego.
Stan gazu doskonałego jest określony przez trzy parametry:
p
‐ ciśnienie,
‐ objętość,
‐ temperatura.
V
T
Badania doświadczalne, a także rozważania teoretyczne pokazują, że w przypadku gazu do‐
skonałego parametry te łączy prosty związek.
Równanie gazu doskonałego:
const
pV
T
=
Fizyka cząsteczkowa i termodynamika 9

Równanie stanu gazu doskonałego, cd.
const
pV
T
=
Prawo Avogadra ‐ W warunkach, scharakteryzowanych przez te same parametry
i ,
p
T
mol każdego gazu zajmuje tę samą objętość.
Np. w tzw. warunkach normalnych dla jednego mola gazu mamy:
5
3
3
273,15 K (0 C)
J
1 atm 1, 013 10 Pa
8,31
mol K
22, 4 l
22, 4 10
m
m
m
T
pV
p
R
T
V
−
=
°
⎫
⎪
=
=
⋅
⇒
= =
⎬
⋅
⎪
=
=
⋅
⎭
‐ uniwersalna stała gazowa.
R
Dla dowolnej masy m gazu:
m
pV
RT
μ
=
Wprowadźmy stałą Boltzmanna:
23
J
1,38 10
K
A
R
k
N
−
=
=
⋅
A
m
pV
N k T
N k T
,
‐ liczba cząsteczek w masie .
μ
=
=
N
m
Fizyka cząsteczkowa i termodynamika 10

Równanie stanu gazu doskonałego, cd.
pV
N k T
=
p
n k T
=
,
N
n
V
=
‐ liczba cząsteczek w jednostce objętości.
Przy ustalonej objętości ciśnienie gazu doskonałego jest wprost proporcjonalne do tempera‐
tury. Z tego względu gaz doskonały jest używany jako ciało termometryczne. Biorąc ciśnienie
jako cechę termometryczną, otrzymuje się termometr o idealnie liniowej skali temperatur,
tzw. doskonałej gazowej skali temperatur.
Praktyczne znaczenie ma tzw. empiryczna skala temperatur, zbudowana w oparciu o zasto‐
sowanie równania p
n k T
=
dla wodoru.
Fizyka cząsteczkowa i termodynamika 11

Pojemność cieplna
Pojemność cieplna ‐
ciała,
c
C
Ilość ciepła potrzebna do tego, aby podwyższyć temperaturę ciała o
jeden kelwin.
c
dQ
C
dT
=
[ ]
J
K
c
C
=
Ciepło właściwe, ‐
c
Pojemność cieplna jednostki masy substancji
c
C
c
m
=
[ ]
J
kg K
c
=
⋅
Molowe ciepło ‐
właściwe,
C
Pojemność cieplna jednego mola substancji
C
c
μ
=
[ ]
J
mol K
C
=
⋅
Fizyka cząsteczkowa i termodynamika 12

Pojemność cieplna w stałej objętości
Przy zmianach temperatury ciała w stałej objętości ciało nie wykonuje pracy nad otoczeniem
0)
i całe ciepło zamienia się na wzrost energii wewnętrznej
(dW
=
(
)
V
dQ
dU
=
.
V
cV
V
dQ
U
C
dT
T
∂
⎛
⎞
=
= ⎜
⎟
∂
⎝
⎠
Dla dowolnej masy gazu doskonałego zachodzi:
V
m
U
C T
μ
=
Pojemność cieplna przy stałym ciśnieniu
Przy zmianach temperatury ciała przy stałym ciśnieniu oprócz zmian energii wewnętrznej
wykonywana jest praca
(
)
p
dQ
dU
p dV
=
+
.
Dla jednego mola gazu doskonałego mamy:
p
V
C
C
R
=
+
Fizyka cząsteczkowa i termodynamika 13

Przemiany gazu doskonałego
Spośród wielu możliwych przemian gazu doskonałego na wyróżnienie zasługują przemiany,
w których ‐ oprócz równania stanu ‐ spełniony jest dodatkowy warunek określający rodzaj
przemiany
Rodzaj przemiany
Dodatkowy
warunek
Równanie stanu
Izobaryczna
const
p
=
/
con t
V T
=
s
Izochoryczna
const
V
=
p /
const
T
=
Izotermiczna
const
T
=
pV
= const
Adiabatyczna
0
dQ
=
const
pV
κ
=
/
p
V
C
C
,
κ
≡
Fizyka cząsteczkowa i termodynamika 14
Fizyka cząsteczkowa i termodynamika 15
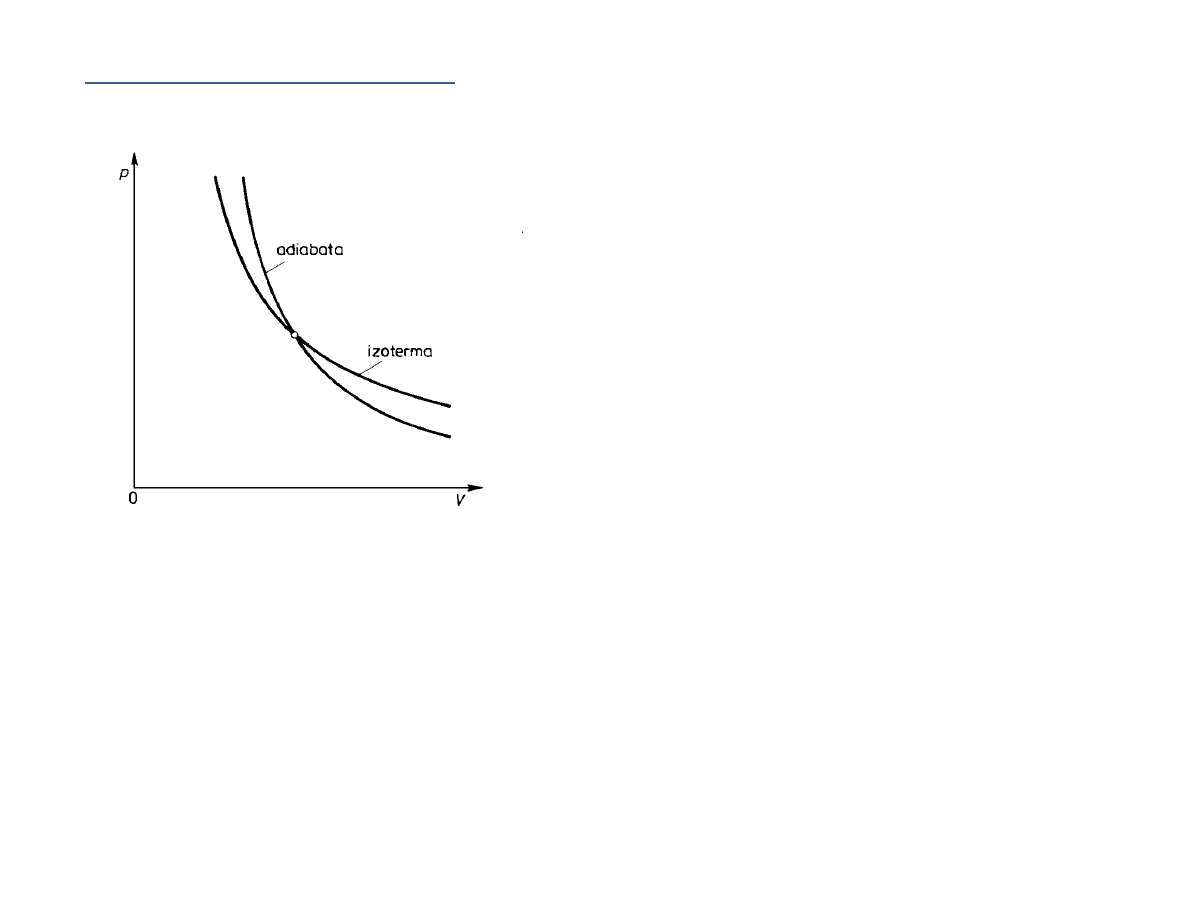
Przykładem przemiany adiabatycznej może być sprężanie i rozprężanie gazu przy rozchodze‐
niu się w gazie fali dźwiękowej, w odniesieniu do małych objętości.
Adiabata:
,
)
const
pV
κ
=
(
1
κ
> .
Izoterma:
const
pV
=
Przemiany gazu doskonałego, cd.
Document Outline
- FIZYKA CZĄSTECZKOWA I TERMODYNAMIKA
- Wielkości stosowane do opisu atomów i cząsteczek
- Wielkości stosowane do opisu atomów i cząsteczek, cd.
- Stan układu
- Przemiana
- Energia wewnętrzna układu
- Zmiany energii wewnętrznej
- Pierwsza zasada termodynamiki
- Praca wykonana przez ciało w przypadku zmiany objętości
- Przedstawienie zmian objętości na wykresie
- Równanie stanu gazu doskonałego (równanie Clapeyrona)
- Równanie stanu gazu doskonałego, cd.
- Równanie stanu gazu doskonałego, cd.
- Pojemność cieplna
- Pojemność cieplna w stałej objętości
- Pojemność cieplna przy stałym ciśnieniu
- Przemiany gazu doskonałego
- Przemiany gazu doskonałego, cd.
Wyszukiwarka
Podobne podstrony:
a06 fizyka czasteczkowa wstep (01 10) IZBOIUERU3RODLRV2 (2)
2013 01 15 ustawa o srodkach pr Nieznany
CERN FIZYKA CZASTEK ELEMENTARNY Nieznany
Wykład 11.01.15 - Audiologia, Logopedia - podyplomowe, I sem - Audiologia
2006 01 15
ZESTAWIENIE STALI 11 01 15, Polibuda mgr, SEM III, konst. metalowe, Konstrukcje metalowe, stale proj
przetwórstwo projekt 19 01 15
Ćwiczenia 8 (23 01 15)
CWICZENIE PROJEKTOWE 11 01 15, Polibuda mgr, SEM III, konst. metalowe, Konstrukcje metalowe, stale p
Ćwiczenia 7 (16 01 15)
opracowane1 01 15
C22 Fizyka jadra atomowego(01 12)
02 01 11 12 01 15 kolokwium 21
2003 01 15
LBC1227 01 15 03 2006 PA PL F
więcej podobnych podstron