
Sponsorem II Etapu 56 Olimpiady Chemicznej
jest Grupa Chemiczna Ciech SA
E
E
E
T
T
T
A
A
A
P
P
P
I
II
I
II
29.01.2010
Z a d a n i a t e o r e t y c z n e
Z
ADANIE
1
Rozpuszczalność fosforanu(V) wapnia
Szkliwo stanowiące powierzchnię korony zęba jest najtwardszą tkanką ludzkiego
organizmu. Składa się prawie wyłącznie z substancji nieorganicznych występujących w
postaci kryształów hydroksyapatytu - minerału zawierającego 3Ca
3
(PO
4
)
2
.
Ca(OH)
2
. Ze
względu na obecność m.in. grup fosforanowych(V) (zasada Brønsteda) rozpuszczalność tego
związku zwiększa się w środowisku kwaśnym. Dlatego spożywanie w nadmiarze kwaśnych
potraw i napojów może prowadzić do erozji szkliwa. Dotyczy to zwłaszcza słodzonych
napojów typu Cola, gdzie w smaku nie odczuwa się dużej kwasowości (pH około 2).
Zadanie dotyczy wpływu zakwaszenia na rozpuszczalność osadu soli zawierającej wapń i
fosfor na przykładzie związku prostszego niż hydroksyapatyt – fosforanu(V) wapnia,
Ca
3
(PO
4
)
2
.
Polecenia:
a. (4 pkt.) Zapisz równanie opisujące równowagę rozpuszczania / osadzania Ca
3
(PO
4
)
2
.
Oblicz rozpuszczalność molową tej soli przy założeniu, że jony (w tym fosforanowe(V))
nie ulegają reakcjom ze składnikami roztworu. Bez przeprowadzania obliczeń odpowiedz,
czy rzeczywista rozpuszczalność molowa Ca
3
(PO
4
)
2
w środowisku obojętnym jest
większa czy mniejsza od obliczonej przy przyjętym założeniu.
b. (6 pkt.) Przeprowadzając odpowiednie obliczenia określ (
I
) graniczne wartości pH,
pomiędzy którymi dominującą formą fosforanu(V) jest jon H
2
PO
4
-
oraz (
II
) graniczne
wartości pH, pomiędzy którymi dominującą formą fosforanu(V) jest jon HPO
4
2-
(przyjmujemy wtedy, że udział molowy każdej innej formy fosforanu(V) jest mniejszy niż
1 % zawartości formy dominującej).
c. (3 pkt.) Określ, jaki odczyn (kwaśny, zasadowy czy obojętny) będą wykazywać
(oddzielnie) roztwory NaH
2
PO
4
, Na
2
HPO
4
oraz Na
3
PO
4
o stężeniu 0,1 mol/dm
3
.
Odpowiedź krótko uzasadnij.
d. (7 pkt.) Na podstawie rezultatów otrzymanych w poprzednich punktach zadania wskaż
formę fosforanu(V), której udział jest największy w środowisku niezbyt silnie kwaśnym
(pH większe od 3). Następnie, zakładając dominację wskazanej formy, oblicz
maksymalną wartość pH, przy której próbka 1 g Ca
3
(PO
4
)
2
ulegnie całkowitemu
rozpuszczeniu w 100 cm
3
roztworu. Sprawdź, czy założenie o dominacji wybranej formy
fosforanu(V) dla wyznaczonej wartości pH rzeczywiście jest spełnione.
Iloczyn rozpuszczalności Ca
3
(PO
4
)
2
: K
s0
= 1
.
10
-26
Stałe dysocjacji H
3
PO
4
: K
a1
= 6
.
10
-3
; K
a2
= 6
.
10
-8
; K
a3
= 5
.
10
-13
Masy molowe: Ca: 40,08 g/mol; P: 30,97 g/mol; O: 16,00 g/mol.
2
Z
ADANIE
2
Kolorowe związki chromu
Próbka metalicznego chromu o masie 6,81 g całkowicie przereagowała z gazowym
chlorowodorem w temperaturze powyżej 600°C. Stałym produktem tej reakcji był bezbarwny
związek A, który otrzymano w ilości 16,1 g.
Po rozpuszczeniu związku A w odtlenionej wodzie, zakwaszonej kwasem solnym, powstał
niebieski roztwór. Roztwór ten stopniowo zmieniał swoją barwę. Zaobserwowano, że zmiana
barwy następowała znacznie szybciej, gdy pozostawał on w kontakcie z powietrzem.
Po pewnym czasie, kiedy zachodzące reakcje przebiegły do końca, roztwór rozdzielono na
dwie części i przeprowadzono krystalizację w zróżnicowanych warunkach temperatury,
stężenia oraz pH. W ten sposób otrzymano dwa różne produkty: fioletową sól B i zieloną sól
C, przy czym analiza elementarna wskazała, że skład pierwiastkowy obu soli jest identyczny.
Kryształy soli B i C przechowywano w eksykatorze nad stężonym kwasem siarkowym. Po
dłuższym czasie stwierdzono, że masa soli C zmalała o
Δ
m
= 13,5 % i ustaliła się, zaś sól B
nie zmieniła swojego składu. Tak otrzymane związki C1 i B użyto do sporządzenia dwóch
roztworów wodnych o takim samym stężeniu wynoszącym 1,20 g/dm
3
. Następnie
odmierzono po 100 cm
3
tych roztworów, które miareczkowano roztworem AgNO
3
o stężeniu
0,100 mol/dm
3
wobec chromianu(VI) potasu zużywając odpowiednio 5,2 i 13,5 cm
3
AgNO
3
.
Polecenia:
a. (2 pkt.) Napisz równanie reakcji zachodzącej pomiędzy chlorowodorem a chromem
prowadzącej do utworzenia związku A. Odpowiedź potwierdź stosownymi obliczeniami.
b. (5 pkt.) Napisz równania reakcji zachodzących w roztworze wodnym związku A bez
dostępu powietrza i w jego obecności.
c. (3 pkt.) Wiedząc, że chrom w omawianych połączeniach występuje w postaci trwałych
kinetycznie kationów kompleksowych o liczbie koordynacyjnej 6, podaj jeden ogólny
wzór dla soli B i C1 uwzględniający część kationową i anionową. Na jego podstawie
przedstaw wzór określający zależność liczby moli jonów Ag
+
zużytych podczas
miareczkowania (n
Ag
) od liczby moli chromu w próbce (n
Cr
).
d. (6 pkt.) Podaj wzory związków B, C i C1 wyraźnie wskazując wzory kationów.
Odpowiedź uzasadnij i potwierdź stosownymi obliczeniami.
e. (4 pkt.) Naszkicuj budowę przestrzenną możliwych izomerów geometrycznych kationu
kompleksowego występującego w solach C i C1.
W obliczeniach przyjmij następujące wartości mas molowych:
H – 1,008 g/mol; O – 16,00 g/mol; Cl – 35,45 g/mol; Cr – 52,00 g/mol
Z
ADANIE
3
Równowagi fazowe
W temperaturze 298K doprowadzono do równowagi trójskładnikowy układ anilina – woda
– toluen. Uzyskany układ dwufazowy rozdzielono na fazę wodną i toluenową. Oznaczono
stężenie aniliny w poszczególnych fazach. Doświadczenie powtórzono dwukrotnie z różnymi
ilościami składników. Otrzymane równowagowe stężenia aniliny, c
t
– w fazie toluenowej i c
w
– w fazie wodnej, podane są w tabeli 1.
3
Tabela 1.
doświadczenie 1
doświadczenie 2
c
t
/(mol/dm
3
) 0,181
1,006
c
w
/(mol/dm
3
) 0,0232
0,102
Przeprowadzono również badania NMR, które wykazały, że anilina w wodzie występuje w
postaci pojedynczych cząsteczek (monomerów) natomiast w fazie toluenowej częściowo
asocjuje tworząc dimery (podane w tabeli stężenie c
t
jest sumarycznym stężeniem obu form
przeliczonym na monomery).
Polecenia:
a. (8 pkt.) Wyprowadź zależność pomiędzy stałą równowagi reakcji dimeryzacji (K):
2 C
6
H
5
NH
2
' (C
6
H
5
NH
2
)
2
a współczynnikiem podziału (k) aniliny między fazę toluenową
i wodną (przyjmij oznaczenia: c
tM
- stężenie monomerów aniliny w fazie toluenowej, c
tD
-
stężenie dimerów aniliny w fazie toluenowej).
b. (6 pkt.) Oblicz wartość współczynnika podziału (k) oraz wartość stałej równowagi reakcji
dimeryzacji (K).
c. (3 pkt.) Oblicz stosunek stężenia dimerów do stężenia monomerów w fazie toluenowej (r)
w dwóch doświadczeniach.
d. (3 pkt.) Wyjaśnij w 2-3 zdaniach, dlaczego anilina w wodzie pozostaje w postaci mono-
merów, a w toluenie ulega dimeryzacji.
Uwaga: współczynnik podziału dotyczy równowagowych stężeń tego samego indywiduum
chemicznego w dwóch fazach.
Z
ADANIE
4
Reakcja Dielsa-Aldera
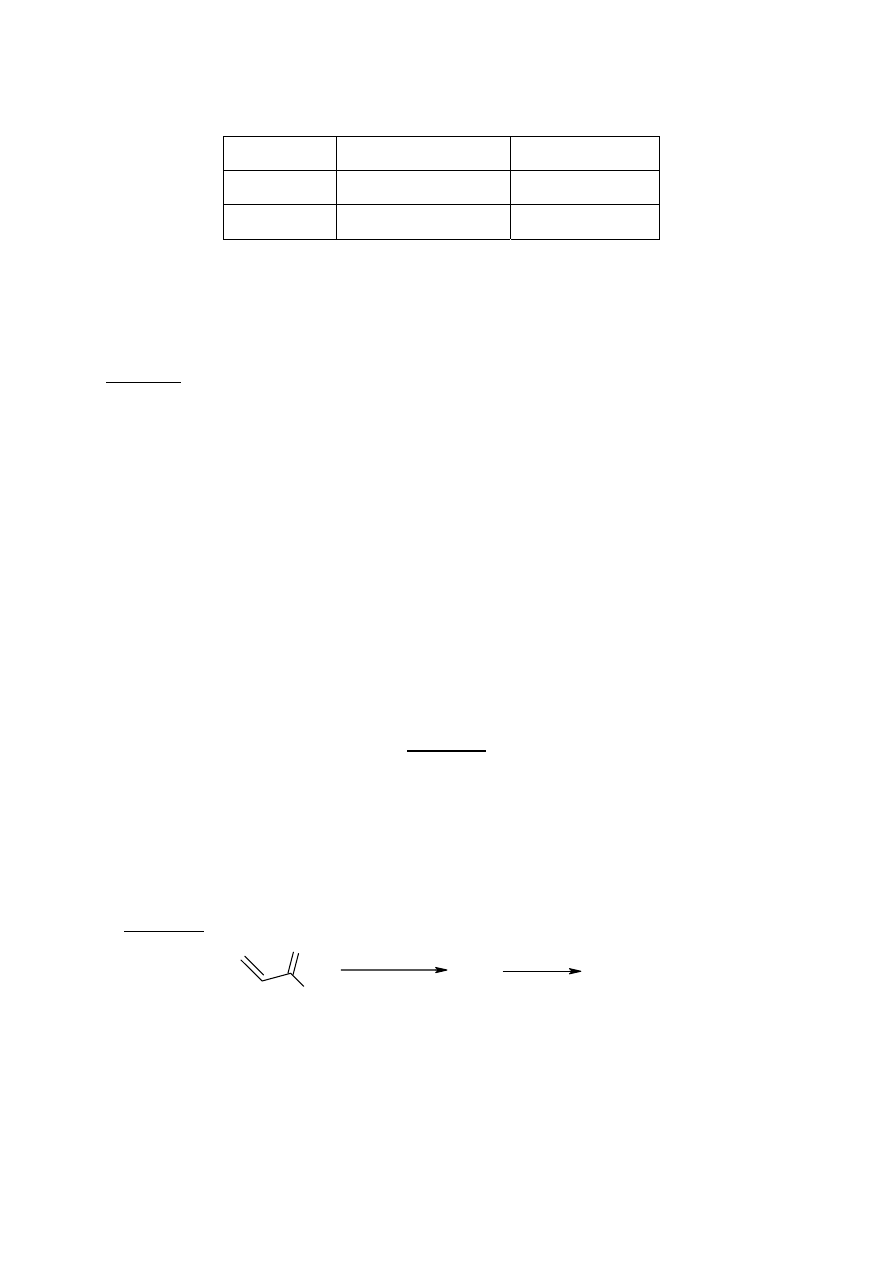
Ważnym etapem w syntezie wielu produktów naturalnych jest reakcja Dielsa-Aldera. Jej
przebieg ilustrują przykładowe schematy 1. i 2. W wyniku reakcji związku A z
cyklopentadienem otrzymano mieszaninę stereoizomerów B i C (Schemat 1). Są one
produktami addycji endo, przy czym w związku B wszystkie atomy asymetryczne mają
konfigurację R, a w związku C, wszystkie - konfigurację S.
Schemat 1.
Cl
O
BnOH
A
B + C
(R)
(S)
cyklopentadien
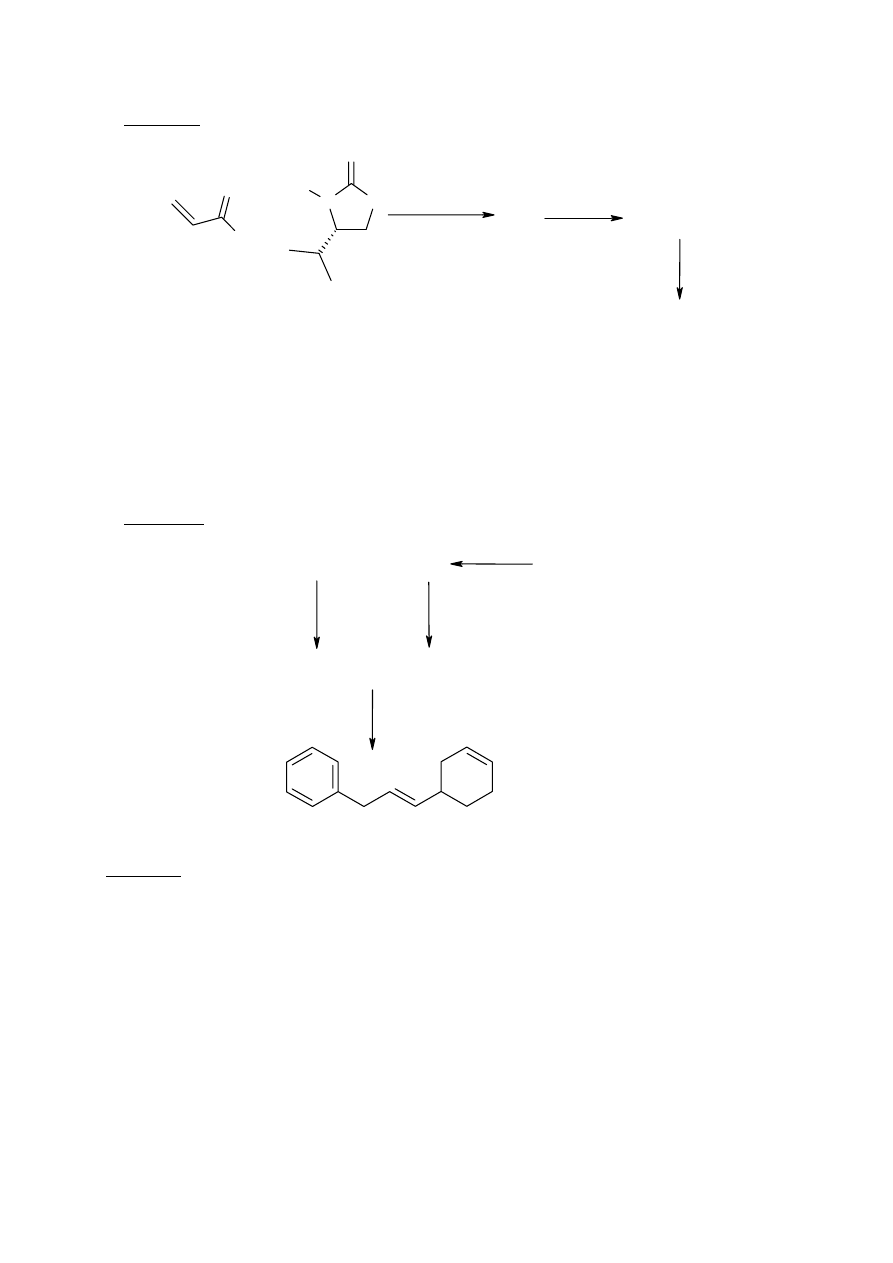
Schemat 2 przedstawia nieco inną odmianę tej reakcji z tzw. strategią „pomocnika
chiralnego”, którym była pochodna (S)-waliny. W syntezie tej, ostateczny produkt B
otrzymano z 86% nadmiarem enancjomerycznym (ee). W zastosowaniach farmakologicznych
stosuje się najczęściej związki czyste optycznie. W celu uzyskania czystego optycznie
związku B, powstające mieszaniny można rozdzielić na etapie związków E i F lub B i C.
4
Schemat 2.
Cl
O
O
N
O
H
D
B + C
+
E + F
ee = 86%
pochodna (S)-waliny
BnO
Bn = benzyl
cyklopentadien
-
Przykład praktycznego zastosowania reakcji Dielsa-Aldera jest przedstawiony na
schemacie 3, który opisuje sposób otrzymywania węglowodoru, będącego użytecznym
prekursorem w syntezie związków naturalnych. Reakcja Dielsa - Aldera to etap G + H, gdzie
G
jest dienem, a H dienofilem.
Schemat 3.
P(C
6
H
5
)
3
zasada, np. n-butylolit
G + H
I
J
K
L
+
C
8
H
9
Br
Polecenia:
a. (12 pkt.) Narysuj wzory strukturalne związków A-L.
b. (1 pkt.) Dla związków B i C zaznacz gwiazdkami asymetryczne atomy węgla.
c. (3 pkt.) Podaj, w jakim stosunku molowym powstają B i C w syntezie przedstawionej na
schemacie 1 i 2. Obie odpowiedzi krótko uzasadnij.
d. (2 pkt.) Jednym zdaniem wyjaśnij rolę pochodnej (S)-waliny w reakcji przedstawionej na
schemacie 2.
e. (2 pkt.) Oceń, czy w celu uzysknia związku B w postaci czystej optycznie łatwiej jest
rozdzielić związki E i F, czy B i C. Odpowiedz krótko uzasadnij.

5
Z
ADANIE
5
Analiza biologicznie aktywnego peptydu
Pewien peptyd (związek P), o masie molowej równej 481 g/mol wykazuje fioletową barwę
w próbie z ninhydryną i nie ulega żadnym reakcjom wobec trypsyny (trypsyna to enzym
hydrolizujący wiązania amidowe po karboksylowej stronie Lys i Arg). Analiza pików w
widmie masowym po fragmentacji tego peptydu wykazała, że jest on zbudowany z czterech
reszt aminokwasów naturalnych przy czym:
- jest wśród nich arginina (Arg)
- jeden z aminokwasów się powtarza.
Oznacza to, że poza argininą, w skład peptydu P wchodzą dwa inne aminokwasy A1 i A2.
Aminokwas A1 jest syntezowany przez bakterie ze związku X1, który zawiera jedną grupę
aldehydową i powstaje w wyniku selektywnej redukcji kwasu glutaminowego.
Aminokwas A1 można również otrzymać zgodnie z poniższym schematem.
X1
X2
NaBH
4
pH 4-6
A1
Masa molowa związku X2 jest o 18 g/mol mniejsza niż masa molowa związku X1
Aminokwas A2
otrzymuje się zgodnie ze schematem.
Z1
Z2
NH
3
aq
P/Br
2
H
2
O
A2
Związkiem wyjściowym Z1 jest nasycony kwas karboksylowy o masie molowej 116 g/mol.
Kwas ten ma rozgałęziony łańcuch węglowy, ale nie ma w swojej strukturze asymetrycznego
atomu węgla.
Polecenia:
a. (3 pkt.) Narysuj wzory półstrukturalne (lub szkieletowe) wszystkich izomerów związku Z1
będących kwasami z rozgałęzionym łańcuchem węglowym, bez względu na to, czy
spełniają inne warunki zadania.
b. (9 pkt.) Podaj wzory strukturalne lub półstrukturalne (bez zaznaczania stereochemii)
aminokwasów A1, A2 oraz związków X1, X2, Z1 (izomeru spełniającego wszystkie
warunki zadania), Z2.
c. (2,5 pkt.) Podaj nazwę aminokwasu C-końcowego (A
C
) wraz z krótkim uzasadnieniem.
d. (2,5 pkt.) Podaj nazwę aminokwasu N-końcowego (A
N
) wraz z krótkim uzasadnieniem.
e. (3 pkt.) Podaj sekwencję peptydu P stosując skróty trzyliterowe dla oznaczenia
poszczególnych aminokwasów. Krótko uzasadnij swój wybór.
W obliczeniach przyjmij przybliżone wartości mas molowych:
H-1 g/mol, C-12 g/mol, N-14 g/mol, O-16g/mol.
Punktacja: wszystkie zadania po 20 pkt., łącznie 100 pkt.
C
ZAS TRWANIA ZAWODÓW
:
300
MINUT

Sponsorem II Etapu 56 Olimpiady Chemicznej
jest Grupa Chemiczna Ciech SA
E
E
E
T
T
T
A
A
A
P
P
P
I
II
I
II
29.01.2010
Rozwiązania zadań teoretycznych
R
OZWIĄZANIE ZADANIA
1
a. Ca
3
(PO
4
)
2
' 3 Ca
2+
+ 2 PO
4
3-
Iloczyn rozpuszczalności: K
s0
= [Ca
2+
]
3
[PO
4
3-
]
2
Oznaczając rozpuszczalność molową jako S można zapisać: [Ca
2+
] = 3S i [PO
4
3-
] = 2S.
Po podstawieniu do wyrażenia na K
s0
otrzymujemy K
s0
= (3S)
3
(2S)
2
= 108S
5
.
Po podstawieniu wartości K
s0
i przekształceniu otrzymamy
S = 2
.
10
-6
mol/dm
3
.
Jednak w rzeczywistości, w roztworze obojętnym, rozpuszczalność Ca
3
(PO
4
)
2
będzie
większa ze względu na protonowanie jonów PO
4
3-
w tym środowisku (mniejsze stężenie
wolnych jonów PO
4
3-
).
b. Wykorzystujemy stałe dysocjacji kwasowej K
a1
, K
a2
i K
a3
. Wyznaczamy najpierw zakres
dominacji formy H
2
PO
4
2-
.
K
a1
= [H
+
][H
2
PO
4
-
]/[H
3
PO
4
]. Zakładając, że [H
2
PO
4
-
]/[H
3
PO
4
] = 99/1, otrzymamy:
[H
+
] = K
a1
(1/99) = 6
.
10
-5
mol/dm
3
, czyli pH = 4,2.
K
a2
= [H
+
][HPO
4
2-
]/[H
2
PO
4
-
]. Zakładając teraz, że [H
2
PO
4
-
]/[HPO
4
2-
] = 99/1, otrzymamy:
[H
+
] = K
a2
(99/1) = 6
.
10
-6
mol/dm
3
, czyli pH = 5,2. Oznacza to, że jony H
2
PO
4
-
są formą
dominującą w zakresie pH od 4,2 do 5,2.
W podobny sposób wyznaczamy zakres dominacji formy HPO
4
2-
.
K
a2
= [H
+
][HPO
4
2-
]/[H
2
PO
4
-
]. Zakładając teraz, że [H
2
PO
4
-
]/[HPO
4
2-
] = 1/99, otrzymamy:
[H
+
] = K
a2
(1/99) = 6
.
10
-10
mol/dm
3
, czyli pH = 9,2.
K
a3=
= [H
+
][PO
4
3-
]/[HPO
4
2-
]. Zakładając, że [PO
4
3-
]/[HPO
4
2-
] = 1/99, otrzymamy:
[H
+
] = K
a3
(99/1) = 5
.
10
-11
mol/dm
3
, czyli pH = 10,3. Oznacza to, że jony HPO
4
2-
są formą
dominującą w zakresie pH od 9,2 do 10,3.
c. W roztworze NaH
2
PO
4
dominującą formą fosforanu(V) są jony H
2
PO
4
-
. Zgodnie z
wynikami otrzymanymi w poprzednim punkcie jony takie dominują w zakresie pH od 4,2
do 5,2, czyli odczyn roztworu soli będzie kwaśny.
Analogicznie, w roztworze Na
2
HPO
4
dominującą formą fosforanu(V) są jony HPO
4
2-
.
Ponieważ jony takie dominują w zakresie pH od 9,2 do 10,3, odczyn roztworu soli będzie
zasadowy.
W roztworze Na
3
PO
4
będą występować jony PO
4
3-
, które są zasadą Brønsteda, ale nie
mają właściwości kwasowych – roztwór soli będzie miał odczyn zasadowy.
Można posłużyć się bezpośrednio wartościami ujemnych logarytmów stałych dysocjacji:
pK
a1
, pK
a2
, pK
a3
wynoszącymi odpowiednio 2,2; 7,2 i 12,3. Forma H
2
PO
4
-
występuje w
dużym stężeniu (w porównaniu z innymi formami) w zakresie pH pomiędzy pK
a1
i pK
a2,
czyli pomiędzy 2,2 oraz 7,2 (odczyn kwaśny). Forma HPO
4
2-
występuje w zakresie pH
pomiędzy pK
a2
i pK
a3,
czyli 7,2 oraz 12,3 (odczyn zasadowy). Z kolei forma PO
4
3-
będzie
formą główną przy pH > pK
a3
, czyli dla pH > 12,3 (odczyn zasadowy).
d. Zgodnie z wynikami otrzymanymi w punkcie b zakładamy, że dominującą formą
fosforanu(V) jest H
2
PO
4
-
. Wówczas [Ca
2+
] = 3S i [H
2
PO
4
-
] = 2S. Łącząc wyrażenia
opisujące stałe dysocjacji K
a2
i K
a3
otrzymamy:
2
K
a2
K
a3
= [H
+
]
2
[PO
4
3-
]/[H
2
PO
4
-
]. Stąd, [PO
4
3-
] = K
a2
K
a3
[H
2
PO
4
-
]/[H
+
]
2
= 2S K
a2
K
a3
/[H
+
]
2
.
Podstawiając wyrażenia na [Ca
2+
] i [PO
4
3-
] do wyrażenia na iloczyn rozpuszczalności
otrzymamy: K
s0
= (3S)
3
(2S K
a2
K
a3
/[H
+
]
2
)
2
. Po przekształceniach uzyskamy końcowe
wyrażenie: [H
+
] = {108S
5
K
a2
2
K
a3
2
/K
s0
}
1/4
.
Rozpuszczalność molowa soli, S wynosi 1 g/ (310,18 g/mol
.
0,1 dm
3
) = 0,032 mol/dm
3
.
Po podstawieniu obliczonej wartości S do wyrażenia na [H
+
] otrzymamy [H
+
] = 2,4
.
10
-5
mol/dm
3
, czyli pH = 4,6. Wartość ta odpowiada zakresowi dominacji formy H
2
PO
4
-
, czyli
przyjęte założenie jest spełnione.
Punktacja:
a. Za zapisanie równania opisującego równowagę
1,0 pkt.
Za obliczenie rozpuszczalności molowej
2,0 pkt.
Za wyjaśnienie błędu w obliczeniu dla roztworu obojętnego
1,0 pkt.
b. Za przeprowadzenie obliczeń granicznych wartości pH 4
×1,5 pkt. = 6,0 pkt.
c. Za podanie odczynu roztworów soli z uzasadnieniem 3 ×1,0 pkt. = 3,0 pkt.
d.
Za poprawną metodę i obliczenie pH
5,0 pkt.
Za obliczenie rozpuszczalności w podanych warunkach:
1,0 pkt.
Za wykazanie słuszności założenia o dominacji H
2
PO
4
-
:
1,0 pkt.
R
AZEM
: 20 pkt.
R
OZWIĄZANIE ZADANIA
2
a. Metaliczny chrom reaguje z chlorowodorem w wysokiej temperaturze tworząc chlorek
chromu(II), zgodnie z równaniem:
Cr + 2HCl
→ CrCl
2
+ H
2
Taki przebieg reakcji znajduje potwierdzenie w obserwowanych zmianach masy chromu:
131
,
0
g/mol
00
,
52
g
81
,
6
Cr
Cr
=
=
=
M
m
n
mola Cr
9
,
122
131
,
0
1
,
16
A
=
=
M
g/mol co odpowiada masie molowej CrCl
2
.
Stąd związek A to chlorek chromu(II), CrCl
2
.
b.
Związki zawierające Cr
2+
wykazują silne właściwości redukujące. W roztworze wodnym
zachodzą reakcje utleniania chromu(II) do jonu Cr
3+
(standardowy potencjał redukcji dla
reakcji Cr
3+
+ e
–
= Cr
2+
wynosi E
0
= –0,41 V). W obecności tlenu zachodzi reakcja:
4CrCl
2
+ 4HCl + O
2
→ 4CrCl
3
+ 2H
2
O
W nieobecności odpowiedniego silnego utleniacza sole chromu(II) redukują kationy
wodorowe i wydziela się gazowy wodór zgodnie z równaniem:
2CrCl
2
+ 2HCl
→ 2CrCl
3
+ H
2
c.
Chlorek chromu(III) krystalizuje z roztworu wodnego w postaci uwodnionej. Woda może
być związana w sferze koordynacyjnej chromu w postaci akwakompleksu lub/i tworzyć
hydrat. Zakładając liczbę koordynacyjną 6, odpowiednie akwachlorokompleksowe
kationy chromu(III) możemy opisać wzorem [CrCl
x
(H
2
O)
6–
x
]
+3–
x
. Sole B i C1 nie
zawierają wody hydratacyjnej (sól C1 powstała w wyniku suszenia soli C nad stężonym
kwasem siarkowym) więc odpowiada im wzór
x
x
x
−
−
3
6
2
Cl
]
)
O
H
(
CrCl
[
.
W reakcji miareczkowania roztworem AgNO
3
biorą udział jedynie jony chlorkowe
niezwiązane w akwachlorokompleksowym jonie chromu, a będące przeciwjonami
(anionami) w odpowiednich solach. Liczba moli jonów Ag
+
zużytych podczas

3
miareczkowania jest zależna od ładunku kationu kompleksowego, a więc od liczby
ligandów chlorkowych i cząsteczek wody związanych z chromem. Z przedstawionego
wzoru ogólnego soli wynika wzór na liczbę moli jonów Ag
+
zużytych podczas
miareczkowania:
Cr
Ag
)
3
(
n
x
n
⋅
−
=
Ogólny wzór soli może być oczywiście przedstawiony również w innej postaci, np.:
3
2
6
Cl
]
)
O
H
(
CrCl
[
−
−
y
y
y
lub
z
z
z
Cl
]
)
O
H
(
CrCl
[
3
2
3
+
−
. Wówczas wzory na liczbę moli
jonów Ag
+
zużytych podczas miareczkowania przyjmą odpowiednio zmienioną formę:
Cr
Ag
)
3
(
n
y
n
⋅
−
=
lub
Cr
Ag
n
z
n
⋅
=
.
d.
Z ogólnego wzoru dla soli B i C1 w postaci:
x
x
x
−
−
3
6
2
Cl
]
)
O
H
(
CrCl
[
(sumarycznie
x
−
6
2
3
)
O
H
(
CrCl
) i odpowiedniego wzoru wyrażającego liczbę moli jonów Ag
+
zużytych
podczas miareczkowania w funkcji liczby moli chromu wynika równanie ogólne:
x
x
M
m
x
c
V
−
−
⋅
−
=
⋅
6
2
3
6
2
3
3
3
)
O
H
(
CrCl
)
O
H
(
CrCl
AgNO
AgNO
)
3
(
Podstawiając wartości podane w zadaniu otrzymuje się dwa równania, odpowiednio dla
soli B i C1:
g/mol
016
,
18
g/mol
266,45
g
120
,
0
)
3
(
10
mol/dm
1
,
0
cm
2
,
5
g/mol
016
,
18
g/mol
266,45
g
120
,
0
)
3
(
10
mol/dm
1
,
0
cm
5
,
13
C1
C1
3
3
3
B
B
3
3
3
⋅
−
⋅
−
=
⋅
⋅
⋅
−
⋅
−
=
⋅
⋅
−
−
x
x
x
x
Rozwiązanie powyższych równań daje wartości:
0
003
,
0
B
≈
=
x
i
2
002
,
2
C1
≈
=
x
.
Zgodnie z tymi obliczeniami można zaproponować następujące wzory soli:
Sól B: [Cr(H
2
O)
6
]Cl
3
zawierająca kationy [Cr(H
2
O)
6
]
3+
.
Sól C1: [CrCl
2
(H
2
O)
4
]Cl zawierająca kationy [CrCl
2
(H
2
O)
4
]
+
.
Korzystając z informacji o identycznym składzie pierwiastkowym soli B i C można łatwo
zauważyć, że liczba cząsteczek wody hydratacyjnej w soli C wynosi 2. Wniosek ten
znajduje potwierdzenie w obliczeniach opartych na zaobserwowanym ubytku masy
próbki soli C w czasie suszenia:
2
996
,
1
414
,
230
5
,
86
016
,
18
5
,
13
)
100
(
1
C
O
H
O
H
2
2
≈
=
=
Δ
−
Δ
=
M
M
n
m
m
Stąd wynika wzór soli C: [CrCl
2
(H
2
O)
4
]Cl·2H
2
O z kationami [CrCl
2
(H
2
O)
4
]
+
.
Wzory soli można wyznaczyć również inną metodą korzystając ze wzoru ogólnego i
biorąc pod uwagę identyczny skład pierwiastkowy soli B i C. Stosunek liczby cząsteczek
wody hydratacyjnej w soli C do liczby jonów chlorkowych nie związanych w sferze
koordynacyjnej chromu w soli C do liczby jonów chlorkowych nie związanych w sferze
koordynacyjnej chromu w soli B wynosi:
3
:
1
:
2
01125
,
0
:
00375
,
0
:
00749
,
0
g
120
,
0
10
mol/dm
1
,
0
cm
5
,
13
:
)
135
,
0
1
/(
g
120
,
0
10
mol/dm
1
,
0
cm
2
,
5
:
g
135
,
0
3
3
3
3
3
3
O
H
2
≈
=
=
⋅
⋅
−
⋅
⋅
−
−
M
e.
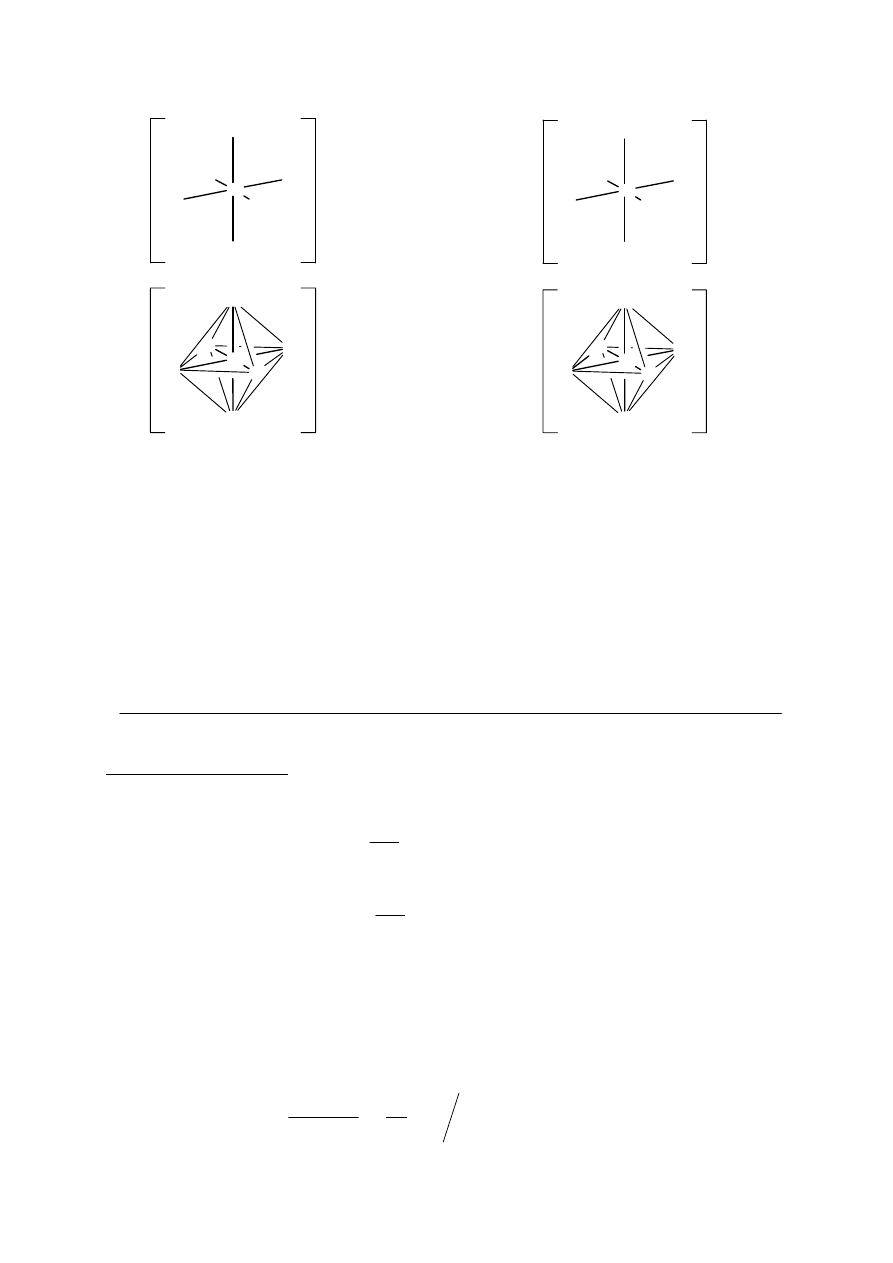
W solach C i C1 występuje taki sam kompleksowy kation dichlorotetraakwachromu(III) z
ligandami znajdującymi się w wierzchołkach zdeformowanego ośmiościanu foremnego
(oktaedru). Dwa ligandy chlorkowe mogą występować w sferze koordynacyjnej jonu
chromu(III) w położeniu trans (kąt Cl–Cr–Cl równa się 180°) lub w położeniu cis (kąt
Cl–Cr–Cl jest bliski 90°). Rysunki pokazujące przykładowe rzuty izomerów
przedstawiono poniżej:
4
Cr
OH
2
OH
2
H
2
O
H
2
O
Cl
Cl
+
Cr
Cl
OH
2
H
2
O
H
2
O
Cl
OH
2
+
Cr
Cl
OH
2
Cl
H
2
O
OH
2
H
2
O
+
Cr
OH
2
Cl
Cl
H
2
O
OH
2
OH
2
+
izomer
trans
izomer cis
Punktacja:
a.
Za równanie reakcji pomiędzy HCl a chromem prowadzącej do związku A oraz
odpowiednie obliczenia
2 pkt
b.
Za napisanie równania reakcji związku A z tlenem
2 pkt
Za napisanie równania reakcji związku A z wydzieleniem wodoru
3 pkt
c.
Za określenie ogólnego wzoru dla soli B i C1 2
pkt
Za podanie wzoru na liczbę moli Ag
+
1
pkt
d.
Za podanie wzoru związku B potwierdzone obliczeniami
2 pkt
Za podanie wzoru związku C potwierdzone obliczeniami
2 pkt
Za podanie wzoru związku C1 potwierdzone obliczeniami
2 pkt
e.
Za narysowanie budowy przestrzennej izomerów cis i trans
4 pkt
R
AZEM
: 20 pkt.
R
OZWIĄZANIE ZADANIA
3
a.
Ponieważ w wodzie występują jedynie monomery aniliny, współczynnik podziału
możemy przedstawić jako:
w
tM
c
c
k
=
(1)
a stała równowagi reakcji dimeryzacji w toluenie to
2
tM
tD
c
c
K
=
(2)
W układzie obie równowagi istnieją obok siebie, a dodatkowo w fazie toluenowej musi
być spełnione równanie bilansu:
c
tM
+ 2 c
tD
= c
t
(3)
Korzystając z równań (1) i (2) eliminujemy w równaniu (3) nieznane stężenia mono-
merów i dimerów w fazie toluenowej otrzymując zależność:
k·c
w
+ 2·K·k
2
·c
w
2
= c
t
(4)
Stąd, stała równowagi dimeryzacji:
(
)
w
w
t
w
w
t
c
k
k
c
c
c
k
c
k
c
K
⋅
⋅
⎟⎟
⎠
⎞
⎜⎜
⎝
⎛
−
=
⋅
⋅
⋅
−
=
2
2
2
2
2
(5)

5
b.
Stała równowagi opisana równaniem (5) musi być równa w dwóch eksperymentach,
których wyniki podaje tabelka w treści zadania. Możemy zatem przyrównać wyrażenia z
prawej strony równania (5) dla doświadczeń 1 i 2. Zapisujemy równość z podstawionymi
wartościami stężeń z tabelki (w mol/dm
3
) i mnożąc obie strony równania przez 2·k
2
otrzymujemy:
102
,
0
/
102
,
0
006
,
1
0232
,
0
/
0232
,
0
181
,
0
⎟
⎠
⎞
⎜
⎝
⎛
−
=
⎟
⎠
⎞
⎜
⎝
⎛
−
k
k
Stąd k = 7,19.
Stałą równowagi dimeryzacji obliczamy z równania (5) otrzymując K = 0,25.
(Należy również uznać odpowiedź K = 0,25 dm
3
/mol)
c.
W celu obliczenia stosunku stężenia dimerów do stężenia monomerów z równania (1)
wyznaczamy:
w
tM
c
k
c
⋅
=
,
i po wstawieniu tej zależności do równania (2) otrzymujemy:
2
2
w
tD
c
k
K
c
⋅
⋅
=
.
Obliczamy
stosunek
w
tM
tD
c
k
K
c
c
r
⋅
⋅
=
=
.
Jak
widać z powyższego równania stosunek ten nie jest stały i zależy od stężenia aniliny
w wodzie. Po podstawieniu danych liczbowych otrzymujemy:
w doświadczeniu 1
r
1
= 0,04
w doświadczeniu 2
r
2
= 0,18
.
d.
O tym, że w fazie wodnej nie zachodzi reakcja dimeryzacji aniliny, decyduje obecność
wiązań wodorowych w środowisku wodnym. Wiązanie wodorowe pomiędzy
cząsteczkami wody i aniliny jest znacznie silniejsze niż oddziaływanie anilina-anilina.
Wiązania wodorowe nie występują w fazie toluenowej, co umożliwia powstawanie
dimerów aniliny.
Punktacja (za zadanie 3):
a.
Za wyprowadzenie równania (5)
8 pkt.
(w tym, za poprawne podanie zależności (1), (2) i (3) po 1 pkt.)
b.
Za obliczenie współczynnika podziału k 4 pkt.
Za obliczenie stałej równowagi reakcji dimeryzacji K
2 pkt.
c.
Za obliczenie stosunków stężeń r
1
i r
2
3 pkt.
d.
Za wyjaśnienie przyczyny powstawania dimerów w toluenie
3 pkt.
R
AZEM
:
20 pkt.
R
OZWIĄZANIE ZADANIA
4
Punktacja (za zadanie 4):
a.
Z wzory strukturalne związków A-L 12×1 pkt. =12 pkt.
b.
Za zaznaczenie asymetrycznych atomów węgla w związkach C i D 2×0,5 pkt. = 1 pkt.
c.
Za podanie prawidłowego stosunku produktów B i C w obydwu rekcjach 1 pkt.
Za uzasadnienia 2×1 pkt. = 2 pkt.
d.
Za wyjaśnienie roli pochodnej (S) - waliny 2 pkt.
e.
Za wybór mieszaniny E i F oraz uzasadnienie 2 pkt.
R
AZEM
:
20 pkt.
6
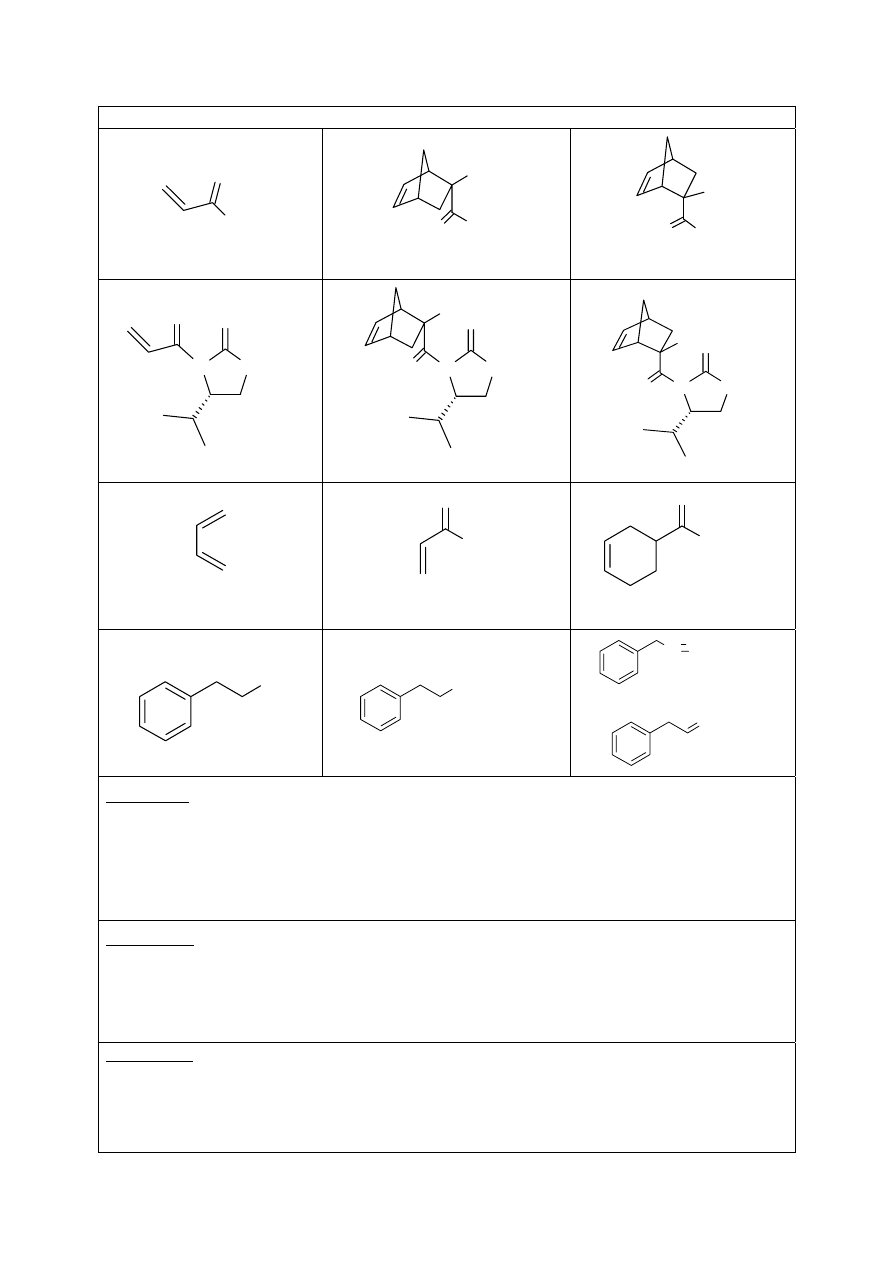
Polecenia a. i b. Wzory związków A - L
O
OBn
A
H
O
OBn
*
*
*
B
O
OBn
H
*
*
*
C
D
O
O
N
O
E
H
O
O
N
O
F
O
O
N
O
H
G
O
H
H
O
H
I
J
Br
P
+
(C
6
H
5
)
3
-
Br
K
L
P
C
H
P
+
lub
(C
6
H
5
)
3
(C
6
H
5
)
3
Polecenie c.
W reakcji Dielsa-Aldera na schemacie 1, substraty są achiralne, zatem powstające związki B i
C
, które de facto są enancjomerami powstają w stosunku 50 : 50 (czyli 1:1). W reakcji
Dielsa-Aldera na schemacie 2, powiedziano, że produkt B powstał z 86% ee, zatem
stosunek B i C = 93 : 7. Z definicji nadmiaru enancjomerycznego:
ee=(%B-%C)/(%B+%C) = 86% oraz %B+%C=100%.
Polecenie d.
Pochodna (S)-waliny w reakcji przedstawionej na schemacie 2 pełni rolę „pomocnika
chiralnego”. Ma ona asymetryczny atom węgla o ściśle określonej konfiguracji, który „kontroluje”
konfigurację powstających w trakcie reakcji, kolejnych centrów asymetrii. Powoduje to, że spośród
dwóch możliwych produktów addycji endo jeden jest zdecydowanie uprzywilejowany.
Polecenie e.
Zdecydowanie łatwiej jest rozdzielić związki E i F, gdyż są one diastereoizomerami, które
zasadniczo różnią się pomiędzy sobą właściwościami fizykochemicznymi, podczas gdy
związki B i C są enancjomerami, więc w środowisku achiralnym maja takie same właściwości
(np. do ich rozdziału trzeba byłoby użyć kosztownych kolumn ze złożem chiralnym).
7
R
OZWIĄZANIE ZADANIA
5
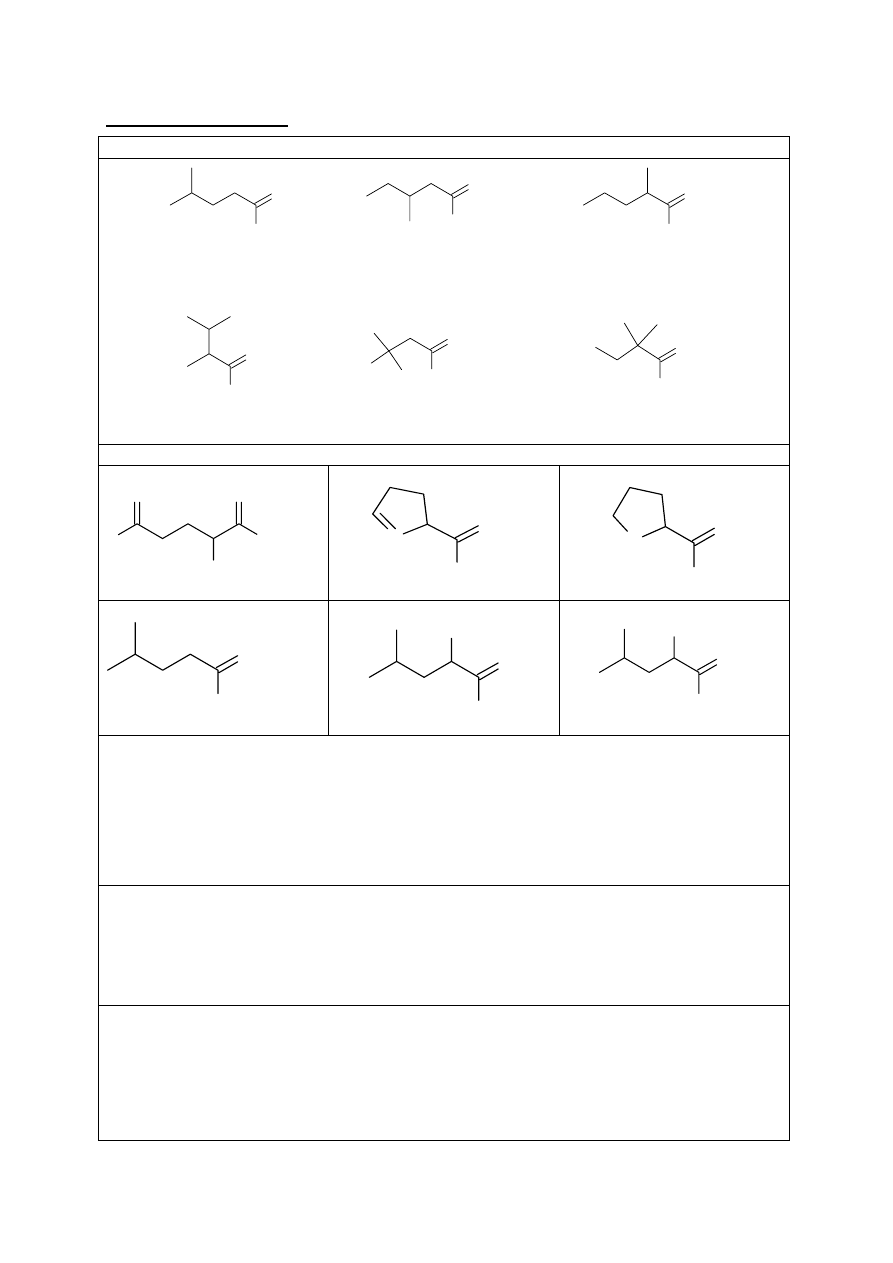
a.
Wzory izomerów Z1:
OH
O
1
OH
O
4
OH
O
2
OH
O
5
OH
O
3
6
OH
O
b.
Wzory związków:
X1
OH
H
NH
2
O
O
X2
O
N
O H
A1
O
N
H
OH
Z1
OH
O
Z2
OH
O
Br
A2
OH
O
NH
2
c.
Związek A
C
to arginina
Uzasadnienie: W punkcie b. zidentyfikowano aminokwasy A1 = Pro i A2 = Leu. Wiadomo,
że peptyd zbudowany jest jeszcze z Arg. W treści zadania podano informację, że peptyd ten
nie ulega jednak żadnym przekształceniom wobec trypsyny, która hydrolizuje wiązania
peptydowe po karboksylowej stronie Lys i Arg. Aminokwasem C-końcowym musi więc być
Arg. Dodatkowo z powyższych informacji wynika, że peptyd musi występować w postaci kwasu.
d.
Związek A
N
to leucyna
Uzasadnienie: Z treści zadania wiadomo, że peptyd P jest zbudowany z 4 reszt, ale tylko 3
aminokwasów. Zatem skoro Arg jest aminokwasem C-końcowym, to N-końcowym będzie
Pro lub Leu. Wiadomo ponadto, że peptyd wykazuje fioletową barwę w próbie z ninhydryną.
Pro jako jedyny aminokwas naturalny daje żółty kolor próby z ninhydryną.
e.
Związek P: Leu-Pro-Pro-Arg
Uzasadnienie: W sekwencji powtarza się Pro lub Leu. Porównanie mas molowych
aminokwasów ze znaną masą molową peptydu P pozwala znaleźć aminokwas, który się
powtarza: 481+3×18(H2O)-[131 (Leu) + 115(Pro) + 174(Arg)] = 115
Zatem powtarzającym się aminokwasem jest Pro.

8
Komentarz do rozwiązania zadnia 5
ad a. Kwas karboksylowy Z1 ma masę molową 116 g/mol
116 – 45 (COOH) = 71
Reszta alkilowa ma wzór ogólny C
n
H
2n+1
zatem 12n + 2n + 1 = 71, czyli n = 5.
Zatem wzór kwasu Z1 to C
5
H
11
COOH
Można przedstawić 6 izomerów kwasu o takim wzorze i rozgałęzionym łańcuchu.
ad b. Tok rozumowania:
Związek X1: Analizując wzór kwasu glutaminowego można stwierdzić, że monoaldehyd
powstały z niego w wyniku selektywnej redukcji to:
OH
H
NH
2
O
O
H
O
H
NH
2
O
O
lub
1
2
W słabo kwaśnym środowisku zachodzi reakcji otrzymywania imin. W zadaniu chodzi o
wewnątrzcząsteczkową reakcję, ponieważ w wyniku tego przekształcenia powstanie
uprzywilejowany pierścień 5-członowy. Reakcja mogłaby zachodzić również
międzycząsteczkowo, ale powstałaby wtedy pochodna, z której nie można by otrzymać
aminokwasu naturalnego. Szukany związek X1 ma więc wzór 2.
Związek X2: Różnica mas molowych X1 i X2 potwierdza, że związkiem X2 jest cykliczna
imina, zawierająca pierścień 5 członowy.
Związek A1: NaBH
4
to selektywny odczynnik redukujący, który redukuje grupę iminową,
natomiast grupa karboksylowa nie ulega żadnym przekształceniom. W ten sposób z
cyklicznej iminy X2 powstaje naturalny aminokwas prolina i jest to związek A1
Związek Z1: Wśród izomerów przedstawionych w pkt. a., tylko kwasy o wzorach 1, 5 i 6
spełniają warunek zadania o braku asymetrycznych atomów węgla, ale tylko z kwasu 1
można otrzymać naturalny aminokwas.
Związki Z2 i A2: Reakcje prowadzące do otrzymania tych związków są znane z pierwszego
etapu olimpiady.
Punktacja:
a.
Za podanie wzorów izomerów kwasu Z1
6 × 0,5 pkt. = 3,0 pkt.
b.
Za wzory związków A1, A2, X1, X2, Z1, Z2 6 × 1,5 pkt. = 9,0 pkt.
c.
Za podanie aminokwasu C-końcowego
1,0 pkt.
Za uzasadnienie wyboru
1,5 pkt.
d.
Za podanie aminokwasu N-końcowego
1,0 pkt.
Za uzasadnienie wyboru
1,5 pkt.
e.
Za podanie sekwencji peptydu
1,0 pkt.
Za uzasadnienie
2,0 pkt.
R
AZEM
: 20 pkt.
Sponsorem II Etapu 56 Olimpiady Chemicznej
jest Grupa Chemiczna Ciech SA
E
E
E
T
T
T
A
A
A
P
P
P
I
II
I
II
30.01.2010
Z a d a n i e l a b o r a t o r y j n e
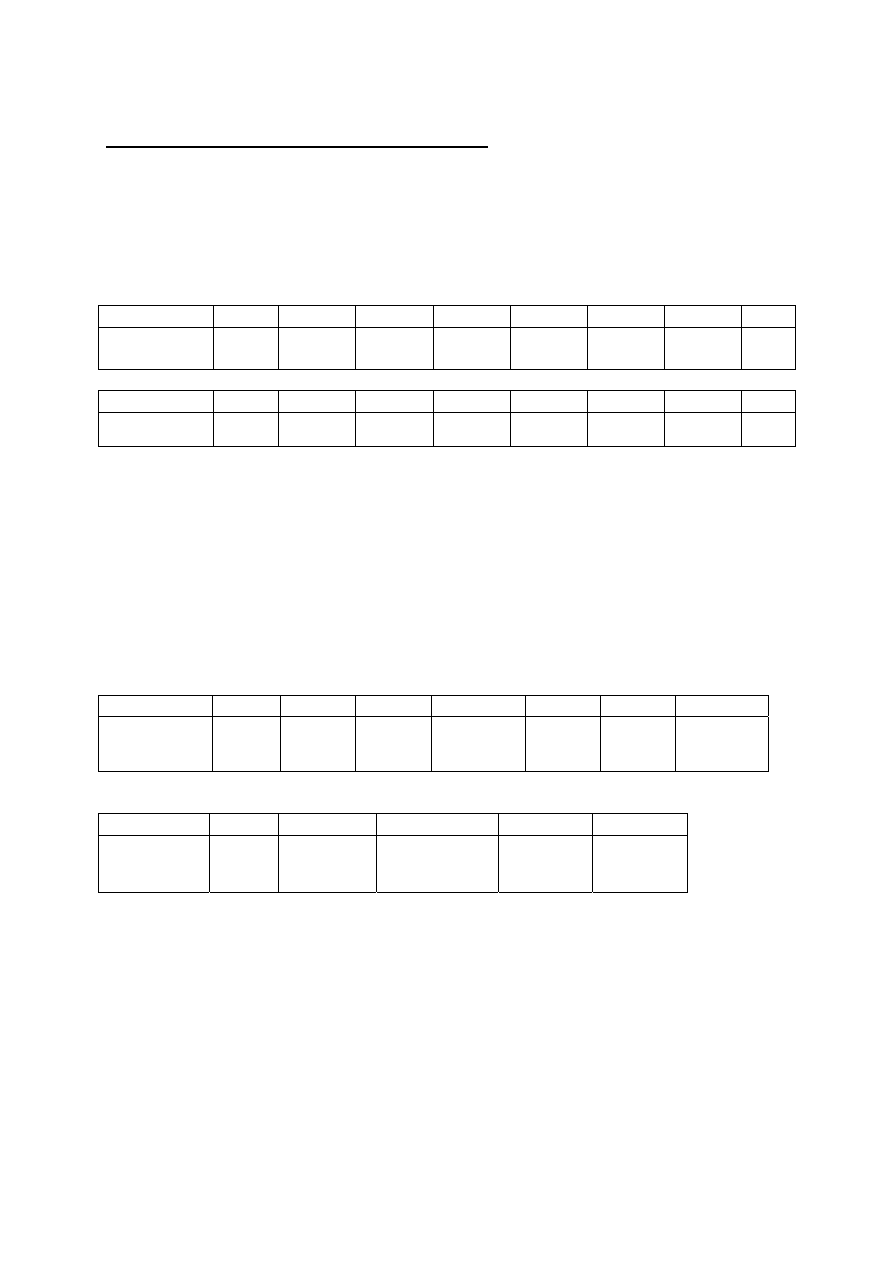
W probówkach opisanych numerami 1-10 znajdują się wodne roztwory zawierające jony
wymienione w przypadkowej kolejności w tabeli 1. Stężenia roztworów soli zawierających te
jony wynoszą około 0,1 mol/dm
3
.
Tabela 1
Kationy Aniony
Bar(II)
Azotany(V)
Cynk(II)
Azotany(III)*#
Kadm(II)
Chlorki
Kobalt(II) *
Siarczany(VI)
Mangan(II)*
Tiocyjaniany*#
Magnez(II)
Jodki#
Potas(I)
Sód(I)
Srebro(I)*
W ośmiu probówkach znajdują się roztwory pojedynczych soli, a w dwóch
dwuskładnikowe mieszaniny soli, jedna o wspólnym kationie, druga o wspólnym anionie.
Określona sól pojawia się w zestawie tylko raz.
Jony zaznaczone gwiazdką (*) na pewno nie występują w mieszaninach.
Jony zaznaczone krzyżykiem (#) występują w postaci soli sodu lub potasu.
W mieszaninach nie ma jednocześnie potasu i sodu.
Probówki opisane literami A-F zawierają roztwory substancji przydatnych w identyfikacji
zawartości probówek 1-10. Substancje te w roztworach występują pojedynczo a ich nazwa oraz
stężenie roztworu podane są w tabeli 2
Tabela 2
Nazwa substancji
Stężenie roztworu
Chlorowodorek formaldoksymu
2%
Tetrafenyloboran sodu
0,2%
Chlorowodorek hydroksyloaminy
2%
1-(2-pirydyloazo)-2-naftol (PAN)
0,05%
Ferroina 0,05%
Błękit tymolowy
0,05%
Formaldoksym, nietrwały w środowisku zasadowym, jest odczynnikiem dającym po
zalkalizowaniu barwne połączenia z jonami manganu i kobaltu na odpowiednim stopniu utlenienia.

2
PAN, stosowany m.in. jako wskaźnik kompleksometryczny, z jonami cynku, kadmu,
manganu i kobaltu tworzy purpurowo zabarwione kompleksy.
Ferroina (kompleks Fe(II) z 1,10-fenantroliną), jest wskaźnikiem redoks o wysokim
potencjale w środowisku silnie kwaśnym.
Tetrafenyloboran sodu jest trwały w środowisku zasadowym.
Do identyfikacji substancji z probówek 1-10 możesz wykorzystać roztwory z probówek
A-F i odwrotnie.
Na swoim stanowisku masz:
Na stanowisku zbiorczym dostępne są:
(w butelkach zaopatrzonych w pipetki polietylenowe)
10 probówek,
roztwór kwasu azotowego(V) o stęż. 1 mol/dm
3
tryskawkę z wodą destylowaną
wodorotlenku sodu o stęż. 1 mol/dm
3
6 polietylenowych pipetek-zakraplaczy aceton
Polecenia:
a. (4 pkt.) Dokonaj obserwacji roztworów 1-10 i zaproponuj, jakie sole mogą występować
pojedynczo, a jakie w mieszaninach, uwzględniając informacje podane w treści zadania.
b. (4 pkt.) Przedstaw w punktach plan analizy uwzględniając próby z roztworem NaOH oraz z
roztworami wykrytych substancji.
c. (22 pkt.) Przeprowadź identyfikację substancji znajdujących się w probówkach 1-10. Podaj
uzasadnienie każdej identyfikacji poparte przynajmniej dwiema obserwacjami.
d. (12 pkt.) Zidentyfikuj substancje znajdujące się w poszczególnych probówkach A-F. W
sposób jednoznaczny uzasadnij każdą identyfikację.
e. (8 pkt.) Podaj w formie jonowej równania reakcji przeprowadzonych w celu identyfikacji
soli, zaznaczając numery probówek, których dana reakcja dotyczy. Zapis równań reakcji z
substancjami z probówek A-F nie jest wymagany.
Suma punktów za zadanie laboratoryjne wynosi 50
Uwaga! Używaj roztworów bardzo oszczędnie. Dolewki nie są możliwe!
Pamiętaj o zachowaniu zasad bezpieczeństwa w trakcie wykonywania analiz!
Przyjrzyj się karcie odpowiedzi Przedstaw odpowiedź tak, by mieściła się w
wyznaczonych polach na arkuszu. Tekst oraz równania reakcji chemicznych
napisane poza wyznaczonym miejscem nie będą sprawdzane!
Opisując obserwacje zachowuj tę samą kolejność i używaj skrótów zaproponowanych w
poniższej tabeli. Jeżeli użyjesz innych skrótów, opisz ich znaczenie.
Dodanie odczynnika
+
Wytrącanie się osadu
(–)
(brak reakcji)
↓
(wytrąca się osad)
Barwa osadu
bia., nieb., ziel., pom., żół., brun., czar. itp.
Wygląd osadu
cś
(ciemniejący na świetle), ser. (serowaty), gal. (galaretowaty),
kryst. (krystaliczny), itp.
Rozpuszczalność w NaOH
rz
(rozpuszczalny w zasadzie)
, nz
(nierozpuszczalny w zasadzie)
Rozpuszczalność w HNO
3
rk
(rozpuszczalny w kwasie)
, nk
(nierozpuszczalny w kwasie)
Na przykład opis obserwacji: + NaOH -
↓
nieb. gal. nz, rk
,
oznacza:
Po dodaniu NaOH wytrąca się niebieski, galaretowaty osad, nierozpuszczalny w NaOH,
rozpuszczalny w HNO
3
Czas rozwiązywania 300 min
Sponsorem II Etapu 56 Olimpiady Chemicznej
jest Grupa Chemiczna Ciech SA
E
E
E
T
T
T
A
A
A
P
P
P
I
II
I
II
30.01.2010
Rozwiązanie zadania laboratoryjnego
Przykładowy zestaw substancji:
1. Azotan(III) sodu
6. Siarczan(VI) kobaltu(II)
A. Tetrafenyloboran sodu
2. Siarczan(VI) magnezu
7. Azotan(V) cynku i azotan(V)
kadmu
B. Chlorowodorek
hydroksyloaminy
3. Siarczan(VI) manganu(II) 8. Tiocyjanian potasu
C. PAN (pirydylazonaftol)
4. Azotan(V) srebra
9. Jodek potasu, siarczan potasu
D. Ferroina
5. Chlorek baru
10. Chlorek sodu
E. Błękit tymolowy
F. Chlorowodorek
formaldoksymu
Polecenie a.
Możliwe rozpuszczalne sole
kationy aniony
Pkt.
Pojedyncze sole
Na(I), K(I)
Zn(II), Cd(II), Co(II), Mg(II), Mn(II)
Ba(II)
Ag(I)
wszystkie aniony
siarczany (VI), azotany(V), chlorki
azotany(V), chlorki
azotany(V)
1
Mieszanina soli o wspólnym kationie
Na(I) lub K(I)
Zn(II), lub Cd(II), lub Mg(II)
Ba (II)
kombinacja azotanów(V), siarczanów(VI), chlorków
i jodków
kombinacja azotanów(V), siarczanów (VI) i chlorków
azotany(V) i chlorki
1
Mieszanina soli o wspólnym anionie
Kombinacja Ba(II), Cd(II), K(I),
Mg(II), Na(I), Zn(II) poza Na z K
Kombinacja Cd(II), K(I), Mg(II),
Na(I), Zn(II) poza Na z K
azotany(V) i chlorki
siarczany(VI)
1
Przypuszczalny skład barwnych roztworów
dwa czerwone (probówka 6 - sól kobaltu(II), probówka D – ferroina)
dwa pomarańczowe (C, E) - błękit tymolowy lub PAN
1
Polecenie b.
Plan analizy
Pkt.
1. Działanie na roztwory z probówek 1-10 roztworem wodorotlenku sodu. Po charakterys-
tycznej barwie strącanych osadów wykrywa się srebro(I), kobalt(II), mangan(II) oraz
stwierdza obecność cynku, magnezu, kadmu. Znajduje się też błękit tymolowy dzięki
charakterystycznemu zabarwieniu.
1
2. Wykrytym azotanem srebra działa się na pozostałe roztwory poszukując jonów
chlorkowych, tiocyjanianowych, jodkowych, azotanowych(III) i tetrafenyloboranowych.
Identyfikacja anionów za pomocą reakcji charakterystycznych.
1
3. W reakcjach krzyżowych pomiędzy roztworami 1-10 nie zawierającymi srebra(I) ani tio-
cyjanianów i azotanów(III) wykrywa się roztwór zawierający sole baru i jony siarczanowe.
1
4. Reakcje charakterystyczne dla potwierdzenia już wykrytych jonów oraz identyfikacji
pozostałych jonów i substancji.
1
2
Polecenie c.
Identyfikacja soli pojedynczych
Nr prob.
Wykryto
Uzasadnienie
Punktacja
1
Na(I)
Azotan(III)
+ NaOH - (-)
+ tetrafenyloboran sodu - (-)
+ AgNO
3
- bia., rk
+ KI - wydzielanie jodu po zakwaszeniu
2
(id 1)
(uz 1)
2
Mg(II)
Siarczan(VI)
+ NaOH - bia., gal., nz, rk
+ PAN – (-)
+ BaCl
2
- bia., kryst., nk
+ AgNO
3
– (-)
2
(id 1)
(uz 1)
3
Mn(II)
Siarczan(VI)
+ NaOH - biało-brun., nz, nk, cp,
+ formaldoksym + NaOH – brunatne zabarwienie
+ BaCl
2
- bia., kryst., nk
+ AgNO
3
– (-)
2
(id 1)
(uz 1)
4
Ag(I)
Azotan(V)
+ NaOH - brun., nz, rk,
+ Cl
-
- bia., ser., nk, cś,
Wynika z treści zadania, tylko ta sól srebra jest
dobrze rozpuszczalna
2
(id 1)
(uz 1)
5
Ba(II)
chlorek
+ NaOH – (-), + CO
2
- bia., kryst.
+ siarczany(VI) - bia., kryst., nk
+ AgNO
3
- bia., ser., nk, cś
2
(id 1)
(uz 1)
6
Co(II)
Siarczan(VI)
Roztwór czerw., + NaOH - nieb., gal., nz, cp
+ KSCN - róż. zab. + aceton - nieb. zab.
+ BaCl
2
- bia., kryst., nk
+ AgNO
3
- (-)
2
(id 1)
(uz 1)
8
K(I)
SCN
-
+ NaOH – (-)
+ tetrafenyloboran sodu, bia., kryst., nk
+ AgNO
3
- bia., ser., nk,
+ Co(II) – róż. zab.,+ aceton - nieb. zab.
2
(id 1)
(uz 1)
10
Na(I)
chlorek
+ NaOH – (-)
+ tetrafenyloboran sodu – (-)
+ AgNO
3
- bia., ser., nk, cś
2
(id 1)
(uz 1)
Dodatkowe skróty użyte w tabeli: cp – ciemniejący na powietrzu, bezp. – bezpostaciowy,
….zab.- …. zabarwienie roztworu
3
Polecenie c.
Identyfikacja soli w mieszaninach
Nr prob.
Wykryto
Uzasadnienie
Punktacja
7
Cd(II)
Zn(II)
Azotany(V)
+NaOH - bia., bezp., nz, rk
+ PAN - czerwone zabarwienie
+NaOH - bia., gal., rz, + HNO
3
- bia., gal., rk
+ PAN - czerwone zabarwienie
+AgNO
3
– (-)
+ BaCl
2
– (-)
3
(id
1,5)
(uz
1,5)
9
K(I)
Siarczany(VI)
Jodki
+ NaOH – (-)
+ tetrafenyloboran sodu - bia., bezp., nk,
+ BaCl
2
– bia., kryst., nk,
+ AgNO
3
, – żółtoziel., ser., nk,
+ NaNO
2
- wydzielanie jodu po zakwaszeniu
3
(id
1,5)
(uz
1,5)
Polecenie d.
Identyfikacja substancji z probówek
A-F
A
Tetrafenylo
boran
sodu
Roztw. bezb., + K(I) - bia., bezp., nk,
+ AgNO
3
- brun., + HNO
3
- bia.
+ błękit tymolowy - granatowe zabarwienie
2
(id 1)
(uz 1)
B
Chlorowodorek
hydroksylo
aminy
Roztw. bezb., + AgNO
3
- bia., ser., cś, nk,
Rozpuszcza Mn
2
O
3
po zakwaszeniu HNO
3
2
(id 1)
(uz 1)
C
PAN
Roztw. żółty, + NaOH – pomarańczowe
zabarwienie
+ Cd(II), Co(II), Zn(II) – czerwone zabarwienie
2
(id 1)
(uz 1)
D
Ferroina
Roztw. czerwony, brak reakcji z NaOH i HNO
3
Odbarwienie z mocno zakwaszonym Mn
2
O
3
2
(id 1)
(uz 1)
E
Błękit
tymolowy
Roztw. żółty, + NaOH - zabarwienie granatowe
+ HNO
3
– zabarwienie malinowe
2
(id 1)
(uz 1)
F
Chlorowodorek
formal-
doksymu
Roztw. bezb., + AgNO
3
- bia., ser., cś, nk,
+ Mn(II) – brunatne zabarwienie po zalaklizowaniu
2
(id 1)
(uz 1)
4
Polecenie e.
Równania reakcji
Nr prob.
Równanie reakcji
Punktacja
pr 2 +
NaOH
Mg
2+
+ 2
−
OH
→ Mg(OH)
2
biały, galaretowaty*
0,5
pr 3 +
NaOH
Mn
2+
+ 2
−
OH
→ Mn(OH)
2
brudnobiały
4Mn(OH)
2
+ O
2
→ 2Mn
2
O
3
+ 4H
2
O
brudnobiały
brunatny
0,5
0,5
pr 4 +
NaOH
2Ag
+
+ 2
−
OH
→ Ag
2
O + H
2
O
brunatny
0,5
pr 6 +
NaOH
2Co
2+
+ 2
−
OH
+
−
2
4
SO → (CoOH)
2
SO
4
niebieski
(CoOH)
2
SO
4
+ 2
−
OH
→ 2Co(OH)
2
+
−
2
4
SO
niebieski
różowy
4Co(OH)
2
+ O
2
+ 2H
2
O → 4Co(OH)
3
różowy brunatny
0,5
0,5
0,5
pr 7+
NaOH
Cd
2+
+ 2
−
OH
→ Cd(OH)
2
biały, bezpostaciowy
0,5
pr 7+
NaOH
Zn
2+
+ 2
−
OH
→ Zn(OH)
2
biały, galaretowaty
Zn(OH)
2
+ 2
−
OH
→ [Zn(OH)
4
]
2-
[Zn(OH)
4
]
2-
+ 2H
+
→ Zn(OH)
2
+ 2H
2
O
0,5
0,5
0,5
pr 4+ pr1 Ag
+
+
−
2
NO → AgNO
2
biały
0,5
pr 4+
pr 5, 10
Ag
+
+
−
Cl
→ AgCl
biały, serowaty, ciemniejący na świetle
0,5
pr 4+
pr 8
Ag
+
+
−
SCN
→ AgSCN
biały, serowaty
0,5
pr 4+
pr 9
Ag
+
+
−
I → AgI
żółtozielony, serowaty
0,5
pr 5 + pr
2, 3, 6, 9
Ba
2+
+
−
2
4
SO → BaSO
4
biały, drobnokrystaliczny
0,5
pr 4 + pr 1
+ HNO
3
AgNO
2
+ H
+
→ Ag
+
+ HNO
2
3HNO
2
→ HNO
3
+ 2NO↑ +H
2
O
0,5
pr 1 + pr 9
+ HNO
3
2
−
2
NO + 2
−
I + 4H
+
→ I
2
+ 2NO↑ + 2H
2
O
bezb brązowy
0,5
pr 6 + pr 8
+ aceton
Co
2+
+ 4
−
SCN
→ [Co(SCN)
4
]
2-
bladoróżowy niebieski
0,5
* Jeżeli wygląd osadu, stanowiący podstawę identyfikacji został określony w odpowiedzi na
polecenie c., nie musi być podawany ponownie w tej tabeli (polecenie e.)
5
Komentarz do rozwiązania zadania laboratoryjnego
W komentarzu przedstawiony jest tok rozumowania oraz przykładowy opis przeprowadza-
nych prób, jaki zawodnik może prowadzić w brudnopisie, przed wypełnieniem karty odpowiedzi.
Ad c. i d.
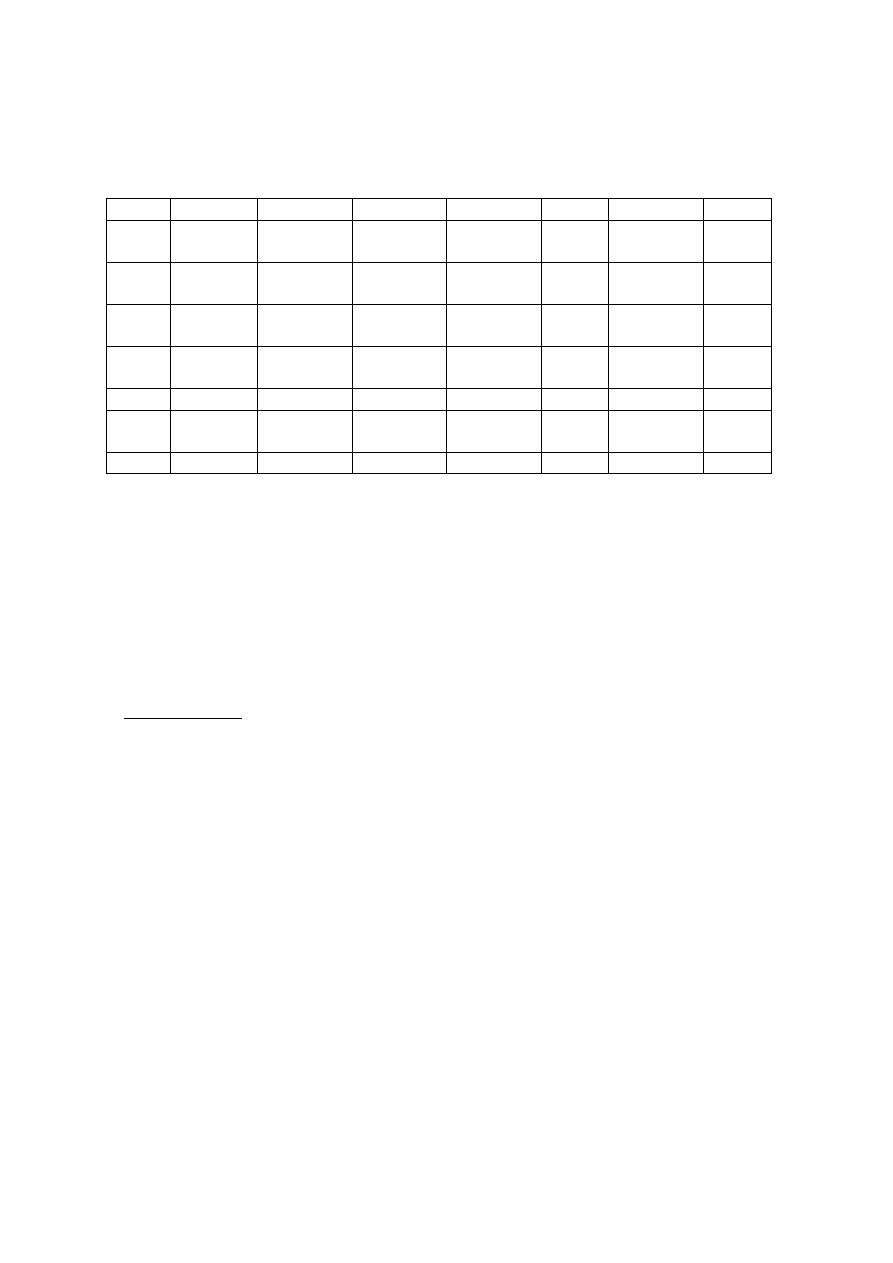
1. Zgodnie z planem analizy należy podziałać roztworem NaOH na wszystkie badane probówki
Nr probówki
1 2 3 4 5 6 7
8
Obserwacja (-) bia.,
nz
biabr,
cp, nz
brun.,
nz
(-)
nieb.,
cp, nz
bia.,
nz
(-)
Nr probówki
9 10 A B C D E F
Obserwacja
(-) (-) (-) (-) pom. (-) nieb.
(-)
Wnioski
: W probówce 3 prawdopodobnie znajdują się jony manganu(II), w probówce 4
jony srebra(I), w probówce 6 jony kobaltu(II).
Wytrącenie dwóch białych osadów, nierozpuszczalnych w nadmiarze odczynnika w
probówce 2 i 7 świadczy o obecności jonów magnezu lub kadmu. Brak białego,
rozpuszczalnego w nadmiarze odczynnika osadu, świadczy o tym, że cynk występuje w
mieszaninie z kadmem lub magnezem.
Zmiana barwy roztworu w probówce C i E sugeruje obecność odpowiednio PAN-u i
błękitu tymolowego
. Brak zmian w przypadku probówki D wskazuje na ferroinę.
2. Wyniki rekcji roztworów z jonami srebra(I) z probówki 4.
Nr probówki
1
2 3 5 6 7 8
Obserwacja
bia.,
rk
(-) (-)
bia., ser.
cś, nk
(-) (-)
bia., ser.
nk,
Nr probówki
9 10
A
B F
Obserwacja żółty,
nk
bia., ser.
cś, nk
brun., rk
bia., nk
bia., ser.
cś, nk
bia., ser.
cś, nk
Biały, serowaty AgCl ciemnieje na świetle. Osad AgI ma charakterystyczne,
żółtozielonkawe zabarwienie. Ze strąconych białych osadów jedynie osad azotanów(III)
rozpuszcza się w kwasie azotowym.
Wnioski:
W probówce 1 występują azotany(III), w probówce 8 prawdopodobnie
tiocyjaniany
, w probówce 9 jodki a w probówce A tetrafenyloboran sodu (roztwór
alkaliczny). Jony chlorkowe występują w probówkach 5, 10, B i F W tych opisanych
literami probówkach mogą znajdować się chlorowodorek hydroksyloaminy lub
chlorowodorek formaldoksymu.
6
3. Reakcje krzyżowe
Reakcjom krzyżowym poddano roztwory z probówek 2, 3, 5, 6, 7, 9 i 10. W pozostałych
zidentyfikowano jony nie będące w mieszaninach lub występujące tylko z sodem i potasem.
Nr pr
2 3 5 6
7
9
10
2
X (-)
bia.,
kryst., nk
(-) (-) (-) (-)
3
(-) X bia.,
kryst., nk
(-) (-) (-) (-)
5
bia.,
kryst., nk
bia.,
kryst., nk
X
bia.,
kryst., nk
(-)
bia.,
kryst., nk
(-)
6
(-) (-) bia.,
kryst., nk
X (-) (-) (-)
7
(-) (-) (-) (-)
X
(-)
(-)
9
(-) (-) bia.,
kryst., nk
(-) (-) X (-)
10
(-) (-) (-) (-)
(-)
(-)
X
Jony baru tworzą z jonami siarczanowymi biały, krystaliczny osad, nierozpuszczalny w
kwasie azotowym.
Wnioski
: Jony baru znajdują się w probówce 5 wraz z jonami chlorkowymi (wykryte
wcześniej). Siarczany(VI) występują w probówkach 2, 3, 6 i 9. Probówka 9 zawiera więc
mieszaninę w skład której wchodzą jony siarczanowe(VI), jony jodkowe i jony sodu lub
potasu.
4. Reakcje charakterystyczne.
Wykrycie cynku.
Jony cynku w reakcji z NaOH strącają amfoteryczny osad rozpuszczalny w nadmiarze
odczynnika. Po ostrożnym zakwaszeniu alkalicznego roztworu osad wodorotlenku cynku
ponownie się wytrąca. Po strąceniu wodorotlenków z probówek 2 i 7 nadmiarem odczynnika i
zdekantowaniu osadu należy pobrać roztwór znad osadu i ostrożnie go zakwasić. Dla
probówki 7 próba ta daje pozytywny wynik, co świadczy, ze w probówce 7 znajdują się jony
cynku w mieszaninie z jonami kadmu lub magnezu. Wynik negatywnej reakcji z jonami Ag(I)
z probówki 4 jak i jonami Ba(II) z probówki 5 świadczy, że probówka 7 zawiera azotany(V).
Potwierdzenie identyfikacji cynku
.
Do kropli roztworu znad osadu wodorotlenków strącanych nadmiarem odczynnika dodaje
się roztwór PAN-u. Powstające intensywne czerwone zabarwienie świadczy o obecności
kompleksu cynku z PAN-em. Taki wynik reakcji otrzymuje się dla roztworów z probówki 7 i
C
. Podobną reakcję daje kadm, który można wykryć oddzielając cynk przez kilkakrotne
przemycie strąconego osadu wodorotlenku roztworem NaOH, rozpuszczenie osadu w kwasie
azotowym i po dodaniu PAN-u ponownym ostrożnym zalkalizowaniu. W odróżnieniu od
kadmu, magnez takiej reakcji nie daje, co ma miejsce w przypadku probówki 2.
Wniosek:
Probówka 2 zawiera siarczan(VI) magnezu, probówka 7 mieszaninę
azotanów(V) cynku i kadmu
, zaś probówka C – PAN.

7
Wykrycie chlorowodorku hydroksyloaminy i ferroiny
.
Ferroina jest wskaźnikiem redoks, w obecności reduktorów jest czerwona, w obecności
utleniaczy bladoniebieska, w niewielkim stężeniu niemal bezbarwna. Chlorowodorek
hydroksyloaminy ma właściwości redukujące.
Biały osad wodorotlenku manganu utlenia się na powietrzu do brunatnego manganianu(IV)
manganu(II) (Mn
2
O
3
), trudno rozpuszczalnego w kwasie azotowym. Rozpuszczanie to
zachodzi po dodaniu chlorowodorku hydroksyloaminy, która redukuje mangan(IV) do
Mn(II). Taka próba daje pozytywny rezultat dla roztworu z probówki B.
Niebieski osad hydroksosoli kobaltu(II) brunatnieje na powietrzu utleniając się do
wodorotlenku kobaltu(III). Dodatek roztworu chlorowodorku hydroksyloaminy powoduje
różowe zabarwienie charakterystyczne dla wodorotlenku kobaltu(II). Pozytywny wynik
reakcji potwierdza identyfikację hydroksyloaminy w probówce B.
Dodanie do zakwaszonej kwasem azotowym(V) (1-2 cm
3
kwasu) zawiesiny Mn
2
O
3
czerwonego roztworu z probówki D powoduje zanik czerwonego zabarwienia. W połączeniu
z brakiem reakcji na zmiany pH potwierdza to identyfikację ferroiny w probówce D.
Wykrycie chlorowodorku formaldoksymu
Po dodaniu chlorowodorku formaldoksymu do roztworu zawierającego jony manganu(II) i
zalkalizowaniu pojawia się brunatne zabarwienie, potwierdzające obecność manganu w
probówce 3 i chlorowodorku formaldoksymu w probówce F.
Wykrycie potasu
Przypuszczenie po reakcji z AgNO
3
, że probówka A zawiera tetrafenyloboran sodu,
powinno zostać potwierdzone w reakcji tego odczynnika z jonami K
+
. Tworzy się wtedy
biały, nierozpuszczalny w rozcieńczonym kwasie osad. Ma to miejsce dla roztworów z
probówek 8 i 9, co potwierdza obecność w nich jonów potasu a tetrafenoboranu sodu w
probówce A. Negatywny wynik reakcji z probówkami 1 i 10 świadczy, że zawierają one jony
sodu.
Ponadto wskazówka z treści zadania sugeruje, że roztwór tetrafenyloboranu sodu powinien
mieć odczyn zasadowy, co łatwo stwierdzić działając na bezbarwne roztwory z probówek A-
F
wykrytym błękitem tymolowym.
Potwierdzenie obecności jonów jodkowych i azotanów(III)
.
W środowisku kwaśnym azotany(III) utleniają jony jodkowe do jodu (zabarwienie żółte).
Wydzielanie jodu następuje po zmieszaniu i zakwaszeniu roztworów z probówek 1 i 9, co
potwierdza obecność jonów jodkowych i azotanów(III). Wydzielony jod można zredukować
także hydroksyloaminą z probówki B.
Potwierdzenie wykrycia jonów kobaltu(II) i jonów tiocyjanianowych
Jony kobaltu(II) tworzą z jonami tiocyjanianowymi różowy kompleks niewiele odbiegający
barwą od roztworu samego kobaltu. Roztwór staje się intensywnie niebieski po dodaniu
acetonu. Tak się dzieje, gdy zmiesza się czerwony roztwór z probówki 6 z bezbarwnym
roztworem z probówki 8.
Potwierdzenie wykrycia błękitu tymolowego.
W środowisku alkalicznym wskaźnik ten ma zabarwienie granatowe, w środowisku
kwaśnym czerwone. Zakwaszenie roztworu z probówki E powoduje powstanie czerwonego
zabarwienia, co w połączeniu z granatowym zabarwieniem w środowisku alkalicznym
jednoznacznie identyfikuje błękit tymolowy.
Document Outline
- zadteor II 56 do druku.pdf
- rozwteor II 56 do druku.pdf
- zad lab II 56 do druku.pdf
- rozw lab II 56 do druku.pdf
Wyszukiwarka
Podobne podstrony:
56 Olimpiada Chemiczna II etap laboratoryjny
56 Olimpiada Chemiczna III etap (2)
57 Olimpiada Chemiczna II etap laboratoryjny
56 Olimpiada Chemiczna III etap laboratoryjny (2)
55 Olimpiada Chemiczna II etap laboratoryjny
57 Olimpiada Chemiczna II etap
55 Olimpiada Chemiczna II etap
56 Olimpiada Chemiczna I etap (2)
56 Olimpiada Chemiczna I etap (2)
57 Olimpiada Chemiczna III etap laboratoryjny
55 Olimpiada Chemiczna III etap laboratoryjny
55 Olimpiada chemiczna III etap
więcej podobnych podstron