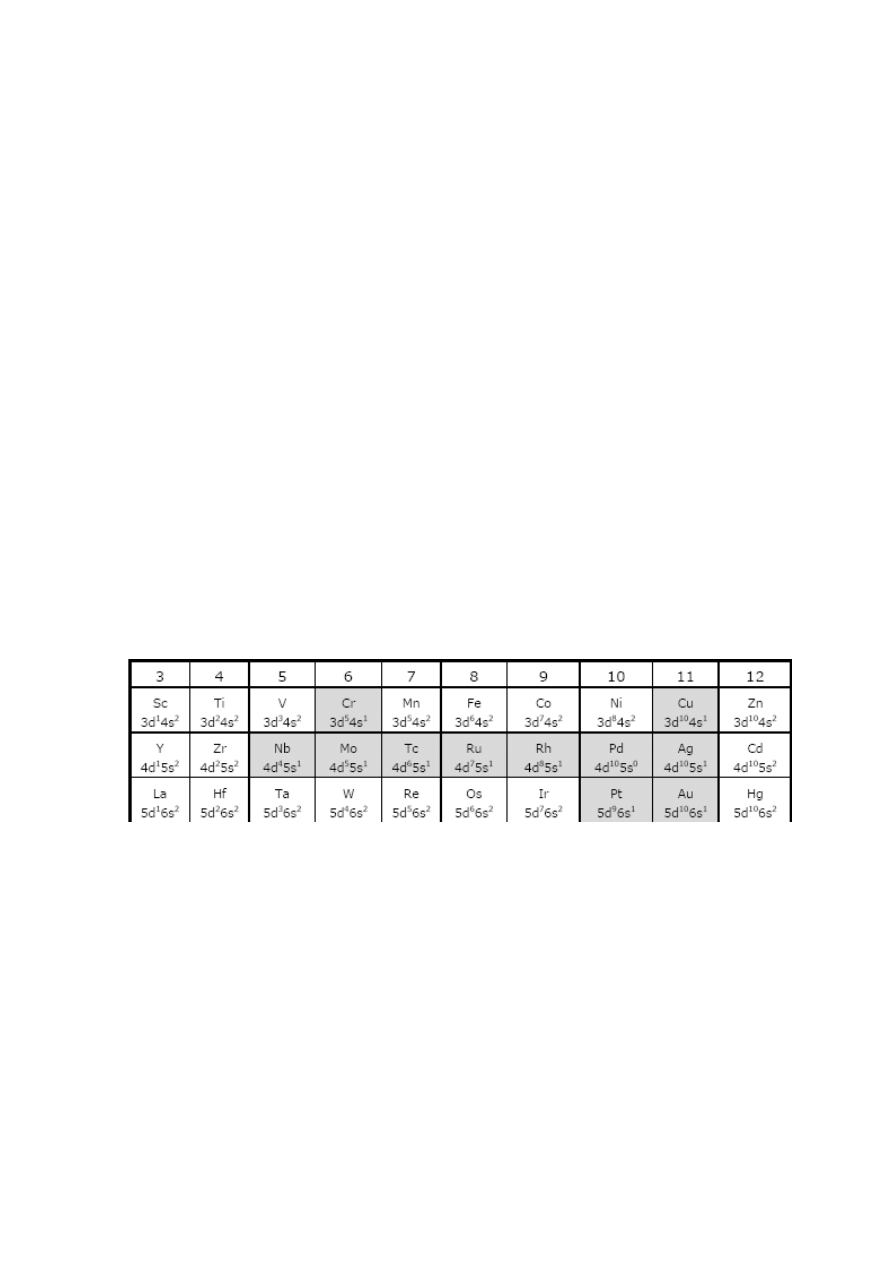
PRZEGLĄD PODSTAWOWYCH KLAS
ZWIĄZKÓW PIERWIASTKÓW BLOKÓW d i f
Wszystkie pierwiastki rodzin bloku d i f są
metalami. Pierwiastki bloku d, rodziny od 3 do 12,
występujące w czwartym, piątym, szóstym i siódmym
okresie UO, noszą miano pierwiastków przejściowych.
Pierwiastki rodzin bloku f, położone w szóstym
i siódmym okresie UO, noszą nazwę wewnątrz
przejściowych. Rozróżnienie to wynika ze szczególnej
struktury
zewnętrznych
powłok
elektronowych
atomów.
● Pierwiastki przejściowe – z pewnymi wyjątkami
(patrz szare pola w zamieszczonej tabeli; pierwiastki
siódmego okresu pominięte) struktura (n-1)d
1-10
ns
2
.
●
Pierwiastki wewnątrz przejściowe – struktury
4f
1-14
5d
1
6s
2
(lantanowce) i 5f
0-14
6d
0-2
7s
2
(aktynowce);
● Orbitale d i f w atomach są obsadzone elektronami
zgodnie z regułą Hunda. Elektrony w połowicznie
obsadzonych orbitalach d i f mają swobodne spiny,
natomiast w całkowicie obsadzonych orbitalach ich
spiny są sparowane. Konfiguracje d
5
i d
10
oraz f
7
i f
14
są bardzo trwałe.

Model klatkowy dla konfiguracji d
5
i d
10
oraz f
7
i f
14
Pierwiastki d-elektronowe
Właściwości fizyczne
Wszystkie są metalami o typowych cechach:
- połysk metaliczny,
- dobre przewodnictwo cieplne i elektryczne,
szczególnie u miedzi i srebra,
- korzystne cechy mechaniczne,
wytrzymałość, kowalność, plastyczność,
- zdolność tworzenia stopów.
W stanie stałym mają struktury krystaliczne A
1
,
A
2
lub A
3
. Metale rodzin 3-11 topią się w wysokich lub
bardzo
wysokich
temperaturach.
Najwyższe
temperatury topnienia mają wolfram (3410
o
C) i ren
(3180
o
C). Niskie temperatury topnienia mają
pierwiastki rodziny 12 (cynkowce), szczególnie rtęć,
która jest metalem o najniższej temperaturze topnienia
(-38,9
o
C). Trzy spośród metali d-elektronowych mają
małą gęstość, mianowicie skand (2,99 g/cm
3
), itr (4,48
g/cm
3
)
i tytan (4,51 g/cm
3
), dlatego należą do grupy
metali lekkich. Gęstość pozostałych metali przekracza
5 g/cm
3
, dlatego są metalami ciężkimi, szczególnie
wolfram (19,35 g/cm
3
), ren (20,53 g/cm
3
), osm (22,48
g/cm
3
), iryd (22,48 g/cm
3
) i platyna (21,45 g/cm
3
).
Metale rodzin 3 – 11 mają są paramagnetyczne,
bowiem w zewnętrznych powłokach elektronowych ich
atomów występują elektrony o swobodnych spinach.
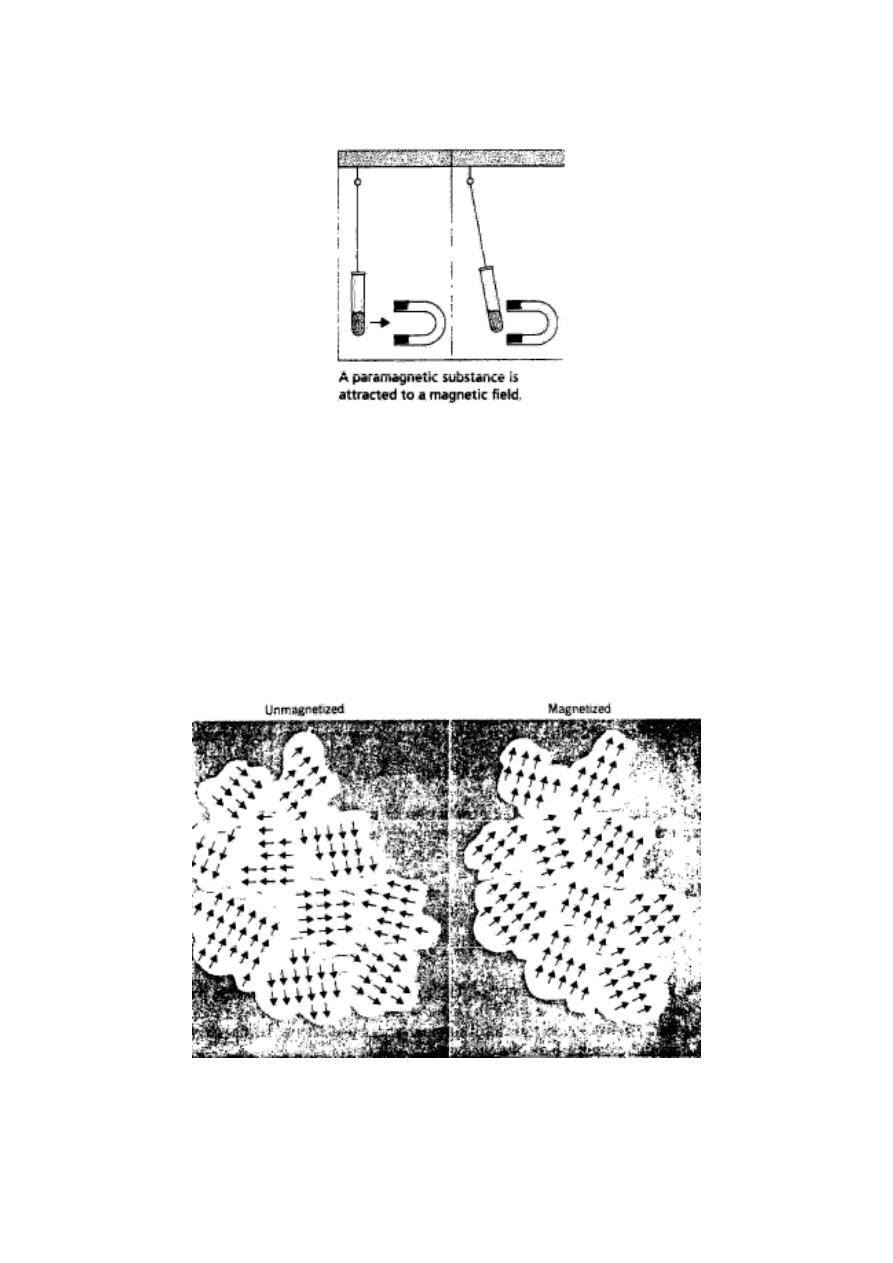
Rys. 1. Oddziaływanie zewnętrznego pola magnetycznego na substancję
paramagnetyczną
Szczególnie silny paramagnetyzm to ferromagnetyzm
u żelaza, niklu, kobaltu, gadolinu (lantanowiec) oraz
w ich stopach. Ferromagnetyzm substancji jest
uwarunkowany pojawieniem się domen, to znaczy
obszarów uporządkowania momentów magnetycznych
elektronów
pod
wpływem
zewnętrznego
pola
magnetycznego.
Rys. 2. Pojawienie się domen w ferromagnetyku w zewnętrznym
polu magnetycznym
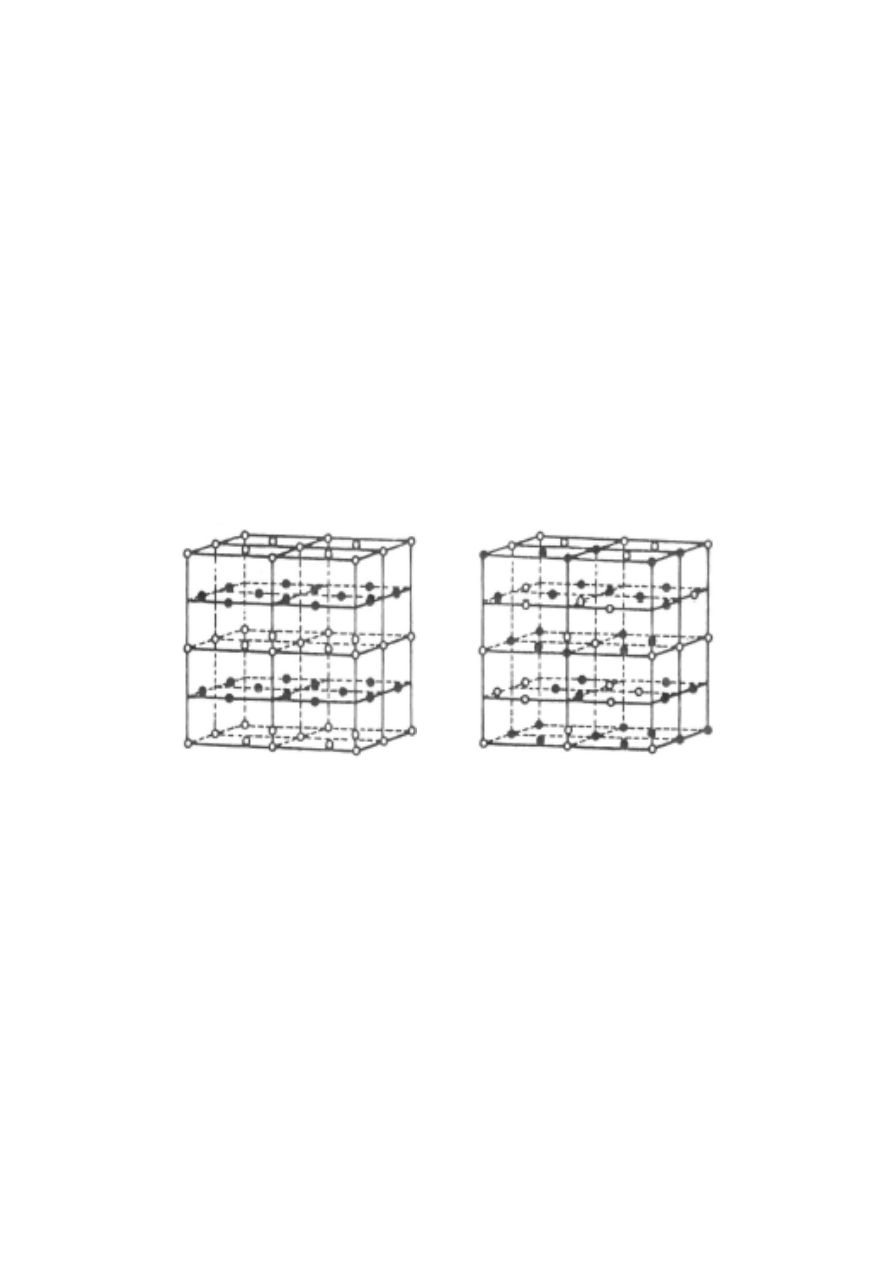
Metale d-elektronowe tworzą liczne stopy dwu-
lub wieloskładnikowe. Przykładowo, złoto próby 900
jest dwuskładnikowym stopem złota (90%) i miedzi
(10%), co zwiększa jego odporność na ścieranie.
Stopami wieloskładnikowymi są różne rodzaje stali.
Duże znaczenie praktyczne mają stopy miedzi
z cynkiem (mosiądze) i cyną (brązy). Można
wyróżnić dwa typy stopów dwuskładnikowych:
- substytucyjne, tj. uporządkowane,
- nieuporządkowane.
a
b
Rys. 3. Struktura stopów dwuskładnikowych
a) substytucyjny z płaszczyznami sieciowymi obsadzonymi na
przemian przez atomy A lub B;
b) nieuporządkowany, atomy A i B są przypadkowo rozmieszczone
Stopy nieuporządkowane powstają po szybkim
ochłodzeniu stopionej mieszaniny dwóch metali.
Długotrwałe wygrzewanie stopu poniżej temperatury
topnienia daje stopy substytucyjne.
Właściwości chemiczne
Za wyjątkiem miedzi, srebra, złota, platynowców
i rtęci, pozostałe metale d-elektronowe mają ujemne
standardowe potencjały elektrochemiczne i są metalami
nieszlachetnymi.
Nieszlachetność
elektrododatnich
metali potwierdza również ich stosunkowo niska
elektroujemność, np. Sc - 1,3, Y – 1,2, Ti – 1,5,
Cr – 1,5, Mn – 1,7, Zn – 1,6. Elektroujemność metali
najbardziej szlachetnych jest wyższa, np. Au – 2,4,
Pt -2,2.
W piątym i szóstym okresie UO promienie
atomowe i jonowe metali przejściowych w tej samej
rodzinie są identyczne lub bardzo podobne z powodu
kontrakcji lantanowcowej. Skutkuje to bardzo dużym
podobieństwem właściwości chemicznych, np. cyrkonu
i
hafnu,
niobu
i
tantalu
oraz
molibdenu
i wolframu.
Tabela 1. Promienie atomowe i jonowe wybranych par metali
Promień, pm
Zr
Hf
Nb
Ta
Mo
W
Atomowy
160
159
146
149
139
139
Jonowy
M(VI)
M(V)
M(IV)
M(III)
86
85
64
68
72
64
68
72
59
65
60
66
Metale d-elektronowe występują w związkach lub
w jonach na różnych stopniach utlenienia (tabela 2). Na
niskich stopniach utleniania (+1, +2) elektrony
walencyjne atomu metalu przejściowego pochodzą
z orbitalu ns. Wyższe stopnie utlenienia - elektronami
walencyjnymi są elektrony z orbitalu (n-1)d.
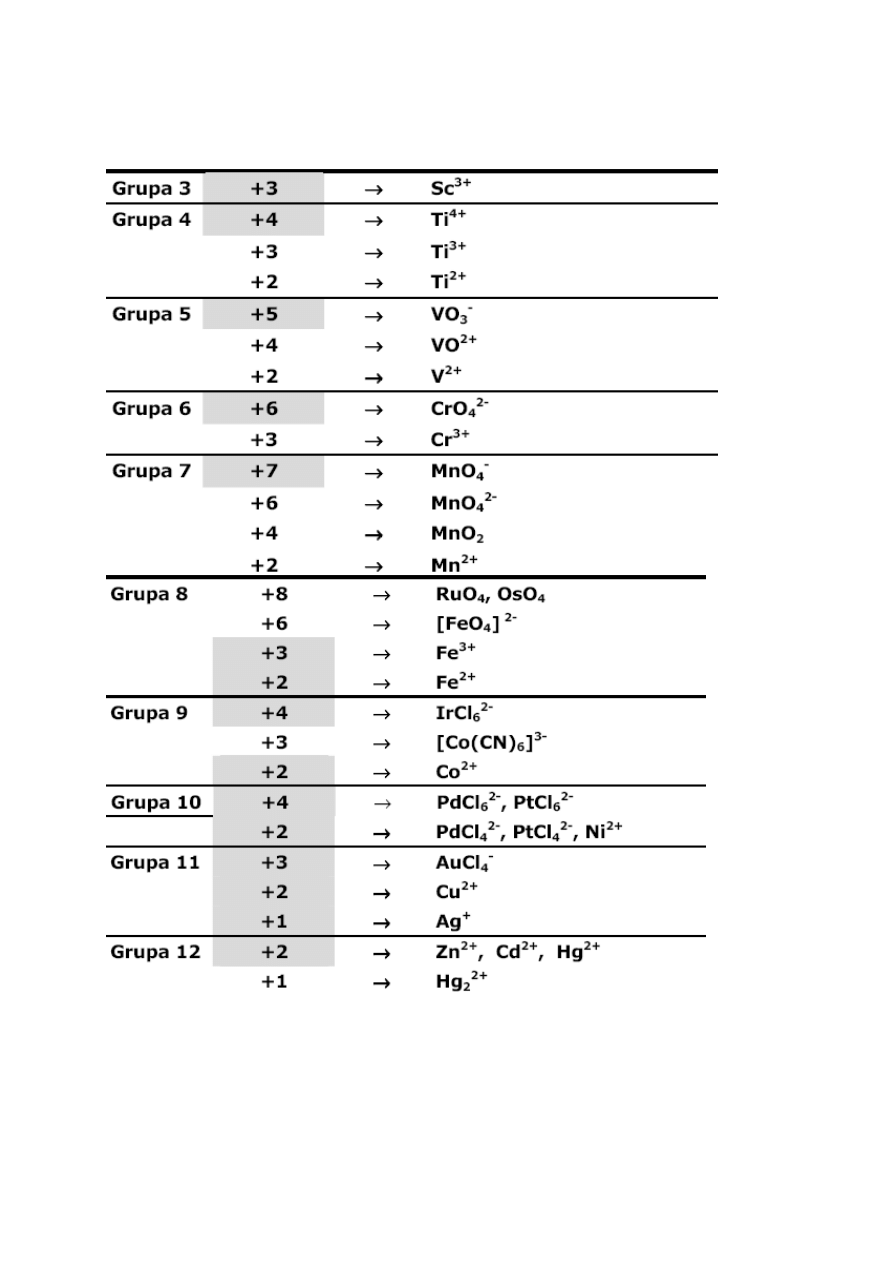
Tabela 2. Stopnie utlenienia metali d-elektronowych
*Tłem szarym zaznaczono najtrwalsze stopnie utlenienia

Niskie i bardzo niskie stopnie utlenienia (ujemne, 0, +1)
metali przejściowych są stabizowane w kompleksach
z takimi ligandami, jak tlenek węgla, jony cyjankowe
CN
-
, węglowodory aromatyczne, 2,2’-bipirydyl (bipy),
1,10-fenantrolina (phen).
Przykłady:
[Fe(CO)
4
]
2-
- tetrakarbonylożelazian(2-)
[Co(CO)
4
]
-
- tetrakarbonylokobaltan(1-)
[Ni(CO)
4
] – tetrakarbonylonikiel(0)
[Ni(CN)
4
]
4-
- tetracyjanoniklan(0)
[Cr(C
6
H
6
)
2
] – dibenzochrom(0),
kompleks sandwiczowy
rys. 4b
[Mn(CO)
6
]
+
- heksakarbonylomangan(I)
[Cu(phen)
2
]
+
- difenantrolinamiedź(I)
[Cu(CN)
4
]
3-
- tetracyjanomiedzian(I)
Wysokie stopnie utlenienia metali przejściowych są
stabilizowane przez aniony tlenkowe O
2-
, aniony
fluorkowe F
-
lub chlorkowe Cl
-
.
Przykłady:
OsO
4
– tetratlenek osmu(VIII)
ReO
4
-
- tetraoksorenian(VII), renian(VII)
[Cr
2
O
7
]
2-
- heptaoksodichromian(VI)
[TaF
7
]
2-
- heptaflurotantalan(V)
[PtCl
6
]
2-
- heksachloroplatynian(IV)
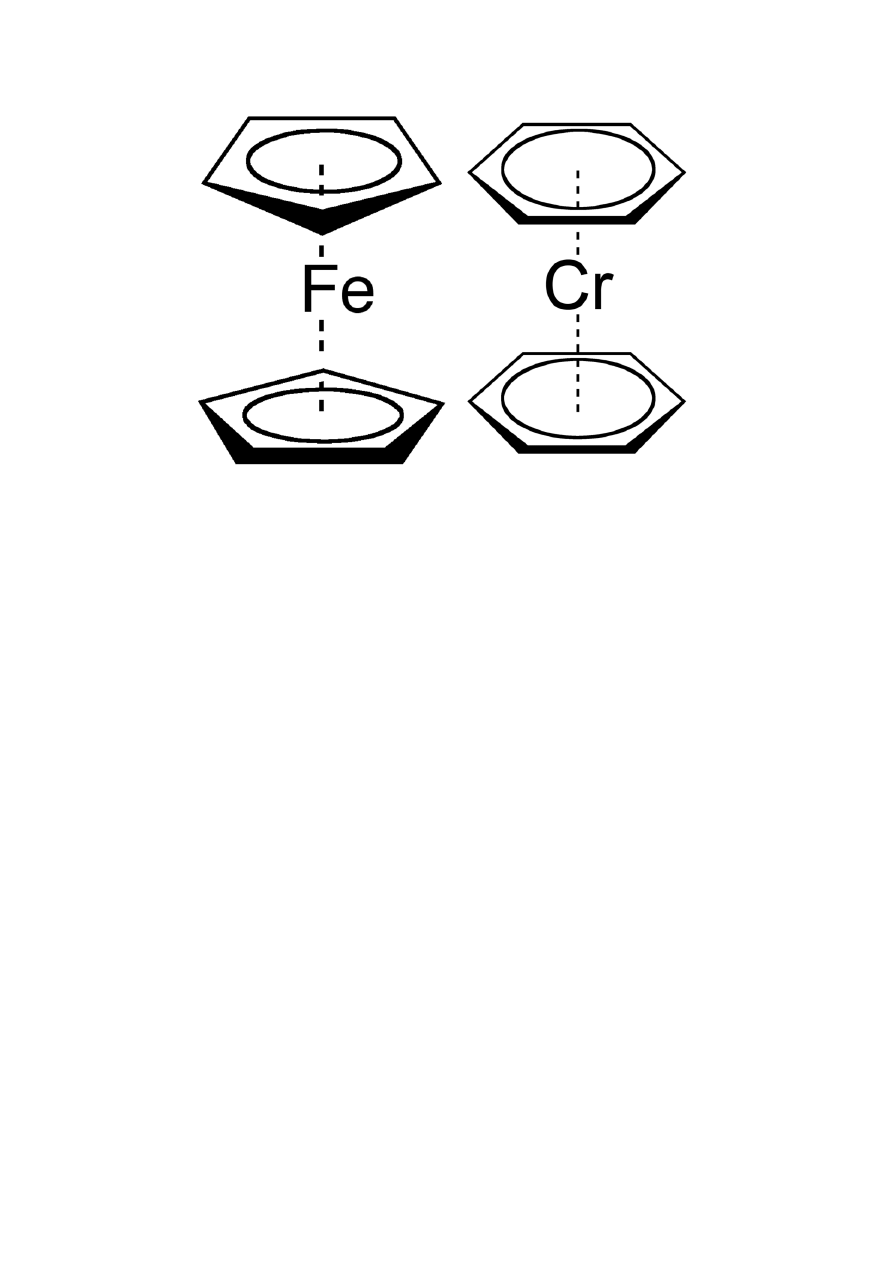
a b
Rys. 4. Kompleksy sandwiczowe (kanapkowe)
a) kompleks cyklopendienylowy Fe(II), ferrocen
b) dibenzochrom(0)
Metale d-elektronowe na różnych stopniach utlenienia mają
zdolność tworzenia:
● prostych kationów, np. Sc
3+
, Cr
3+
, Fe
2+
, Fe
3+
, Co
2+
, Ni
2+
, Co
2+
,
Cu
2+
, Ag
+
, Zn
2+
, Cd
2+
, Hg
2+
. Wiele tych kationów w postaci
akwakompleksów jest barwna;
● oksokationów, np. TiO
2+
, VO
2+
, VO
2
+
, MoO
2
2+
;
● oksoanionów, np. TiO
3
2-
, VO
4
3-
, CrO
4
2-
, MoO
4
2-
, WO
4
2-
,
MnO
4
-
, ReO
4
-
;
● wielkiej liczby kompleksów, w tym związków barwnych.
Barwa połączeń metali pierwiastków przejściowych jest
wynikiem przejść elektronowych między rozszczepionymi
w polu ligandów orbitalami d. Absorpcja kwantów
promieniowania o ściśle określonej energii w zakresie
widzialnym skutkuje tym, że dany jon lub cząsteczka ma taką
barwę, jak światło przepuszczane (rys. 5, barwa dopełniająca).

Rys. 5. Postawowe barwy w zakresie widzialnym
Tlenki metali d-elektronowych
Układy metal - tlen są zazwyczaj bardzo skomplikowane, np.
w układzie wanad – tlen stwierdzono dwanaście faz tlenkowych o
różnym stosunku molowym V/O. Niektóre tlenki metali
d-elektronowych mogą mieć skład odbiegający od idealnej
stechiometrii,
są
więc
typowymi
(związkami
niestechiometrycznymi (bertolidami), np. Fe
0,93
O
1,00
, Ti
1,00
O
0,98
.
Tlenki metali d-elektronowych mogą mieć charakter:
● zasadowy, np. MnO, FeO, CoO, NiO, CuO, CdO;
● kwasowy, np. TiO
2
,V
2
O
5
, CrO
3
, Mn
2
O
7
;
● amfoteryczny, np. Cr
2
O
3
, ZnO.
Od tlenków kwasowych, np. V
2
O
5
, Nb
2
O
5
, CrO
3
pochodzą
odpowiednie kwasy tlenowe, których aniony mogą mieć
skomplikowaną strukturę opartą na tetraedrycznych anionach
MO
4
2-
. Aniony te mogą mieć wspólne naroże, np. anion
dichromianowy(VI),
Cr
2
O
7
2-
,
jest
zbudowany
z
dwóch
tetraedrycznych anionów CrO
4
2-
o wspólnym narożu (rys. 6).
wyższa energia
niższa energia
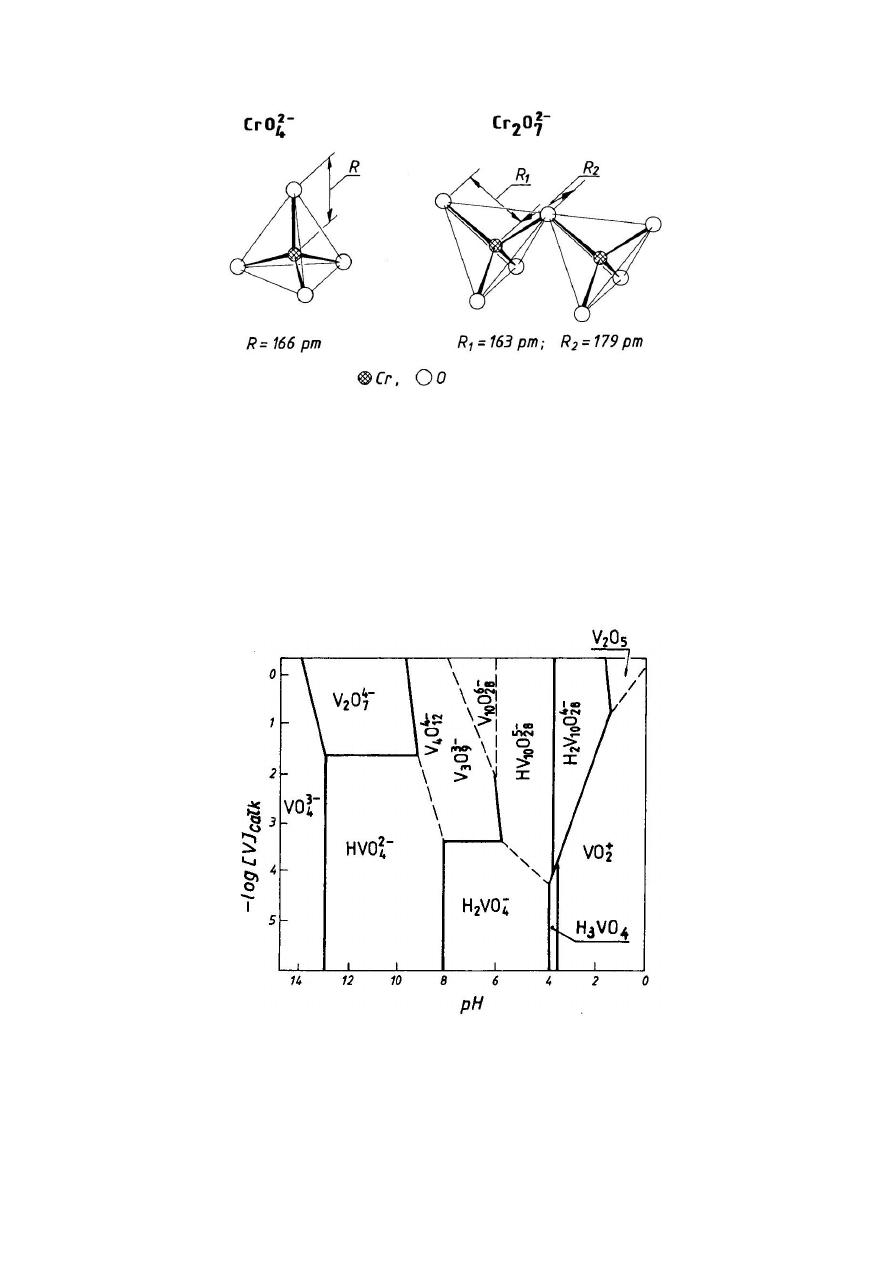
Rys. 6. Struktura anionów CrO
4
2-
i Cr
2
O
7
2-
Kwas chromowy(VI) – H
2
CrO
4
i kwas dichromowy(VI) – H
2
Cr
2
O
7
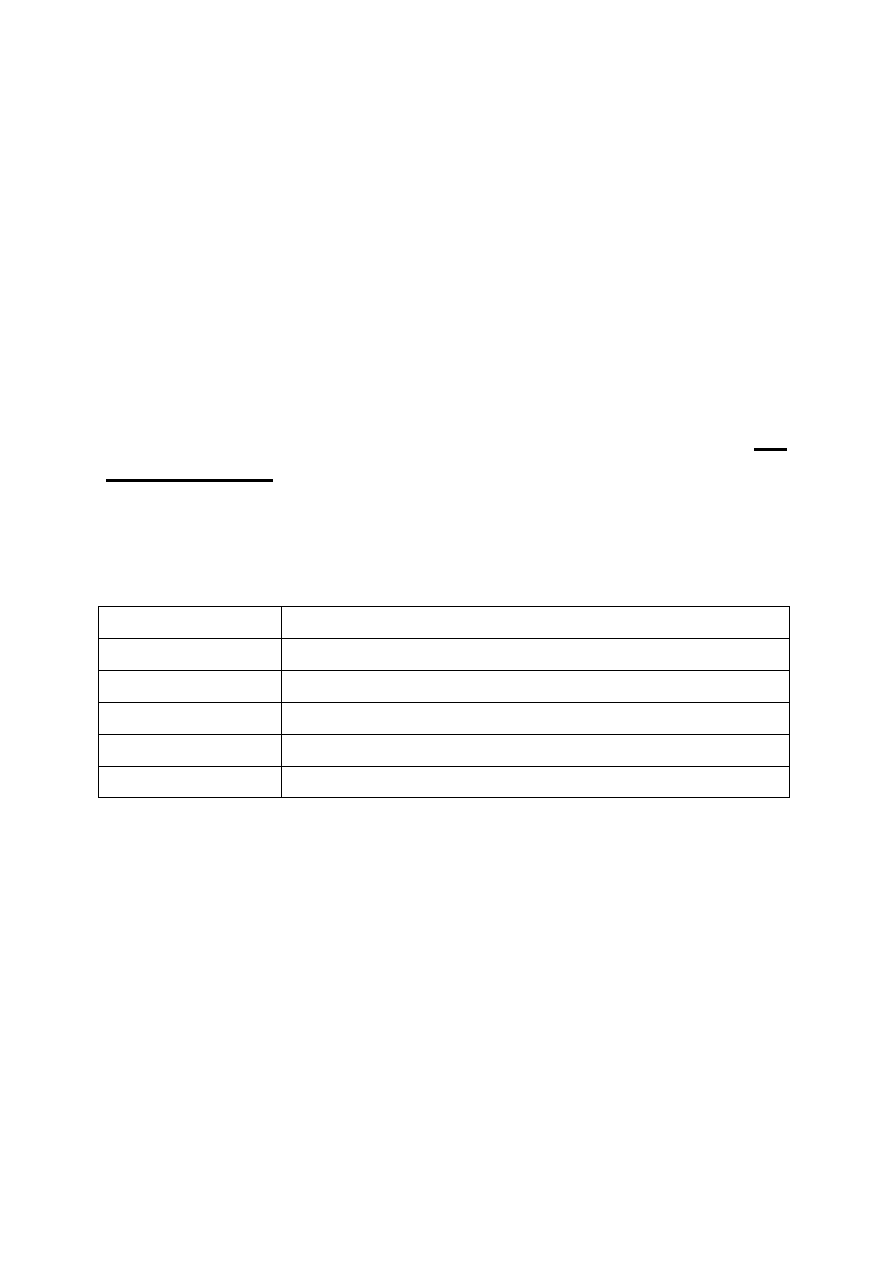
są typowymi przedstawicielami tzw. izopolikwasów. Znacznie
większa liczba izopolikwasów wywodzi się od V
2
O
5
(rys. 7).
Elementem
strukturalnym
anionów
izopolikwasów
wanadowych(V) są tetraedryczne aniony VO
4
3-
, które mogą mieć
wspólne naroże, krawędź lub ścianę.
Rys. 7.
Występowanie różnych form jonowych wanadu(V) w funkcji pH
i całkowitego stężenia metalu w roztworze

Wodorki metali d-elektronowych
Wodorki
metali
d-elektronowych
mają
charakter metaliczny i są typowymi fazami
śródwęzłowymi, bowiem atomy wodoru zajmują luki
w przestrzeniach międzywęzłowych sieci metalu.
Typowym przykładem jest pallad, który pochłania
do 44% atomowych wodoru. Wodór nie zmienia sieci
A
1
palladu, ale powoduje zwiększenie wymiarów
komórki elementarnej. Pallad nasycony wodorem
nie pochłania więcej wodoru, a w postaci cienkich
folii przepuszcza selektywnie wodór zatrzymując
inne gazy i pary. Stąd folie z palladu spełniają
funkcję sita molekularnego służącego do bardzo
dokładnego oczyszczania wodoru.
Podobny charakter mają wodorki tytanu
i niektórych lantanowców oraz ich stopów. Metale
obciążone
wodorem
w
stosunkowo
niskiej
temperaturze oddają wodór po ogrzaniu. Znajduje
to zastosowania praktyczne, np. w ogniwach
paliwowych lub do magazynowania wodoru.
Związki metali d-elektronowych z innymi
niemetalami
Związki pierwiastków metali przejściowych
z azotem, borem, węglem i krzemem mają szereg
bardzo ważnych cech, mianowicie bardzo wysokie
temperatury topnienia, są żaroodporne, bardzo
twarde, dają się obrabiać mechanicznie. Są to
typowe fazy sródwęzłowe, ponieważ promienie
atomowe
wymienionych
niemetali
są
małe
w porównaniu z promieniami metali przejściowych.
Z
tego
powodu
niemetale
zajmują
luki
w przestrzeniach międzywęzłowych sieci uzyskanych
połączeń.
FAZY ŚRÓDWĘZŁOWE
Połączenia metali przejściowych (M) z pierwiastkami
niemetalicznymi (X) o małych promieniach atomowych,
takich jak wodór, bor, węgiel, azot, krzem, z powodu
specyficznej ich struktury sieciowej określa się mianem faz
sródwęzłowych. Związki te zaliczamy do związków
niestechiometrycznych (bertolidów), ponieważ występują
zazwyczaj w szerszych zakresach składów niż to wynika z
przypisywanych im wzorom chemicznym (tabela 3).
Tabela 3. Wybrane przykłady faz śródwęzłowych
Układ
Przykłady
M-H
TiH
2
, ZrH
2
, VH, PdH
0,6
, ThH
3,75
, UH
3
M-B
VB
2
, NbB
2
, TaB
1,0-1,3
, TaB
2
M-C
V
4
C
3
, Nb
0,75-1,00
C, WC, Mn
7
C
3
, Fe
3
C
M-N
TiN
0,42-1,16
, V
3
N, F
4
N, Co
3
N, Ni
3
N
M-Si
TiSi
2
, NbSi
2
, CrSi
2
Związkom śródwęzłowym zazwyczaj odpowiada skład
chemiczny zbliżony do wzorów MX, M
2
X, M
4
X i MX
2
. Ich
struktury można jakościowo przewidzieć kierując się
regułami Hägga, określającymi, że przy stosunku promieni
atomowych r
X
:r
M
< 0,59 powstają proste typy sieci
przestrzennych, natomiast przy r
X
:r
M
> 0,59 powstają
struktury
bardziej
złożone.
Promienie
atomowe
rozważanych tu pierwiastków niemetalicznych są równe:
r
H
= 0,030, r
B
= 0,087, r
C
= 0,077, r
N
= 0,071, r
Si
= 0,117 nm.
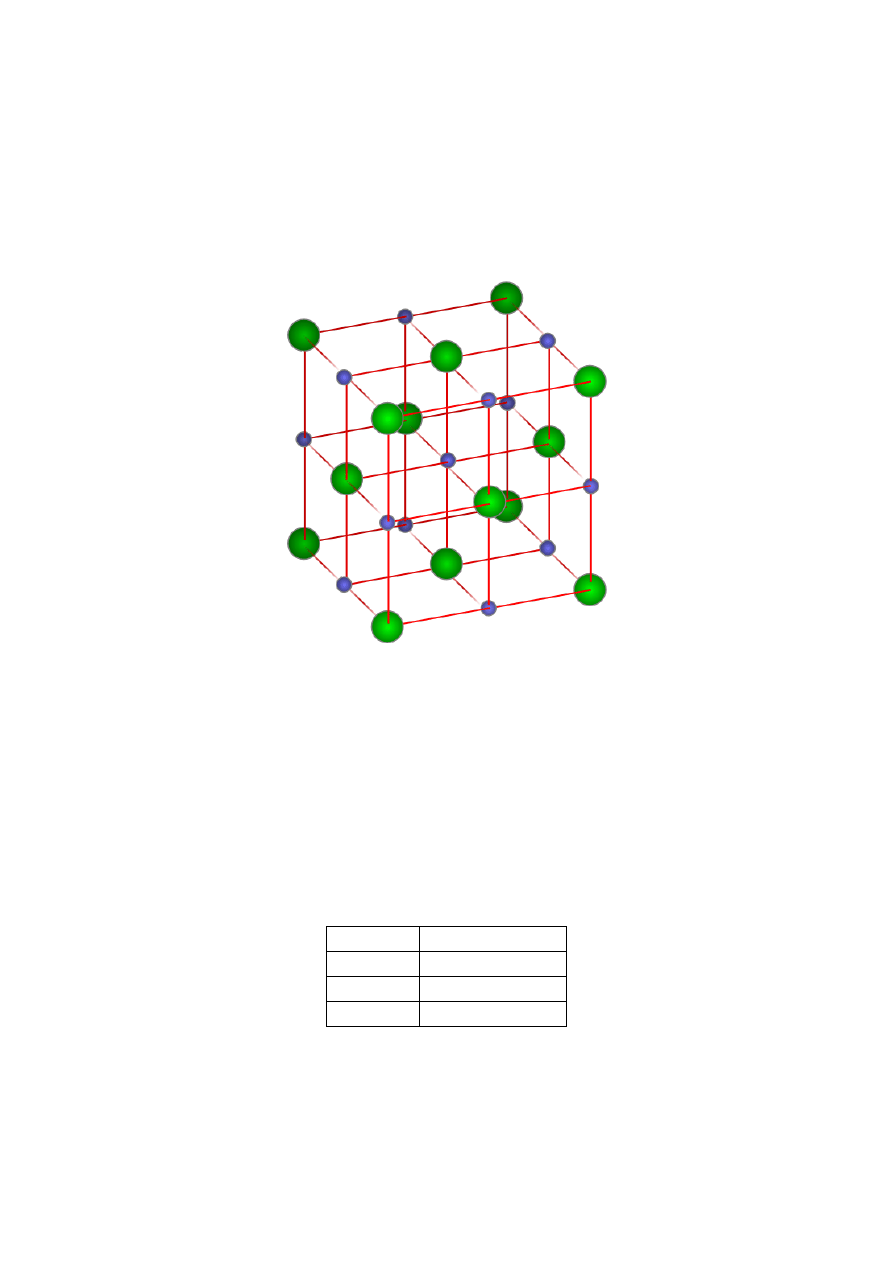
Rozpatrzmy sieć metalu typu A
1
, z której po obsadzeniu
trzynastoma atomami niemetalu środka sześcianu (1) oraz
środka każdej krawędzi (12), uzyskuje się sieć regularną
typu NaCl.
Rys. 8. Faza śródwęzłowa z siecią regularną typu A1
Związki śródwęzłowe mogą mieć również sieci wywodzące
się z sieci typu A
2
i A
3
lub prymitywnej sieci heksagonalnej.
Stosowalność reguł Hägga dobrze ilustrują związki
chromu, r
Cr
= 0,128 nm. Pierwszą z nich spełniają azotki
chromu, natomiast węgliki chromu podlegają drugiej
regule.
W przypadku węglików często pojawiają się fazy
o składzie MC
2
, których sieci są zdeformowane
Związek
Struktura
rombowa
Cr
2
N
A
3
CrN
A
3
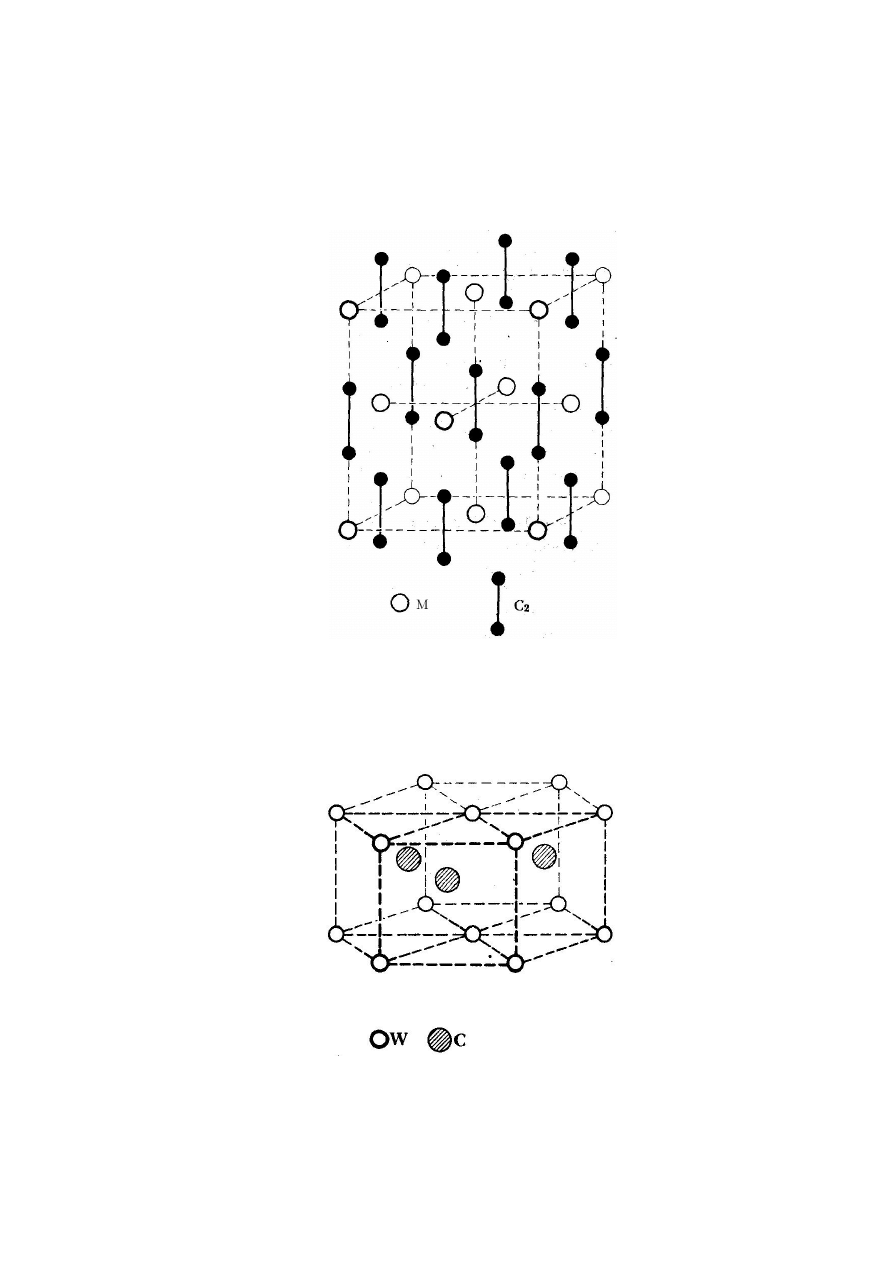
tetragonalnie, a pozycje międzywęzłowe są obsadzone
przez dwa atomy węgla, tworzących parę C
2
:
Rys. 9. Struktura sieci węglika o składzie MC
2
Przykładem związku o strukturze heksagonalnej jest
węglik wolframu, WC:
Rys. 7. Struktura hegsagonalna węglika wolframu WC

W przeciwieństwie do wodorków, azotków i węglików,
borki metali przejściowych zazwyczaj nie spełniają reguły
Hägga, dlatego tworzą własne typy struktur, MB, M
2
B,
MB
2
, MB
4
, MB
6
i niekiedy MB
12
, w których atomy boru
tworzą charakterystyczne ugrupowania, np. łańcuchy
(MB), warstwy (MB
2
) lub sieci trójwymiarowe (MB
4
, MB
6
i MB
12
).
Fazy śródwęzłowe są doskonałymi przewodnikami,
niekiedy ich przewodnictwo, np. TiB
2
i ZrB
2
, jest znacznie
większe niż czystego składnika metalicznego, a w bardzo
niskich temperaturach stają się nadprzewodnikami.
Ponadto, węgliki, azotki i borki tytanowców, wanadowców,
i chromowców są materiałami bardzo twardymi
o twardości
9 w skali Mohsa. Krzemki wymienionych
metali przejściowych są również bardzo twarde, ale nie
dorównują pod tym względem węglikom, azotkom lub
borkom. Wszystkie wymienione związki śródwęzłowe mają
bardzo wysokie temperatury topnienia, są żaroodporne,
wykazują
bardzo
dużą
odporność
na
korozję
wysokotemperaturową. Na drodze spiekania uzyskuje się
z nich lite materiały o cennych właściwościach
mechanicznych i użytkowych. Z tego powodu węgliki,
azotki, borki i krzemki metali przejściowych mają
podobne znaczenie praktyczne jak węglik krzemu, SiC,
oraz azotek boru, BN.
Węgliki
Węgliki metali przejściowych są znane od dawna
i należą do najlepiej poznanych związków śródwęzłowych.
Właściwości
fizyczne
najważniejszych
gospodarczo
węglików metali zestawiono w tabeli 4.
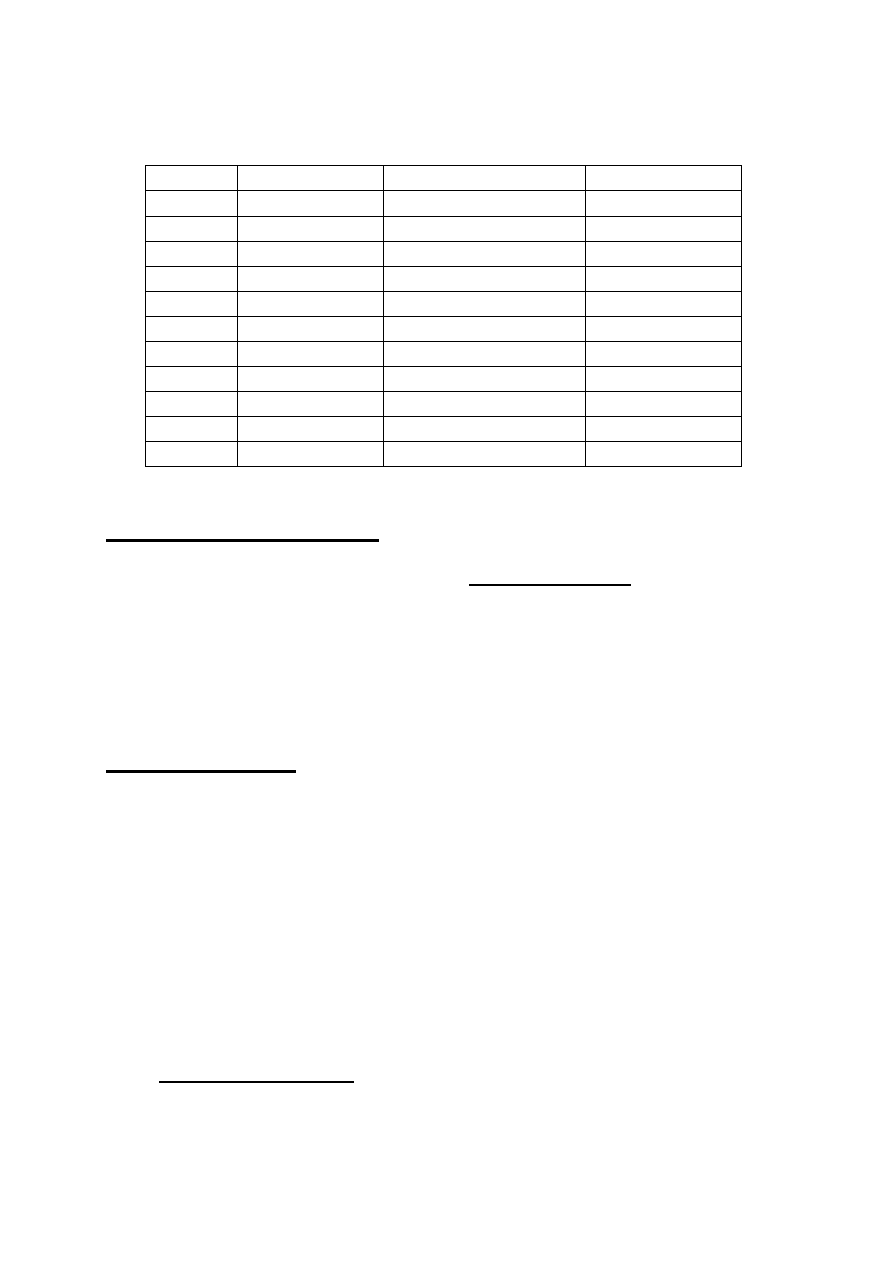
Tabela 4. Właściwości węglików metali przejściowych
Związek Gęstość, g/cm
3
Temp. topnienia,
o
C
Struktura
TiC
4,93
3160
NaCl
ZrC
6,73
3532
NaCl
HfC
12,76
3890
NaCl
5,77
2830
A
1
NbC
7,82
3490
A
1
TaC
13,9
3880
A
1
6.65
1890
Rombowa
Mo
2
C
9,18
2400
Brak danych
MoC
2692
Brak danych
W
2
C
17,34
2730
A
3
WC
15,70
2630
Heksagonalna
Zastosowania węglików
Należy tu wspomnieć o węgliku boru, B
4
C, który
w temperaturze powyżej 2200
o
C można spiekać na lity
materiał. Z węglika boru, ze względu na duży przekrój
czynny boru na wychwyt neutronów termicznych,
wykonuje się pręty kontrolne w reaktorach jądrowych.
Obok węglika boru, duże znaczenie praktyczne ma
węglik krzemu, SiC, który ze względu na dobre
przewodnictwo cieplne, dużą żaroodporność i odporność
na gwałtowne zmiany temperatury, jest cenionym
materiałem ceramicznym, np. stosowanym do wyrobu
tygli. Ponadto, SiC odznacza się niezwykłą twardością,
dlatego jest stosowany jako materiał ścierny i polerski. SiC
jest półprzewodnikiem samoistnym i w postaci prętów
stosuje się go jako element grzejny w elektrycznych
piecach oporowych, pracujących w temperaturze 1100-
1500
o
C.
Węglik
tytanu
jest
najtwardszym
węglikiem
metalicznym, który domieszkowany skandem dorównuje
twardością diamentowi. TiC jest bardzo odporny na

utlenianie w wysokich temperaturach, dlatego stosuje się
go jako wykładzinę w komorach spalania silników
odrzutowych, gdzie gazy spalinowe mają temperaturę 900-
1100
o
C.
Węgliki cyrkonu i hafnu, ZrC i HfC, stosuje się jako
materiały w technice jądrowej. Jądrowo czysty Zr, tzn.
wolny od domieszki hafnu, stosuje się jako osłonę
elementów paliwowych (UC wzbogacony w U
235
). Z kolei
HfC, ze względu na duży przekrój czynny hafnu na
wychwyt neutronów termicznych, jest używany jako
materiał na pręty kontrolne w reaktorach jądrowych.
Węgliki niobu i tantalu, wchodzą w skład faz
mieszanych typu (Ti,Ta)C, (Nb,Ta)C i (Ti,Nb,Ta,W)C,
stosowanych do produkcji narzędzi skrawających, wierteł,
itp., oraz elementów konstrukcyjnych maszyn i urządzeń
narażonych na silne tarcie i zużycie w wyniku pracy
pod
dużymi
obciążeniami
w
podwyższonych
temperaturach. TaC ma wyjątkowo dużą odporność
termiczną w temperaturach do 3000
o
C, ponadto, jako
składnik węglików mieszanych nadaje wykonanym z nich
kształtkom
znaczną
wytrzymałość
mechaniczną
i odporność na utlenianie
Węglik wolframu, WC, jest jednym z najważniejszych
związków śródwęzłowych, ponieważ odznacza się wysoką
temperaturą topnienia, dużą twardością i dobrą
odpornością termiczną, a jednocześnie wykazuje zdolność
tworzenia stopów i faz mieszanych z kobaltem. Stopy te
mają dużą twardość i są powszechnie stosowane do
wyrobu narzędzi skrawających, wierteł, tłoczników,
matryc, itp.

Azotki
Ty
Azotki metali przejściowych mają właściwości fizyczne
podobne do odpowiednich węglików (tabela 5).
Tabela 5. Właściwości fizyczne azotków niektórych metali przejściowych
Związek Gęstość, g/cm
3
Temp. topnienia,
o
C
Struktura
TiN
5,43
2930
NaCl
ZrN
7,09
2960
NaCl
HfN
13,94
3310
NaCl
VN
6,10
2050
A
1
NbN
8,47
2573
Brak danych
TaN
14,36
3090
Brak danych
Cr
2
N
Brak danych
1895
A
3
CrN
Brak danych
1500
A
3
Do omawianej grupy związków można również
zaliczyć azotek boru, BN, oraz azotek krzemu, Si
3
N
4
, które
wykazują podobieństwo podstawowych właściwości
fizycznych do typowych faz sródwęzłowych, jakimi są
azotki metali przejściowych. Wszystkie związki są bowiem
bardzo twarde i topią się na ogół w wysokich lub bardzo
wysokich temperaturach. Azotki metali przejściowych
bardzo dobrze przewodzą prąd elektryczny. Azotki
molibdenu i wolframu są stosunkowo nietrwałe, ponieważ
rozkładają się w temperaturze poniżej 800
o
C.
Jako tworzywa specjalne azotki odgrywają mniejszą
rolę niż omawiane wcześniej węgliki. Tym niemniej warto
odnotować, że prasowane na gorąco półprodukty z azotku
boru są mniej kruche niż materiały ceramiczne, dlatego
można je obrabiać mechanicznie, np. nawiercać lub
skrawać. Cenną cechą tygli ze spiekanego azotku krzemu
jest brak zwilżalności ich wewnętrznej powierzchni przez
stopiony krzem lub german, stąd zastosowanie ich w
procesach topienia strefowego obydwu tych pierwiastków.
Inne zalety Si
3
N
4
to mała gęstość (3,18 g/cm
3
) i duża

odporność chemiczna na działanie kwasów. Kolejna cecha
to odporność na gwałtowne zmiany temperatury i trwałość
termiczna aż do 2000
o
C, stąd azotek krzemu nadaje się
na wykładzinę w komorach spalania silników i turbin
gazowych.
Azotek tytanu, TiN, jest bardzo twardym materiałem
stosowanym do wyrobu wierteł i narzędzi skrawających.
Azotki cyrkonu i niobu, ZrN, NbN, cechuje znakomita
ogniotrwałość i duża odporność na stopione metale
i ich pary oraz korozję gazową, stąd obydwa związki
nadają się na wykładziny komór spalania silników i turbin
i dysz w silnikach rakietowych. W niskich temperaturach
azotki cyrkonu i niobu są nadprzewodnikami.
Rys. 8. Świder pokryty azotkiem tytanu TiN

Wyszukiwarka
Podobne podstrony:
9. Przegląd podstawowych klas związków pierwiastków bloków d i f, pwr biotechnologia(I stopień), II
8 Przeglad podstawowych klas z Nieznany (2)
Przegląd podstawowych algorytmów
Przegląd podstawowy i rozszerzony tunelu, Protokół - tunele
Przegląd podstawowy i rozszerzony konstrukcji oporowej, Protokół - konstrukcje oporowe
Test umiejętności podstawowych - klas VI, Sprawdziany
Przegląd podstawowy i rozszerzony przepustu, Protokół - przepusty
Przegląd podstawowy i rozszerzony obiektu mostowego, Protokół - obiekty mostowe
IT Przegląd podstawowych algorytmów
1CHEMICZNY AS TRZECICH KLAS zadanie 5 pierwiastek E tworzy kwas o wzorze H2EOn
więcej podobnych podstron