1
Równowaga w
dzie ciecz-para
Ćwiczenie laboratoryjne nr 1

2
Opracowała dr in . Anna Ptaszek
Układy wieloskładnikowe wielofazowe
Równowaga gaz-ciecz
Rozpuszczalno gazów w cieczach jest zjawiskiem niezwykle istotnym. Prosta obserwacja ró nic w
rozpuszczalno ci np. tlenu CO
2
w wodze pozwala wyci ga ciekawe wnioski co do natury tego zjawiska.
CO
2
rozpuszcza si bardzo dobrze w wodze jego dyfuzja w niej umo liwia ycie samo ywnych mikroorgani-
zmów w zbiornikach wodnych. Organizmy te produkuj tlen a poniewa jego rozpuszczalno jest zdecydo-
wane mniejsza ni CO
2
(w tych samych warunkach ci nienia temperatury) desorbuje z wody przechodzi do
atmosfery. Łatwo zatem stwierdzi , e ilo gazu rozpuszczonego w okre lonej cieczy zale y zarówno od
natury owej cieczy jak gazu/gazów. Poni ej zestawiono przykładowe warto ci współczynników pochłaniania
(rozpuszczana, g/100g cieczy) gazów w kilku cieczach w temperaturze 20ºC.
H
2
N
2
O
2
CO
2
H
2
S
NH
3
woda
0,017
0,015
0,028
0,88
2,68
710
etanol
0,080
0,130
0,143
3,00
-
-
benzen
0,066
0,104
0,163
-
-
-
Warto zauwa y , e ró nice w rozpuszczalno ci gazów zwi zane s ze wzajemnym oddziaływaniami
cz steczek gazu cieczy. Rozpuszczalno gazów w niepolarnych cieczach (benzen) jest niewielka. Rozpusz-
czalno gazów polarnych zale y natomiast od rodzaju rozpuszczalnika oczywi cie wzrasta ze wzrostem
oddziaływa pomi dzy cz steczkami. Niekiedy dyfuzji gazu w cieczy towarzyszy dysocjacja cz steczek gazu
co intensyfikuje proces rozpuszczana. Analiza reguły faz Gibbsa wskazuje, e w przypadku układu dwufazo-
wego (a wi c faza gazowa ciekła) dwuskładnikowego (np. CO
2
H
2
O) istniej dwa stopne swobody a wi c
dwa niezale ne parametry: ci nienie temperatura. Tak wi c równowaga w takim przypadku (ilo gazu
rozpuszczonego w cieczy) zale y zarówno od temperatury ci nienia. Poni ej porównano rozpuszczalno
CO
2
w wodze w ró nych warunkach ci nienia temperatury.
p, bar
20ºC
35ºC
60ºC
25
16,3
1
-
-
30
18,2
10,6
-
35
20,1
12,4
-
40
22,0
16,1
8,5
45
23,9
18,0
9,3
Wzrost ci nienia powoduje zwi kszenie ilo ci gazu rozpuszczonego w cieczy. Dzi ki temu mo liwa jest
produkcja gazowanych wód napojów. Podwy szenie temperatury przy ustalonym ci nieniu powoduje
zmniejszenie rozpuszczalno ci. Niew tpliwie ka dy z nas zauwa ył to otwieraj c butelk z rozgrzan wod
1
ml CO
2
w 1g H
2
O w przeliczeniu na warunki normalne ☺
3
Opracowała dr in . Anna Ptaszek
gazowan (gwałtowna desorpcja nadmiaru CO
2
) lub obserwuj c desorpcj tego gazu z ochłodzonego napoju
gazowanego w ciepłym pomieszczeniu. Ilo ciowo wpływ temperatury opisuje równane Claususa-Clapeyrona:
gdzie
to ułamk molowe gazu w roztworze odpowiednio temperaturach
,
. Wielko
to entalpia
(ciepło) rozpuszczana 1 mola gazu w roztworze nasyconym przy czym zakłada si , e to ciepło jest stałe w
zakresie analizowanych temperatur. Wpływ ci nienia na rozpuszczalno gazu opisuje prawo Henry’ego. W
stałej temperaturze ilo m gazu rozpuszczonego w danej obj to ci cieczy jest wprost proporcjonalna do
ci nienia (pr no ci) cz stkowej gazu p nad roztworem. Je eli ilo rozpuszczonego gazu jest niewielka to
mo na j wyrazi za pomoc ułamka molowego x zapisa to prawo w nast puj cy sposób:
Współczynnik proporcjonalno ci He nazywany jest stał Henry’ego jest wielko c stabelaryzowan dla wielu
gazów. Uwa ny Czytelnik ☺ skojarzy to prawo z omawianym na in ynierii procesowej ruchem masy i jej
przenikaniem z fazy gazowej do fazy ciekłej lub na odwrót. By mo e przypomni sobie równie „skok”
st
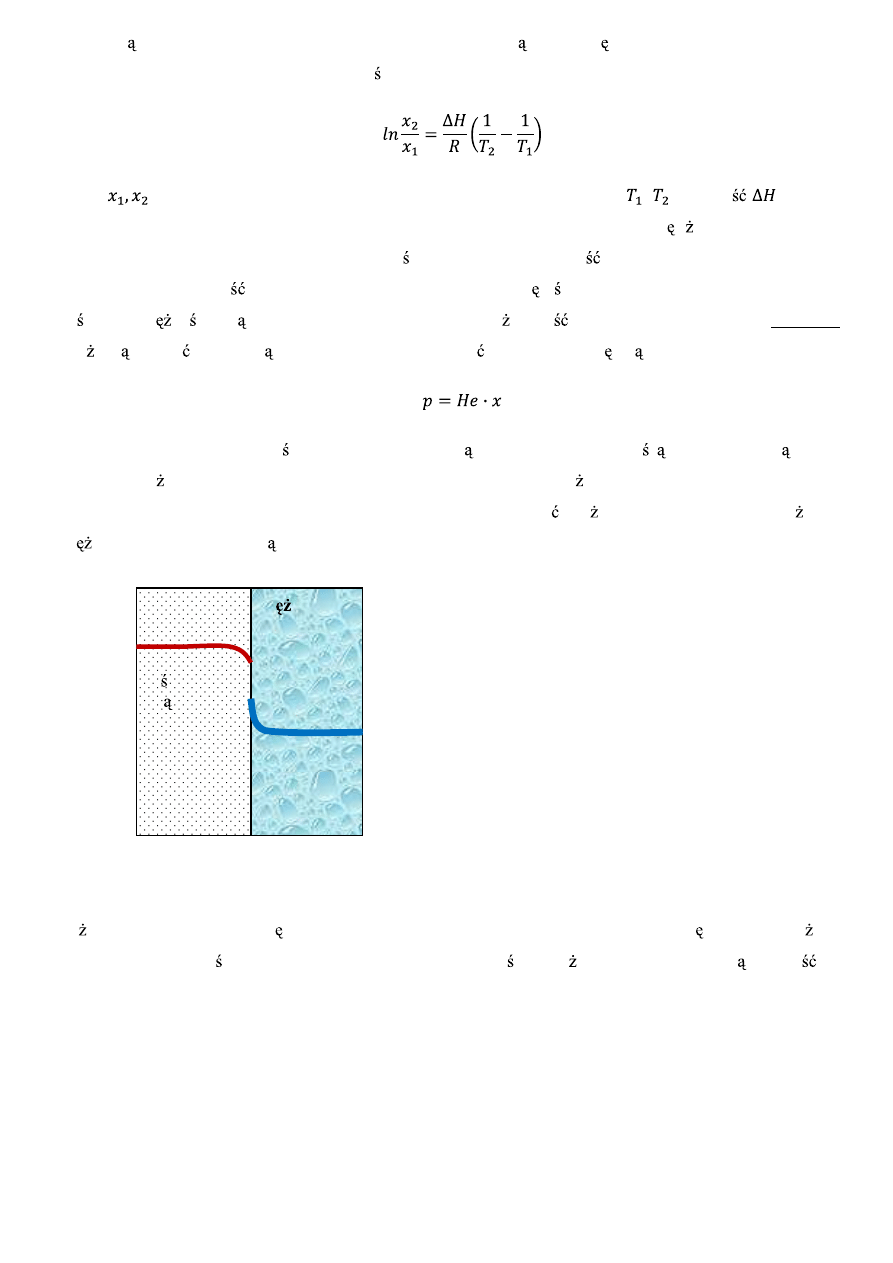
enia substancji dyfunduj cej na granicy faz (rys. 1):
Rys. 1. Przenikane strumienia masy przez powierzchni mi dzyfazow
Je eli w cieczy rozpuszcza si kilka gazów np. O
2
i CO
2
to prawo Henry’ego stosuje si osobno do ka dego z
tych gazów. Oczywi cie, tak jak to zostało wykazane wcze niej, ka dy gaz posiada „swoj ” warto stałej
Henry’ego.
st enie
molowe
CO
2
rozpusz-
czonego
w wodze
x
P
ci nienie
cz stkowe
CO
2
w po-
wietrzu

4
Opracowała dr in . Anna Ptaszek
Równowaga ciecz-para
Równowaga ciecz-gaz opisywana prawem Henry’ego stosowana jest najcz ciej do opisu rozpuszczania
gazu w cieczy w przypadku gdy analizowany gaz jest jednym z wielu składników mieszaniny tworz cej
faz gazow i rozpuszcza si w cieczy w niewielkiej ilo ci. Przykładowo mo na opisa w ten sposób
absorpcj CO
2
obecnego w powietrzu (w którym mimo efektu cieplarnianego i tak stanowi niecały 0,1%
molowo) w wodzie (w której np. w 20ºC stanowi 0,88% masowo). Je eli rozwa amy mieszanin dwóch
cieczy (woda-kwas octowy, etanol-woda) to tylko w skrajnych przypadkach st
e mo na stosowa
prawo Henry’ego. Omawiane przypadki obejmuj sytuacj , gdy w mieszaninie jest np. bardzo mało
etanolu (domowa nalewka) lub niewielka ilo CH
3
COOH (rozcie czony ocet spo ywczy).
Układy doskonałe
Do opisu ciekłych mieszanin dwóch lub wi cej cieczy stosuje si prawo Raoulta:
w którym oznacza zawarto wybranej substancji w ciekłej mieszaninie,
pr no
(ci nienie) pary nasyconej cieczy w danej temperaturze
2
, a ci nienie cz stkowe sub-
stancji w oparach nad mieszanin . W przypadku np. octu prawo Raoulta mo na zapisa zarówno dla
wody (i=1) i kwasu octowego (i=2)
3
w temperaturze 20ºC:
Tak wi c w oparach pozostaj cych w równowadze termodynamicznej z octem ciekłym 10% (obj.) w
temperaturze otoczenia ci nienie cz stkowe pary wodnej wynosi b dzie:
, natomiast kwas octowy
. Całkowite ci nienie oparów b dzie
równe zgodnie z prawem Daltona sumie ci nie cz stkowych:
Znajomo ci nienia całkowitego i ci nie cz stkowych umo liwia obliczenie ułamków molowych obu
składników mieszaniny w fazie gazowej:
2
w przypadku wody korzysta mo
na z tablic parowych, dla innych cieczy szukamy danych w postaci tablic lub stałych
Antoine’a np. w Poradniku fizykochemicznym lub Kalendarzu chemicznym
3
Jako składnik pierwszy wyró
niona jest zawsze ciecz „l
ejsza” czyli ta o ni
szej temperaturze wrzenia (wi kszej pr
no
ci
pary). W tym przypadku jest to woda, która pod ci
nieniem atmosferycznym na temperatur wrzenia równ
99,9ºC. Kwas
octowy wrze w temperaturze 118ºC.
5
Opracowała dr in . Anna Ptaszek
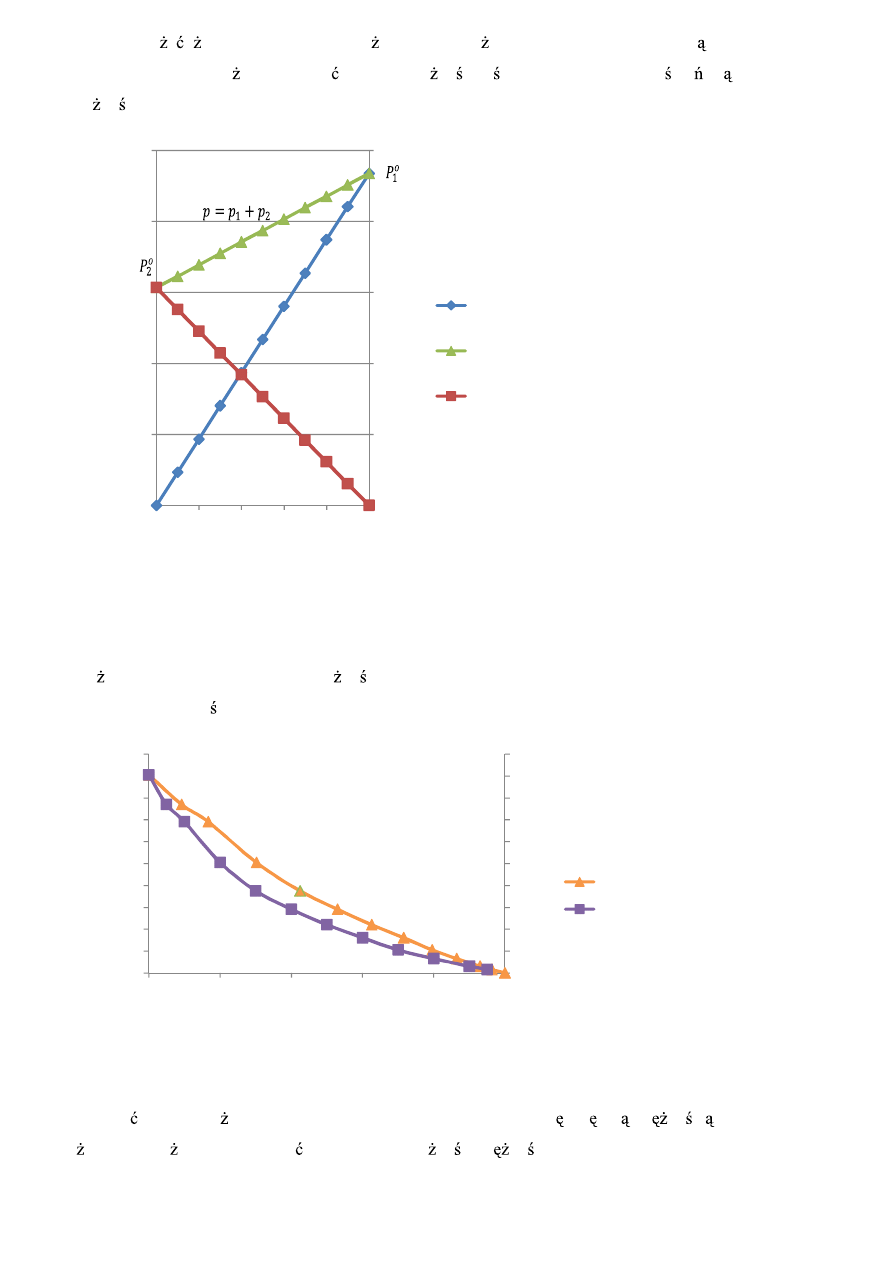
Warto zauwa y , e woda jako składnik „l ejszy” przewa a w fazie gazowej. Korzystaj c z tych danych
fizykochemicznych mo na narysowa wykres zale no ci ci nienia całkowitego i ci nie cz stkowych w
zale no ci od składu cieczy.
Rys.2 Pr
no
sumaryczna i ci
nienia cz
stkowe par układu woda-kwas octowy (w temperaturze 20ºC) przy zało
eniu,
e
badana mieszanina tworzy układ doskonały.
Poni ej przedstawiono wykres zale no ci temperatury wrzenia mieszaniny woda-kwas octowy od
składu cieczy pod ci nieniem atmosferycznym.
Rys. 3. Zale
no
ci temperatury wrzenia mieszaniny woda-kwas octowy od składu cieczy przy p=1Atm.
Jak wida ciecz o ni szej temperaturze wrzenia charakteryzuje si wi ksz pr no ci par (składnik
„l ejszy”). Mo na to przedstawi na wykresie zale no ci pr
no ci pary nasyconej od temperatury.
!
"
#
$
$
%
#
$
$
%
&
'
()
'*
+
&
,
*
+
-
.
/
0 1
2
3 4
56
7
0 8
3 9
6
9
:
;
<
=
>
;
=
>
#
$$
%
#
$$
%

6
Opracowała dr in . Anna Ptaszek
Rys. 4 Porównanie pr
no
ci pary nasyconej dla wody i kwasu octowego.
Dla takiego układu zdefiniowa mo na współczynnik lotno ci wzgl
dnej
definiowany jako iloraz
pr no ci pary nasyconej składnika l ejszego do pr no ci pary drugiego składnika w tej samej
temperaturze:
Mo na dokona dalszych podstawie i uzyska , przy zało eniu e rozwa amy nadal mieszanin
dwuskładnikow , nast puj c zale no :
Dla mieszaniny woda-kwas octowy
. Na tej podstawie mo na zapisa :
Równanie to mo e posłu y do wyznaczania równowagowego składu fazy parowej (po dokonaniu
przekształce ☺):
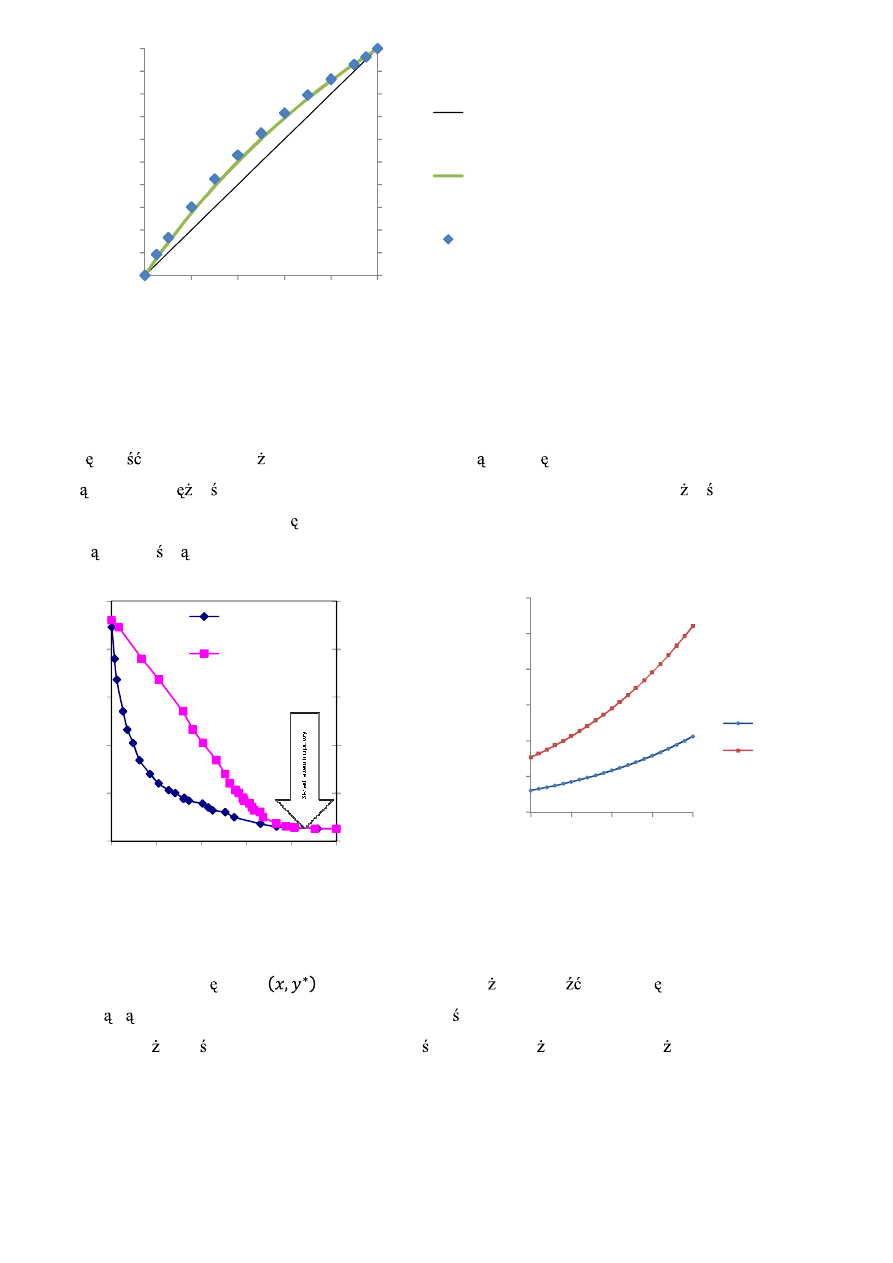
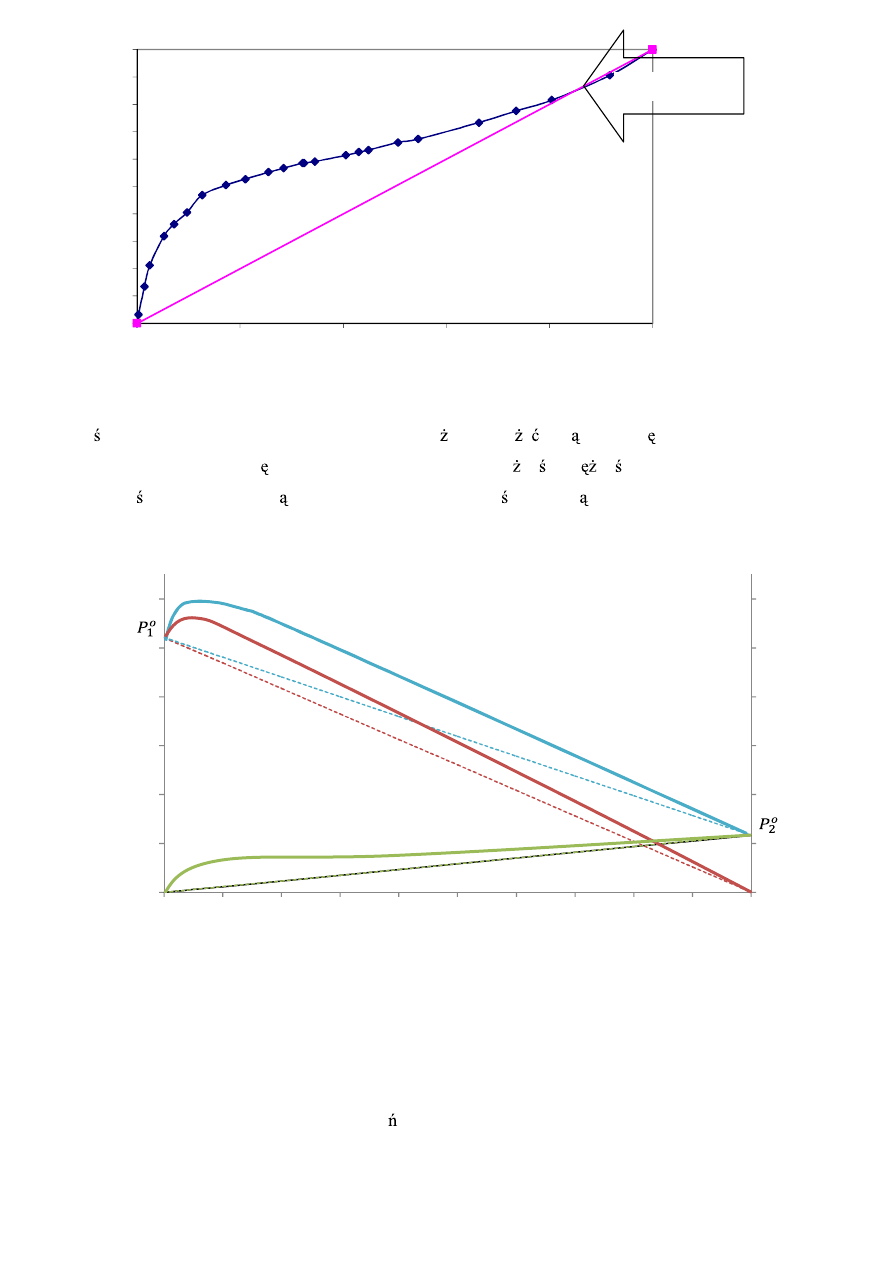
Na poni szym wykresie porównano przebieg linii równowagi pisanej powy szym równaniem z danymi
do wiadczalnymi (punkty). Dodatkowo wprowadzono przek tn czyli lini takiej samej zawarto ci
składnika bardziej lotnego w cieczy i oparach. Jak wida podgrzewanie octu spo ywczego powoduje
odprowadzanie z mieszaniny przede wszystkim wody. Dodatkowo zauwa y mo na, e w przypadku tej
mieszaniny wyprowadzone przez nas równanie linii równowagi pozostaje w du ej zgodno ci z danymi
do wiadczalnymi.
)
*
)
+
*
+
'
-
+
7
5
7
3
3
7
Opracowała dr in . Anna Ptaszek
Rys. 5. Linia równowagi i dane do
wiadczalne dla układu woda-kwas octowy (p=1Atm).
Układy niedoskonałe
Wi kszo mieszanin spo ywczych wykazuje interesuj ce odst pstwa od prawa Raoulta i przebieg
cz stkowych pr
no ci par odbiega od linii prostej. W konsekwencji na krzywej zale no ci temperatury
wrzenia od składu pojawia si charakterystyczny punkt wspólny dla linii pary nasyconej i cieczy
wrz cej okre laj cy skład azeotropowy.
Rys. 6. Wykres temperaturowy tzw. „rybka” dla mieszaniny etanol-woda (p=1Atm) oraz wykres zale
no
ci pr
no
ci pary
nasyconej od temperatury.
W układzie współrz dnych
skład azeotropowy mo na odnale na przeci ciu linii równowagi z
przek tn (równy skład w oparach i cieczy). Wła nie ten azeotrop jest pewnym utrapieniem dla
technologa ywno ci bowiem nawet zmiana ci nienia (podwy szenie lub obni enie) nie powoduje
poprawy zachowania tej mieszaniny!
+
+
*
&
)
+
*
+
8
:
6
8
3
3
4
:
6
7 8
:
<
=
=
<
;
;
77
82
87
92
97
102
77
82
87
92
97
102
0
20
40
60
80
100
te
m
p
e
ra
tu
ra
,
o
C
% molowy etanolu
linia wrzenia
linia
skraplania
#
$$
%
#
$
$
%
)
*
)
+
*
+
'
-
+
7
5
7
3
3
;
8
Opracowała dr in . Anna Ptaszek
Rys. 7 Azeotropia na wykresie równowagowym.
Wła nie w przypadku układów niedoskonałych mo na rozwa y zwi zek pomi dzy prawem Raoulta i
Henry’ego. Przyjrzyjmy si hipotetycznemu wykresowi zale no ci pr
no ci par etanolu i wody pod
stałym ci nieniem. Linia ci gła ilustruje rzeczywiste ci nienia cz stkowe i całkowite natomiast
przerywana zachowanie zgodne z prawem Raoulta.
Rys. 8. Dodatnie odst pstwo od prawa Raoulta.
☺
☺
☺
☺ ☺
☺
☺
☺ ☺
☺
☺
☺ ☺
☺
☺
☺ ☺
☺
☺
☺ Literatura:
Tadeusz Drapała Chemia fizyczna z zadaniami WNT
Stanisław Michałowski, Kazimierz Wa kowicz Termodynamika procesowa WNT 1993
Roman Koch, Antoni Kozioł Dyfuzyjno-cieplny rozdział substancji WNT 1994
0
10
20
30
40
50
60
70
80
90
100
0
20
40
60
80
100
z
a
w
a
rt
o
e
ta
n
o
lu
w
o
p
a
ra
c
h
zawarto
etanolu w cieczy
#
$
$
%
#
$$
%
Skład
azeotropowy

9
Opracowała dr in . Anna Ptaszek
☺ ☺ ☺ ☺ ☺☺ ☺ ☺ ☺ ☺ ☺ ☺ ☺ ☺ ☺ ☺ ☺ ☺ ☺ ☺ ☺ ☺ ☺ ☺ ☺ ☺ ☺ ☺ ☺ ☺ ☺ ☺ ☺ ☺ ☺
Wyszukiwarka
Podobne podstrony:
destylacja prawa fizyczne
Fiz teoria prawa fizyczne, Matura, fizyka, matematyka
!!!!!!!!destylacja, Chemia Fizyczna, chemia fizyczna- laborki rozne, destylacja
Prawa fizyczne
prawa fizyczne, FIZYKA-ZBIÓR MATERIAŁÓW
nowe prawa fizyczne
Prawa fizyczne w układach pneumatycznych
wniosek o przyznanie prawa pomocy osobie fizycznej, WZORY PISM i UMÓW, wzory pism
Destylacja mieszaniny dwuskladnikowej etanol - izobutanol I rzedowy, chemia fizyczna
Elementy prawa cywilnego, Koszty uzyskania przychodow w podatku dochodowym od osob fizycznych
Kultura fizyczna - wyjątki z rozdziału 2, Opracowanie ustaw z zakresu prawa administracyjnego(1)
zbiorcze-destylacja, CHEMIA, semestr 4, fizyczna
osoba fizyczna, Socjologia, Elementy prawa dla socjologów
Destylacja, Farmacja, Chemia Fizyczna, zadania
Ćwiczenie 4 - destylacja, Technologia INZ PWR, Semestr 3, Chemia Fizyczna, Chemia fizyczna - Laborat
prawa i zasady fizyczne, Fizyka
Elementy prawa [ Ściaga, prowadzący dr. T. Majtas kodeks cywilny i konstytucje], prawo, Osobą fizycz
więcej podobnych podstron