
Test z działu:
Poznajemy budowę atomu

1.Ziarnista budowa materii
Dyfuzja – samorzutne mieszanie się stykających się substancji – cząstki jednej substancji
wnikają w cząstki drugiej substancji.
Teoria atomistyczno-cząsteczkowej budowy atomu materii – pojawiła się na początku
XIX w., znajdując potwierdzenie w faktach doświadczalnych i prawach z nich
wynikających. W 1808 r. John Dalton przedstawił najważniejsze założenia teorii.
Założenia teorii atomistyczno cząsteczkowej:
1.Atomy tego samego pierwiastka chemicznego są identyczne pod względem masy i
rozmiarów.
2.Atomy mają kształt kulisty.
3.Atom jest najmniejszą cząstką pierwiastka chemicznego która ma wszystkie cechy tego
pierwiastka.
4. Pierwiastek chemiczny jest zbiorem takich samych atomów.
5.Atomy łączą się tworząc cząsteczki.
6.Związek chemiczny jest zbiorem takich samych cząsteczek.
2.Historyczny rozwój pojęcia atom:
Demokryt z Abdery – stworzył podstawy atomistycznej teorii budowy materii.
John Dalton – twórca atomistyczno-cząsteczkowej teorii budowy atomu.
Henry Cavendish – opracował pierwszy model atomu.
Ernest Rutherford - jako pierwszy potwierdził istnienie jądra atomowego.
Niels H. D. Bohr – opracował podstawy mechaniki kwantowej.
Joseph J. Thomson – odkrył elektrony.
Antoine’a H. Becquerela – odkrył zjawisko promieniotwórczości naturalnej.
Sir James Chadwick – odkrył neutrony.
Maria Skłodowska Curie – odkryła pierwiastek rad i polon oraz złożoną budowę atomu.
3. Masa i rozmiary atomów
Masa atomowa – masa atomu wyrażona w jednostkach masy atomowej (u).
Masa cząsteczkowa – masa cząsteczki wyrażona w jednostkach masy atomowej (u).
Jednostka masy atomowej (u) –
ଵ
ଵଶ
masy atomu węgla i wynosi około 0,166*10
-23
g.
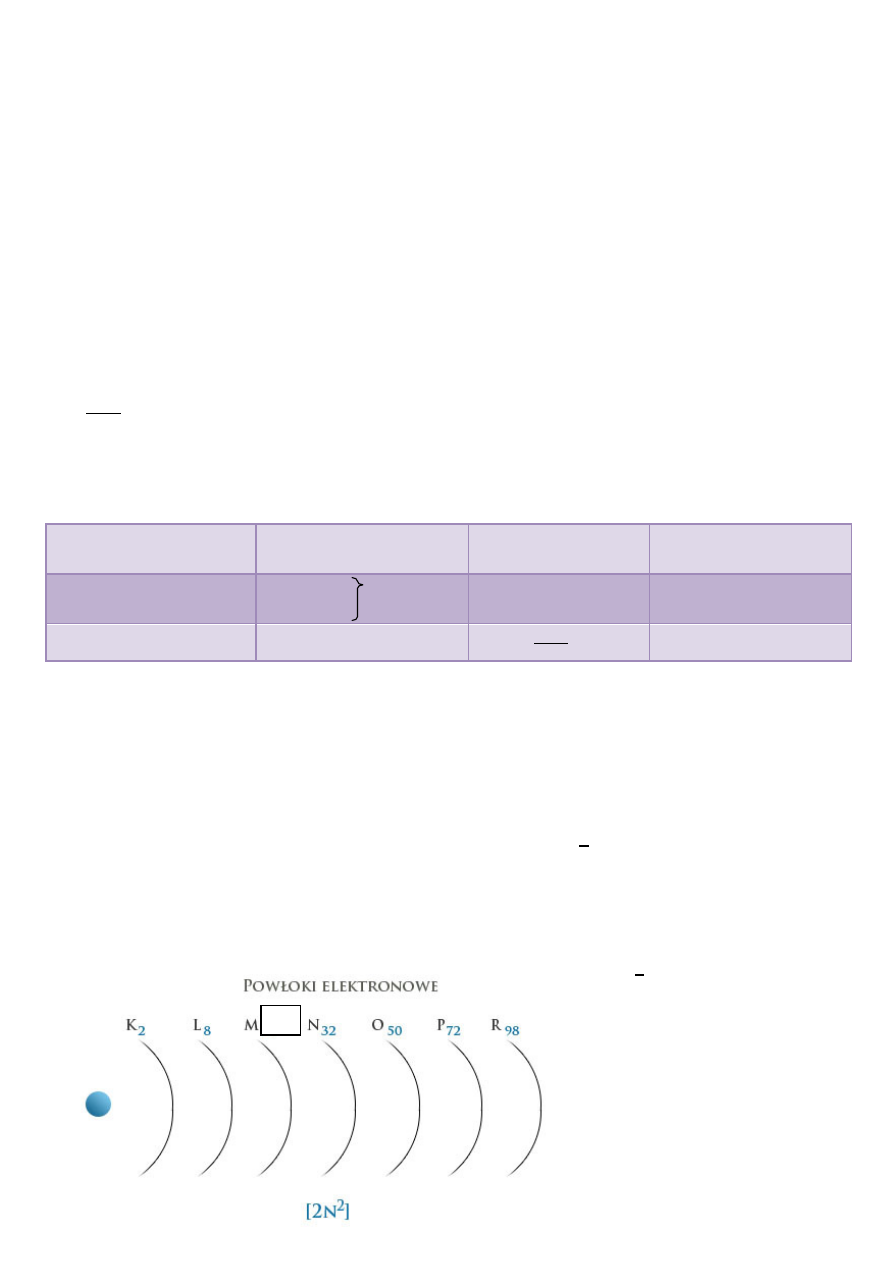
4.Budowa atomu
Atom – układ złożony z jądra atomowego i poruszających się wokół niego elektronów
tworzących powłoki elektronowe.
Jądro atomowe – najbardziej wewnętrzna, dodatnio naładowana część atomu,
zawierająca protony i neutrony, zwane nukleinami.
Protony – cząstki podstawowe wchodzące w skład jądra atomowego mające masę równą
1 u i ładunek elektryczny równy jednemu elementarnemu ładunkowi dodatniemu.
Neutrony – cząstki podstawowe wchodzące w skład jądra atomowego, mające masę
równą 1 u i obojętne elektrycznie.
Elektrony – cząstki podstawowe poruszające się wokół jądra atomowego, mające
ładunek elektryczny równy jednemu elementarnemu ładunkowi ujemnemu i masę równą
ଵ
ଵ଼ସ
u .
Elektrony walencyjne – elektrony najbardziej oddalone od jądra atomu.
Pierwiastek chemiczny – zbiór atomów o takiej samej liczbie atomowej.
Nazwa cząsteczki
Przybliżona masa
Ładunek
elektryczny
Jądro atomowe
Proton nukleony
Neutron
1u
1u
+1
0
Powłoki elektronowe Elektron
ଵ
ଵ଼ସ
u
-1
Liczbę nukleonów, a więc protonów i neutronów wchodzących w skład jądra atomowego,
nazywa się liczbą masową i oznacza symbolem A.
A = liczba protonów + liczba neutronów
Liczby masową i atomową, zapisuje się symbolu chemicznego pierwiastka w sposób
następujący:
E
Liczbę neutronów można obliczyć: A-Z
Z – liczba protonów w jądrze atomowym(liczba atomowa)
ଽ
ସ
Be
Liczba p+ = 4
Liczba e - = 4
Liczba n
0
= 9-4=5
1
8
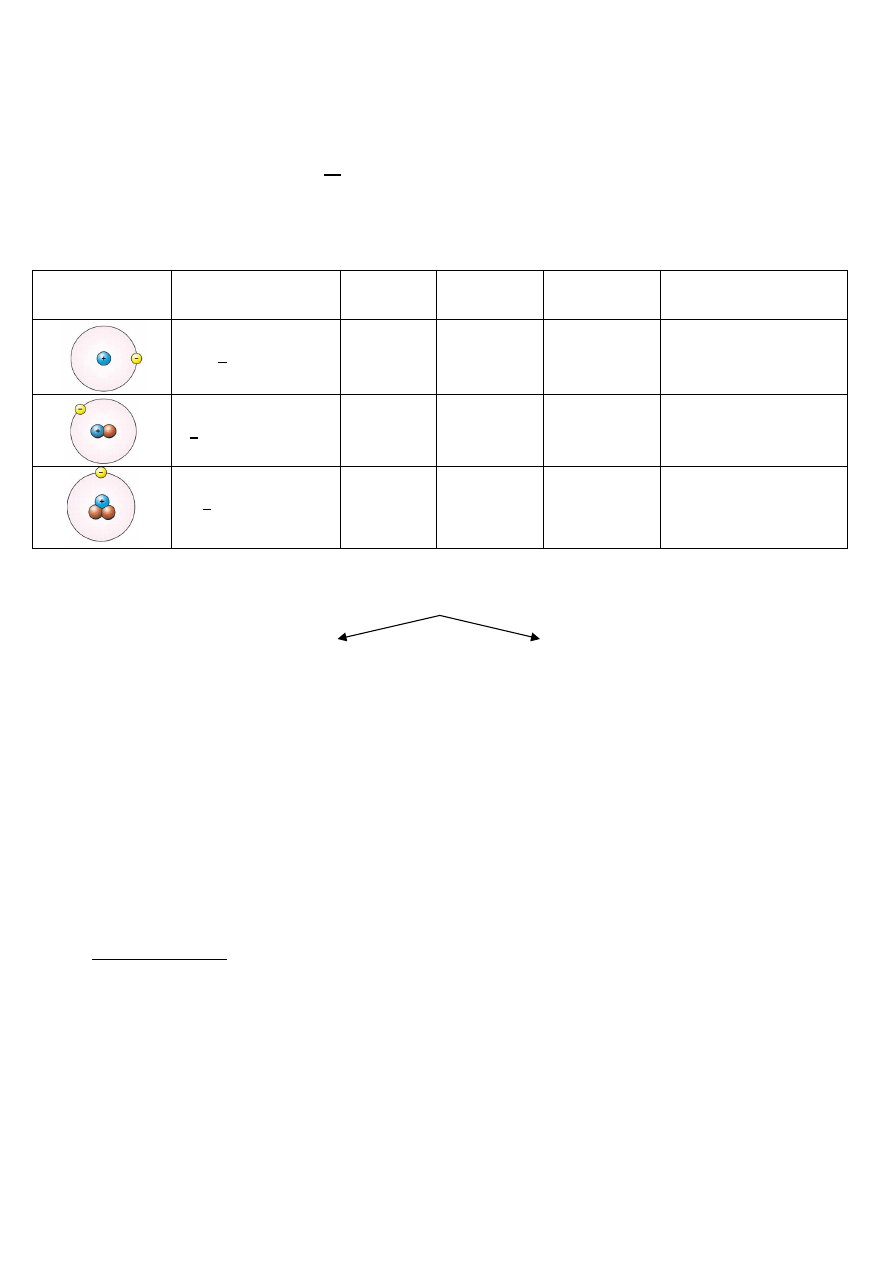
5.Izotopy
Izotopy – atomy tego samego pierwiastka chemicznego różniące się między sobą liczbą
neutronów w jądrze.
Jednostka masy atomowej -
ଵ
ଵଶ
masy atomu izotopu
12
C.
Masa atomowa – średnia masa atomowa pierwiastka chemicznego, wynikająca z
zawartości procentowej jego izotopu.
Model atomu
Izotop
(symbol i nazwa)
Liczba
protonów
Liczba
neutronów
Liczba
elektronów
Rozpowszechnienie
w przyrodzie
ଵ
ଵ
H - prot
1
0
1
Ok. 99,9%
ଶ
ଵ
H – deuter (D)
1
1
1
Ok. 0,015%
ଷ
ଵ
H – tryt (T)
1
2
1
Ilości śladowe
Izotopy
Naturalne Sztuczne
(występujące w przyrodzie) (otrzymane przez człowieka)
Trwałe Promieniotwórcze
(atomy, których jądra nie (nietrwałe atomy, które ulegają
ulegają samorzutnym samorzutnym przemianom
przemianom jądrowym) jądrowym)
m
at
=
%ଵ∗ଵା%ଶ∗ଶ
ଵ%
m
at
= średnia masa atomowa pierwiastka chemicznego
%m1, %m2 = zwartość procentowa poszczególnych izotopów
A1, A2 = masy atomowe poszczególnych izotopów.
Zastosowanie izotopów:
- Geologia i archeologia, medycyna, przemysł i technika, paliwo, źródło energii.
Wyszukiwarka
Podobne podstrony:
Chemia II Budowa atomu
Chemia Poznajemy pochodne węglowodorów zawierające azot kartkówka
KARTA PRACY - Poznajemy budowe orkiestry symfoniczne, KARTY PRACY
Poznajemy budowe drzewa, Ekologia, przyroda
Chemia II Budowa atomu
POZNAJEMY BUDOWĘ KSIĄŻKI
Karta pracy Poznajemy budowę gam molowych
chemia budowa atomu
1. Budowa atomu...., chemia(2)
Budowa atomu testy chemia liceum, chemia liceum
Wykład 5. Elektronowa struktura atomu, chemia, CHEMIA OGÓLNA -Walkowiak- (WPC 1002w) DOC
Budowa atomu, Chemia
Chemia nowej ery 2 Klasówki Sole Poznajemy sole
Jadro atomu, Notatki i materiały dodatkowe, Chemia, materiały dodatkowe
Budowa atomu 2, CHEMIA, semestr 1, chemia ogólna, wykłady
budowa materii i wiazania chem, Chemia, Gimnazjum, kl1, Budowa atomu
8. budowa atomu pow+éoki i elektrony zadania maturalne, Chemia
budowa atomu, Semestr 1, Chemia
więcej podobnych podstron