MATUSZEWICZ WOJCIECH
INFORMATYKA I ROK
WYZNACZANIE WSPÓŁCZYNNIKA ELEKTROCHEMICZNEGO I STAŁEJ FARADAYA.
Układ pomiarowy
----------------------------
Elekrolizę wykonujemy w naczyniu szklanym,zawierającym elektrolit,którym w
naszym przypadku jest roztwór wodny siarczanu miedzi.Elektrody wykonane są z blachy
miedzianej . Wartość prądu przepływającego przez elektrolit powinna być dobrana tak,aby
nie przekraczała 1 A na 1 ![]()
powierzchni czynnej elektrody.W tym układzie po zamknięciu
obwodu na katodzie nastąpi wydzielenie miedzi,natomiast na anodzie jony reszty kwasowej
![]()
oddają ładunek i reagując z miedzią elektrody tworzą drobiny
![]()
.
Przebieg ćwiczenia
--------------------------------
1.Oczyszczamy katodę papierem ściernym i oplukujemy pod bieżąca woda .Następnie osuszamy suszarka .
2.Ważymy dokładnie katode-wyznaczamy masę ![]()
.
3.Montujemy układ pomiarowy.
4.Zamykamy obwód i ustawiamy zadana wartość natężenia prądu I.
5.W odstępach trzyminutowych,mierzonych za pomocą stopera ,zapisujemy wartość I.
6.Po 30 min. rozewrzeć obwód ,wyjąc katodę i wysuszyć.
7.Ważymy katodę -wyznaczamy masę ![]()
.
8.Wyznaczamy różnice mas ![]()
.
9.Wyliczamy średnia wartość natężenia prądu I,w czasie trwania elektrolizy i wyliczamy wartość współczynnika
elektrochemicznego i stałej Faradaya.
Obliczenia
------------------
AD9.
-------
Średnia wartość natężenia prądu wynosi 0.64 A.
Na podstawie pierwszego prawa elektrolizy Faradaya m=k I t ,gdzie m-masa wydzielonej substancji,I-średni prąd przepływający w czasie t trwania elektrolizy,k-równoważnik elektrochemiczny.Stąd ![]()
.
m=![]()
=0,325 g
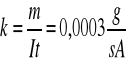
![]()
R-równoważnik chemiczny
A-masa atomowa
W-wartościowość
W=2 A=63,6 ![]()
stad R=31.8 ![]()
Na podstawie drugiego prawa elektrolizy Faradaya ![]()
,gdzie F-stała Faradaya.Stąd ![]()
Pierwsze prawo elektrolizy można zapisać w postaci ![]()
.Stad ![]()
.Na podstawie tego równania wyliczamy błąd
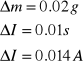
![]()
![]()
Stad wartość stałej Faradaya uzyskanej na podstawie doświadczenia wynosi
![]()
Wnioski
--------------
Celem doświadczenia było wyznaczenie równoważnika elektrochemicznego i stałej
Faradaya.Obliczona na podstawie pomiarów masy,natężenia prądu i czasu stała Faradaya
wynosi
.Wartość tablicowa stałej Faradaya wynosi
![]()
.Uwzględniając tolerancje wynikająca z rachunku błędów widać duża
zgodność wyznaczonej w ćwiczeniu stałej z wartością tablicowa.
Wyszukiwarka
Podobne podstrony:
WYZNACZANIE WSPÓŁCZYNNIKA ELEKTROCHEMICZNEGO I STAŁEJ FARADAYA, Stala Faradaya
stala faradaya, Studia, Semestr II, Fizyka II
stała faradaya elektroliza, Uczelnia, sem I, fiza, LABORATORIUM, Nowe laborki
Stala Faradaya, Fizyka, FIZYKA, Fizyka ćwiczenia Miszta, Fizykaa, LabFiz1 od izki, LabFiz1-instrukcj
Stała Faradaya, Sprawozdania - Fizyka
faraday sprawko
faradaj, Szkoła, Fizyka
I pracownia, Faraday-jurek, Ethan Frome
3. Wyznaczanie współczynnika elektrochemicznego miedzi i stałej Faraday’a, LAB10 02, Wyznaczanie r˙w
Wyznaczanie współczynnika elektrochemicznego i stałej Faradaya
29 67 77, ćwiczenie 67 prawo Faradaya
fizyka, Prąd zmienny, PRAWO FARADAYA
Wyznaczanie współczynnika elektrochemicznego i stałej Faradaya
29 67 77, ćwiczenie 67 prawo Faradaya
fizyka, Prąd zmienny, PRAWO FARADAYA
elektrochemia, prawa elektrolizy Faraday'a
Prawa elektrolizy Faraday`a, FIZYKA-ZBIÓR MATERIAŁÓW
Fizyka- Zjawisko Faradaya, Cel ?wiczenia:
więcej podobnych podstron