Data: 01.04.2014 r. |
Nr ćwiczenia i tytuł: 10. Spinele
|
Ocena |
|
|
|
Asystenta: |
Sprawozdanie: |
Prowadzący: dr Paweł Stelmachowski |
Wykonująca: Monika Góralik |
|
|
1. Cel ćwiczenia.
Ćwiczenie miało na celu zbadanie katalitycznej aktywności spineli żelaza i kobaltu (konkretnie: CoFe2O4, Co2FeO4 i Co3O4) w reakcji rozkładu nadtlenku wodoru (H2O2).
2. Przebieg doświadczenia i wyniki.
W osobnych moździerzach drobno utarto niewielkie ilości trzech spineli o ogólnym wzorze CoxFe3-xO4, gdzie x=1-3 (czyli CoFe2O4, Co2FeO4 i Co3O4), a następnie z każdej z tych próbek sporządzono po trzy odważki o masie ok. 50 mg (0,05 g, próbki zważone na wadze technicznej
z dokładnością pomiaru równą 0,01 g) - w sumie dziewięć odważek. Każdą z nich przeniesiono ilościowo do znajdującego się nad mieszadłem magnetycznym naczynia reakcyjnego przez lejek, po czym dodano 40 cm3 5 M roztworu wodorotlenku potasu (KOH), wprowadzono mieszadełko, zamknięto kolbę nasadką połączoną rurą z biuretą gazową wypełnioną olejem parafinowym, rozpoczęto mieszanie, wstrzyknięto za pomocą strzykawki 2 cm3 5% roztworu H2O2 i obserwowano zmianę objętości wydzielającego się podczas reakcji tlenu. Tą reakcję, przebiegającą w środowisku zasadowym, można opisać równaniami:
H2O2 + OH- ↔ H2O + HO2-
2 HO2- → O2 + 2 OH-
Odczytu dokonywano najpierw co 5 sekund, a następnie co 10 i 30 sekund (czas między kolejnymi odczytami zwiększono w chwili wyraźnego spadku szybkości wydzielania się tlenu). Pomiar przerywano w chwili, w której objętość O2 nie ulegała zmianie. Ze względu na brak czasu pominięto pomiar dla jednej z próbek Co3O4.
Tabela1: wyniki pomiarów dla CoFe2O4
próbka nr 1 |
próbka nr 2 |
próbka nr 3 |
|||
t [s] |
VO2 [cm3] |
t [s] |
VO2 [cm3] |
t [s] |
VO2 [cm3] |
0 |
0,00 |
0 |
0,00 |
0 |
0,00 |
5 |
1,50 |
5 |
2,50 |
5 |
1,00 |
10 |
1,80 |
10 |
5,20 |
10 |
1,90 |
15 |
2,70 |
15 |
8,50 |
15 |
2,70 |
20 |
3,70 |
20 |
12,00 |
20 |
4,80 |
25 |
4,60 |
25 |
14,00 |
25 |
4,80 |
30 |
5,50 |
30 |
15,80 |
30 |
5,70 |
35 |
6,20 |
40 |
16,00 |
35 |
6,60 |
40 |
6,80 |
45 |
16,50 |
40 |
7,30 |
45 |
7,50 |
50 |
16,80 |
45 |
8,10 |
50 |
8,00 |
55 |
17,00 |
50 |
8,90 |
60 |
9,00 |
60 |
17,30 |
55 |
9,60 |
70 |
9,90 |
70 |
18,00 |
60 |
10,30 |
80 |
10,80 |
80 |
18,50 |
65 |
11,00 |
90 |
11,30 |
90 |
18,80 |
70 |
11,60 |
100 |
11,80 |
100 |
19,20 |
80 |
12,90 |
110 |
12,30 |
110 |
19,50 |
85 |
14,10 |
120 |
12,60 |
120 |
19,60 |
90 |
15,10 |
150 |
13,30 |
130 |
20,00 |
95 |
16,20 |
180 |
13,70 |
140 |
20,10 |
100 |
17,30 |
210 |
13,90 |
150 |
20,20 |
105 |
18,30 |
240 |
14,00 |
160 |
20,30 |
115 |
19,70 |
270 |
14,00 |
170 |
20,30 |
125 |
21,00 |
300 |
14,10 |
180 |
20,40 |
135 |
22,00 |
330 |
14,15 |
190 |
20,40 |
145 |
22,70 |
360 |
14,20 |
220 |
20,50 |
155 |
23,30 |
390 |
14,25 |
250 |
20,60 |
165 |
23,70 |
420 |
14,30 |
280 |
20,70 |
175 |
24,00 |
450 |
14,30 |
310 |
20,70 |
185 |
25,00 |
480 |
14,35 |
340 |
20,80 |
195 |
24,50 |
510 |
14,40 |
370 |
20,80 |
205 |
24,60 |
540 |
14,50 |
400 |
20,80 |
215 |
24,70 |
570 |
14,50 |
430 |
20,80 |
245 |
25,50 |
600 |
14,60 |
- |
- |
275 |
25,25 |
630 |
14,65 |
- |
- |
305 |
25,40 |
660 |
14,70 |
- |
- |
335 |
25,65 |
690 |
14,70 |
- |
- |
365 |
25,90 |
720 |
14,80 |
- |
- |
395 |
26,00 |
750 |
14,80 |
- |
- |
425 |
26,20 |
780 |
14,90 |
- |
- |
455 |
26,35 |
810 |
14,90 |
- |
- |
485 |
26,45 |
840 |
14,95 |
- |
- |
515 |
26,50 |
870 |
15,00 |
- |
- |
545 |
26,55 |
900 |
15,05 |
- |
- |
575 |
26,65 |
930 |
15,20 |
- |
- |
605 |
26,70 |
960 |
15,30 |
- |
- |
635 |
26,75 |
990 |
15,30 |
- |
- |
665 |
26,80 |
1020 |
15,35 |
- |
- |
695 |
26,80 |
1050 |
15,40 |
- |
- |
725 |
26,80 |
1080 |
15,40 |
- |
- |
755 |
26,80 |
1110 |
15,60 |
- |
- |
- |
- |
1140 |
15,70 |
- |
- |
- |
- |
1170 |
15,80 |
- |
- |
- |
- |
1200 |
15,90 |
- |
- |
- |
- |
1230 |
16,00 |
- |
- |
- |
- |
1260 |
16,10 |
- |
- |
- |
- |
1290 |
16,25 |
- |
- |
- |
- |
1320 |
16,40 |
- |
- |
- |
- |
1350 |
16,50 |
- |
- |
- |
- |
1380 |
16,70 |
- |
- |
- |
- |
1410 |
16,80 |
- |
- |
- |
- |
1440 |
17,10 |
- |
- |
- |
- |
1470 |
17,20 |
- |
- |
- |
- |
1500 |
17,20 |
- |
- |
- |
- |
1530 |
17,20 |
- |
- |
- |
- |
1560 |
17,20 |
- |
- |
- |
- |
Wykres1: wykres zależności objętości wydzielonego tlenu od czasu - CoFe2O4
Vmax1:17,2 cm3
Vmax2:20,8 cm3
Vmax3:26,8 cm3
Tabela2: wyniki pomiarów dla Co2FeO4
próbka nr 1 |
próbka nr 2 |
próbka nr 3 |
|||
t [s] |
VO2 [cm3] |
t [s] |
VO2 [cm3] |
t [s] |
VO2 [cm3] |
0 |
0,00 |
0 |
0,00 |
0 |
0,00 |
5 |
1,30 |
5 |
1,00 |
5 |
2,50 |
10 |
2,30 |
10 |
1,70 |
10 |
3,30 |
15 |
3,60 |
15 |
2,60 |
15 |
4,70 |
20 |
5,00 |
20 |
3,50 |
20 |
6,00 |
25 |
5,70 |
25 |
4,70 |
25 |
7,00 |
30 |
6,80 |
30 |
5,80 |
30 |
8,20 |
35 |
7,90 |
35 |
7,00 |
35 |
9,30 |
40 |
9,00 |
40 |
8,10 |
40 |
10,10 |
45 |
9,80 |
45 |
9,10 |
45 |
11,60 |
50 |
10,70 |
50 |
10,20 |
50 |
11,90 |
55 |
11,60 |
55 |
11,20 |
55 |
12,70 |
60 |
12,50 |
60 |
12,20 |
60 |
13,50 |
65 |
13,30 |
65 |
13,10 |
65 |
14,30 |
70 |
14,10 |
70 |
14,00 |
70 |
15,00 |
75 |
14,80 |
75 |
14,70 |
75 |
15,60 |
80 |
15,50 |
80 |
15,50 |
80 |
16,30 |
90 |
16,80 |
85 |
16,20 |
85 |
16,70 |
100 |
18,10 |
90 |
16,80 |
90 |
17,30 |
110 |
19,00 |
95 |
17,50 |
95 |
17,80 |
120 |
19,90 |
100 |
18,10 |
100 |
18,30 |
130 |
20,70 |
105 |
18,70 |
105 |
18,80 |
140 |
21,40 |
110 |
19,20 |
115 |
19,30 |
150 |
21,90 |
115 |
19,70 |
120 |
20,00 |
160 |
22,25 |
120 |
20,30 |
125 |
20,30 |
170 |
22,60 |
125 |
20,60 |
130 |
20,70 |
180 |
22,90 |
130 |
21,00 |
140 |
21,20 |
190 |
23,20 |
135 |
21,40 |
150 |
21,70 |
200 |
23,50 |
140 |
21,70 |
160 |
22,20 |
210 |
23,70 |
145 |
22,10 |
170 |
22,70 |
220 |
23,90 |
150 |
22,50 |
180 |
23,00 |
230 |
24,10 |
155 |
22,90 |
190 |
23,30 |
240 |
24,30 |
160 |
23,20 |
200 |
23,65 |
250 |
24,40 |
165 |
23,50 |
210 |
23,80 |
260 |
24,50 |
170 |
23,70 |
220 |
24,20 |
270 |
24,60 |
175 |
24,00 |
230 |
24,30 |
300 |
24,80 |
180 |
24,20 |
240 |
24,40 |
330 |
25,00 |
190 |
24,50 |
250 |
24,60 |
360 |
26,80 |
200 |
25,00 |
260 |
24,80 |
390 |
26,95 |
210 |
25,20 |
270 |
24,90 |
420 |
27,10 |
220 |
25,50 |
300 |
25,30 |
450 |
27,20 |
230 |
25,70 |
330 |
25,55 |
480 |
27,30 |
240 |
26,10 |
360 |
25,85 |
510 |
27,40 |
250 |
26,20 |
390 |
26,00 |
540 |
27,50 |
260 |
26,50 |
420 |
26,20 |
570 |
27,50 |
270 |
26,70 |
450 |
26,40 |
600 |
27,55 |
280 |
26,90 |
480 |
26,50 |
630 |
27,60 |
290 |
27,00 |
510 |
26,60 |
660 |
27,60 |
300 |
27,10 |
540 |
26,65 |
690 |
27,65 |
310 |
27,20 |
570 |
26,70 |
720 |
27,70 |
320 |
27,40 |
600 |
26,75 |
750 |
27,70 |
330 |
27,50 |
630 |
26,80 |
780 |
27,80 |
360 |
27,70 |
660 |
26,85 |
810 |
27,80 |
390 |
28,00 |
690 |
26,90 |
840 |
27,85 |
420 |
28,20 |
720 |
27,00 |
870 |
27,90 |
450 |
28,30 |
750 |
27,00 |
900 |
27,90 |
480 |
28,40 |
780 |
27,00 |
930 |
27,95 |
510 |
28,60 |
- |
- |
960 |
28,00 |
540 |
28,70 |
- |
- |
990 |
28,00 |
570 |
28,80 |
- |
- |
1020 |
28,10 |
600 |
28,90 |
- |
- |
1050 |
28,10 |
630 |
29,00 |
- |
- |
1080 |
28,20 |
660 |
29,00 |
- |
- |
1110 |
28,20 |
690 |
29,00 |
- |
- |
1140 |
28,30 |
720 |
29,00 |
- |
- |
1170 |
28,30 |
- |
- |
- |
- |
1200 |
28,30 |
- |
- |
- |
- |
Wykres2: wykres zależności objętości wydzielonego tlenu od czasu - Co2FeO4
Vmax1:28,3 cm3
Vmax2:29 cm3
Vmax3:27 cm3
Tabela3: wyniki pomiarów dla Co3O4
próbka nr 1 |
próbka nr 2 |
||
t [s] |
VO2 [cm3] |
t [s] |
VO2 [cm3] |
0 |
0,00 |
0 |
0,00 |
5 |
1,00 |
5 |
1,60 |
10 |
1,60 |
10 |
2,10 |
15 |
2,00 |
15 |
2,40 |
20 |
2,80 |
20 |
2,70 |
25 |
3,00 |
25 |
2,80 |
30 |
3,20 |
30 |
3,50 |
35 |
3,50 |
35 |
3,60 |
40 |
4,10 |
40 |
3,70 |
45 |
4,50 |
45 |
4,50 |
50 |
4,90 |
50 |
4,30 |
55 |
5,30 |
55 |
4,80 |
60 |
5,70 |
60 |
4,80 |
65 |
6,10 |
65 |
5,00 |
70 |
6,50 |
70 |
5,60 |
80 |
7,40 |
75 |
5,90 |
90 |
8,10 |
80 |
6,30 |
100 |
8,80 |
85 |
6,50 |
110 |
9,60 |
90 |
6,70 |
120 |
10,30 |
95 |
7,00 |
130 |
11,10 |
100 |
7,30 |
140 |
11,80 |
105 |
7,50 |
150 |
12,40 |
110 |
7,80 |
160 |
13,00 |
120 |
8,30 |
170 |
13,70 |
125 |
8,60 |
180 |
14,30 |
130 |
8,80 |
190 |
14,80 |
135 |
9,10 |
200 |
15,45 |
140 |
9,30 |
210 |
15,90 |
145 |
9,50 |
220 |
16,40 |
150 |
9,80 |
230 |
16,90 |
160 |
10,40 |
240 |
17,30 |
170 |
11,00 |
250 |
17,80 |
180 |
11,40 |
260 |
18,20 |
190 |
12,00 |
270 |
18,60 |
200 |
12,50 |
280 |
19,10 |
210 |
13,00 |
290 |
19,50 |
220 |
13,40 |
300 |
19,80 |
230 |
13,80 |
330 |
20,80 |
240 |
14,20 |
360 |
21,80 |
250 |
14,50 |
390 |
22,60 |
260 |
14,90 |
420 |
23,30 |
270 |
15,40 |
450 |
24,00 |
280 |
15,80 |
480 |
24,70 |
290 |
16,20 |
510 |
25,20 |
300 |
16,50 |
540 |
25,70 |
310 |
16,80 |
570 |
26,10 |
320 |
17,10 |
600 |
26,60 |
330 |
17,30 |
630 |
26,90 |
340 |
17,70 |
660 |
27,20 |
350 |
17,90 |
690 |
27,50 |
360 |
18,20 |
720 |
27,80 |
370 |
18,50 |
750 |
28,00 |
380 |
18,80 |
780 |
28,30 |
390 |
19,00 |
810 |
28,50 |
400 |
19,30 |
840 |
28,70 |
410 |
19,50 |
870 |
28,90 |
420 |
19,80 |
900 |
29,00 |
430 |
20,00 |
930 |
29,20 |
440 |
20,20 |
960 |
29,35 |
450 |
20,40 |
990 |
29,40 |
460 |
20,60 |
1020 |
29,50 |
470 |
20,80 |
1050 |
29,70 |
480 |
21,00 |
1080 |
29,80 |
510 |
21,15 |
1110 |
29,90 |
540 |
22,00 |
1140 |
30,00 |
570 |
22,50 |
1170 |
30,10 |
600 |
22,90 |
1200 |
30,20 |
630 |
23,20 |
1230 |
30,30 |
660 |
23,50 |
1260 |
30,40 |
690 |
23,90 |
1290 |
30,40 |
720 |
24,00 |
1320 |
30,40 |
750 |
24,30 |
- |
- |
780 |
24,60 |
- |
- |
810 |
24,90 |
- |
- |
840 |
25,10 |
- |
- |
870 |
25,20 |
- |
- |
900 |
25,30 |
- |
- |
930 |
25,50 |
- |
- |
960 |
25,50 |
- |
- |
990 |
25,70 |
- |
- |
1020 |
25,80 |
- |
- |
1050 |
25,90 |
- |
- |
1080 |
26,00 |
- |
- |
1110 |
26,10 |
- |
- |
1140 |
26,20 |
- |
- |
1170 |
26,30 |
- |
- |
1200 |
26,30 |
- |
- |
1230 |
26,30 |
Wykres3: wykres zależności objętości wydzielonego tlenu od czasu - Co3O4
Vmax1:30,4 cm3
Vmax2:26,3 cm3
Graficznie wyznaczone wartości Vmax to stabilna objętość wydzielonego podczas reakcji tlenu, uzyskana pod koniec każdego z pomiarów. Ze względu za zbyt duże rozbieżności w Vmax oraz czasie pomiarów nie dokonano interpretacji wyników dla spinelu CoFe2O4 oraz nie obliczono stałych szybkości reakcji.
Dane przydatne do obliczeń (przyjęto, że doświadczenie wykonano w warunkach normalnych):
T=298 K
p=101325 Pa
VH2O2=2
CH2O2=5%
d=1 g/cm3 (przyjęto tą wartość ze względu na dobrą rozpuszczalność H2O2 w wodzie oraz niskie stężenie roztworu)
MH2O2=34 g/mol
Teoretyczną wartość Vmax wyznaczono z równania gazu doskonałego (przyjęto, że wydzielony
w reakcji tlen zachowywał się jak gaz doskonały):
pVmax=nO2RT →
gdzie R=8,314 J/mol*K. Ze znajomości gęstości roztworu nadtlenku wodoru można wyznaczyć masę tego roztworu:
mr=1 g/cm3*2 cm3=2 g
oraz masę samego H2O2 w roztworze i maksymalną ilość tlenu, jaka może być wydzielona:
nH2O2=0,1 g / 34 g/mol=0,00294 mol
Znając liczbę moli nadtlenku wodoru oraz równanie reakcji:
2H2O2 → H2O + O2
można obliczyć maksymalną ilość tlenu, jaka może się wydzielić. Z równania wynika, że z 2 moli H2O2 powstaje 1 mol O2. Stąd nO2=0,00294 / 2=0,00147 mol.
Na podstawie wyników z tabel 2 i 3 narysowano wykresy zależności ln(Vmax - Vt) od czasu. Vmax to obliczona wcześniej wartość teoretyczna (35,94 cm3). Przyjęto, że reakcja rozkładu nadtlenku wodoru to reakcja pierwszego rzędu, dla której słusznej jest równanie ln (Vmax-Vt) = ln (Vmax)-kt. Stała k jest tożsama ze współczynnikami kierunkowymi prostych wyznaczonych na poniższych wykresach (k=-b). Wzięto pod uwagę tylko część punktów każdego z wykresów. Jest to związane z dyfuzją cząsteczek nadtlenku wodoru - w początkowych stadiach reakcji jest ich wystarczająco dużo
i częściej dochodzi do kontaktu z katalizatorem. Wraz z upływem czasu maleje ich liczba, rzadziej dochodzi do kontaktu substancji z drobinami spinelu, reakcja znacznie spowalnia, a wartości wykresu zaczynają przybierać stałą wartość. Można wziąć pod uwagę wszystkie punkty wykresu jedynie w przypadku, gdyby w całej rozciągłości czasu reakcji cząsteczki nadtlenku wodoru ze stałą częstotliwością napotykałyby drobiny katalizatora (co nie jest możliwe).
Wykres4: zależność ln(Vmax - Vt) od czasu - Co2FeO4
Wykres5: zależność ln(Vmax - Vt) od czasu - Co3O4
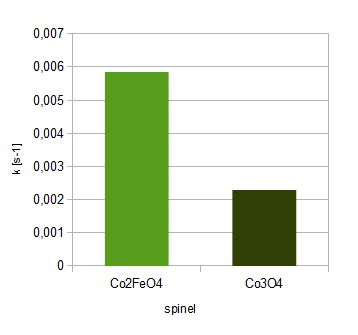
Tabela4: stałe szybkości reakcji rozkładu H2O2 dla różnych spineli jako katalizatorów
spinel |
k1 [s-1] |
k2 [s-1] |
k3 [s-1] |
kśr [s-1] |
Co2FeO4 |
0,005618 |
0,006359 |
0,005566 |
0,005848 |
Co3O4 |
0,002631 |
0,001951 |
- |
0,002291 |
Wykres6: porównanie stałych szybkości reakcji rozkładu H2O2 dla różnych spineli jako katalizatorów
3. Opracowanie teoretyczne
a) Struktura spinelu Co3O4.
Właściwy wzór tego spinelu to CoIICoIII2O4. Energia stabilizacji jonu Co2+ w polu krystalicznym wynosi 71,5 kJ/mol w polu oktaedrycznym i 62,8 kJ/mol w polu tetraedrycznym. Dla jonu Co3+ te energie przyjmują wartości odpowiednio 188 kJ/mol dla pola oktaedrycznego i 109 kJ/mol dla pola tetraedrycznego. Gdyby CoIICoIII2O4 był spinelem normalnym, tzn. kationy dwuwartościowe zajmowałyby 8 luk tetraedrycznych (tzn. 1/8 wszystkich luk tetraedrycznych), a kationy trójwartościowe 16 luk oktaedrycznych (tzn. połowę z 32 wszystkich luk oktaedrycznych), to jego całkowita energia stabilizacji wyniosłaby:
Estabilizacji=8*62,8+16*188=3510,4 kJ/mol
Gdyby ten związek był spinelem odwróconym, tzn. połowa kationów trójwartościowych obsadziłaby 8 luk tetraedrycznych, a druga połowa wraz z kationami dwuwartościowymi 16 luk oktaedrycznych, to energia stabilizacji związku wyniosłaby:
Estabilizacji=8*71,5+8*188+8*109=2948 kJ/mol
Preferowana struktura to ta, w której energia stabilizacji jest wyższa, stąd można wywnioskować, że Co3O4 to spinel normalny.
b) Współstrącanie wodorotlenków żelaza(III) i kobaltu(II).
Współstrącanie wodorotlenków żelaza(III) i kobaltu(II) wymaga wysokiego pH (równego
ok. 12,5), gdyż dopiero wtedy można mieć pewność, że oba związki zostaną wytrącone, ponadto wysokie pH zapewnia dość duże stężenie jonów wodorotlenowych (OH-) - wtedy dochodzi do przekroczenia iloczynów rozpuszczalności wodorotlenków. Iloczyn rozpuszczalności dla Co(OH)2 wynosi ok. 2*10-16, pH potrzebne do strącenia tego związku ok. 9 - można to sprawdzić, dokonując odpowiednich obliczeń:
Co(OH)2 ↔ Co2+ + 2OH-
LCo(OH)2=[Co2+]*[OH-]2=x*(2x)2=4x3
[OH-]=2x
pH=14-pOH=14+log[OH]=14+log[2*3,684*10-6]=14-5,13=8,87≈9
gdzie pOH=-log[OH].
W podobny sposób można udowodnić, że do strącenia Fe(OH)3 (L=3,2*10-38) wystarczy pH bliskie 7 (przy czym z obliczeń można zauważyć, że do przekroczenia iloczynu rozpuszczalności wystarczy pH bliskie 5):
Fe(OH)3 ↔ Fe3+ + 3OH-
LCo(OH)2=[Fe3+]*[OH-]3=x*(3x)3=27x4
[OH-]=3x
pH=14-pOH=14+log[OH]=14+log[3*1,855*10-10]=14-9,25=4,75≈5
4. Wnioski.
Ćwiczenie pozwoliło na zbadanie właściwości katalitycznych spineli. Na podstawie wykresu 6. można wywnioskować, że spinel o wzorze Co2FeO4 wykazuje znacznie wyższą aktywność katalityczną niż Co3O4. Można przypuszczać, że im niższe x we wzorze CoxFe3-xO4, tym wyższa aktywność katalityczna, jednak nie można potwierdzić tego przypuszczenia ze względu na brak miarodajnych
i powtarzalnych wyników pomiaru dla spinelu CoFe2O4, co wynikło ze zbyt dużych błędów popełnionych podczas doświadczenia (złe korzystanie z biurety gazowej, niepewność pomiaru biuretą, problemy z odczytywaniem prawidłowych wartości objętości wydzielonego tlenu). Te same błędy, choć w dużo mniejszym stopniu, wpłynęły na wyniki pomiarów dla dwóch pozostałych spineli (różnice między stałymi szybkości dla próbek tego samego spinelu). Na wyniki mogły wpłynąć też niepewności związane z odważaniem próbek spineli oraz odmierzaniem objętości roztworu nadtlenku wodoru.
Wyszukiwarka
Podobne podstrony:
spinele2012
spinele, minerały
Spinele, charakterystyka poszczególnych grup układu okresowego
spinele II, minerały
Altiero Spinelli
spinele2012
spinele II
Altiero Spinelli Manifest z Ventotene (1941) [PL]
Altiero Spinelli 2
spinele
Altiero Spinelli
więcej podobnych podstron