Piotr Wiśniewski 18.X.2002
Ćwiczenie nr 25
Temat: Wyznaczanie równoważnika elektrochemicznego miedzi.
Tabela wyników:
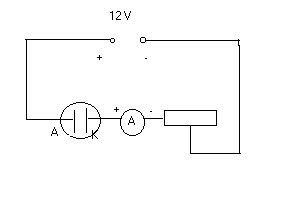
Schemat podłączenia układu do ćwiczenia:
Masa katody woltametru przed eksperymentem:
Natężenie I mierzony w określonych odstępach czasu (co dwie minuty):
Lp. |
Czas [s] |
Natężenie [A] |
0 |
0 |
2 |
1 |
120 |
2,1 |
2 |
240 |
2,2 |
3 |
360 |
2,25 |
4 |
480 |
2,3 |
5 |
600 |
2,35 |
6 |
720 |
2,35 |
7 |
840 |
2,35 |
8 |
960 |
2,35 |
9 |
1080 |
2,35 |
10 |
1200 |
2,3 |
Masa katody po eksperymencie:
Teoria zjawiska:
Elektrolity stanowią charakterystyczną grupę przewodników prądu elektrycznego. Otrzymujemy je w wyniku rozpuszczenia w wodzie lub innym rozpuszczalniku o dużej stałej dielektrycznej, substancji o wiązaniu jonowym, tzn. kwasów, zasad i soli. Procesowi rozpuszczania wymienionych substancji towarzyszy proces rozpadu cząsteczek obojętnych elektrycznie na jony, zwany dysocjacją elektrolityczną. Wyjaśnienie tego procesu jest następujące. Cząsteczka o wiązaniu jonowym składa się z dwu członów naelektryzowanych: jeden ładunkiem dodatnim, drugi ujemnym. Człony e nazywane jonami dodatnimi (+) i jonami ujemnymi (-) związane są w jedną całość siłami wzajemnego przyciągania elektrostatycznego. Siła ta, zgodnie z prawem Coulomba , wyrażona jest wzorem:
gdzie: q1,q2 - ładunki jonów
r - odległość między jonami
Siła wyrażona tym wzorem jest siłą wiązania jonowego i działa wtedy, gdy cząsteczka znajduje się w otoczeniu cząsteczek powietrza.
Ładunek jonów w cząsteczce powstaje dzięki przekazaniu przez jeden człon cząsteczki jednego lub więcej elektronów walencyjnych członowi drugiemu. Dzięki temu jon ujemny ma nadmiar elektronów, jon dodatni - niedobór. Wielkość ładunku każdego z jonów wyrażona jest iloczynem ładunku elementarnego e i wartością jonu.
Nie wszystkie cząsteczki znajdujące się w roztworze ulegają rozpadowi na jony, lecz tylko pewien ich procent. Stosunek liczny cząsteczek zjonizowanych do ogólnej liczby cząsteczek w roztworze nazywamy stopniem dysocjacji:
gdzie: n - liczba cząsteczek zdysocjowanych
N - ogólna liczba cząsteczek rozpuszczonych
Wartość stopnia dysocjacji zależy od wielu czynników: temperatury, stężenia roztworu, rodzaju ciału rozpuszczonego, a przede wszystkim - od natury rozpuszczalnika. Wysoki stopień dysocjacji występuje zwykle w takich rozpuszczalnikach, które odznaczają się dużą wartością stałej dielektrycznej.
Jony, tak jak i cząsteczki poruszają się. Może się zdarzyć, że anion - jon ujemny - i kation - jon dodatni - zbliżają się do siebie tak bardzo, że wskutek oddziaływań elektrostatycznych przyciągną się wzajemnie i połączą; utworzą w ten sposób znów cząsteczkę obojętną. Zjawisko to nazywamy rekombinacją; jest ono zjawiskiem odwrotnym do procesu dysocjacji. Wskutek równoczesnego występowania obu wymienionych działań, w elektrolicie wytwarza się stan tzw. równowagi dynamicznej; cechuje go stały stopień dysocjacji; w stanie tym liczba jonów, które ulegną rekombinacji jest stale wyrównywana nowymi jonami, powstałymi w wyniku dysocjacji.
Z chwilą przyłożenia napięcia do elektrod zanurzonych w roztworze (elektrody łączymy z biegunami źródła stałego napięcia) powstaje między nimi pole elektryczne. Pod jego wpływem jony o ładunku ujemnym (aniony) poruszają się ku anodzie, jony o ładunku dodatnim (kationy) - ku katodzie. Szybkość ich ruchu zależy od natury jonów, lepkości otaczającego ośrodka i od natężenia pola. Im większe natężenie tym większa jest prędkość jonów. Osiągnąwszy elektrody, jony osiadają na nich i neutralizują się : aniony oddają anodzie swoje nadwyżkowe elektrony, te zaś przechodzą do obwodu zewnętrznego i wędrują ku katodzie; na katodzie kationy przyłączają brakujące im elektrony.
Ilość substancji wydzielających się w czasie elektrolizy na elektrodach określona jest prawami, które w drodze eksperymentalnej zostały ustalone przez Faradaya.
I prawo Faradaya.
Masa substancji wydzielonej na każdej z elektrod jest proporcjonalna do wartości ładunku przeniesionego przez elektrolit (1):
gdzie: k - równoważnik elektrochemiczny równy liczbowo masie substancji wydzielonej przez prąd o natężeniu 1A w czasie 1s. Współczynnik ten jest zależny od rodzaju wydzielającej się substancji, natomiast niezależny jest od stężenia roztworu, od kształtu i od wzajemnej odległości elektrod oraz od temperatury roztworu.
I - natężenie prądu płynącego przez elektrolit
t - czas przepływu prądu
Q = I * t - ładunek przeniesiony przez elektrolit
II prawo Faradaya.
Masy substancji wydzielonych na dowolnej elektrodzie z dowolnego roztworu takim samym prądem i w ciągu tego samego czasu mają się do siebie tak, jak równoważniki chemiczne tych substancji.
A więc (2):
gdzie:
masa atomowa substancji
w - wartościowość
Uwzględniając (1) i (2) można napisać(3):
lub (4):
gdzie: F - stała Faradaya.
Stosując stałą Faradaya można przepisać równanie (1) w postaci:
Z równania (4) wynika, że stała Faradaya ma wymiar ładunku elektrycznego, zaś z równania (5) wynika, że gdy I * t =F , wydzielona zostanie masa m = R, czyli masa jednego równoważnika chemicznego. Stała Faradaya jest równa ładunkowi związanemu z wydzieleniem na dowolnej elektrodzie jednego gramo - lub kilogramo - równoważnika chemicznego. Stosując konsekwentnie układ SI używać należy pojęcia kilogramorównoważnika. W tym przypadku wartość stałej Faradaya wynosi:
Obliczenia:
Wyznaczanie równoważnika elektrochemicznego:
Dane:
--------------------------------------------------------------------
Wyznaczanie stałej Faradaya:
---------------------------------------------------------------------
Obliczanie niepewności:
I. Niepewność dla równoważnika elektrochemicznego:
niepewność dla czasu t:
niepewność dla natężenia I :
Lp. |
Czas [t] |
Wartość natężenia [A] |
Ei |
Ei2 |
1 |
2 |
2,1 |
0,19 |
0,0361 |
2 |
4 |
2,2 |
0,09 |
0,0081 |
3 |
6 |
2,25 |
0,04 |
0,0016 |
4 |
8 |
2,3 |
-0,01 |
0,0001 |
5 |
10 |
2,35 |
-0,06 |
0,0036 |
6 |
12 |
2,35 |
-0,06 |
0,0036 |
7 |
14 |
2,35 |
-0,06 |
0,0036 |
8 |
16 |
2,35 |
-0,06 |
0,0036 |
9 |
18 |
2,35 |
-0,06 |
0,0036 |
10 |
20 |
2,3 |
-0,01 |
0,0001 |
Średnia 2,29 |
0,0640 |
|||
- niepewność typu A :
- niepewność typu B :
- niepewność dla natężenia I :
niepewność dla masy - mkat i mkat_po :
pochodna po czasie t :
pochodna po napięciu I :
pochodna po masie :
niepewność całkowita :
niepewność rozszerzona :
ostateczny wynik :
--------------------------------------
II. Niepewność dla stałej Faradaya:
niepewność dla M :
niepewność dla k (powyżej):
pochodna po M :
pochodna po k :
niepewność całkowita :
niepewność rozszerzona :
ostateczny wynik :
---------------------------------------------------------
Wnioski:
Wyszukiwarka
Podobne podstrony:
1 laborkiid 9413 Nieznany (2)
Obrobka cieplna laborka sprawko
WYDZIA~1, Labolatoria fizyka-sprawozdania, !!!LABORKI - sprawozdania, Lab, !!!LABORKI - sprawozdania
LABORKA2, Biotechnologia, Fizyka, Labolatorium
sila termoelektryczna, Transport i Logistyka (AM) 1 (semestr I), Fizyka, fiza laborki (rozwiązania),
Cw. 1 (gazowe) Badanie procesu spalania gazu ziemnego, PODRĘCZNIKI, POMOCE, SLAJDY, SUROWCE I PALIWA
laborka na za tydzień, laboratorium fizyczne, Laboratorium semestr 2 RÓŻNE
10.6 poprawione, semestr 4, chemia fizyczna, sprawka laborki, 10.6
PKM, Politechnika Lubelska, Studia, Studia, organizacja produkcji, laborki-moje, od majka, SPRAWOZDA
Pojęcia na egzamin z metali, Chemia Fizyczna, chemia fizyczna- laborki rozne, Rozne
Cwiczenie zabawowe, STUDIA, Polibuda - semestr II, Hydraulika i hydrologia, laborki z hydro
poprawa druk, Uczelnia, sem I, fiza, LABORATORIUM, Nowe laborki, Ciecz
linia cisnien, STUDIA, Polibuda - semestr II, Hydraulika i hydrologia, laborki z hydro, laborki
BIOCHEMIA 8, Laborki
Drgania Ćwiczenie nr 13, Politechnika Lubelska, Studia, semestr 5, Sem V, Sprawozdania, Laborka, Lab
Wyznaczanie stałej siatki dyfrakcyjnej, Prz inf 2013, I Semestr Informatyka, Fizyka, SPRAWOZDANIA DU
mmgg, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II sprawka
IzoLinioweLABORKA-StronaTytulowa, Laborki
Zadanie koncowe, Studia PŁ, Ochrona Środowiska, Biochemia, laborki, sprawka
więcej podobnych podstron