Tomasz Osmański
Ćwiczenie nr 4 i 5
Wykonanie ogniwa pierwotnego typoszeregu R
Kontrolowane wyładowanie ogniwa pierwotnego
Wstęp teoretyczny:
Ogniwa chemiczne są niskonapięciowymi źródłami prądu stałego, a ilość dziedzin w których mają zastosowania jest ogromna. Napięcie w ogniwach chemicznych (SEM) jest zależne od rodzaju substancji użytych w ogniwach i wartość jego jest różnią pomiędzy potencjałem elektrochemicznym utleniacza i reduktora. Ponieważ w chwili obecnej super utleniaczem mają potencjały lekko powyżej 3V, a super reduktory ok. -3V, to maksymalne napięcie jakie można otrzymać z ogniwa wynosi 6V. Aby wytworzyć wyższe napięcie, należy połączyć kilka ogniw szeregowo, dzięki czemu napięcie końcowe będzie sumą napięć wszystkich ogniw.
Ogniwo Leclanche zaliczmy do nieodwracalnych ogniw pierwotnych. Nieodwracalność tego ogniwa polega na tym, że po wyczerpaniu ogniwa, nie ma możliwości całkowitego, lub nawet częściowego odtworzenia materiałów elektrodowych w procesie elektrolizy. Ogniwo zaproponowane przez Laclanche'go składało się z z pręta ze spieczonego węgla elektrodowego, z zaciskiem metalowym, otoczonego sprasowaną mieszaniną składającą się z trzech części dwutlenku manganu (braunsztynu), i jednej części sadzy w celu zwiększenia przewodnictwa całej masy. Masa wokół pręta grafitowego nasycona jest 20% roztworem chlorku amonu, z niewielkim dodatkiem chlorku rtęci (II). Zadaniem NH4Cl, jest zapewnienie kompleksowania kationom cynku, dzięki czemu następuje obniżenie potencjału standardowego elektrody cynkowej zgodnie z poniższym równaniem Nernsta:
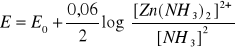
Obecność w mieszaninie chlorku rtęci w mieszaninie powoduje utworzenie amalgamatu na wewnętrznej powierzchni kubka cynkowego, co w konsekwencji powoduje zwiększenie reaktywności cynku.
Materiał elektrodowy sprasowany wokół elektrody grafitowej stanowi elektrodę dodatnią ogniwa. Elektrodą ujemną w tym ogniwie jest natomiast kubek cynkowy, w którym umieszcza się materiał elektrodowy. Miedzy materiałem elektrodowym, a powierzchnią cynku wprowadza się porowatą przegrodę, w postaci specjalnie spreparowanego papieru, którego zadanie jest podobne do roli klucza elektrolitycznego, tzn. umożliwia wyrównywanie ładunku w obydwu półogniwach (jest przepuszczalne dla roztworu elektrolitu), ale zapobiega samorzutnemu wyładowaniu się ogniwa.
Schematycznie ogniwo Leclanche'go można zapisać jak układ:
![]()
Reakcje które biegną podczas pracy tego ogniwa są następujące:
Katoda:
MnO2 + 1e + NH4+ ↔ MnOOH + NH3 (E0 = 0,98V)
2 MnOOH → Mn2O3 + H20
Anoda:
Zn ↔ Zn2+ + 2e (E0 = -0,77V)
Zn2+ + 2NH3 ↔ [Zn(NH3)2]2+
Sumaryczną reakcję biegnącą w ogniwie przedstawia się poniższym równaniem:
Zn + 2MnO2 + 2NH4Cl ↔ [Zn(NH3)2]Cl2 + Mn2O3 + H2O
Próba regeneracji takiego ogniwa w procesie elektrolizy sprowadzi się do rozkładu wody na wodór i tlen.
Jeżeli skorzystamy z wartości potencjałów standardowych reakcji połówkowych, to SEM tego ogniwa obliczona na ich podstawie wynosi: 1,75V. Wartość tego potencjału jest zależna w dość znacznym stopniu od składu mieszaniny elektrodowej i może ulegać niewielkim odchyleniom od teoretycznej. Producenci tego typu ogniw podają ich potencjał jako równy 1,5V. W przypadku jednak pobierania z ogniwa dużych prądów następuje gwałtowny spadek napięci na zaciskach od 1,1V - 1,2V.
Ważnym parametrem opisującym każde ogniwo jest tzw. pojemność elektryczna, wyrażona najczęściej w jednostce A*h (amperogodzina). Wielkość ta zależna jest od ilości materiału elektrodowego w ogniwie, a jej teoretyczną wartość można policzyć, na podstawie praw Faradaya.
Na opakowaniach ogniw typoszeregu R nie podawana jest ich pojemność. Ponieważ jednak celem tego ćwiczenia było praktyczne wykonanie takiego ogniwa, to znając jego skład mogę obliczyć teoretyczną pojemność elektryczną, przeliczoną na MnO2.
Ilość użytego MnO2 wynosiła 20g. Masa molowa tego związku wynosi: 87g/mol, stąd ilość moli mojego składnika jest równa:
n = 20/87= 0,23 mola. Ponieważ jeden mol dwutlenku manganu przyjmuje 1 mol elektronów, stąd teoretyczny ładunek jaki może zostać pobrany przez obliczoną ilość substancji wynosi.
Q = 96500C/mol * 0,23 mola = 22195 C = 22195 A*s = 22195 A*s * 1h/3600s = 6,16 Ah
Równanie termodynamiczne ogniwa galwanicznego i konwencja Sztkoholmska:
Podstawowym równaniem termodynamicznym opisującym ogniwo jest równanie postaci:
![]()
, w którym
![]()
- standardowa entalpia swobodna reakcji biegnącej w ogniwie
E - potencjał ogniwa
F - stała Faradaya - ładunek 1 mola elektronów
![]()
- stechiometryczny współczynnik elektronów
A by powyższe równanie było jednoznaczne, co do znaku potencjału konieczne było wprowadzenie kilku reguł dotyczących zapisu schematycznego ogniwa. Reguły takie zostały ustalone przez UPAC w tzw. konwencji sztokholmskiej.
1) Mając dane równanie sumaryczne biegnące w ogniwie, zapisujemy odpowiadający mu schemat w taki sposób, aby wynikający z równia proces redukcji zachodził w półogniwie prawym, proces redukcji natomiast w półogniwie lewym
2) Siłą elektromotoryczną ogniwa nazywamy potencjał elektrostatyczny drutu przyłączonego do elektrody znajdującej się na schemacie ogniwa po prawej stronie, mierzony w stanie równowagi względem potencjału drutu z tego samego metalu przyłączonego do elektrody lewej:
![]()
W czasie pracy ogniwa następuje przeniesienie ładunku przez granicę faz - z wnętrza jednej fazy metalicznej (elektroda), do drugiej fazy metalicznej, a także z fazy metalicznej (elektrody) do roztworu. Procesy te zachodzą także i odwrotnie. Energia tego typu przemian określana jest przez różnicę potencjałów Galvaniego obu faz. Potencjał Galvaniego (φ), który jest charakterystyczny dla danej fazy nazywa się pracą elektrostatyczną, potrzebną do przeniesienia jednostkowego ładunku dodatniego z punktu bardzo oddalonego w przestrzeni do wnętrza danej fazy. Potencjał ten różni się od potencjału Volty o tzw. potencjał powierzchniowy (φ), czyli wartość pracy elektrostatycznej związanej z przekazaniem ładunku przez granicę faz:
![]()
Już na samym początku rozwoju elektrochemii ustalono, że gdy zanurzymy metal do roztworu soli tego metalu, to na granicy faz metal-roztwór wytwarza się pewien potencjał, którego bezpośrednio nie jesteśmy w stanie zmierzyć (mierzymy tylko różnicę potencjałów w stosunku do potencjału standardowej elektrody wodorowej). Wytworzony potencjał jest zależny od rodzaju zanurzonego metalu, i stężenia kationów tego metalu w danym roztworze.
Przyczyny występowania potencjału na granicy metal/roztwór to:
wybiórcza adsorpcja jonów jednego rodzaju, powodująca nagromadzenie się ładunku jednego znaku w sąsiedztwie granicy faz, i dla zachowania elektroobojętności układu w całości, wytworzenie rozmytego ładunku przeciwnego znaku we wnętrzu tej samej fazy. W tym przypadku różnica potencjałów umiejscowiona jest w obrębie jednej fazy.
adsorpcja polarnych cząsteczek rozpuszczalnika bądź substancji rozpuszczonej, zachodzącą w taki sposób, że dipole orientują się na granicy faz. Spadek potencjału zlokalizowany jest wówczas również w obrębie jednej fazy, na grubości jednej lub kilku warstw cząsteczkowych.
Pracownia Elektrochemii
Wyszukiwarka
Podobne podstrony:
4697
4697
praca-licencjacka-b7-4697, Dokumenty(8)
4697
037 2id 4697
4697
4697
4697
4697
więcej podobnych podstron