Imię i nazwisko
Imię i nazwisko
Grupa
Ćwiczenie 8
Temat: Mieszaniny buforowe
I. Część teoretyczna
Stężenie jonów hydroniowych wywiera wpływ na stan równowagi chemicznej w roztworach wodnych, jak również na przebieg reakcji chemicznych. W celu wytworzenia i utrzymania właściwego stężenia jonów hydroniowych w roztworze stosujemy mieszaniny buforowe: są to mieszaniny słabych zasad lub kwasów z ich solami np. CH3COOH i CH3COONa lub NH4OH i NH4Cl oraz mieszaniny soli słabych kwasów wieloprotonowych o różnych stopniach neutralizacji np. NaH2PO4 i Na2HPO4 lub Na2HPO4 i Na3PO4 .
Mieszaniny buforowe mają określone pH, którego wartość zmienia się nieznacznie po wprowadzeniu do roztworu pewnego nadmiaru jonów H3O+ lub OH-. Inaczej mówiąc, mieszaniny te wykazują „działanie buforujące", tzn. uniemożliwiają gwałtowną zmianę pH roztworu. Podobnie rozcieńczanie czy zwiększanie stężenia roztworów buforowych nie ma wpływu na wartość ich pH. Dla buforu o charakterze kwaśnym np. CH3COONa + CH3COOH, stężenie jonów hydroniowych [H3O+] oblicza się ze wzoru
![]()
gdzie:
Kk - stała dysocjacji i słabego kwasu,
Ck - stężenie kwasu,
Cs - stężenie soli.
Mechanizm działania roztworu buforującego jest taki: po dodaniu do mieszaniny buforowej kwasu anion soli zawartej w buforze tworzy z jonem H3O+ słabo zdysocjowany kwas, natomiast po dodaniu zasady jon hydroniowy kwasu zawartego w mieszaninie tworzy z jonem OH' słabo zdysocjowane cząsteczki wody. Wskutek powstania słabo zdysocjowanych cząstek kwasu i wody, pH roztworu zmienia się nieznacznie.
![]()
![]()
![]()
W przypadku buforu zasadowego np. NH4OH i NH4Cl, do obliczenia stężenia jonów hydroniowych [H3O+] stosuje się równanie
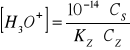
gdzie:
Cs - stężenie soli,
Cz - stężenie zasady,
Kz - stalą dysocjacji słabej zasady danego buforu.
II. Część doświadczalna
Doświadczenie 1
Przebieg doświadczenia:
Sporządzamy roztwory 0,1 M i 0,2 M w następujących proporcjach
Roztwór 1 chlorek amonu/wodorotlenek amonowy - 1/16
Roztwór 2 chlorek amonu/wodorotlenek amonowy - 1/4
Roztwór 3 chlorek amonu/wodorotlenek amonowy - 1/1
Roztwór 4 chlorek amonu/wodorotlenek amonowy - 4/1
Roztwór 5 chlorek amonu/wodorotlenek amonowy - 16/1
A następnie odczytujemy za pomocą papierka lakmusowego pH
Opracowanie wyników:
Związek chemiczny |
Stosunek objętościowy roztworów |
||||
0,1 mol/dm3 chlorek amonowy |
1 |
1 |
1 |
4 |
16 |
0,1 mol/dm3 wodorotlenek amonowy |
16 |
4 |
1 |
1 |
1 |
Wartość pH |
10,0 |
9,7 |
9,4 |
8,8 |
8,2 |
0,2 mol/dm3 chlorek amonowy |
1 |
1 |
1 |
4 |
16 |
0,2 mol/dm3 wodorotlenek amonowy |
16 |
4 |
1 |
1 |
1 |
Wartość pH |
7,0 |
7,3 |
7,4 |
7,6 |
7,9 |
Doświadczenie 2
Przebieg doświadczenia:
Stosując roztwory 0,1 M, sporządzamy mieszaniny buforowe mieszając je w następujących proporcjach:
Roztwór 1 wodoroortofosforan(V) sodowy/dwu wodoroortofosforan(V) sodowy - 1/16
Roztwór 2 wodoroortofosforan(V) sodowy/dwu wodoroortofosforan(V) sodowy - 1/4
Roztwór 3 wodoroortofosforan(V) sodowy/dwu wodoroortofosforan(V) sodowy - 1/1
Roztwór 4 wodoroortofosforan(V) sodowy/dwu wodoroortofosforan(V) sodowy - 4/1
Roztwór 5 wodoroortofosforan(V) sodowy/dwu wodoroortofosforan(V) sodowy - 16/1
A następnie dodajemy dwuchromian(VI) potasu - barwa żółta
Opracowanie wyników:
Doświadczenie 3
Przebieg doświadczenia:
Stosując roztwory 0,1 M, sporządzamy mieszaniny buforowe mieszając je w następujących proporcjach:
Roztwór 1 kwas octowy/octan sodowy - 1/16
Roztwór 2 kwas octowy/octan sodowy - 1/4
Roztwór 3 kwas octowy/octan sodowy - 1/1
Roztwór 4 kwas octowy/octan sodowy - 4/1
Roztwór 5 kwas octowy/octan sodowy - 16/1
Opracowanie wyników:
Związek chemiczny |
Stosunek objętościowy roztworów |
||||
0,1 mol/dm3 kwas octowy |
1 |
1 |
1 |
4 |
16 |
0,1 mol/dm3 octan sodowy |
16 |
4 |
1 |
1 |
1 |
Wartość pH |
7,0 |
7,3 |
7,3 |
7,3 |
7,3 |
Doświadczenie 4
Przebieg doświadczenia:
Do próbówki wlewamy 1/5 objętości chlorku baru i dodajemy 5-10 kropli kwasu solnego, a następnie wlewamy małymi porcjami roztwór dwuchromianu(VI) potasu aż do momentu wytrącenia się osadu. Wymieszaną zawartość próbówki dzielimy na dwie części - jedną zastawiamy jako wzorzec, a do drugiej dodajemy 5 cm3 octanu sodowego.
Opracowanie wyników:
Doświadczenie 5
Przebieg doświadczenia:
Jak wyżej tylko bez dodatku kwasy solnego
Opracowanie wyników:
Wyszukiwarka
Podobne podstrony:
Chemia4, Chemia uniwersytet
Chemia2, Chemia uniwersytet
Chemia5, Chemia uniwersytet
Chemia6, Chemia uniwersytet
Chemia3, Chemia uniwersytet
Chemia8, Chemia uniwersytet
Chemia Egzamin A4, Chemia uniwersytet
Chemia Egzamin 2, Chemia uniwersytet
Chemia1, Chemia uniwersytet
Chemia Egzamin 1, Chemia uniwersytet
Chemia4, Chemia uniwersytet
CHEMIA BUDOWLANA, sprawozdania, , sprw. 3, UNIWERSYTET ZIELONOGÓRSKI
CHEMIA BUDOWLANA, sprawozdania, , sprw. 1, UNIWERSYTET ZIELONOGÓRSKI
chemia fizyczna - zestawy pytan, uniwersytet warmińsko-mazurski, inżynieria chemiczna i procesowa, r
UNIWERSYTET ZIELONOGÓRSKI spr, Studia budownictwo pierwszy rok, Chemia budowlana, Chemia budowlana,
aaa. opracowania 24-48, Analityka Medyczna 2014-19 Uniwersytet Medyczny Wrocław, Chemia ogólna i nie
Egzamin chemia up lublin uniwersytet przyrodniczy
chemia zywnosci[1], uniwersytet warmińsko-mazurski, inżynieria chemiczna i procesowa, rok II semestr
chemia analityczna emisyjna spektrometria atomowa, Geologia, UNIWERSYTET WARSZAWSKI, SEMESTR I, METO
więcej podobnych podstron