Korozja metali
|
|
||
Rozróżniamy korozję chemiczną i elektrochemiczną |
|||
Korozja chemiczna |
|
||
Korozja gazowa |
|
||
Korozja elektrochemiczna |
|
||
Proces rdzewienia |
|||
|
|||
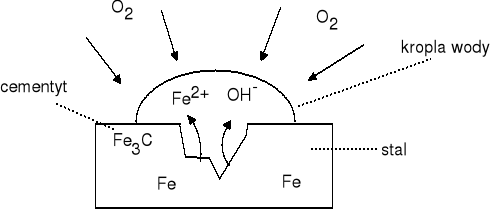
Cementyt stanowi elektrodę dodatnią (katodę), a żelazo ujemną (anodę). |
|||
Anoda: |
Fe0 - 2e = Fe2+ |
||
Katoda: |
2 H2O + O2 + 4e = 4 OH- |
||
Powstające jony Fe2+ reagują z jonami wodorotlenowymi OH-: Fe2+ + 2 OH- = Fe(OH)2 Wodorotlenek żelaza (II) ulega utlenieniu: 4 Fe(OH)2 + O2 + 2 H2O = 4 Fe(OH)3 Samorzutny rozkład wodorotlenku żelaza (III): 2 Fe(OH)3 = Fe2O3*3 H2O Na powierzchni żelaza tworzy się warstwa uwodnionych tlenków tzw. rdza. |
|||
Czynniki wpływające na korozję:
|
|||
Ochrona metali przed korozją. |
|
1. stosowanie powłok ochronnych
|
|
|
|
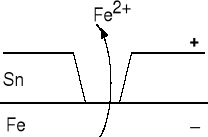
Cyna staje się katodą, a żelazo anodą. Powłoka utworzona z cyny słabo chroni przed korozją, przyczynia się do zwiększenia szybkości korozji. Żelazo jako metal o niższym potencjale niż cyna utlenia się szybciej. |
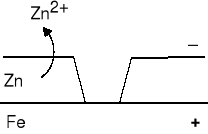
Żelazo staje się katodą, a cynk anodą. Powłoka utworzona z cynku dobrze chroni przed korozją. Cynk jako metal o niższym potencjale niż żelazo utlenia się szybciej i przechodzi do roztworu w postaci jonów. |
2. stosowanie ochrony katodowej W zbiornikach i kotłach umieszcza się grafitowe elektrody połączone z dodatnim biegunem napięcia. Ściany zbiornika łączy się z ujemnym biegunem napięcia nadając im tak niski potencjał by atomy żelaza nie mogły przechodzić w kationy. |
|
3. osłabienie agresywności środowiska |
|
4. dobór odpowiedniego w danych warunkach metalu lub stopu |
|
Wyszukiwarka
Podobne podstrony:
Stop metali, Chemia nieorganiczna
Korozja metali, Energetyka, Chemia
Korozja metali, technologia chemiczna, chemia fizyczna, srawozdania
,chemia L,korozja metali
7 korozja metali, Politechnika Rzeszowska, Chemia
Korozja metali I, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, Korozja metali I
korozja metali i, I semstr moje materiały, chemia materialow budowlanych, laborki
chemia, Korozja metali II, Wydz
chemia korozja metali
chemia korozja metali bzyk
CHEMIA - LABORATORIUM - SPRAWOZDANIE - Korozja metali, STUDIA
KOROZJA METALI, Szkoła, penek, Przedmioty, Chemia, Laboratoria
Korozja metali II oksydowanie, STUDIA POLIBUDA, INŻYNIERIA MATERIAŁOWA, SEMESTR I, Chemia, Laborator
korozja metali 3, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, 1sem.chemia.laborki, Chem
Korozja metali, Energetyka, Chemia
CHEMIA NIEORGANICZNA 2
więcej podobnych podstron