Obliczenia
|
WARTOŚĆ |
JEDNOSTKI |
ciepło spalenia drucika qsp,d |
-6688000 |
J/kg |
ciepło Joule'a qJ |
10 |
J/m |
masa wody w kalorymetrze mw |
2,8832 |
kg |
masa drucika md |
0,00001905 |
kg |
długość drucika ld |
0,15 |
m |
ciepło właściwe wody cw |
4175 |
J/kg*K |
pojemność cieplna kalorymetru z osprzętem r |
1531 |
J/K |
Tkor ( Renaulta-Pfaundlera ) |
2,1623 |
K |
Tkor (metoda graficzna) |
1,9272 |
K |
masa molowa M związku C7H7O3N |
153,13538 |
g/mol |
Obliczenie ciepła spalania badanego związku z poniższego wzoru. W miejsce ΔTrz wstawione są wartości ΔTkor obliczone kolejno obydwiema metodami:
Qsp,s + qsp,dmd + qJld + (mwcw + r)ΔTrz = 0
Qsp,s = -26023,0370 J [metoda graficzna]
Qsp,s = -29213,5625 J [metoda Renaulta-Pfaundlera]
Średnie ciepło spalania: -27618,2997 ± 1595 J
Obliczenie molowego ciepła spalania w stałej objętości: podzielenie ciepła spalania z obydwu metod Qsp,s przez masę pastylki (0,9204g) i pomnożenie przez masę molową związku.
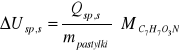
![]()
[![]()
]
![]()
[![]()
]
Średnie molowe ciepło spalania: -4595,1095 ± 265 kJ/mol
Reakcja spalania związku ![]()
νi,g = 7 + 1 - 33/4 = -1/4
Obliczenie standardowego molowego ciepła spalania:
![]()
![]()
kJ/mol [metoda graficzna]
![]()
kJ/mol [metoda R-F]
Średnie standardowe molowe ciepło spalania: -4599,3864 ± 266 kJ/mol
Obliczenie standardowego molowego ciepła tworzenia:
[ C(grafit) + O2(g) = CO2(g) ] H (tw) (CO2) |
-393,51 |
kJ/mol |
TABELA 14.3.B |
[ H2(g) + 1/2O2(g) = H2O(c) ] H (tw) (H2O) |
-285,9 |
kJ/mol |
str.406 |
[ 1/2N2(g) + O2(g) = NO2(g) ] H (tw) (NO2) |
33,32 |
kJ/mol |
podręcznik |
![]()
= -![]()
(C7H7O3N) + 7 *![]()
(CO2) + ![]()
(H2O) + ![]()
(NO2)
METODA GRAFICZNA:
![]()
= - 4333,6968 + 7*(-393,51) + 7/2*(-285,9) + 33,32 = 611,7968
METODA RENAULTA-PFAUNDLERA
![]()
= - 4865,0760 + 7*(-393,51) + 7/2*(-285,9) + 33,32 = 1143,1760
Średnie standardowe molowe ciepło tworzenia: 877,4864 ± 266 kJ/mol
Wyszukiwarka
Podobne podstrony:
chemia fizyczna laboratoria, iwona chem. fiz. ćw. 91
Moje Ćw 24, POLITECHNIKA ŁÓDZKA, Technologia Żywności i Żywienia Człowieka, semestr 4, Chemia fizycz
chemia fizyczna laboratoria, iwona-chem. fiz. ćw. 33, Iwona Frątczak
SEM ogniwa1, Technologia chemiczna, Chemia fizyczna, Laboratorium, inne, SEM ogniwa
wpływ stężenia i temperatury na lepkość roztworów, Chemia fizyczna, laboratorium, Chemia fizyczna
Ćwiczenie 1 - oznaczanie stalej i stopnia dysocjacji, Biotechnologia PWR, Semestr 3, Chemia fizyczna
chem.fiz.równowagi fazowe, Inżynieria środowiska, inż, Semestr III, Chemia fizyczna, laboratorium
Badanie równowagi fazowej w układzie trójskładnikowym 8.3, Technologia chemiczna, Chemia fizyczna, l
elektrolityzadania st, Technologia chemiczna, Chemia fizyczna, laboratorium
chemia fizyczna laboratoria, 95,94, 97
chemia fizyczna laboratoria, 31,32,33vigora, 97
chemia fizyczna laboratoria, 16Ania, ffffff
chemia fizyczna laboratoria, KOND42, 97
chemia fizyczna laboratoria, KOND42, 97
22, chemia fizyczna laboratorium, 22
więcej podobnych podstron