Nr i tytuł ćwiczenia:
Ćwiczenie 1-1. Wyznaczanie ciepła rozpuszczania
|
|||||
Imię i nazwisko osoby prowadzącej ćwiczenia:
Bożena Parczewska Plesnar |
|||||
Data wykonania ćwiczenia |
Godz. |
Nr grupy studenckiej
|
Zespół
|
Nazwiska osób wykonujących ćw.
|
Pkt za spr |
14.04.2010 |
11-14 |
1 |
c |
Marta Brzostowska |
|
Uwagi prowadzącego: |
|
||||
1.Cel ćwiczenia
Celem ćwiczenia jest wyznaczanie ciepła rozpuszczania substancji stałych (kwasu benzoesowego) oraz pomiarów ich rozpuszczalności w różnych temperaturach.
2.Wstęp teoretyczny:
Ciepło rozpuszczania- efekt energetyczny towarzyszący procesowi rozpuszczania. Rozpuszczanie różni się od reakcji chemicznej tym, że w odróżnieniu do reakcji chemicznej ilość substancji biorących udział w procesie rozpuszczania nie musi spełniać ściśle określonych stosunków masowych. Efekt energetyczny towarzyszący procesowi rozpuszczania zależy od: rodzaju substancji rozpuszczanej i rozpuszczalnika, od tego ,czy dana substancja jest wprowadzana do czystego roztworu lub do roztworu o określonym stężeniu oraz od wartości początkowego i końcowego stężenia roztworu. Rozróżnia się kilka rodzajów ciepła rozpuszczania: molowe ciepło rozpuszczania, pierwsze ciepło rozpuszczania, pełne ciepło rozpuszczania, pełne ciepło rozpuszczania, cząstkowe ciepło rozpuszczania, ostatnie ciepło rozpuszczania.
Wartość ciepła rozpuszczania pod stałym ciśnieniem (entalpię rozpuszczania ΔHr) można wyznaczyć w bezpośrednich pomiarach kalorymetrycznych lub obliczyć z równania izobary van't Hoffa na podstawie danych o rozpuszczalności substancji w danym rozpuszczalniku w różnych temperaturach.
Rozpuszczalność (Rs) to stosunek masy substancji rozpuszczonej do masy rozpuszczalnika:
Rs=ms/mr
Gdzie:
ms - masa substancji rozpuszczonej
mr - masa rozpuszczalnika
Najczęściej podawana jest rozpuszczalność substancji w 100g rozpuszczalnika, a więc obliczana z zależności:
Rs=(ms/mr)100
Eksperymentalnie rozpuszczalność wyznacza się, wprowadzając do rozpuszczalnika nadmiar substancji rozpuszczanej i wytrząsając lub mieszając roztwór w stałej temperaturze doprowadza się do stanu równowagi. Następnie po odsączeniu osadu określa się jedną z metod analitycznych stężenie substancji w roztworze nasyconym.
Oblicza się stałą równowagi (K) procesu:
(AB)S↔(AB)C
Gdzie:
(AB)S - substancja rozpuszczana występująca w fazie stałej
(AB)C - substancja rozpuszczana występująca w roztworze nasyconym,
Z zależności:
K=[AB]C/[AB]S
Ponieważ w wyrażeniu tym wielkość [AB]S ma stałą wartość, zależną jedynie od powierzchni fazy stałej, która praktycznie jest stała, więc stałą równowagi (K) oblicza się z równania:
K=[AB]C
Gdzie [AB]C = Rs , tzn. jest równa rozpuszczalności badanej substancji.
Wpływ temperatury na tę równowagę opisuje równanie izobary van't Hoffa:
d(lnK)/dT= ΔH/RT2
gdzie:
K - stała równowagi, równa rozpuszczalności (Rs) w temperaturze T
ΔH - entalpia rozpuszczania, czyli efekt energetyczny związany z procesem rozpuszczania substancji w danej temperaturze i pod stałym ciśnieniem (prowadzący do otrzymania roztworu nasyconego).
Całkując równanie d(lnK)/dT= ΔH/RT2 w przedziale temperatur T1-T2 - przy założeniu, że ΔH nie zmienia się w tym zakresie temperatury, otrzymuje się wyrażenie na entalpię rozpuszczania:
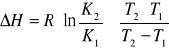
Gdzie:
K2 i K1 - rozpuszczalność substancji odpowiednio w temperaturze T2 i T1
R - stała gazowa (8,313 J∙mol-1∙K-1 ).
3. Wykonanie ćwiczenia
Na wadze technicznej odważamy mniej więcej po 2 g kwasu benzoesowego i wsypujemy go do 4 ponumerowanych kolb stożkowych z korkiem na szlif o pojemności 100 cm3. Do każdej kolby dodajemy po 80 cm3 wody destylowanej odmierzonej cylindrem, podgrzanej do temperatury około 60°C. Dwie kolby wkładamy do wytrząsarki na około 30 minut, a pozostałe dwie wytrząsamy chwile i wkładamy do łaźni parowej o temperaturze 40°C. Ważymy na wadze technicznej 4 puste kolby stożkowe o pojemności 250 cm3. Następnie bez wyjmowania kolb z termostatów pobiera się kolejno, pipetą o objętości 25 cm3 (z nasuniętym na jej koniec wężykiem gumowym, zawierającym zatyczkę z waty w charakterze sączka) i 50 cm3 z kolb wytrząsanych na wytrząsarce, nasycony roztwór badanej substancji. Pobrane roztwory przenosi się do zważonych kolb stożkowych. Kolby z roztworami ważymy na wadze. Przeprowadzamy miareczkowanie mianowanym roztworem NaOH w obecności fenoloftaleiny.
4.Opracowanie wyników
obliczenie Δm
Nr. kolby |
Masa pustej kolby stożkowej[g] |
Masa kolby z roztworem [g] |
Δm [g] |
1 |
133.47 |
183.25 |
49,78 |
2 |
128.98 |
178.74 |
49,76 |
3 |
108.08 |
132.87 |
24,79 |
4 |
127.85 |
152.63 |
24,78 |
obliczanie gęstości roztworów ze wzoru
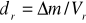
,
gdzie: Δm - różnica mas kolby z nasyconym roztworem kwasu benzoesowego i kolby pustej, Vr - objętość kwasu przed miareczkowaniem
Obliczenia dla roztworów:
Nr. kolby |
Δm [g] |
Vr [cm3] |
dr [g/cm3] |
1 |
49,78 |
50 |
0,9956 |
2 |
49,76 |
50 |
0,9952 |
3 |
24,79 |
25 |
0,9916 |
4 |
24,78 |
25 |
0,9912 |
obliczanie stężenia molowego kwasu benzoesowego z zależności:
![]()
gdzie Vkwasu - objętość roztworu przed miareczkowaniem, ckwasu - stężenie molowe kwasu benzoesowego w roztworze, VNaOH - objętość mianowanego roztworu NaOH użyta podczas miareczkowania, cNaOH - stężenie mianowanego roztworu NaOH (0,1003 mol/dm3)
Nr. kolby |
VNaOH [cm3] |
cNaOH [mol/dm3] |
Vkwasu [cm3] |
ckwasu [mol/dm3] |
1 |
20.00 |
0,1003 |
50 |
0,04012 |
2 |
23.00 |
0,1003 |
50 |
0,04614 |
3 |
13.00 |
0,1003 |
25 |
0,05216 |
4 |
13.70 |
0,1003 |
25 |
0,05496 |
Kolba numer 1 - ckwasu=0,1003mol∙dm-3∙20cm3/50cm3=0,04012 mol∙dm-3
Kolba numer 2 - ckwasu=0,1003mol∙dm-3∙23cm3/50cm3=0,04614 mol∙dm-3
Kolba numer 3 - ckwasu=0,1003mol∙dm-3∙13cm3/25cm3=0,05216 mol∙dm-3
Kolba numer 4 - ckwasu=0,1003mol∙dm-3∙13.7cm3/25cm3=0,05496 mol∙dm-3
d) obliczenie rozpuszczalności z zależności:
K=![]()
gdzie: cr - stężenie molowe wyznaczone metodą miareczkowania alkacymetrycznego roztworu nasyconego w danej temperaturze [mol/dm3], Ms - masa molowa substancji (dla kwasu benzoesowego = 122,12 g/mol), dr - gęstość roztworu nasyconego danej substancji [g/dm3].
Nr. kolby |
cr [mol/dm3] |
dr [g/dm3] |
Rs [g/100 cm3 H2O] |
1 |
0,04012 |
995,6 |
0,4921 |
2 |
0,04614 |
995,2 |
0,5662 |
3 |
0,05216 |
991,6 |
0,6424 |
4 |
0,05496 |
991,2 |
0,6771 |
Kolba numer 1-Rs=(0,04012mol∙dm-3∙122,12g∙mol-1/995,6 g∙dm-3)∙100 =0,4921g/100 g H2O
Kolba numer 2-Rs=(0,04614mol∙dm-3∙122,12g∙mol-1/995,2g∙dm-3)∙100 =0,5662g/100 g H2O
Kolba numer 3-Rs=(0,05216mol∙dm-3∙122,12g∙mol-1/991,6g∙dm-3)∙100 =0,6424g/100 g H2O
Kolba numer 4-Rs=(0,05496mol∙dm-3∙122,12g∙mol-1/991,2g∙dm-3)∙100 =0,6771g/100 g H2O
e) wyznaczenie entalpii procesu rozpuszczania,
T1 K1 = (R1+R2)/2=(0,4921g+0,5662g)/2=0,5292g/100g H2O
![]()
![]()
K![]()
=(R3+R4)/2=(0,6424g+0,6771g)/2=0,6597g/100g H2O
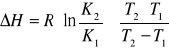
gdzie: K2 i K1 - rozpuszczalność substancji w temperaturach T2 i T1, R - stała gazowa [![]()
], T1 - 296,0 K, T2 - 313,0K. Podstawiając dane do wzoru otrzymujemy:
∆H=8,313J∙mol-1∙K-1(ln 0,6597/0,5292)∙[313,0 K∙296,0 K/(313,0K−296,0K)]=9986,04 J∙mol-1
Wartość średnia ΔH wynosi 9986,04 J/mol≈10 kJ/mol
Wyznaczanie entalpii rozpuszczania biorąc pod uwagę kąt nachylenia prostej:
A=(0,003167; -0,451) B=(0,00341; -0,978)
a=(y2-y1)/(x2-x1)=[-0,978+(-0,451)]/( 0,00341-0,003167)= -0,527/0,000243= -2168,72K
a=-ΔH/R
ΔH=-aR= -2168,72K ∙ 8,313J/mol∙K=18028,60 J/mol
5.Wnioski
Zapoznałyśmy się z metodą wyznaczania ciepła rozpuszczania substancji w stanie stałym z pomiarów jej rozpuszczalności w różnych temperaturach.
Z przebiegu obrazu graficznego wnioskujemy, że proces jest reakcją endotermiczną.
Rozpuszczalność danej reakcji wzrasta wraz ze wzrostem temperatury.
Wyniki uzyskane metodą teoretyczną 18388,99J/mol oraz algebraiczną 18028,60 J/mol są bardzo zbliżone.
Wszelkie wartości, które odbiegają od siebie na wykresie mogą być spowodowane błędami pomiarowymi, błędami podczas miareczkowania, ochłodzeniem się roztworu, wytrąceniem części kwasu.
Wyszukiwarka
Podobne podstrony:
sprawozdanie fizyczna71, SGGW - Technologia żywnosci, II semestr, SEMESTR 2, wyklady II rok, od kas
chemia fiz spr połączone, SGGW - Technologia żywnosci, II semestr, SEMESTR 2, wyklady II rok, od ol
puszcz, SGGW - Technologia żywnosci, II semestr, SEMESTR 2, wyklady II rok, od oli, technologia, ch
Obliczenia91, SGGW - Technologia żywnosci, II semestr, SEMESTR 2, wyklady II rok, od kaski
fiz 62 poprawione, SGGW - Technologia żywnosci, II semestr, SEMESTR 2, fizyka, sprawozdania, Sprawo
fiz 66, SGGW - Technologia żywnosci, II semestr, SEMESTR 2, fizyka, sprawozdania, Sprawozdania
Przedmiotem ergonomii ost, SGGW - Technologia żywnosci, II semestr, SEMESTR 2, wyklady II rok, BHP
fiz 13, SGGW - Technologia żywnosci, II semestr, SEMESTR 2, fizyka, sprawozdania, Sprawozdania
7, SGGW - Technologia żywnosci, II semestr, SEMESTR 2, fizyka, sprawozdania, Sprawozdania
podstawy test, SGGW - Technologia żywnosci, II semestr, SEMESTR 2, wyklady II rok, PODSTAWY ŻYWIENI
B Egzamin testowy z przedmiotu, SGGW - Technologia żywnosci, II semestr, SEMESTR 2, wyklady II rok,
więcej podobnych podstron