Grupa |
Zespół |
Ćwiczenie |
Data |
Ocena |
22
|
8
|
11
|
28.03.2000
|
|
Imię i nazwisko |
Temat ćwiczenia |
|||
Edyta Błaż Maria Borzęcka Joanna Jarosz
|
Współczynnik podziału Nernsta
|
|||
1. Wstęp teoretyczny
Prawo podziału Nernsta opisuje szczególny przypadek równowagi w trójskładnikowym układzie izotermiczno - izobarycznym. Jest to układ złożony z dwóch praktycznie nie mieszających się cieczy A i B, które tworzą dwie fazy: 1 - nasycony roztwór B w A i 2 - nasycony roztwór A w B. Do jednej z tych faz została wprowadzona niewielka ilość substancji C, która jest rozpuszczalna zarówno w A jak i w B, co spowodowało rozpoczęcie procesu przenoszenia substancji C przez powierzchnię między fazową z jednej fazy do drugiej. Proces ten trwa tak długo aż ustali się równowaga termodynamiczna. Zgodnie z drugą zasadą termodynamiki dla układów wielofazowych, w stanie równowagi potencjały chemiczne substancji C w obydwu fazach muszą być jednakowe:
μC(1) = μC(2) → μC0(1) + RTlnaC(1) = μC0(2) + RTlnaC(2).
Po przekształceniach:
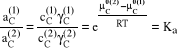
w stanie standardowym γC(1) = γC(2) = 1 dla roztworu idealnie rozcieńczonego, więc:
![]()
współczynnik podziału Nernsta, dla roztworów rzeczywistych zależy on od stężenia.
W ćwiczeniu rozważamy przypadek, gdy składnik C - kwas HA jest w fazie 1 częściowo zdysocjowany, a w fazie 2 częściowo zasocjowany. Wówczas w fazie 1 (wodnej):
HA(1) ![]()
H+ + A-
Kdys. = ![]()
c(1) - całkowite stężenie składnika C w fazie 1, α - stopień dysocjacji składnika C
W fazie organicznej:
2HA(2) = (HA)2(2)
Kdim. = ![]()
→ [(HA)2](2) = Kdim · [HA]2(2)
Całkowite stężenie składnika C (kwasu HA) w poszczególnych fazach wynosi:
cC(1) = ![]()
, cC(2) = [HA](2) + 2[(HA)2](2)
Składnikiem ulegającym podziałowi między fazę wodną i organiczną jest monomer, dla którego współczynnik podziału wynosi:
KC = ![]()
Z powyższych równań wynika zależność: ![]()
Znając stopień dysocjacji α można wartości KC i Kdim odczytać z wykresu ![]()
w funkcji c(1).
2. Cel ćwiczenia
Celem ćwiczenia było graficzne wyznaczenie współczynnika podziału kwasu benzoesowego między fazę wodną a ksylenową oraz stałej dimeryzacji tego kwasu na podstawie miareczkowania go roztworem NaOH w obydwu fazach.
3. Zadane parametry
substancja |
ilość |
inne |
woda destylowana |
3 |
d = 1[g/cm3] |
ksylen |
3
|
d = 0,86[g/cm3] |
kwas benzoesowy |
0,102[g] |
M = 122 [g/mol] Kdys. = 6,40 ·10-5
|
|
0,255[g] |
|
|
0,354[g] |
|
NaOH |
|
c = 0,1 [mol/dm3]
|
temperatura roztworu: 21ºC
4. Sposób wykonania ćwiczenia
Odważono, na wadze analitycznej, trzy naważki kwasu benzoesowego - wartości w punkcie 3. Przeniesiono je analitycznie do kolbek Erlenmayerek i do każdej dodano 25 cm3 ksylenu. Po rozpuszczeniu się próbek kwasu do każdej kolbki dodano po 35 cm3 wody destylowanej i wytrząsano przez 20 minut. Następnie roztwory przelano do rozdzielaczy, pozostawiono do rozdzielenia się faz (dolna faza - wodna, górna - ksylenowa) i spuszczono poszczególne fazy do osobnych naczyń. Pobrano po 2 cm3 z każdej fazy ksylenowej i po 5 cm3 z każdej fazy wodnej. Pobrane próbki miareczkowano 0,1 molowym roztworem NaOH. Wyniki miareczkowania przedstawiono w tabeli w punkcie 5.
5. Wyniki pomiarów
naważki kwasu [g] |
V(1) (faza wodna) [cm3] |
V(2) (faza ksylenowa) [cm3] |
n(1) (w 35cm3) [mol] |
n(2) (w 25 cm3) [mol] |
c(1) [mol/dm3] |
c(2) [mol/dm3] |
|
0,102 |
0,25 |
0,55 |
1,75·10-4 |
6,88·10-4 |
0,0050 |
0,0275 |
0,1069 |
0,255 |
0,40 |
1,40 |
2,80·10-4 |
17,50·10-4 |
0,0080 |
0,0700 |
0,0855 |
0,354 |
0,50 |
2,05 |
3,50·10-4 |
25,62·10-4 |
0,0100 |
0,1025 |
0,0769 |
c(1) (1- |
c(2) / c(1) |
c(2) / c(1)·(1- |
0,0045 |
5,5000 |
6,1584 |
0,0073 |
8,7500 |
9,5684 |
0,0092 |
10,2500 |
11,1035 |
Kdys. = ![]()
= 6,4 · 10-5 → c(1) ![]()
2 + Kdys.· ![]()
- Kdys. = 0;
![]()
= ![]()
6. Dyskusja wyników, wnioski
Współczynnik podziału i stałą dimeryzacji wyznaczono graficznie na załączonym wykresie. Wartość stałej dimeryzacji wynosi: 413,5, a współczynnik podziału kwasu benzoesowego między fazę wodną a ksylenową wynosi: 0,833. Współczynnik podziału jest, w przypadku układu badanego w ćwiczeniu, bliski jedności, więc efektywne usunięcie kwasu benzoesowego z roztworu wodnego do fazy ksylenowej wymagałoby kilkakrotnej ekstrakcji za pomocą kolejnych porcji czystego ksylenu.
2
Wyszukiwarka
Podobne podstrony:
1667 1961 ZarzadzenieNrR 52 2011
1667
1667
RozporzMI DzU2005-201-1667, obsługa magazynów
1667
I OSK 1667
1667
1667
ZZbigniew Hundert Strażnicy koronny i wojskowy w dobie Jana Sobieskiego (1667–1696) Kilka uwag o oso
więcej podobnych podstron