Pytania egzaminacyjne na Studium Doktoranckie ICHO 1990 - 2000
Rok 2000
Uwzględniając tylko krzesłowe konformacje pierścienia sześcioczłonowego narysować wszystkie możliwe formy dekaliny. Podać relacje stereochemiczne (konformery, diastereoizomery, enancjomery).
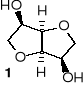
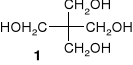
Proszę określić konfiguracją absolutną wszystkich centrów stereogenicznych
izomannitu (1,4:3,6-dianhydro-D-mannitolu, 1).
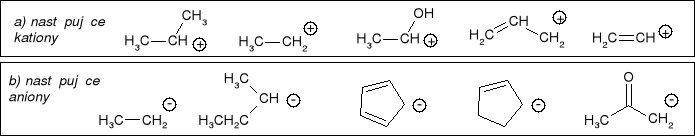
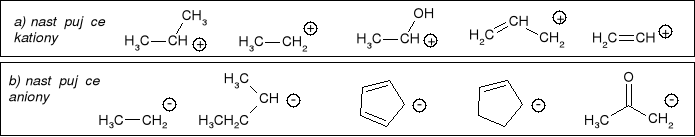
Uszeregować według wzrastającej stabilności:
Zaproponować najprostszą syntezę a. trans-cykloheksano-1,2-diolu oraz b. cis-cykloheksano-1,2-diolu wychodząc z cykloheksanu. Odpowiedź krótko uzasadnić.
W wyniku fotochemicznego chlorowania węglowodoru o wzorze sumarycznym C6H14 otrzymuje się mieszaninę tylko dwóch monochloropochodnych. Jedna z tych pochodnych ulega bardzo szybkiej solwolizie w metanolu, natomiast druga reaguje bardzo powoli. Podać wzór tego węglowodoru oraz napisać równania reakcji.
Wychodząc z benzenu otrzymać: a) 1,3,5-tribromobenzen, b) 1,3-bromochlorobenzen.
Wychodząc z naftalenu otrzymać: a) 1-naftyloaminę, b) 2-naftyloaminę
Naszkicować schematycznie widma 1H NMR uwzględniając przybliżone przesunięcia chemiczne oraz kształty i intensywności względne multipletów następujących związków:
CH3-CH2-O-CH3 (CH3)2CH-Cl CH3-O-CH2F trans-CH3CH=CH-CO2CH3
Proszę przypisać odpowiednie sygnały poszczególnym atomom wodoru.
Którą z par związków jest łatwiej rozdzielić bez użycia metod chromatograficznych i dlaczego:
a) I: orto-hydroksyacteofenon - meta-hydroksyacetofenon, czy też II: - meta-hydroksyacetofenon - para-hydroksyacetofenon
b) I: para-metoksytoluen - eter benzylowometylowy, czy też II: para-krezol - alkohol benzylowy
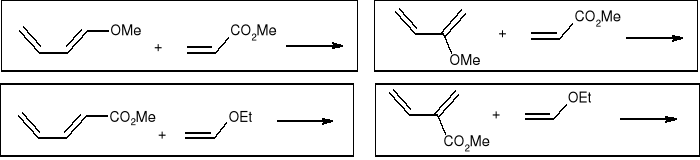
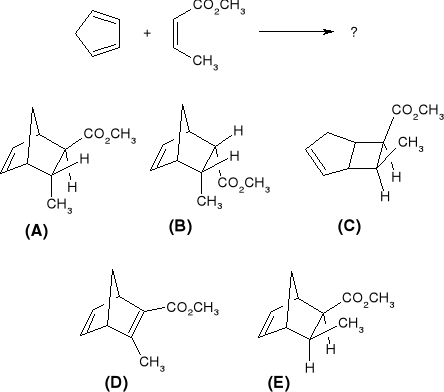
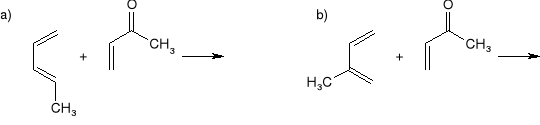
Jakich regioizomerów należy się spodziewać w następujących reakcjach cykloaddycji [4+2]:
Rok 1999
Narysować wszystkie możliwe stereoizomery 1,2-dimetylocykloheksanu w obu alternatywnych konformacjach krzesłowych. Zaznaczyć, które z nich są enancjomerami.
Ustalić wzór strukturalny związku X dysponując następującymi informacjami:
wzór sumaryczny C8H14O3;
intensywne pasma 1716 i 1740 cm-1 w widmie podczerwieni
widmo 1H NMR o następujących sygnałach (δ, ppm): 1,24 (triplet, J = 7,2 Hz, 3H), 1,34 (s, 6H), 2.14 (singlet, 3H), 4.17 (kwartet, J = 7,2 Hz, 2H).
3. Określić konfiguracje wszystkich centrów stereogenicznych w cząsteczce metylo α-D- glukopiranozydu
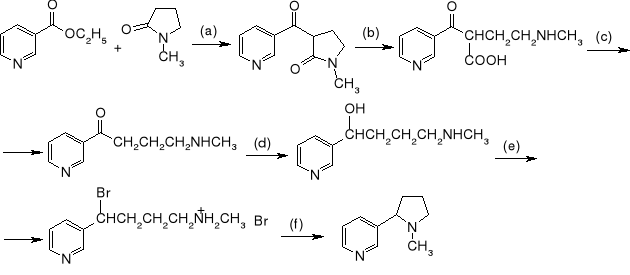
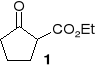
4. Jak z 2-etoksykarbonylocyklopentanonu (1) otrzymać:
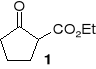
2-etoksykarbonylocyklopentanol2-hydroksymetylenocyklopentanon
2-hydroksymetylenocyklopentanol
5. Związek A powstały w reakcji aldehydu benzoesowego z Ph3P=CH2 poddano reakcji z cyklopentadienem otrzymując produkt B, który poddano działaniu wodoru na katalizatorze palladowym otrzymując produkt C. Podać struktury związków A, B i C, oraz mechanizmy procesów prowadzących do związków A i B.
6. Z chlorobenzenu i dowolnych odczynników nieorganicznych otrzymać 1-chloro-4- deutero-3-nitrobenzen
7. W reakcji styrenu z chloroformem w obecności tert-butanolanu potasu powstaje 1,1- dichloro-2-fenylocyklopropan. Napisać równanie z uwzględnieniem pośrednich produktów w tej reakcji. Czy reakcja taka może przebiegać w obecności wodorotlenku sodowego? Odpowiedź uzasadnić.
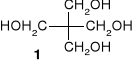
8. Końcowym produktem reakcji aldehydu octowego z nadmiarem aldehydu mrówkowego w środowisku zasadowym jest pentaerytrytol (1). Podać równania kolejnych etapów syntezy oraz ich mechanizmy
9. Porównać mechanizmy reakcji E1, E2 i E1cB. Podać po jednym przykładzie dla każdej z tych reakcji.
10. Narysować produkty addycji bromku metylomagnezowego (i następczej hydrolizy w warunkach kwaśnych) do: a. aldehydu octowego, b. acetonu, c. tlenku etylenu oraz d. acetonitrylu.
Rok 1998
Otrzymać 4-fluoro-3-nitrobenzofenon z toluenu i dowolnych odczynników nieorganicznych.
Otrzymać 2-metylocyklopentanon z cykloheksenu, wykorzystując dowolne odczynniki nieorganiczne oraz odczynniki organiczne, zawierające nie więcej niż dwa atomy węgla.
Podać proste sposoby przekształcenia chlorku benzylu w:
benzyloaminę,
2-fenyloetyloaminę,
3-fenylopropyloaminę.
Wyjaśnić dlaczego imidazol jest mocniejszym kwasem niż pirol i mocniejszą zasadą niż pirydyna.
Acetylooctan etylu i acetyloaceton występują w równowagach tautomerycznych. Zapisać te równowagi oraz wskazać, dla którego ze związków równowaga przesunięta jest bardziej na korzyść enolu i dlaczego.
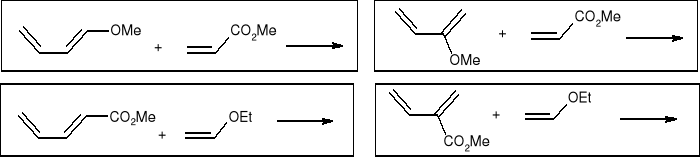
Podać struktury związków pośrednich w przemianie:
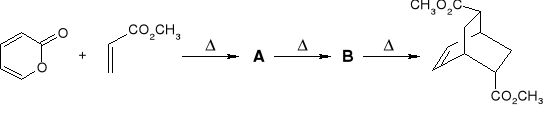
Uwaga: akrylan metylu użyty był w nadmiarze.
Na acetofenon podziałano fosforowym ylidem metylenowym. Podać strukturę powstałego produktu oraz mechanizm tej reakcji.
Narysować wszystkie możliwe izomery i konformery 1,2-dimetylo- oraz 1,3-dimetylocykloheksanu. Które z form pozostają w relacji enancjomerycznej, a które są tożsame? Uwaga: uwzględnić tylko krzesłową konformację pierścienia cykloheksanowego.
Naszkicować widma 1H NMR, uwzględniając przybliżone przesunięcia chemiczne i kształty multipletów, dla poniższych związków:
PhCHClCH3
PhCH2CHCl2
PhCH2CHO
10. Narysować w konfiguracji (R) i (S) alaninę i aldehyd glicerynowy.
Rok 1997
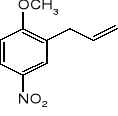
Z fenolu, metanolu, bromku allilu i dowolnych reagentów nieorganicznych, otrzymać:
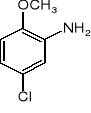
Wychodząc z p-chloroaniliny otrzymać:
Wyjaśnić dlaczego imidazol jest mocniejszą zasadą od pirydyny i mocniejszym kwasem od pirolu.
Podać możliwe sposoby redukcji propiofenonu do n-propylobenzenu.
Używając reakcji Wittiga otrzymać następujące olefiny:
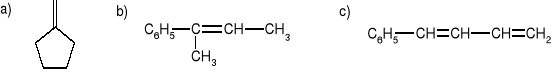
Podać możliwe produkty poniższych reakcji:
Podać możliwe produkty poniższych reakcji:
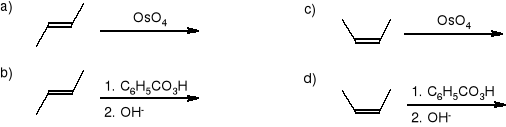
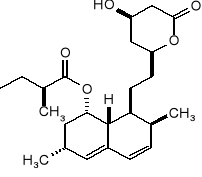
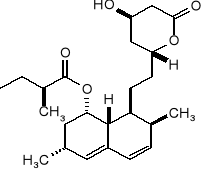
Wyznaczyć konfigurację absolutną wszystkich centrów stereogenicznych mewinoliny:
Uwzględniając tylko konformacje krzesłowe pierścienia sześcioczłonowego, narysować wszystkie możliwe izomery konfiguracyjne i konformacyjne 1,2-dimetylocykloheksanu. Podać relacje stereochemiczne typu dia i enancjo pomiędzy tymi formami.
10. Naszkicować widma 1H NMR poniższych związków:

Rok 1996
Z toluenu i dowolnych odczynników nieorganicznych otrzymać 3-fluoro-4-deuterotoluen.
Z naftalenu, toluenu i dowolnych odczynników nieorganicznych otrzymać 2-metyloantrachinon
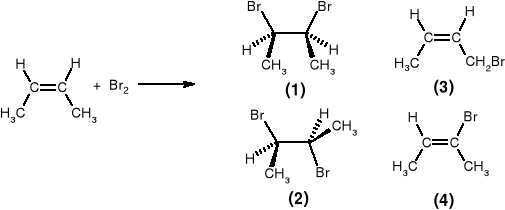
Spośród podanych niżej struktur wskazać główny produkt powstający w wyniku bromowania cis-2-butenu, prowadzonego bez dostępu światła. Zaproponować mechanizm tej reakcji.
Podać produkt poniższej sekwencji reakcji. Zaproponować mechanizm tworzenia produktu końcowego.
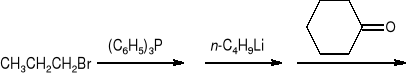
Który z podanych związków jest głównym produktem poniższej reakcji?
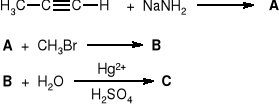
Podać struktury związków A B i C powstających w poniższej sekwencji reakcji:
W jaki sposób przeprowadzić przekształcenie związku A w związek B?
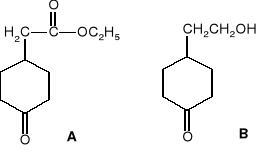
Narysować wszystkie konformacje krzesłowe cis- i trans-3-etylo-1-izopropylocykloheksanu. Która z nich jest najstabilniejsza dla związku cis, a która dla związku trans?
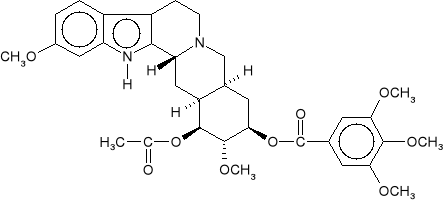
Wyznaczyć konfiguracje absolutne dla centrów chiralności rezerpiny.
Narysować schematycznie widmo 1H NMR p-chloroetylobenzenu i zdefiniować występujące w nim układy spinowe.
Rok 1995
Z benzenu, toluenu i dowolnych odczynników nieorganicznych, otrzymać:
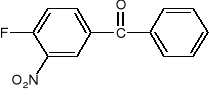
Z p-krezolu, propylenu, metanolu i dowolnych odczynników nieorganicznych, otrzymać:
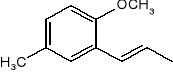
Podać produkty powstające w poniższych reakcjach:
Wychodząc z acetylooctanu etylu, zaproponować sposób otrzymywania:
kwasu -hydroksymasłowego,
4-hydroksybutan-2-onu.
Podać główne produkty powstające w reakcji 2-metylocyklopentadienu z akrylanem metylu. Jakiego katalizatora można użyć do przyspieszenia tej reakcji?
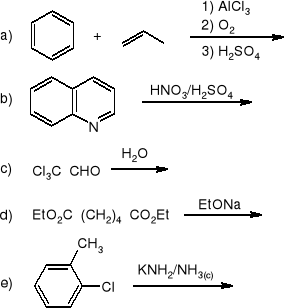
Wyjaśnić dlaczego w alkalicznym roztworze bromku trimetylosulfoniowego w ciężkiej wodzie (D2O) następuje szybka wymiana atomów wodoru na atomy deuteru. Czy przedstawiona niżej sól sulfoniowa będzie również ulegała podobnej reakcji? Odpowiedź uzasadnić.
Jakie produkty reakcji powstaną, kiedy na poniższe związki podziała się bromkiem etylomagnezowym w roztworze bezwodnego eteru, a następnie rozcieńczonym kwasem solnym?
![]()
Zakładając, że t-Bu >> Et > Me > Cl, narysować najstabilniejsze konformery dla:
trans-1,2-dimetylocykloheksanu,
cis-1-t-butylo-4-chlorocykloheksanu,
trans-1-metylo-3-etylocykloheksanu,
cis-1-chloro-2-metylocykloheksanu.
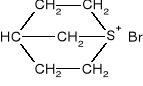
Znaleźć wszystkie centra chiralności w linkomycynie i określić ich konfiguracje absolutne.
Podać multipletowość widm 13C NMR, wykonanych bez odsprzęgania protonów, dla:
CH3Cl,
CH2Cl2,
CHCl3,
CDCl3.
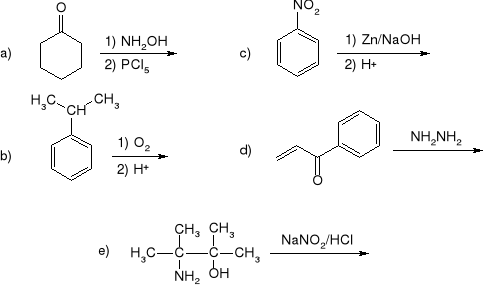
Rok 1994
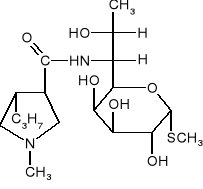
Z toluenu i dowolnych odczynników nieorganicznych otrzymać 2-fluoro-5-nitrotoluen.
Podczas reakcji orto-bromoanizolu z amidkiem potasu w ciekłym amoniaku tworzy się mieszanina orto- i meta-anizydyny. Jaka jest przyczyna takiego przebiegu reakcji? Czy takiej reakcji będzie ulegał meta-bromoanizol? Odpowiedź uzasadnić.
Z tetrahydrofuranu i etanolu oraz dowolnych odczynników nieorganicznych otrzymać 2-etylocyklopentanon.
Wychodząc z acetylooctanu etylu, zaproponować sposób otrzymywania:
kwasu -hydroksymasłowego,
4-hydroksybutan-2-onu.
Dlaczego do celów spektroskopii NMR używamy rozpuszczalników deuterowanych?
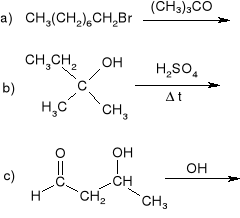
Napisać produkty eliminacji i podać, czy dana reakcja przebiega według mechanizmu E1, E2 czy E1cB:
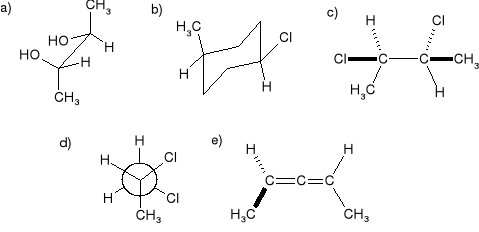
Które z poniższych struktur są chiralne?
Podać produkty następujących reakcji:
Podać produkty poniższych reakcji. Podać mechanizm dla reakcji a).
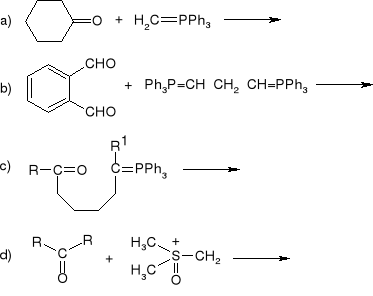
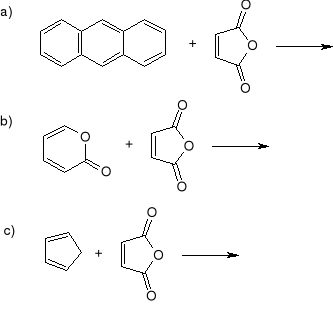
Z jakich substratów w wyniku reakcji Dielsa-Aldera powstają poniższe produkty?
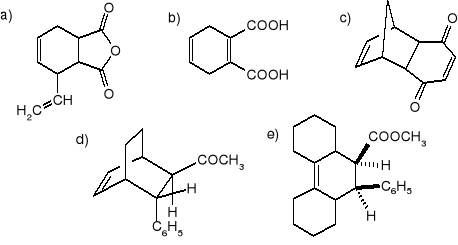
Rok 1993
W jaki sposób z p-fluoroaniliny otrzymać m-fluoroanilinę?
Jaki produkt powstaje podczas nitrowania naftalenu mieszaniną nitrującą? Wyjaśnić kierunek tej reakcji. Jakich produktów należy oczekiwać podczas nitrowania chinoliny w podobnych warunkach?
Jakich produktów należy oczekiwać w przypadku przyłączenia cząsteczki bromu do maleinianu dimetylu i do fumaranu dimetylu? Produkty te przedstawić wzorami przestrzennymi.
jakie główne produkty powstaną w poniższych reakcjach i według jakich mechanizmów reakcje te przebiegają?
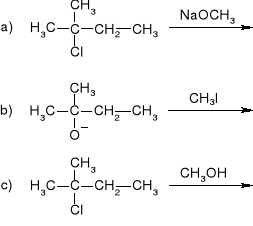
Podać, używając wzorów przestrzennych, wszystkie możliwe produkty reakcji cyklopentadienu z akrylonitrylem oraz 1-metoksybuta-1,3-dienu z akrylonitrylem. (Rysując wzory izomerów należy uwzględnić tylko jeden z enancjomerów.)
W jaki sposób otrzymać kwas cykloheksylooctowy z cykloheksanonu i kwasu chlorooctowego?
Wychodząc z acetylooctanu etylu, zaproponować sposób otrzymywania:
kwasu -hydroksymasłowego,
4-hydroksybutan-2-onu.
Podać produkty dla każdej z poniższych reakcji:
Określić konfigurację absolutną (R,S) wszystkich centrów chiralności w mewinolinie:
Naszkicować widma 1H NMR:
1-chloro-1-metoksyetylenu,
E-1-chloro-2-metoksyetylenu,
Z-1-chloro-2-metoksyetylenu.
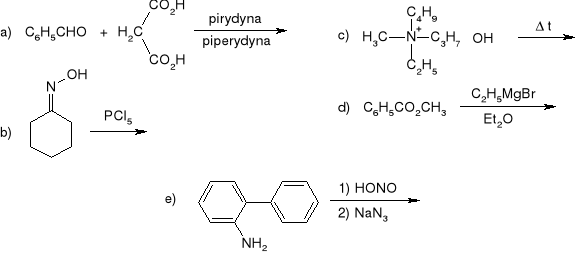
Rok 1992
Zaproponować syntezę kwasu 4-cyjanofenoksyoctowego z fenolu.
Jak otrzymać, wychodząc z nitrobenzenu i toluenu, związek o wzorze:
Wyjaśnić dlaczego imidazol jest mocniejszym kwasem niż pirol i mocniejszą zasadą niż pirydyna.
Napisać równania i określić produkty reakcji 1-metylocykloheksenu z:
wodnym roztworem kwasu siarkowego,
z borowodorem, po której reakcji produkt traktuje się nadtlenkiem wodoru.
Napisać wzory wszystkich możliwych cykloadduktów (1:1), powstających z izoprenu i tetrafluoroetylenu. Który z nich jest głównym produktem reakcji?
Podać struktury możliwych produktów następujących reakcji:
CH3COCH2C6H5 + (CH3)3CMgX →
C6H5COC6H5 + CH3CH2MgX →
C6H5CH=CHCO2C2H5 + C6H5MgX →
Jakiego produktu należy oczekiwać w reakcji bromoformu z tert-butanolanem potasu w tetrahydrofuranie, prowadzonej w obecności:
trans-2-butenu,
cis-2-butenu,
aldehydu benzoesowego?
W jakich warunkach, działając na benzen chlorem, otrzymuje się 1,2,3,4,5,6-heksachlorocykloheksan. Napisać wzory wszystkich możliwych diasteroizomerów produktu i wskazać, które z nich są związkami mezo, a które są racematami.
Narysować w konfiguracji (R) i (S) kwas mlekowy i fenyloalaninę.
Naszkicować schematycznie widma 1H NMR:
bromku etylu,
bromku izopropylu,
bromku allilu.
Rok 1991
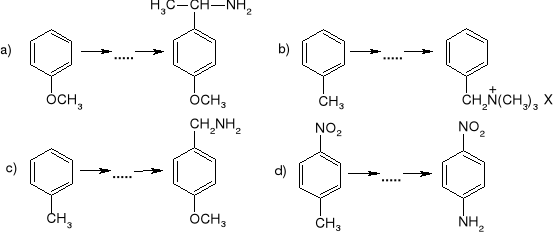
Przeprowadzić poniższe transformacje, wybierając dla każdego z przypadków najlepszą metodę:
Anetol jest głównym składnikiem olejku anyżowego.
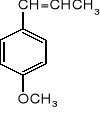
Zaproponować prostą syntezę anetolu, wychodząc z anizolu.
Związek X o wzorze C10H14O rozpuszcza się w wodnym roztworze NaOH lecz jest nierozpuszczalny w wodnym roztworze NaHCO3. Związek X reaguje z woda bromową dając pochodną dibromową C10H12Br2O. Region 3000 - 4000 cm-1 widma w podczerwieni wykazuje szerokie pasm o środku przy 3250 cm-1, natomiast region 680 - 840 cm-1 wykazuje pik przy 830 cm-1. Widmo 1H NMR związku X zawiera następujące sygnały (δ, ppm): 1,3 (singlet, 9H), 4,9 (singlet, 1H), 7,0 (sym. multiplet, 4H). Jaka jest struktura związku X?
Podać reagenty, jakich należy użyć w zaproponowanej syntezie racemicznej nikotyny:
Podać struktury produktów, jakich należy się spodziewać w reakcjach 1-pentynu z:
Br2 (1 mol),
HBr (1 mol) w obecności nadtlenków,
NaNH2 w ciekłym amoniaku, a następnie CH3I,
CuCl, NH3, O2, CH3OH.
Mając do dyspozycji trifenylofosfinę oraz dowolny aldehyd, keton i halogenek alkilowy, otrzymać poniższe alkeny:
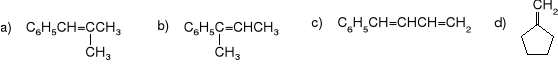
Podać mechanizm używanej reakcji.
Gdy wprowadzi się keton diizopropylowy (0,1 mola) do eterowego roztworu bromku etylomagnezowego (1 mol), powstaje produkt reakcji przyłączenia z wydajnością 90% w przeliczeniu na użytą ilość ketonu. Natomiast w reakcji prowadzonej w roztworze zawierającym 0,1 mola bromku etylomagnezowego na 1 mol ketonu diizopropylowego powstaje 35% produktu reakcji redukcji oraz 15% produktu reakcji enolizacji w przeliczeniu na użytą ilość odczynnika Grignarda, a tylko 50% produktu reakcji przyłączenia. Czy taki sposób reagowania odpowiada bardziej odczynnikowi Grignarda o budowie R2Mg2⋅MgX2, czy też o budowie RMgX? Odpowiedź uzasadnić.
Reakcja akrylanu metylu z 2-metylofuranem prowadzi do mieszaniny izomerycznych (4+2) cykloadduktów. Narysować wzory wszystkich możliwych izomerów produktu.
W jednym z katalogów można znaleźć informację, że oferowana D-mannoza jest prawoskrętna ([]D +29,3), natomiast w innym katalogu oferuje się lewoskrętną D-mannozę ([]D -17,0). Obie informacje są prawdziwe. Jakie jest wyjaśnienie tego faktu?
Określić relacje pomiędzy poniższymi parami struktur. Czy są to enancjomery, diastereoizomery, izomery konstytucyjne (strukturalne), czy też dwie cząsteczki tego samego związku?
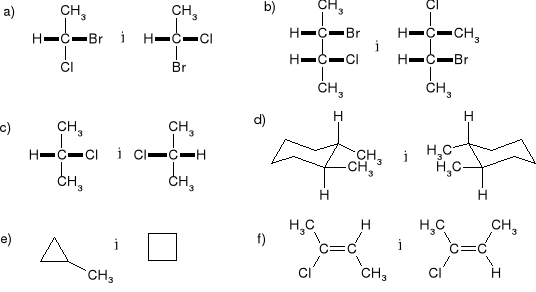
Rok 1990
Wychodząc z chlorobenzenu zaproponować syntezę 3,5-dinitrochlorobenzenu.
Wychodząc z fenolu zaproponować syntezę kwasu 4-cyjanofenoksyoctowego.
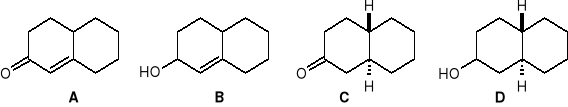
Podać warunki, w jakich z ,-nienasyconego ketonu A można otrzymać poniższe związki B, C i D.
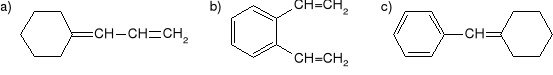
Mając do dyspozycji, obok trifenylofosfiny, dowolny potrzebny aldehyd lub keton i halogenek organiczny, otrzymać poniższe alkeny:
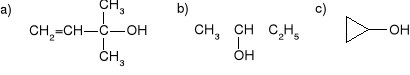
Podać w jaki sposób można otrzymać poniższe związki w reakcji przebiegającej przy użyciu odczynnika Grignarda:
Podać wszystkie możliwe regioizomery i/lub diastereoizomery powstające w poniższych rekcjach termicznych:
Narysować w konfiguracji R i S alaninę i aldehyd glicerynowy.
Naszkicować schematycznie widma 1H NMR 1,3-dichloropropanu i 1-bromo-3-chloropropanu, wykonane przy dostatecznie silnym polu magnetycznym.

Wyszukiwarka
Podobne podstrony:
pytania egzaminacyjne na egzaminatora prawa jazdy, znakiM, 1
pytania egzaminacyjne na egzaminatora prawa jazdy, Egzamin - Czestochowa 2006, 1
pytania egzaminacyjne na egzaminatora prawa jazdy, TECHNIKA KIEROWANIA I OBSUGA POJAZDU C, TECHNIKA
pytania egzaminacyjne na egzaminatora prawa jazdy, 5, 1
pytania egzaminacyjne na egzaminatora prawa jazdy, ODPOWIEDZI- obsuga D, ODPOWIEDZI - TECHNIKA KIERO
pytania egzaminacyjne na egzaminatora prawa jazdy, ODPOWIEDZI KATEGORIA B, ODPOWIEDZI KATEGORIA &b
pytania egzaminacyjne na egzaminatora prawa jazdy, Pytania
pytania egzaminacyjne na egzaminatora prawa jazdy, ODPOWIEDZI- obsuga C, ODPOWIEDZI - TECHNIKA KIERO
pytania egzaminacyjne na egzaminatora prawa jazdy, ODPOWIEDZI- obsuga C, ODPOWIEDZI - TECHNIKA KIERO
pytania z egzaminu na uprawnienia 25 wrzesień 2009 r, geodezja, inne
pytania egzaminacyjne na egzaminatora prawa jazdy, KATEGORIA A - egzamin Konin, KATEGORIA „
pytania egzaminacyjne na egzaminatora prawa jazdy, ODPOWIEDZI-obsuga A, ODPOWIEDZI - TECHNIKA KIE
pytania egzaminacyjne na egzaminatora prawa jazdy, ODPOWIEDZI KATEGORIA A, ODPOWIEDZI KATEGORIA &
pytania egzaminacyjne na egzami Nieznany
Pytania egzaminacyjne na Tajchmana, Teoria Konserwacji Zabytków Architektury
Pytania z egzaminu na kurs koparki
na kolokwium z Konwersji E = nergii Prowadz±cy, Pytania egzaminacyjne na kolokwium z Konwersji E
pytania egzaminacyjne na egzaminatora prawa jazdy, ODPOWIEDZI-obsuga B, ODPOWIEDZI - TECHNIKA KIEROW
pytania egzaminacyjne na egzaminatora prawa jazdy regulamin
więcej podobnych podstron