Prawo dziania mas Gutenberga - Waagego
W stanie równowagi chemicznej stosunek iloczynu stężeń molowych produktów reakcji do iloczynów stężeń molowych substratów jest w danej temp. dla danej reakcji wielkością stałą zwaną stałą równowagi. Jeżeli udział w reakcji biorą liczby cząsteczek poszczególnych substancji dane stężeń podnosimy do potęg równych liczbom odpowiednich cząstek w równowadze chemicznej.
A + B ⇔ C + D | mA + nB ⇔ pC + rD
W miarę przebiegu reakcji stężenia A i B maleją a stężenia produktów rosną. W skutek tego i szybkość reakcji w kierunku od lewej strony do prawej maleje natomiast szybkość reakcji odwrotnej wzrasta. Po pewnym czasie obie szybkości się zrównuje taki układ substancji reagujących w których szybkość reakcji lewo i prawostronnych są sobie równe nazywamy STANEM RÓWNOWAGI.
Prawo to odnosi się do reakcji odwracalnych np. dysocjacji jonowej soli, kwasów, zasad.
Kompleksy proste - powstające w wyniku jonu centralnego z ligadami jednofunkcyjnymi tzw. prostymi. Ligady te zawierają tylko jeden atom ligadowy (bezpośrednio wiążący się z atomem )
Kompleksy chelatowe - kompleksy w których metal wchodzi w skład pierścienia (ligady wielofunkcyjne, łączą się z metalami w kompleksy tworząc pierścienie)
Chelaty wewnętrzne - kompleksy obojętne dodatnie ładunki jonów metali kompensowane są ładunkiem ujemnym ligadów (ligadami są tutaj organiczne odczynniki dwufunkcyjne)
Chelaty jonowe - tzw. asocjaty jonowe; kompleksy chelatowe proste obdarzone ładunkiem, mogą łączyć się z jonami o przeciwnym znaku. Związki te są trudno rozpuszczalne w wodzie natomiast dobrze w rozpuszczalnikach niepolarnych np. chloroform lub benzyna.
Właściwości fizykochemiczne chelatów wewnętrznych - powstaje on gdy ligad organiczny zawiera w odpowiednim położeniu grupę kwasową której wodór może zastąpić metalem i tzw. grupą koordynacyjną, która wiąże metale koordynacyjne. Grupy kwasowe: karboksylowa COOH, hydroksylowa OH, oksymowa NOH. Grupy koordynacyjne to: karbonylowa CO, tionowa CS, nitrozowa NO.
nierozpuszczalne w wodzie tylko w niepolarnych rozpuszczalnikach organicznych CHCl3
wykazują silne zabarwienie
trwałość chemiczna
dość lotne
niskie temp. wrzenia
Ekstrakcja - proces przeprowadzania substancji rozpuszczonej w jednej fazie ciekłej do drugiej fazy ciekłej nie mieszającej się z pierwszą. Jedną fazą jest zwykle roztwór wodny, a drugą rozpuszczalnik organiczny nie mieszający się z wodą. Osiągnięcie stanu równowagi między fazami uzyskuje się dzięki wytrząsaniu mechanicznemu lub ręcznemu.
Prawo podziału - substancja rozpuszczona dzieli się między dwa nie mieszające się rozpuszczalniki tak, że w stanie równowagi stosunek substancji rozpuszczonej w tych dwóch rozpuszczalnikach jest stały w danej temperaturze i nie zależy od ogólnego stężenia substancji.
|
Co i Cw oznaczają stężenia danego składnika w rozpuszczalniku organicznym i w roztworze wodnym. |
Prawo podziału jest słuszne a stała podziału P ma wartość niezmienna tylko wtedy gdy rozpuszczona substancja znajduje się w obydwu fazach w tej samej postaci. W rzeczywistości substancja poddana podziałowi w procesie ekstrakcji może ulegać różnym reakcjom chemicznym np. dysocjacja.
Współczynnik podziału D - stosunek sumy stężeń wszystkich form substancji w fazie organicznej do sumy stężeń wszystkich form substancji w fazie wodnej.
![]()
Reguła faz Gibbsa - liczba faz (f) plus liczba stopni swobody (s) równa się liczbie składników (n) plus (z) f + s = n + z
W ekstrakcji typu ciecz - ciecz są dwie fazy ciekłe i jeden składnik (substancja ekstrahowana) A więc w stałej temp. i w stałym ciśnieniu reguła faz przewiduje jeden stopień swobody.
Chloroform, trójchlorometan (CHCl3), ciężka, bezbarwna ciecz, temperatura wrzenia 61°C, o
charakterystycznym zapachu, dobrze rozpuszczalna w alkoholu i eterze. Chloroform ma działanie narkotyczne, jest toksyczny (utleniając się wydziela fosgen). Otrzymuje się go w przemyśle działaniem podchlorynu wapniowego na alkohol etylowy lub aceton.
Stosowany jest jako rozpuszczalnik (rozpuszcza m.in. kauczuk, żywice, siarkę).
odzież ochronna
gumowe rękawice
praca pod włączonym wyciągiem
8 - hydroksyhinolina - odczynnik chelatujący dwufunkcyjny ligad (2 atomy ligadowe) a jednocześnie jednoprotonowe kwasy nie zawierające ugrupowań hydrofilowych. C9H7ON
Jon równowagi - zostaje on osiągnięty gdy pomiędzy roztworem a nadmiarem substancji rozpuszczonej w jednostce czasu będą wymienione jednakowe ilości cząstek.
Zależność ekstrakcji %E od pH zależy od wartości n.
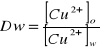
Wyszukiwarka
Podobne podstrony:
4095
4095
4095
4095
4095
4095
4
więcej podobnych podstron