Tomasz Warzocha
III rok Chemii Inf.
36. Zastosowanie pomiaru siły elektromotorycznej ogniw
galwanicznych do wyznaczania wielkości fizykochemicznych.
Cel ćwiczenia:
Celem ćwiczenia jest doświadczalne wyznaczenie iloczynu rozpuszczalności trudno rozpuszczalnych soli o wzorze ogólnym AgX oraz wyznaczenie standardowego potencjału półogniwa Ag/Ag+ i współczynnika aktywności jonów srebrowych przez pomiar SEM.
a) Wyznaczanie iloczynu rozpuszczalności
Sporządzam ogniwo o schemacie (-) Ag/AgX//AgNO3/Ag (+) gdzie X to odpowiednio jony: Cl-,Br-,I-,OH-,SCN-,Cr2O72-. Na początku naczyńko pomiarowe napełniamy 9 cm3 0,1M AgNO3. W drugim odmierzamy 3 cm3 0,1M AgNO3 oraz kolejno 6 cm3 KCl, KCl, KI, KSCN, KOH i K2Cr2O7. Do obu naczynek wkładamy elektrody srebrowe łączymy je kluczem elektrolitycznym. Wartości SEM kolejnych ogniw odczytujemy na woltomierzu cyfrowym.
W celu wyznaczenia iloczynu rozpuszczalności korzystamy z zależności:
Ir = [Ag+][X-]
Stężenie jonów [X-] we wszystkich roztworach jest takie same i wynosi: mola/dm3.
Pozostaje więc do obliczenia stężenie jonów Ag+ w lewym półogniwie, w tym celu korzystamy
z wyrażenia na SEM zbudowanego ogniwa:
gdzie: c1 - stężenie jonów Ag+ w lewym półogniwie
c2 - stężenie jonów w prawym półogniwie (0,1 mol/dm3)
n - liczba elektronów biorących udział w reakcji
F - stała Faradaya (96500 C)
T - temperatura [K]
Obliczenia dla temperatury pomiaru 293K:
1. SEM = 0,41 [V] (KCl + AgNO3)
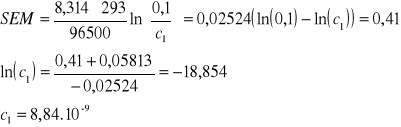
IrAgCl= 8,84. 10-9 . 0,033333 = 2,95 . 10-10
W analogiczny sposób wyliczam pozostałe iloczyny rozpuszczalności.
2. SEM = 0,59 [V] (KBr + AgNO3)
c1 = 7,07 . 10-12
IrAgB r= 2,36 . 10-13
3. SEM=0,78 [V] (KI + AgNO3)
c1 = 3,81 . 10-15
IrAgI = 1,27 . 10-16
4. SEM = 0,36 [V] (KOH + AgNO3)
c1 = 6,41 . 10-8
IrAgOH = 2,14. 10-9
5. SEM = 0,53 [V] (KSCN + AgNO3)
c1 = 7,62. 10-11
IrAgSCN = 1,27. 10-12
6. SEM = 0,09 [V] (K2Cr2O7 + AgNO3)
c1 = 2,83. 10-3
IrAg2Cr2O7 = 2,67 . 10-7
Schemat ogniwa |
SEM [V] |
c1 = [Ag+] |
IrAgX |
Irz (z tablic) |
(-) Ag/AgCl//AgNO3/Ag (+) |
0,41 |
8,84. 10-9 |
2,95 . 10-10 |
1,78 . 10-10 |
(-) Ag/AgBr//AgNO3/Ag (+) |
0,59 |
7,07 . 10-12 |
2,36 . 10-13 |
5,25 . 10-13 |
(-) Ag/AgI//AgNO3/Ag (+) |
0,78 |
3,81 . 10-15 |
1,27 . 10-16 |
8,31 . 10-17 |
(-) Ag/AgOH//AgNO3/Ag (+) |
0,36 |
6,41 . 10-8 |
2,14. 10-9 |
. 10-9 |
(-) Ag/AgSCN//AgNO3/Ag (+) |
0,53 |
7,62 . 10-11 |
1,27 . 10-12 |
10-12 |
(-) Ag/Ag2Cr2O7//AgNO3/Ag (+) |
0,09 |
2,83 . 10-3 |
2,67 . 10-7 |
2 . 10-7 |
c |
SEM |
E |
pierw |
0,1 |
0,49 |
0,548117 |
0,316228 |
0,05 |
0,47 |
0,545612 |
0,223607 |
0,01 |
0,44 |
0,556234 |
0,1 |
0,005 |
0,41 |
0,54373 |
0,070711 |
0,002 |
0,4 |
0,556857 |
0,044721 |
0,001 |
0,38 |
0,554352 |
0,031623 |
Wyszukiwarka
Podobne podstrony:
ch.fiz.12, Chemia fizyczna
chem fiz, Studia, Chemia, fizyczna, examin
36 chemia fizyczna
fiz 40b, Chemia fizyczna
Chemia fiz - ćw. 1-2, Chemia Fizyczna
ch fiz 37, Chemia fizyczna
chem.fiz.równowagi fazowe, Inżynieria środowiska, inż, Semestr III, Chemia fizyczna, laboratorium
15 wyznaczanie ciepła spalania, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, Chem
Egzamin - chemia fizyczna (2), Egzamin chem.fiz
chemia fizyczna laboratoria, iwona chem. fiz. ćw. 91
lab chem fiz 23, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, CHEMIA FIZYCZNA
Chemia fizyczna cd (2), Egzamin chem.fiz
chem.fiz.stała dysocjacji, Inżynieria środowiska, inż, Semestr III, Chemia fizyczna, laboratorium
więcej podobnych podstron