Laboratorium 10 W Ę G L O W O D A N Y W O R G A N I Z M I E C Z Ł O W I E K A
Ćwiczenie 1: Krzywa tolerancji glukozy
Podstawowym węglowodanem stanowiącym materiał energetyczny w organizmie człowieka jest glukoza. Utrzymywanie stałego stężenia glukozy we krwi jest kluczowe dla prawidłowego funkcjonowania i znajduje się pod kontrolą hormonalną. Podstawowym badaniem czynnościowym pozwalającym na ocenę przemiany węglowodanowej jest test tolerancji glukozy - GTT. Test tolerancji po obciążeniu doustnym polega na podaniu badanemu (na czczo) 75 g glukozy w ok. 300 ml wody, a następnie pomiarze stężenia glukozy we krwi w odpowiednich odstępach czasu (na czczo, po 1 h od podania glukozy, po 2 h od podania glukozy), w celu oceny szybkości normalizacji stężenia cukru we krwi. U ludzi zdrowych, stężenie glukozy na czczo nie powinno przekraczać 100 mg/dL, po podaniu glukozy zwiększa się osiągając wartości maksymalne po ok. 1 h (do ok. 160 mg/dL), aby po 2 h powrócić do wartości prawidłowych (do ok. 110 mg/mL). Nieprawidłowy wynik testu GTT moźe mieć charakter zmniejszonej tolerancji glukozy (wyższy przyrost stężenia, powolniejszy powrót do wartości prawidłowych) lub zwiększonej tolerancji (płaska krzywa glikemii po obciążeniu). Zmniejszona tolerancja glukozy w różnym stopniu występuje głównie w cukrzycy.
Celem ćwiczenia jest oznaczenie stężenia glukozy w surowicy krwi pobranej od dwóch pacjentów (A i B) w czasie 0, 1 h i 2 h w przebiegu wykonania testu GTT. Oznaczenie stężenia glukozy w każdej próbie będzie przeprowadzone metodą enzymatyczną:
oksydaza glukozowa
glukoza + O2 + H2O → kwas glukonowy + H2O2
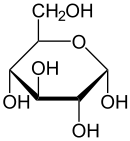
peroksydaza
H2O2 + barwnik zredukowany → 2 H2O + barwnik utleniony
Wykonanie:
Przygotuj 6 krótkich szklanych probówek i do każdej dodaj po 1 ml odczynnika roboczego (zawierającego enzymy i barwnik w roztworze buforowym). Do każdej probówki dodaj po 10 μl odpowiedniej surowicy krwi (dla pacjenta A: surowice A0, A1 i A2, dla pacjenta B: surowice B0, B1, B2). Wszystkie próby inkubuj w temp. pokojowej przez 10 min. Po tym czasie zmierz absorbancję wszystkich prób względem odczynnika roboczego jako próby ślepej przy długości fali 500 nm.
Oblicz stężenie glukozy w każdej próbie korzystając ze wzoru:
stężenie glukozy [mg/dL] = Apróby/Awzorca × stężenie wzorca
gdzie stężenie wzorca wynosi: 100 mg/dL, a absorbancja próby wzorcowej A = 0,280
Narysuj na papierze milimetrowym wykresy przedstawiające krzywe tolerancji glukozy (wykres zależności stężenia glukozy od czasu) dla każdego z pacjentów. Przedstaw wnioski dotyczące przemiany węglowodanowej obu pacjentów.
Ćwiczenie 2: Oznaczanie stężenia kwasów sialowych w surowicy krwi metodą Winzlera
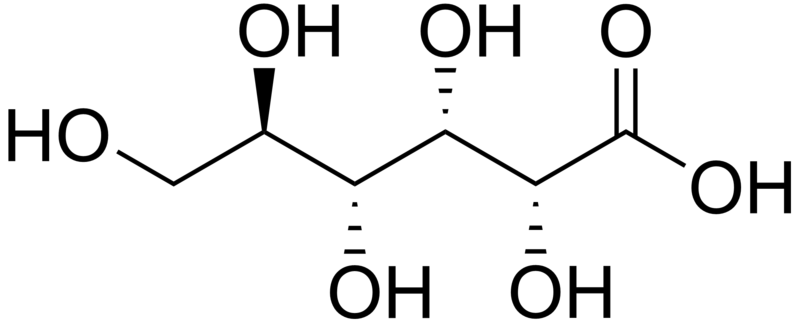
Kwasy sialowe to N- lub O-acylowe pochodne kwasu neuraminowego, który jest 9-węglowym cukrem o strukturze mannozoaminy połączonej z pirogronianem. Podstawowym kwasem sialowym jest kwas N-acetyloneuraminowy (NeuAc) o wzorze sumarycznym C11H19O9N. Kwasy sialowe są składnikami glikoprotein oraz gangliozydów. Pełnią ważną funkcję w przekazywaniu sygnałów między komórkami i występują w substancji szarej mózgu. Ich obecność w mucynach nadaje śluzom odpowiednią lepkość oraz właściwości smaru i ochronne. Kwasy sialowe są syntetyzowane przez komórki w czasie infekcji wirusowej. Błony komórek nowotworowych zawierają więcej kwasu sialowego niż błony komórek prawidłowych.
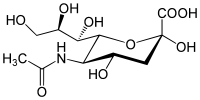
kwas N-acetyloneuraminowy
Zasada oznaczenia kwasów sialowych metodą Winzlera:
W budowie kwasu sialowego występuje obok grupy karboksylowej kwasu pirogronowego, ugrupowanie dezoksyaminoheksozy. Dezoksycukry w środowisku silnie kwaśnym reagują z difenyloaminą (patrz próba Dishego na wykrycie DNA). W surowicy krwi reakcja ta w niewielkim stopniu zależy od dezoksycukrów, a głównie od obecności kwasów sialowych w gliko- i mukoproteinach.
difenyloamina
Wykonanie:
Przygotuj dwie długie szklane probówki. Do jednej odmierz 100 μL surowicy, do drugiej 100 μL wody destylowanej (próba ślepa). Do obu probówek dodaj po 4900 μL 5% roztworu TCA, wymieszaj dokładnie i ogrzewaj we wrzącej łaźni wodnej przez 15 min. (następuje odszczepienie kwasów sialowych od cząsteczek białek). Następnie po oziębieniu probówek, przelej ich zawartość do probówek wirówkowych i po zrównoważeniu odwiruj (3000 obrotów / min. przez 5 min.). Po odwirowaniu z każdej probówki pobierz do nowych szklanych probówek po 2 mL supernatantu i dodaj po 4 mL 1% roztworu difenyloaminy w mieszaninie lodowatego kwasu octowego i stężonego kwasu siarkowego (VI). Po wymieszaniu obie próby ogrzewaj we wrzącej łaźni wodnej przez 30 min. Po oziębieniu zmierz absorbancję próby właściwej względem próby ślepej przy długości fali 530 nm.
Oblicz zawartość kwasów sialowych wg wzoru:
stężenie kwasów sialowych [μg/mL] = Apróby/Awzorca × 80
gdzie Awzorca = 0,140 (dla wzorcowego roztworu kwasu sialowego o stężeniu 200 μg/mL)
Wyszukiwarka
Podobne podstrony:
krzywa cukrowa u kotów
Program zajęć ED, aaa, studia 22.10.2014, Materiały od Piotra cukrownika, materialy Kamil, Szkoła, L
EDi4 2-lista 2004, aaa, studia 22.10.2014, Materiały od Piotra cukrownika, materialy Kamil, Szkoła,
EDi4 2-lista 2003, aaa, studia 22.10.2014, Materiały od Piotra cukrownika, materialy Kamil, Szkoła,
Test 2003 odpowiedzi, aaa, studia 22.10.2014, Materiały od Piotra cukrownika, materialy Kamil, Szkoł
Wyniki 2004, aaa, studia 22.10.2014, Materiały od Piotra cukrownika, materialy Kamil, Szkoła, Labora
Kolokwium I 2002, aaa, studia 22.10.2014, Materiały od Piotra cukrownika, materialy Kamil, Szkoła, L
Kolokwium II 2002, aaa, studia 22.10.2014, Materiały od Piotra cukrownika, materialy Kamil, Szkoła,
Egzamin 2003 pytania, aaa, studia 22.10.2014, Materiały od Piotra cukrownika, materialy Kamil, Szkoł
Egzamin 2004 podział, aaa, studia 22.10.2014, Materiały od Piotra cukrownika, materialy Kamil, Szkoł
Egzamin 2004, aaa, studia 22.10.2014, Materiały od Piotra cukrownika, materialy Kamil, Szkoła, Labor
Kolokwium I 2003, aaa, studia 22.10.2014, Materiały od Piotra cukrownika, materialy Kamil, Szkoła, L
Egzamin 2003, aaa, studia 22.10.2014, Materiały od Piotra cukrownika, materialy Kamil, Szkoła, Labor
Wyniki kolokwium 5 6, aaa, studia 22.10.2014, Materiały od Piotra cukrownika, materialy Kamil, Szkoł
Program zajęć EDi, aaa, studia 22.10.2014, Materiały od Piotra cukrownika, materialy Kamil, Szkoła,
Pytania 2004, aaa, studia 22.10.2014, Materiały od Piotra cukrownika, materialy Kamil, Szkoła, Labor
Program zajęć EZ, aaa, studia 22.10.2014, Materiały od Piotra cukrownika, materialy Kamil, Szkoła, L
Wyniki kolokwium 5 2, aaa, studia 22.10.2014, Materiały od Piotra cukrownika, materialy Kamil, Szkoł
więcej podobnych podstron