L.p. |
C [mol/m3] |
pierw.C |
σ [Ω-1m-1] |
σśr [Ω-1m-1] |
Λ [Ω-1m2mol-1] |
||
1 |
121,000 |
11,000 |
1,2860 |
1,2760 |
1,2880 |
1,2833 |
0,01060606 |
2 |
60,500 |
7,778 |
0,6910 |
0,6950 |
0,6970 |
0,6943 |
0,01147658 |
3 |
30,250 |
5,500 |
0,3700 |
0,3770 |
0,3750 |
0,3740 |
0,01236364 |
4 |
15,125 |
3,889 |
0,1870 |
0,1874 |
0,1875 |
0,1873 |
0,01238347 |
5 |
7,563 |
2,750 |
0,1164 |
0,1150 |
0,1154 |
0,1156 |
0,01528595 |
6 |
3,781 |
1,945 |
0,0696 |
0,0695 |
0,0697 |
0,0696 |
0,01840661 |
CZĘŚĆ 1
Wartości σ [Ω-1m-1] z trzech pierwszych wierszy zostały przemnożone przez 10-1, natomiast wartości z pozostałych trzech wierszy - przez 10-4.
Obliczenie przewodności molowej: ![]()
![]()
Λ 0 [Ω-1m2mol-1] |
t+ |
t- |
λ0+ [Ω-1m2mol-1] |
λ0- [Ω-1m2mol-1] |
0,0173 |
0,68 |
0,32 |
0,005882 |
0,011418 |
Wartość granicznej przewodności molowej została odczytana z wykresu funkcji y=ax +b
y = -0,0017x + 0,0204
Współczynnik b jest zarazem wartością Λ 0.
Liczba przenoszenia t- została obliczona na podstawie znanej wartości t+ (0,68). Obie zsumowane wartości muszą dać 1, zatem t- wynosi 0,32.
Nasza sól to: A2X = 2A+ + X2- (![]()
)
![]()
Zależność między liczbą przenoszenia, przewodnością molową jonu oraz przewodnością molową elektrolitu.
![]()
Zatem ![]()
[Ω-1m2mol-1] , a
![]()
, więc ![]()
[Ω-1m2mol-1]
CZĘŚĆ 2
Mierzony elektrolit |
σ [Ω-1m-1] |
σsr [Ω-1m-1] |
σroztw- σwod |
[Ω-1m2mol-1] |
C [mol/m3] |
Ks |
Nasycony roztwór soli trudnorozpuszczalnych |
0,02150 |
0,02173 |
0,021723 |
|
0,5192 |
|
|
0,02180 |
|
|
|
|
|
|
0,02190 |
|
|
|
|
|
Rozpuszczalnik: H2O destylowana |
0,000009 |
0,0000103 |
|
|
|
|
|
0,000010 |
|
|
|
|
|
|
0,000012 |
|
|
|
|
|
Δσ σroztw- σwod = 0,02173 - 0,0000103 = 0,021723 [Ω-1m-1]
![]()
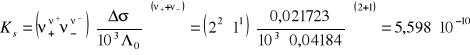
Standardowe odchylenie liczone było ze wzoru:
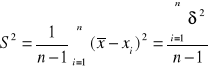
, ![]()
![]()
- wartość średniej arytmetycznej
xi - wynik i-tego spośród n pomiarów
x = ![]()
![]()
[Ω-1m2mol-1]
Wyszukiwarka
Podobne podstrony:
SEM ogniwa1, Technologia chemiczna, Chemia fizyczna, Laboratorium, inne, SEM ogniwa
wpływ stężenia i temperatury na lepkość roztworów, Chemia fizyczna, laboratorium, Chemia fizyczna
Ćwiczenie 1 - oznaczanie stalej i stopnia dysocjacji, Biotechnologia PWR, Semestr 3, Chemia fizyczna
tabele, chemia fizyczna, Nowy folder, zalaczniki
chem.fiz.równowagi fazowe, Inżynieria środowiska, inż, Semestr III, Chemia fizyczna, laboratorium
chemia fizyczna laboratoria, iwona chem. fiz. ćw. 91
Badanie równowagi fazowej w układzie trójskładnikowym 8.3, Technologia chemiczna, Chemia fizyczna, l
elektrolityzadania st, Technologia chemiczna, Chemia fizyczna, laboratorium
chemia fizyczna laboratoria, 95,94, 97
chemia fizyczna laboratoria, 31,32,33vigora, 97
chemia fizyczna laboratoria, 16Ania, ffffff
chemia fizyczna laboratoria, KOND42, 97
chemia fizyczna laboratoria, KOND42, 97
22, chemia fizyczna laboratorium, 22
Pytanianakolosach, Akademia Górniczo - Hutnicza, Technologia Chemiczna, Studia stacjonarne I stopnia
Ćwiczenie 10 - katalityczny rozpad wody utlenionej, Biotechnologia PWR, Semestr 3, Chemia fizyczna -
więcej podobnych podstron