SPRAWDZIAN ROCZNY Z CHEMII
Które z podanych stwierdzeń są prawdziwe? ........................................................................
I-.Tlenki reagujące z kwasami, a nie reagujące z zasadami, nazywamy tlenkami zasadowymi.
II-Tlenki reagujące z zasadami, a nie reagujące z kwasami, nazywamy tlenkami kwasowymi.
III-Tlenki reagujące zarówno z mocnymi kwasami, jak i z mocnymi zasadami nazywamy tlenkami amfoterycznymi.
IV-Tlenki amfoteryczne są zwykle trudno rozpuszczalne w wodzie.
V-Tlenki obojętne nie reagują ani z kwasami, ani z wodą.
Które z wymienionych poniżej wodorotlenków zaliczamy do amfoterycznych, a które do zasadowych?
Moc kwasów beztlenowych:
rośnie w obrębie okresu ze wzrostem elektroujemności niemetalu tworzącego kwas;
maleje w obrębie okresu ze wzrostem elektroujemności niemetalu tworzącego kwas;
maleje w obrębie grupy ze wzrostem elektroujemności niemetalu tworzącego kwas;
poprawne są odpowiedzi A i C.
Pewien uczeń chciał zbadać, czy tlenek antymonu Sb2O3 ma amfoteryczny charakter. Podpowiedz mu jakie rekcje powinien przeprowadzić.
.................................................................................................................................................
................................................................................................................................................
Która z poniższych odpowiedzi zawiera grupę tlenków nie reagujących z wodą?
Uczeń miał otrzymać chlorek miedzi (II) dowolnymi metodami. Którymi z zaproponowanych metod mógł otrzymać ten związek? ......................................................
Oblicz, ile gramów tlenu weszło w skład 160g SO 2 wiedząc, że stosunek mas siarki do tlenu w tym związku wynosi 1:1.
Uzupełnij zdanie:
Atom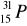
zawiera: .......protonów; ........neutronów; .......elektronów.Zaznacz symbole perwiastków będących izotopami:
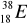
;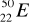
;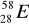
;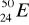
;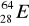
;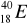
;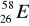
.Wybierz poprawne zdanie:
1 mol substancji w warunkach normalnych zajmuje objętość 22,4 dm3;
1 mol gazu zajmuje objętość 22,4 dm3;
1 mol gazu doskonałego w warunkach normalnych zajmuje objętość 22,4 dm3;
1 mol pierwiastka gazowego zajmuje objętość 22,4 dm3;
Zapis:
zgodny z zakazem Pauliego, ale sprzeczny z regułą Hunda;
zgodny z regułą Hunda, ale sprzeczny z zakazem Pauliego;
zgodny z zakazem Pauliego i regułą Hunda;
sprzeczny z zakazem Pauliego i regułą Hunda.
Atom pewnego pierwiastka ma konfigurację elektronową:
Narysuj wzory elektronowe następujących cząsteczek i określ rodzaje wiązań w nich występujących.
Zapisz cząsteczkowo i jonowo równania reakcji:
HNO3 + Ca(OH)2 → ...........................................................................................................................
..............................................................................................................................................................
..............................................................................................................................................................
Mg + H2SO4 → ...................................................................................................................................
..............................................................................................................................................................
..............................................................................................................................................................Napisz wzory sumaryczne podanych soli:
siarczan (VI) srebra (I).............. chlorek amonu................
siarczan (VI) żelaza (II)............. fosforan (V) baru...............Zapisz równania rekcji dysocjacji związków:
H3BO3 →...........................................................................................
NH4OH →..........................................................................................
Al(OH)3 →..........................................................................................W jaki sposób producenci fajerwerków osiągają barwne efekty płomienia?
wodorotlenki |
|
zasadowe |
amfoteryczne |
|
|
a) NaOH; b) Zn(OH)2
c) Cr(OH)3; d) Ca(OH)2;
e) Al(OH)3; f) Cu(OH)2;
g) Ba(OH)2; h) KOH.
A) Fe2O3, CO2, SiO2, NO2; C) CO, NO, SiO2, CuO2;
B) N2O, NO, CaO, CrO3; D) N2O, NO2, NO, CO.
I. metal + kwas; IV. tlenek metalu + tlenek niemetalu;
II. tlenek metalu + kwas; V. wodorotlenek + kwas.
III. sól + sól;
↑↓ |
↑ |
|
jest:
.........1s2 2s2 2p6 3s2 3p6 3d3 4s2 Podaj jego symbol.
N2 , H2O , MgO
..................................................................................................................................................................
...................................................................................................................................................................
18. Zapisz wzór na stałą dysocjacji kwasu HClO3.
Wyszukiwarka
Podobne podstrony:
Rolnictwo gr A SPRAWDZIAN, do wykorzystania w szkole
Reakcje w roztworachgr A i B SPRAWDZIAN, do wykorzystania w szkole
Litowce i fluorowce SPRAWDZIAN, do wykorzystania w szkole
Rolnictwo SPRAWDZIAN, do wykorzystania w szkole
Budowa atomów i prawa chemiczne SPRAWDZIAN, do wykorzystania w szkole
Jednofunnkcyjne pochodne weglowodorow SPRAWDZIAN, do wykorzystania w szkole
ocena opisowa kl. 3 do wykorzystania na świadectwo, Oligofrenopedagogika
ocena opisowa kl.3 do wykorzystania na świadectwa, OCENA OPISOWA, ocena opisowa
Pochodne weglowodorow POWTÓRZENIE, do wykorzystania w szkole
Struktura atomu, do wykorzystania w szkole
sprawdzian roczny kl.2, Nauka, Egzaminy, testy
ZADANIA mole nie są trudne, do wykorzystania w szkole
Tajemnica krzyża - Misterium Wielkopostne do wykorzystania w szkole podstawowej i gimnazjum, Narrato
Sprawdzian powietrze kl 5 bartek, nauka w szkole podstawowej
Sprawdzian TECHNIKA kl IG ZNACZENIE TECHNIKI W ŻYCIU CZŁOWIEKA, Do szkoły, GIM TECHNIKA
REBUS do kl.III, Pedagogika, do pracy w szkole
kartka z kalendarza (kl.II), Pedagogika, do pracy w szkole
sprawdzian kompetencji kl II, Różności do szkoły
SPRAWDZIAN KOMPETENCJI PO KL 2, Do szkoły, klasa 2
więcej podobnych podstron