Wielkości ekstensywne i intensywne, przykłady.
Wielkości parcjalne określa się dla funkcji układu zwanych funkcjami ekstensywnymi. Ich wartości zależą od ogólnej masy (liczby moli) układu w sposób liniowy, tzn. gdy układ zostanie k-krotnie powiększony bez zmian T, p i stężeń, to wartości funkcji wzrosną też k-krotnie. Należą do nich m.in. objętość V, energia wewnętrzna U, entalpia H, energia swobodna F, entalpia swobodna G, pojemność cieplna Cp.
Wszystkie wielkości parcjalne są funkcjami intensywnymi. Funkcje intensywne to takie funkcje, których wartości nie zależą od globalnej masy układu, lecz tylko od stanu układu (w przeciwieństwie do funkcji ekstensywnych). Do wielkości intensywnych należą np. temperatura, ciśnienie, gęstość, stężenie.
Definicja cząstkowej molowej wielkości, molowej wielkości funkcji dla roztworu, wielkości funkcji dla danej masy roztworu oraz odpowiadających funkcji mieszania na przykładzie V, G, H.
Molową wielkością cząstkową składnika i w roztworze nazywa się pochodną cząstkową wielkości ekstensywnej Z roztworu względem liczby moli tego składnika, przy stałych T, p oraz liczbach pozostałych składników.
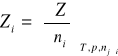
Zgodnie z def. molowej wielkości cząstkowej Zi równanie przyjmuje postać:
![]()
dzieląc obie strony przez sumaryczną liczbę moli n=sigma ni otrzymujemy:
![]()
_
gdzie Z =Z/n jest molową wartością wielkości Z dla roztworu, xi=ni/n są ułamkami wolowymi skłądników.
Równanie Gubbsa-Duhema.
![]()
Wiąże zmiany wszystkich wielkości cząstkowych w układzie. Jeżeli w układzie dwuskładnikowym znana jest zależność funkcyjna wielkości cząstkowej jednego ze składników od jego stężenia, to równanie powyższe pozwala obliczyć wartość parcjalną dla drugiego składnika.
Wykres objętości molowej dla roztworu doskonałego i rzeczywistego.
Roztwory doskonałe:
![]()
Funkcje nadmiarowe:
![]()
Graficzne wyznaczanie cząstkowych molowych objętości składników.
Tangensy kątów nachylenia tych stycznych wyznaczają wartości objętości cząstkowych składnika rozpuszczonego. Wielkości cząstkowe zmieniają się w sposób ciągły ze zmianą stężenia składnika. Należy zawsze podać dla jakiego stężenia została obliczona wartość wielkości parcjalnej.
Wyszukiwarka
Podobne podstrony:
wielkości molowe-odp na pytaniammmm, Chemia Fizyczna, chemia fizyczna- laborki rozne, Rozne
Chemia egzamin odp na pytania 1, 1
Chemia egzamin odp na pytania 2
Pojęcia na egzamin z metali, Chemia Fizyczna, chemia fizyczna- laborki rozne, Rozne
Ściąga z chemii (Na, Chemia Fizyczna, chemia fizyczna- laborki rozne, Rozne
Ściąga na zaliczenie laboratorium u mgr. Pacławskiego, Chemia Fizyczna, chemia fizyczna- laborki roz
Odpowiedzi na test (A-F) z niemetali, Chemia Fizyczna, chemia fizyczna- laborki rozne, Rozne
Pojęcia na egzamin z metali, Chemia Fizyczna, chemia fizyczna- laborki rozne, Rozne
Chemia a ochrona środowiska - referat, Chemia Fizyczna, chemia fizyczna- laborki rozne, Rozne
Zarządzanie odp na pytania z koła
odp na pytania z normy
Katalizatory - referat, Chemia Fizyczna, chemia fizyczna- laborki rozne, Rozne
odp na pytania, WSZOP INŻ BHP, V Semestr, BUDOWA I EKSPLOATACJA MASZYN I URZADZEN
Gospodarek odp na pytania 17-23
Gospodarek, odp na pytania 17 23
Polimery - Wyklady odp na pytania - ściąga (1), rok3
odp na pytania kolos eko, Semestr I
Ogniwagal.wzor, Chemia Fizyczna, chemia fizyczna- laborki rozne, Ogniwa
więcej podobnych podstron