Marcin NOWOSIAD 23.05.2001
IBD, LP-8, G-4
Temat ćwiczenia 23: “Sprawdzenie praw elektrolizy Faradaya.”
Zagadnienia do samodzielnego opracowania
1. Przepływ prądu przez elektrolity.
2. Pierwsze i drugie prawo Faradaya.
W ćwiczeniu stosowanym elektrolitem jest wodny roztwór CuSO4. Po zdysocjowaniu tworzą się jony dodatnie Cu+2 i jony ujemne SO4-2. Po wprowadzeniu do elektrolitu CuSO4 elektrod i połączeniu ich ze źródłem napięcia jony ujemne SO4-2 poruszają się z niewielką prędkością w kierunku anody A, jony dodatnie Cu+2 w kierunku katody K. W wyniku tej elektrolizy możemy stwierdzić, że na katodzie osadzi się Cu, na anodzie właściwie reszta kwasowa SO4, lecz grupa SO4 reaguje natychmiast z wodą:
SO4 + H2O = H2SO4 + ½ O2
Rezultat jest taki, że na anodzie wydziela się tlen. Celem ćwiczenia jest, przez zmierzenie wydzielonej masy miedzi na katodzie, wyliczenie współczynnika elekrochemicznego substancji i stałej Faradaya.
Przyrządy:
analityczna waga laboratoryjna, elektrody miedziowe, amperomierz, zasilacz, sekundomierz.
Kolejność czynności:
1. Połączyć obwód według schematu :
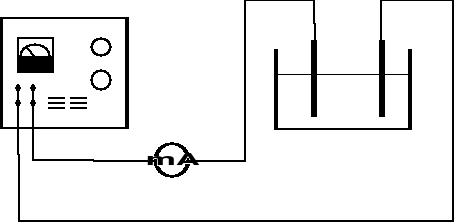
2. Sprawdzić poprawność obwodu elektrycznego zamykając na krótki czas. Równocześnie regulować natężenie prądu w obwodzie, tak aby gęstość nie przekraczała 0,5 A/dm2. (Natężenie prądu wyznaczyć w oparciu o powierzchnie elektrody).
3. Wyjąć katodę, oczyścić starannie papierem ściernym, wypłukać wodą. Wyznaczyć masę m1 katody z analitycznej wagi laboratoryjnej.
4. Umieścić ponownie katodę w elektrolicie, włączyć prąd uruchamiając jednocześnie zegar. Utrzymać stałą wartość natężenia prądu przez czas t = 30 minut.
5. Po upływie tego czasu przerwać przepływ prądu. Opłukać katodę wodą, osuszyć i wyznaczyć masę m2 katody. Masę wydzielonej miedzi obliczyć ze wzoru m = m2 - m1. Przekształcając wzór ![]()
obliczyć równoważnik elektrochemiczny miedzi :
![]()
6. Z układu okresowego pierwiastków odczytać masę atomową miedzi mCu, wartościowość miedzi w = 2 i ze wzoru wyrażającego II prawo Faradaya obliczyć stałą Faradaya :
![]()
7. Wskazówki do opracowania błędów.
Masę miedzi wydzieloną w procesie elektrolizy wyznacza się ważąc katodę na wadze analitycznej przed zamknięciem obwodu i po przerwaniu elektrolizy. Za błąd jakim obarczona jest wydzielona masa miedzi uważać będziemy sumę błędów popełnionych przy obu ważeniach wynikającą z dokładności wagi. Aby osiągnąć dużą dokładność ważenia należy przed przystąpieniem do pomiarów sprawdzić poziome ustawienie wagi oraz wyznaczyć zerowe położenie wskazówki wagi nie obciążonej. Czas trwania elektrolizy mierzy się sekundomierzem. Ponieważ proces trwa 30 minut pomiar czasu można określić z dokładnością do kilkunastu sekund.
I |
m1 |
t |
m2 |
m |
k |
kk |
F |
FF |
[ m A] |
[g] |
[ s ] |
[g] |
[g] |
[g/mA⋅s] |
[g/mA⋅s] |
[mA⋅s] |
[mA⋅s] |
250 |
61,962 |
1800 |
62,142 |
0,18 |
4⋅10-7 |
4⋅10-7±3,5⋅10-9 |
7,946⋅107 |
7,946⋅107±694968,75 |
Obliczenia :
m = m2 - m1 = 62,142 - 61,962 = 0,18 [ g ]
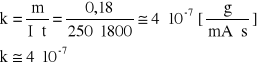
![]()
Błędy pomiarów :
błąd pomiaru masy
m1 = m2 = 0,0002 [ g ]
błąd względny

błąd pomiaru czasu
t = 1 [ s ]
błąd względny ![]()
błąd pomiaru prądu
![]()
gdzie k - klasa przyrządu pomiarowego
ZP - zakres pomiarowy
![]()
błąd względny procentowy ![]()
błąd obliczeń równoważnika elektrochemicznego
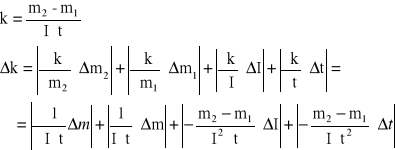
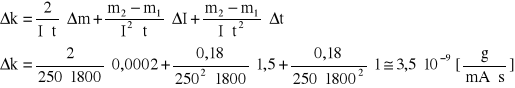
błąd względny ![]()
błąd obliczeń stałej Faradaya
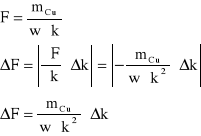
![]()
błąd względny ![]()
Wnioski :
Celem ćwiczenia było sprawdzenie praw elektrolizy Faradaya. Sprawdzanie tych praw polegało na wyznaczeniu równoważnika elektrochemicznego dla miedzi oraz stałej Faradaya. Równoważnik elektrochemiczny ![]()
, stała Faradaya ![]()
.
Wyszukiwarka
Podobne podstrony:
ćw 23, Prz inf 2013, I Semestr Informatyka, Fizyka, [FIZYKA] Laborki, laboratorium stare, Fizyka Dam
SiS strona tytulowa spr, Prz inf 2013, I Semestr Informatyka, Fizyka, Wykłady-Fizyka, Sygnały i Syst
SiS strona tytulowa spr, Prz inf 2013, I Semestr Informatyka, Fizyka, Wykłady-Fizyka, Sygnały i Syst
Wyznaczanie stałej siatki dyfrakcyjnej, Prz inf 2013, I Semestr Informatyka, Fizyka, SPRAWOZDANIA DU
Tabela pomiarowa, Prz inf 2013, I Semestr Informatyka, Fizyka, [FIZYKA] Laborki, laboratorium stare
tabele 1B+, Prz inf 2013, I Semestr Informatyka, Fizyka, [FIZYKA] Laborki, laboratorium stare, 1b
Ćwiczenie nr 44 prawie dobre ale juz teraz lux, Prz inf 2013, I Semestr Informatyka, Fizyka, [FIZYKA
ćw 1 obliczenia, Prz inf 2013, I Semestr Informatyka, Fizyka, [FIZYKA] Laborki, laboratorium stare,
spr5, Prz inf 2013, I Semestr Informatyka, Fizyka, [FIZYKA] Laborki, laboratorium stare, bartochowsk
obliczenia ćw23, Prz inf 2013, I Semestr Informatyka, Fizyka, [FIZYKA] Laborki, laboratorium stare,
Ćwiczenie nr 44, Prz inf 2013, I Semestr Informatyka, Fizyka, [FIZYKA] Laborki, laboratorium stare,
Wstęp teoretyczny ćw 44, Prz inf 2013, I Semestr Informatyka, Fizyka, [FIZYKA] Laborki, laboratorium
pierwsza strona sprawozdania własne, Prz inf 2013, I Semestr Informatyka, Fizyka, [FIZYKA] Laborki,
pierwsza strona sprawozdania, Prz inf 2013, I Semestr Informatyka, Fizyka, [FIZYKA] Laborki, laborat
Ćwiczenie 47, Prz inf 2013, I Semestr Informatyka, Fizyka, SPRAWOZDANIA DUZO, laboratorium
więcej podobnych podstron