Jednostki podstawowe układu SI
Punktem wyjścia dla stosowanego układu jednostek są jednostki podstawowe. Nie da się jednej jednostki podstawowej otrzymać z drugiej jednostki podstawowej za pomocą jakiegoś wzoru. Poza tym każda jednostka podstawowa jest ustalana w oparciu fizycznie istniejące ciało, lub doświadczenie.
Jednostki podstawowe układu SI |
||
Nazwa wielkości |
nazwa jednostki |
skrót literowy |
długość |
metr |
m |
masa |
kilogram |
kg |
czas |
sekunda |
s |
natężenie prądu |
amper |
A |
temperatura |
kelwin |
K |
ilość substancji |
mol |
mol |
światłość źródła światła |
kandela |
cd |
Jednostki pochodne układu SI
Jednostki pochodne układu SI można (w odróżnieniu od jednostek podstawowych) otrzymać z jednostek podstawowych stosując rozmaite wzory.
Nazwa |
nazwa jednostki |
skrót literowy |
powiązania, uwagi |
pole powierzchni Pp |
metr kwadratowy |
m2 |
|
objętość V |
metr sześcienny |
m3 |
|
siła F |
niuton |
N = kg∙ m∙ s-2 |
|
praca / energia |
dżul |
J = kg ∙ m2∙ s-2 |
J = N∙ m |
ciśnienie p |
paskal |
Pa = kg∙ m-1∙ s-2 |
Pa = N/ m2 |
gęstość ρ |
kilogram na metr sześcienny |
kg∙ m-3 |
|
moc P |
wat |
W = kg m2∙ s-3 |
W = J / s |
ciepło właściwe Cw |
dżul przez kilogram kelwin |
m2s-2K-1 |
J/kgK |
Przedrostki jednostek
Aby nie operować tysiącami, milionami i miliardami do opisu bardzo dużych i bardzo małych wielkości, stosuje się przedrostki. W poniższej tabeli zostały one zestawione wraz z nazwami wielkości będących mnożnikami.
przedrostek |
skrót |
liczba przez którą mnożymy |
przykład |
atto |
a |
10-18 |
as (attosekunda) |
femto |
f |
10-15 |
fm (femtometr) |
piko |
p |
10-12 |
pF (pikofarad) |
nano |
n |
10-9 |
nm (nanometr) |
mikro |
μ |
10-6 |
μm (mikrometr) |
mili |
m |
10-3 |
mg (miligram) |
centy |
c |
10-2 = 0,01 |
cm (centymetr) |
decy |
d |
10-1 = 0,1 |
dm (decymetr) |
deka |
da |
10 |
dag (dekagram) |
hekto |
h |
102 = 100 |
hl (hektolitr) |
kilo |
k |
103 = 1000 (tysiąc) |
kg (kilogram) |
mega |
M |
106 = 1 000 000 (milion) |
MHz (megaherc) |
giga |
G |
109 = 1 000 000 000 (miliard) |
GHz (gigaherc) |
tera |
T |
1012 = 1 000 000 000 000 (bilion) |
TB (terabajt) w informatyce |
Inne jednostki i układy jednostek
Poniżej podano kilka jednostek spoza układu SI dość często stosowanych w Polsce.
Stopień Celsjusza (°C) -
|
0 K (czyli zero bezwzględne) to -273,15°C, lub inaczej 0°C = 273,15K
|
Atmosfera (atm) - mamy dwie konkurencyjne atmosfery |
atmosfera techniczna:
atmosfera fizyczna: |
Kaloria (1 cal) to jednostka energii, a głównie ciepła. Równa jest energii jaką trzeba dostarczyć, aby o 1°C ogrzać 1 cm3 wody. |
1 cal = 4,1868 J |
Kilowatogodzina (1 kWh) - jednostka używana do określania energii elektrycznej |
1kWh = 3 600 000 J |
kilogram siła (KG) jest taką naturalną jednostką siły równą w przybliżeniu sile, jakiej trzeba użyć, aby utrzymać na Ziemi masę 1kg. Ponieważ grawitacja jest różna w różnych punktach naszego globu, więc nie da się wprowadzić idealnego kilograma siły, lecz tylko "średni" kilogram siła. |
1KG = 9,80665 N |
Milimetr słupa rtęci (mmHg) - jednostka ciśnienia wywodząca się ze sposobu pomiaru tej wielkości za pomocą barometrów rtęciowych |
1 atm = 760 mmHg
|
Termodynamika
Termodynamika jest działem fizyki zajmującym się zjawiskami cieplnymi.
Bada ona jak pod wpływem dostarczania, lub odbierania energii cieplnej zmienia się temperatura, objętość, stan skupienia i inne własności ciał.
Współczesna termodynamika tłumaczy zjawiska cieplne w oparciu o tzw. teorię kinetyczno - molekularną (nazywaną też teorią kinetyczno - cząsteczkową).
Oznacza to, że zjawiska związane ze zmianami temperatury dają się wytłumaczyć jako konsekwencja ruchu i wzajemnych oddziaływań atomów i cząsteczek.
Stany skupienia
Typowo obserwowane ciała występują w trzech podstawowych stanach:
|
stałym |
|
ciekłym |
|
lotnym (czyli jako gaz, lub para) |
Cechy ciał w owych stanach skupienia są następujące:
|
w stanie stałym - ciało posiada określony kształt i samorzutnie, a także mimo działania niewielkich sił ten stan zachowuje. Ciała w stanie stałym charakteryzują się sprężystością. Ściśliwość ciał stałych jest szczątkowa. |
|
w stanie ciekłym - ciało w warunkach działania siły grawitacji gromadzi się dolnej części naczynia, przenika przez pory i szczeliny, nie ma stałego kształtu. Posiada natomiast powierzchnię charakteryzującą się pewnego rodzaju niewielką sprężystością. Patrząc od strony mikroskopowej, ciecze posiadają pewną regularność ułożenia atomów i cząsteczek w zasięgu kilku - kilkunastu odległości międzatomowych. Jednak brakuje tu struktury dalekiego zasięgu. Ciecze są bardzo słabo ściśliwe (właściwie prawie nieściśliwe) |
|
w stanie gazowym - ciało rozprzestrzenia się w całej objętości naczynia. Gaz wywiera ciśnienie na otaczające go przedmioty, jest ściśliwy łatwo się miesza z innymi substancjami lotnymi. |
Schematyczna budowa mikroskopowa w trzech stanach skupienia
ciało stałe krystaliczne |
ciecz, lub ciało stałe bezpostaciowe |
gaz |
|
|
|
TRZY STANY SKUPIENIA
Stan skupienia zależy od temperatury.
W ciele stałym energia drgań cząsteczek jest zbyt mała, żeby przeciwdziałać sile wiązań chemicznych tworzących kryształ.
Wraz ze wzrostem temperatury energia drgań rośnie, tak że wiązania zostają zerwane i kryształ nie może dalej istnieć. Mówimy, że przekroczona została temperatura topnienia i substancja stała się cieczą.
Dalsze ogrzewanie prowadzi do jeszcze szybszych ruchów cząsteczek, aż wreszcie mogą one pokonać napięcie powierzchniowe cieczy i uwolnić się.
Mówimy wtedy, że przekroczona została temperatura wrzenia i ciecz zamieniła się w gaz.
Zmiany stanów skupienia
Stany skupienia ciał mogą ulegać zmianie pod wpływem:
|
dostarczonego /odebranego ciepła (zmiany energii wewnętrznej) |
|
zmiany ciśnienia |
Zmiany stanu skupienia są jednym z przykładów przejść fazowych, czyli zmiany fazy substancji (pojęcie "fazy" jest szersze niż stanu skupienia bo obejmuje także np. różne postacie krystaliczne, czy np. zmianę własności magnetycznych substancji).
Nazwy zmian stanów skupienia
stan końcowy stan początkowy |
ciało stałe |
ciecz |
gaz |
ciało stałe |
bez zmiany stanu |
topnienie |
sublimacja |
ciecz |
krzepnięcie |
bez zmiany stanu |
parowanie |
gaz |
resublimacja |
skraplanie |
bez zmiany stanu |
Stan równowagi, a stany nieustalone
Opisane warunki dotyczące zmian stanów skupienia dotyczą sytuacji, w których ciała znajdują się w stanie równowagi - tzn. mamy ustabilizowanie obu faz substancji.
W stanie ustalonym ciało zachowuje swój stan skupienia dowolnie długo.
W typowych życiowych sytuacjach mamy jednak do czynienia z zaburzeniami stanów równowagi - wciąż następują zmiany, a dodatkowo różne substancje są wymieszane i w różny sposób zmieniają swoje stany.
I tak np. podczas mrozu w zimie leżący śnieg (lód) powoli sublimuje (im wyższa temperatura, tym szybciej) przechodząc do stanu lotnego.
Jednak podczas odwilży mamy do czynienia już z trzema stanami skupienia - stałym (leżącym śniegiem), ciekłym (wodą z roztopionego śniegu) i lotnym.
Mogą tu zachodzić jednocześnie różne konkurencyjne procesy - śnieg sublimuje i topnieje, jednocześnie jednak część pary wodnej resublimuje, ew. skrapla się osadzając się na chłodniejszych elementach.
Ciecz też może w częściowo powracać do stanu stałego, lub częściowo parować.
Wszystkie te procesy zachodzą równocześnie, jednak w zależności od temperatury i ciśnienia jedne biorą górę nad innymi i dlatego ostatecznie przy wyższych temperaturach dochodzi do stopienia się śniegu i wyparowania wody, zaś przy temperaturach poniżej zera może dość do osadzania się szronu, spadku śniegu (co jest związane z resublimacją) itp.
W przypadku substancji składających się z jednego rodzaju atomów lub jednego rodzaju cząsteczek, które tak jak woda posiadają tylko trzy fazy - krystaliczną, ciekłą i gazową, wykres ten przybiera zazwyczaj następującą postać:
Strzałki przedstawiają przemiany fazowe:
Temperatura
Podstawową wielkością charakteryzującą zjawiska cieplne jest temperatura.
Wielkość tę odczytujemy z termometru, dzięki czemu dowiadujemy się czy jest ciepło, czy zimno.
Ale od odczucia ciepła i zimna, do poprawnego określenia wielkości fizycznej droga nie jest prosta.
Od razu pospieszę z częściową odpowiedzią, że to nie temperatura przepływa od rozgrzanej płyty kuchenki do postawionego na niej garnka.
Przepływającym medium jest energia, (a ta przepływająca energia nazywana jest po prostu ciepłem).
Za to:Temperatura wskazuje kierunek przepływu energii cieplnej.
Gorące ciało (czyli ciało o wyższej temperaturze) ma energię „na wyższym poziomie”, niż ciało chłodne. A ponieważ poziomy energetyczne dążą do wyrównywania się, to:
samorzutny przepływ energii zachodzi zawsze od ciała o wyższej temperaturze do ciała o niższej temperaturze.
To wydaje się oczywiste, bo przecież nikt nigdy nie zauważył by zimny lód ogrzał cieplejszego niż on człowieka, jednak warto mieć świadomość, że fakt ten jest podstawą dla pojęcia temperatury. W ten sposób temperatura szereguje wszystkie ciała w zależności od ich możliwości samorzutnego oddawania, lub przyjmowania ciepła.
Przekaz ciepła wiąże się z faktem, że zetknięcie cząsteczek ciała cieplejszego (szybciej się poruszających) z cząsteczkami ciała chłodniejszego (wolniejszych), powoduje zderzanie się ich i pobudzanie tych ostatnich do szybszego ruchu, przy spowalnianiu cząsteczek oddających swoją energię kinetyczną. Mechanizm przekazywania ciepła działa zarówno w przypadku ciał stałych, cieczy, jak i gazów.
W wyniku przekazu ciepła dochodzi najczęściej do wyrównywania temperatur - ciało cieplejsze (oddające ciepło) ochładza się, a ciało chłodniejsze ogrzewa.
Jednostka ciepła Jednostką ciepła jest dżul (J), co wynika z faktu, że ciepło jest forma energii, a dżul jest jednostką wszystkich rodzajów energii.
Uwaga warto zapamiętać, że żadne ciało ciepła nie "posiada". Ciepło może być tylko przekazywane.
Kelwin - jednostka temperatury w układzie SI
Jednostką temperatury w układzie SI jest kelwin.
Stopień Celsjusza Stopień Celsjusza jest jednostką powstałą z podzielenia pewnego uzgodnionego zakresu temperatur na 100 równych części.
|
temperatura początkowa (dolna) wspomnianego zakresu temperatur jest równa jest temperaturze topnienia lodu pod ciśnieniem normalnym. Jest to 0 °C. |
|
temperatura końcowa (górna) wspomnianego zakresu temperatur jest równa jest temperaturze wrzenia wody pod ciśnieniem normalnym. Jest to 100 °C. |
Po podzieleniu zakresu na 100 równych odcinków, każdy z nich będzie wyznaczał różnicę temperatur równą 1°C.
Skala Celsjusza, a skala bezwzględna (Kelwina)
Pomiędzy skalą Celsjusza, a skalą Kelwina zachodzi podobieństwo.
Bo różnica temperatur jest w obu skalach identyczna, czyli jeśli pomiędzy dwoma punktami temperaturowymi jest różnica temperatur 15°C, to znaczy że w tym przypadku mamy też różnicę 15 K (kelwinów).
Odmienność obu skal temperaturowych polega na wybraniu innych punktów stanowiących "zero" - równych 0.
|
0 stopni Celsjusza odpowiada temperaturze topnienia lodu, podczas gdy w skali Kelwina jest to już 273,15 K. |
|
0 kelwinów to tzw. zero bezwzględne (także "zero absolutne"), czyli najniższa w ogóle możliwa do osiągnięcia temperatura. W skali Celsjusza jest - 273,15°C. |
|
|
Temperatura jest tym wyższa, im szybciej poruszają się cząsteczki/ atomy danego ciała.
W temperaturze zera bezwzględnego cząsteczki nie poruszają się wcale.
Temperatura jest wprost proporcjonalna do średniej energii kinetycznej cząsteczek ciała.
Ważnym pojęciem ściśle powiązanym z temperaturą jest energia wewnętrzna.
Jednak pomiędzy tymi pojęciami występują istotne różnice.
W szczególności energia wewnętrzna rośnie wraz z ilością substancji, a temperatura jest wyznaczana jest wielkością lokalną - wyznaczaną prawie w punkcie, a przynajmniej w niewielkim obszarze zawierającym próbkę materii. Temperatura nie zależy wiec od ilości cząsteczek, tylko od "średniego" zachowania się w danym obszarze.
Energia wewnętrzna
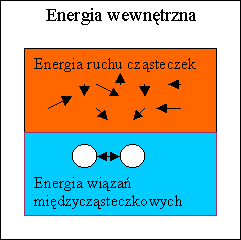
Energia wewnętrzna jest to jakby suma energii ciała oddana do dyspozycji zjawisk cieplnych. Składa się ona więc przede wszystkim z energii kinetycznej ruchu cząsteczek (czyli od temperatury) oraz energii wiązań międzycząsteczkowych.
Piszę „przede wszystkim” bo w pewnych sytuacjach do głosu mogą dojść dodatkowe energie (np. pola magnetycznego, chemiczna, jądrowa), które potrafią zaburzyć ten prosty obraz. Jednak w typowych przypadkach mamy do czynienia z powyższymi dwoma podstawowymi energiami.
Energia wewnętrzna ma ścisły związek z temperaturą - im większa jest energia wewnętrzna, tym większa będzie temperatura ciała.
Dla rozrzedzonych gazów jest to zależność ścisła - temperatura wzrasta dokładnie w takim stopniu jak energia wewnętrzna.
W przypadku cieczy i ciał stałych sprawa się nieco komplikuje. Tutaj na energię wewnętrzną ma wpływ nie tylko temperatura, ale oddziaływania między cząsteczkami. Wpływ tego ostatniego czynnika ujawnia się w szczególności podczas przejść fazowych - zmian stanu skupienia (np. topnienia, czy parowania.
Wyszukiwarka
Podobne podstrony:
Jednostki podstawowe układu SI
JEDNOSTKI PODSTAWOWE UKLADU SI Nieznany
4x Jednostki podstawowe układu SI
Jednostki pochodne układu SI
Jednostki pochodne układu SI, Zarządzanie i inżynieria produkcji, Semestr 3, Metrologia
Jednostka pochodna układu SI
Przedrostki jednostek miar układu SI, Zarządzanie i inżynieria produkcji, Semestr 3, Metrologia
Jednostki pochodne układu SI
Jednostka pochodna układu SI(1), nauka, fizyka, FIZYKA-ZBIÓR MATERIAŁÓW
Przedrostki jednostek fizycznych układu SI
Jednostki podst układu SI
Podstawowe jednostki układu SI
Podstawowe jednostki układu SI
podstawowe jednostki ukladu SI, Dokumenty Textowe, Ciekawostki i rozmaitości
Jednostki podstawowe Międzynarodowego Układu Jednostek Miar, Jednostki podstawowe Międzynarodowego U
więcej podobnych podstron