3. ANALIZA JAKOŚCIOWA ANIONÓW
Jakościowa analiza chemiczna ma na celu określenie jakościowego składu badanej substancji. Polega ona na tym że do badanej próbki dodaje się odpowiedniego odczynnika, pod wpływem którego zachodzi jakaś zauważalna, charakterystyczna reakcja, najczęściej roztwór się zabarwia, wytrąca lub rozpuszcza się osad (często barwny), wydziela się gaz lub powstaje charakterystyczny zapach. Takie reakcje, które pozwalają na wykrycie danego jonu w obecności innych jonów - nazywane są reakcjami charakterystycznymi.
Klasyczną analizę można przeprowadzić jako analizę wybiórczą lub analizę systematyczną. Analiza wybiórcza polega na wykrywaniu poszczególnych jonów z oddzielnych próbek badanego roztworu w dowolnej kolejności, bez oddzielania od siebie grup jonów za pomocą reakcji charakterystycznych. Analiza systematyczna polega na kolejnym oddzielaniu lub stwierdzeniu nieobecności grup jonów za pomocą tzw. odczynników grupowych. W ten sposób dzieli się analizowane jony na grupy, w których łatwiej jest wykryć poszczególne jony. W systematycznym toku analizy każdy jon jest wykrywany dopiero po wykryciu i usunięciu (oddzieleniu) wszystkich jonów przeszkadzających.
3.1. ANALIZA ANIONÓW
Zgodnie z klasyczną systematyką aniony dzielą się na VII grup analitycznych. Podział ten oparty jest na reakcjach z jonami Ag+ i Ba2+ (stosowane są tu roztwory 0,1 mol/dm3 AgNO3 i 0,1 mol/dm3 BaCl2). Biorąc pod uwagę rozpuszczalność soli srebra(I) i baru można zaliczyć dany anion do jednej z siedmiu grup analitycznych co zaprezentowano w tabeli 2.
Tabel 1
Podział anionów na grupy analityczne
Grupa |
Aniony |
Zachowanie anionów względem odczynników grupowych jakimi są: 0,1 mol/dm3 roztworyAgNO3 i BaCl2 |
1 |
2 |
3 |
I |
Cl-, Br-, J-, CN-, SCN-, [Fe(CN)6]3-, |
Jony Ag+ wytrącają osad nierozpuszczalny |
II |
S2-, NO2-, CH3COO- |
Jony Ag+ wytrącają osad rozpuszczalny w HNO3. Jony Ba2+ osadu nie wytrącają. |
III |
CO32-, SO32-, BO2-, C4H4O62-, C2O42- |
Jony Ag+ wytrącają biały osad rozpuszczalny |
IV |
PO43-, S2O32-, CrO42-, Cr2O72, AsO33-, AsO43- |
Jony Ag+ wytrącają barwne osady rozpuszczalne w HNO3. Jony Ba2+ wytrącają osady rozpuszczalne w HNO3. |
V |
NO3-, ClO3-, ClO4-, MnO4- |
Jony Ag+ osadu nie wytrącają. Jony Ba2+ osadu nie wytrącają. |
VI |
SO42-, F-, SiF62- |
Jony Ag+ nie wytrącają osadu. Jony Ba2+ wytrącają biały osad. |
VII |
SiO32- |
Jony Ag+ wytrącają biały żółty osad rozpuszczalny w HNO3. Jony Ba2+ wytrącają biały osad rozpusz-czalny w HNO3. Podczas odparowywania ze stężonym HCl wytrąca się nierozpuszczalny osad. |
W tabeli zaznaczono te aniony które identyfikuje się na ćwiczeniach laboratoryjnych
REAKCJE CHARAKTERYSTYCZNE WYBRANYCH ANIONÓW
3.1.1. Reakcje jonu chlorkowego Cl-
1. Azotan(V) srebra(I) AgNO3. Jony Ag+ wytrącają z roztworów zawierających jony Cl- biały, serowaty osad chlorku srebra (I) AgCl
![]()
↓
Osad ten na świetle przybiera barwę szarofioletową na skutek powstawania metalicznego srebra. Osad chlorku srebra(I) rozpuszcza się:
w stężonym HCl
![]()
w NH4OH
![]()
Po dodaniu kwasu azotowego wytrąca się ponownie osad:
![]()
w Na2S2O3
![]()
2. Manganian(VII) potasu KMnO4. Jony MnO4- w środowisku kwaśnym odbarwiają się, utleniając jony Cl- do wolnego chloru, który można poznać po charakterystycznym zapachu. Reakcja zachodzi na gorąco:
![]()
3.1.2. Reakcje jonu siarczkowego S2-
1. Azotan(V) srebra(I) AgNO3. Jony Ag+ wytrącają z roztworów zawierających jony S2- czarny osad Ag2S. Osad ten rozpuszcza się w rozcieńczonym HNO3 na gorąco:
![]()
2. Kwasy nieutleniające. H2SO4 lub HCl (roztwory rozcieńczon) rozkładają siarczki wydzielając gazowy siarkowodór H2S:
![]()
H2S wykrywamy po charakterystycznym zapachu, a także po czernieniu bibuły zwilżonej roztworem octanu ołowiu(II), umieszczonej u wylotu probówki, z której wydziela się H2S:
![]()
3.1.3. Reakcje jonu octanowego CH3COO-
1. Azotan(V) srebra(I) AgNO3. Jony Ag+ wytrącają (ze stężonych roztworów zawierających jony CH3COO-) biały osad octanu srebra (I), CH3COOAg, dobrze rozpuszczalny w gorącej wodzie:
![]()
↓
2. Rozcieńczony kwas siarkowy H2SO4 wypiera z octanów wolny kwas octowy CH3COOH, który przy ogrzaniu możemy wykryć po charakterystycznym zapachu
![]()
3.Chlorek żelaza(III) FeCl3. Żelazo (III) w roztworach obojętnych, zawierających jony CH3COO- daje czerwonobrunatne zabarwienie związane z powstawaniem octanu żelaza(III) Fe(CH3COO)3. Po zagotowaniu wytrąca się brunatny osad hydroksooctanu żelaza(III) Fe(OH)2CH3COO:
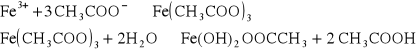
3.1.4. Reakcje jonu węglanowego CO32-
1. Azotan(V) srebra(I) AgNO3. Jony Ag+ wytrącają z roztworów zawierających jony CO32- biały osad węglanu srebra(I) Ag2CO3, rozkładający się po ogrzaniu na CO2 i brunatny tlenek srebra (I) Ag2O:
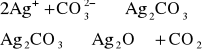
2. Chlorek baru BaCl2. Odczynnik ten wytrąca z roztworów zawierających jony CO32- biały osad węglanu baru BaCO3, rozpuszczalny w rozcieńczonych kwasach mineralnych (oprócz H2SO4) i w kwasie octowym.
![]()
↓
3. Kwasy nieutleniające rozkładają węglany z burzliwym wydzieleniem CO2:
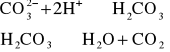
3.1..5. Reakcje jonu fosforanowego PO43-
1. Azotan(V) srebra(I) AgNO3. Jony Ag+ wytrącają z obojętnych roztworów zawierających jony PO43- żółty osad fosforanu(V) srebra(I) Ag3PO4, łatwo rozpuszczalny w rozcieńczonym HNO3, CH3COOH i NH4OH
![]()
2. Chlorek baru BaCl2. Odczynnik ten wytrąca z roztworów zawierających jony PO43- biały osad wodorofosforanu (V) baru BaHPO4,
![]()
↓
3. Mieszanina magnezowa (roztwór zawierający MgCl2 + NH4OH + NH4Cl) wytrąca z roztworów zawierających jony PO43- biały krystaliczny osad fosforanu magnezu i amonu MgNH4PO4, rozpuszczalny w kwasach:
![]()
↓
4. Molibdenian amonowy (NH4)2MoO4 w nadmiarze stężonego HNO3 wytrąca na zimno z roztworów zawierających jony PO43- jasnożółty osad tetrakis[trimolibdeniano(VII)] fosforanu(V) triamonu (NH4)3[P(Mo3O10)4]
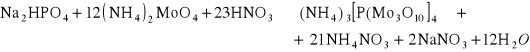
3.1.6. Reakcje jonu chromianowego (VI) CrO42-
1. Azotan(V) srebra(I) AgNO3. Jony Ag+ wytrącają z obojętnych roztworów zawierających jony CrO42- brunatnoczerwony osad chromianu(VI) srebra(I) Ag2CrO4:
![]()
↓
2. Chlorek baru BaCl2. Odczynnik ten wytrąca z obojętnych roztworów zawierających jony CrO42- żółty osad chromianu(VI) baru BaCrO4, rozpuszczalny w rozcieńczonym HNO3 i HCl, a nierozpuszczalny w CH3COOH
![]()
↓
3. Jony Pb2+ np. Pb(NO3)2, (CH3COO)2Pb wytrącają z roztworów zawierających jony CrO42- żółty osad chromianu (VI) ołowiu (II) PbCrO4:
![]()
4. Reduktory np. siarczany (IV) w środowisku kwaśnym redukują jony CrO42--do jonów Cr3+:
![]()
Reakcji redukcji chromianów towarzyszy zmiana zabarwienia z żółtego na zielone.
Wykonanie:
Do 1 cm3 badanego roztworu dodać kilka kropli kwasu (H2SO4, HCl), a następnie roztworu siarczanu(IV) sodu Na2SO3. Zmiana barwy z żółtej na zieloną świadczy o obecności anionów chromianowych.
3.1.7. Reakcje jonu azotanowego(V) NO3-
1. Reakcja obrączkowa, nasycony roztwór siarczanu(VI) żelaza(II) FeSO4 w obecności stężonego H2SO4 daje z jonami azotanowymi brunatne zabarwienie, na skutek utworzenia jonu Fe(NO)2+ rozkładającego się przy ogrzewaniu:
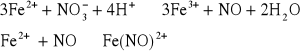
Wykonanie:
Do badanego roztworu dodać niewielką ilość stężonego H2SO4, a następnie probówkę z roztworem silnie ochłodzić pod bieżącą wodą. Do zimnego roztworu dodawać po ściance probówki niewielką ilość roztworu FeSO4. W miejscu zetknięcia się obu cieczy powstaje brunatna obrączka kompleksu Fe(NO)SO4.
3.1.8. Reakcje jonu siarczanowego SO42-
1. Chlorek baru BaCl2. Odczynnik ten wytrąca z roztworów zawierających jony SO42- biały, krystaliczny osad praktycznie nierozpuszczalnego w kwasach mineralnych siarczanu(VI) baru BaSO4
![]()
↓
2. Jony Pb2+. Jony te wytrącają z roztworów zawierających jony SO42- biały, krystaliczny osad siarczanu(VI) ołowiu PbSO4:
![]()
↓
Osad rozpuszcza się w winianie i octanie amonowym.
3.1.9. Reakcje jonu krzemianowego SiO32-
1. Azotan(V) srebra(I) AgNO3. Jony Ag+ wytrącają z roztworów zawierających jony SiO32- jasnożółty osad krzemianu srebra(I) Ag2SiO3, rozpuszczalny w rozcieńczonych kwasach i rozcieńczonym NH4OH
![]()
↓
Roztwór otrzymany przez rozpuszczenie Ag2SiO3 w kwasie szybko mętnieje na skutek wytrącania kwasów krzemowych.
2. Chlorek baru BaCl2. Odczynnik ten wytrąca z roztworów zawierających jony SiO32- biały osad krzemianu baru BaSiO3, rozpuszczalny w HNO3:
![]()
↓
3. Rozcieńczone kwasy: HCl, HNO3, H2SO4. Kwasy te wytrącają z roztworów krzemianów (zwłaszcza przy podgrzaniu) galaretowaty osad mieszaniny kwasów krzemowych:
![]()
↓
4. Sole amonowe wytrącają z roztworów krzemianów (również przy podgrzaniu) galaretowaty osad H2SiO3:
![]()
![]()
Jony NH4+ na skutek wiązania jonów OH- naruszają równowagę reakcji hydrolizy krzemianów, co przesuwa położenie równowagi reakcji w kierunku tworzenia się kwasów krzemowych.
Wykonanie ćwiczenia
W otrzymanych do analizy próbkach należy zidentyfikować znajdujące się tam aniony.
Identyfikacje należy prowadzić w probówkach, używając 1-2 cm3 badanego roztworu i dodając taką samą objętość roztworu odczynnika. Przystępując do analizy należy zwrócić uwagą na barwę roztworu otrzymanego do analizy, ponieważ niektóre kationy i aniony wykazują w roztworach wodnych charakterystyczne zabarwienie.
W celu sprawdzenia poprawności identyfikowanych jonów wykonuje się tzw. ślepe próby, polegające na użyciu zamiast badanego roztworu roztworów zawierających odpowiednie jony.
7
Wyszukiwarka
Podobne podstrony:
Sprawozdanie 2 Badanie właściwości i analiza jakościowa anionów, Politechika Białostocka, budownictw
analiza jakościowa anionów, Politechnika Śląska ZiIP i inne, Chemia, Chemia notatki
Badanie wlasciwosci i analiza jakosciowa anionow(2), Studia, Chemia, chemia od Ines(1)
TEMAT 2, TEMAT: BADANIE WŁAŚCIWOŚCI I ANALIZA JAKOŚCIOWA ANIONÓW
ANALIZA JAKOŚCIOWA KATIONÓW, Chemia
Analiza jakościowa anionów i kationów
Analiza jakościowa kationów i anionów, Energetyka, I rok, chemia
Analiza jakościowa kationów i anionów, Technika Rolnicza i Leśna, Semestr 1, Chemia i Materiałoznaws
Analiza jakościowa Kationów i anionów(1.0 pkt), Mechanika i Budowa Maszyn, Chemia sprawozdania
Analiza jakościowa kationów i anionów, Analiza jakościowa
Wybrane metody analizy jakościowej. Reakcje analityczne wybranych anionów, sprawka z chemi utp rok I
Sprawozdanie 2 Badanie właściwości i analiza jakościowa kationów, Politechika Białostocka, budownict
Laboratorium 4 Reakcje utleniania i redukcji, Studia - Inżynieria materiałowa, Chemia ogólna i nieor
Laboratorium 9 Iloczyn rozpuszczalności, Studia - Inżynieria materiałowa, Chemia ogólna i nieorganic
Nieorg. analiza jakościowa, Chemia
więcej podobnych podstron