Sprawozdanie nr 2
Konduktometria.
Ćwiczenie K - 2
Ilościowe oznaczanie zawartości dwutlenku węgla w powietrzu
Cel i zakres ćwiczenia
Oznaczanie oparte jest na reakcji :
Ba(OH)2 + CO2 → BaCO3 + H2O (1 mol Ba(OH)2 reaguje z 1 molem CO2)
Na podstawie spadku przewodnictwa właściwego roztworu wodorotlenku barowego przed i po pochłonięciu CO2 oblicza się zawartość dwutlenku węgla.
Odczynniki i aparatura:
wodorotlenek barowy świeżo sporządzony o stężeniu około 0,01 mol/dm3
konduktometr
zestaw płuczek, aspirator
Wykonanie ćwiczenia
napełnić cztery płuczki o pojemności 150 cm3 mianowanym roztworem Ba(OH)2, połączyć szeregowo z aspiratorem i zatkać wylot zatyczką
zmierzyć przewodność właściwą wyjściowego roztworu Ba(OH)2 w jednej z płuczek
zdjąć zatyczki z płuczki i przepuścić przez płuczki 20 dm3 powietrza z szybkością 28dm3/h
zmierzyć przewodnictwo właściwe roztworu Ba(OH)2 w każdej z płuczek
Wyniki pomiarów:
Obliczenia
wodorotlenek sodowy o natężeniu 0,1 mol/dm3
konduktometr
otrzymany roztwór kwasu solnego i kwasu octowego o nieznanym stężeniu rozcieńczyć wodą destylowaną w kolbie miarowej do 100 cm3. Następnie pobrano do zlewki 20 cm3 tak przygotowanego roztworu i dodano 80 cm3 wody destylowanej
zlewkę z tak przygotowaną próbką umieścić na mieszadle magnetycznym i zmierzyć przewodnictwo
dodawać z biurety po 1 cm3 wodorotlenku sodowego o stężeniu 0,1 mol/dm3, mieszając po dodaniu każdej porcji i odczytać wartość przewodnictwa. Przed odczytaniem należy trzykrotnie wyjąć sondę pomiarową
miareczkowanie prowadzić do 6 - 7 punktów po przekroczeniu punktu końcowego (PK2!)
miareczkowanie wykonać dla kilku prób (najlepiej 5)
Dyskusja wyników:
Średnia arytmetyczna zbiorowości próbnej:
Wariacja zbiorowości próbnej
Odchylenie standardowe pojedynczego wyniku
Odchylenie standardowe średniej arytmetycznej
Względne odchylenie standardowe, charakteryzuje wielkość rozrzutu wyników
Przedział ufności:
Średnia arytmetyczna zbiorowości próbnej:
Wariacja zbiorowości próbnej
Odchylenie standardowe pojedynczego wyniku
Odchylenie standardowe średniej arytmetycznej
Względne odchylenie standardowe, charakteryzuje wielkość rozrzutu wyników
Przedział ufności:
Numer płuczki |
Przewodnictwo [mS] |
Stężenie Ba(OH)2 [mol/dm3] |
Roztwór podstawowy |
4,3 |
0,0088 |
Płuczka I |
3,2 |
0,0065 |
Płuczka II |
3,5 |
0,0071 |
Płuczka III |
3,6 |
0,0073 |
Płuczka IV |
3,8 |
0,0078 |
Obliczam różnicę stężeń roztworu Ba(OH)2 :
Płuczka I 0,0088 mol/dm3 - 0,0065 mol/dm3 = 0,0023 mol/dm3
Płuczka II 0,0088 mol/dm3 - 0,0071 mol/dm3 = 0,0017 mol/dm3
Płuczka III 0,0088 mol/dm3 - 0,0073 mol/dm3 = 0,0015 mol/dm3
Płuczka IV 0,0088 mol/dm3 - 0,0078 mol/dm3 = 0,0010 mol/dm3
Do płuczek wlano po 150 cm3 Ba(OH)2 można, więc obliczyć ilość moli dwutlenku węgla w każdej płuczce:
![]()
Płuczka I 0,0023 mol/dm3 ⋅ 0,15 dm3 = 0,000345 mola
Płuczka II 0,0017 mol/dm3 ⋅ 0,15 dm3 = 0,000255 mola
Płuczka III 0,0015 mol/dm3 ⋅ 0,15 dm3 = 0,000225 mola
Płuczka IV 0,0010 mol/dm3 ⋅ 0,15 dm3 = 0,00015 mola
Σ = 0,000975 mola
1 mol - 22,4 dm3 CO2
0,000975 mol - x dm3 CO2
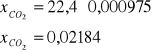
Procentowa zawartość CO2 w powietrzu wynosi:
28 dm3 powietrza - 100%
0,02184 dm3 CO2 - x%
![]()
x=0,078
Ćwiczenie K - 3
Konduktometryczne oznaczanie zawartości kwasu solnego i octowego w mieszaninie
1. Cel i zakres ćwiczenia
Konduktometryczne oznaczanie równocześnie występujących dwóch kwasów jest możliwe tylko wówczas, gdy różnią się one dość znacznie wartościami stałych dysocjacji (mają różną moc).
2. Czynniki i aparatura
3. Wykonanie ćwiczenia
4. Wyniki pomiarów:
VNaOH [cm3] |
Wartości przewodnictwa [mS] |
||
|
Pomiar I |
Pomiar II |
Pomiar III |
0 |
2,50 |
2,50 |
2,43 |
0,5 |
2,60 |
2,60 |
2,45 |
1,0 |
2,50 |
2,45 |
2,39 |
1,5 |
2,40 |
2,39 |
2,30 |
2,0 |
2,30 |
2,20 |
2,18 |
2,5 |
2,13 |
2,09 |
2,02 |
3,0 |
2,03 |
1,99 |
1,92 |
3,5 |
1,90 |
1,87 |
1,80 |
4,0 |
1,80 |
1,72 |
1,70 |
4,5 |
1,65 |
1,62 |
1,54 |
5,0 |
1,60 |
1,51 |
1,45 |
5,5 |
1,48 |
1,39 |
1,32 |
6,0 |
1,38 |
1,25 |
1,21 |
6,5 |
1,18 |
1,19 |
1,12 |
7,0 |
1,00 |
1,09 |
1,01 |
7,5 |
0,92 |
0,98 |
0,92 |
8,0 |
0,89 |
0,89 |
0,82 |
8,5 |
0,87 |
0,82 |
0,80 |
9,0 |
0,86 |
0,81 |
0,81 |
9,5 |
0,85 |
0,82 |
0,82 |
10,0 |
0,90 |
0,85 |
0,85 |
10,5 |
0,91 |
0,89 |
0,90 |
11,0 |
0,92 |
0,90 |
0,91 |
11,5 |
0,95 |
0,91 |
0,92 |
12,0 |
0,99 |
0,95 |
0,94 |
12,5 |
1,00 |
0,97 |
0,97 |
13,0 |
1,02 |
1,00 |
0,99 |
13,5 |
1,09 |
1,02 |
1,00 |
14,0 |
1,10 |
1,05 |
1,03 |
14,5 |
1,12 |
1,10 |
1,05 |
15,0 |
1,24 |
1,19 |
1,21 |
15,5 |
1,30 |
1,29 |
1,33 |
16,0 |
1,42 |
1,40 |
1,45 |
16,5 |
1,51 |
1,53 |
1,58 |
Jak widać z wykresów, pierwszy punkt końcowy (PK1) oznaczający koniec miareczkowania mocnego kwasu solnego (HCl) leży na pierwszym załamaniu krzywej miareczkowania. Ilość zużytego NaOH wynosi odpowiednio:
I 8,13 cm3
II 8,20cm3
III 8,10cm3
Drugi punkt końcowy (PK2) oznacza koniec miareczkowania kwasu octowego (CH3COOH). Ilość zużytego NaOH wynosi odpowiednio:
I 14,35cm3
II 14,50cm3
III 14,48cm3
PK1
![]()
![]()
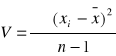
; n -1= k - liczba stopni swobody
![]()
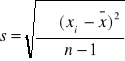
![]()
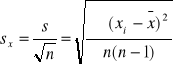
![]()
![]()
![]()
95% dla k = 2 tstudenta = 4,303
![]()
[ ]
![]()
[cm3]
PK2
![]()
![]()
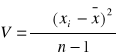
; n -1= k - liczba stopni swobody
![]()
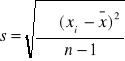
![]()
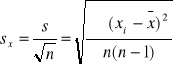
![]()
![]()
![]()
95% dla k = 2 tstudenta = 4,303
![]()
[ ]
![]()
[cm3]
Obliczam zawartość obu kwasów w mieszaninie:
NaOH + HCl → NaCl + H2O
NaOH + CH3COOH → CH3COONa + H2O
NaOH reaguje z obydwoma kwasami w stosunku 1 : 1, więc:
![]()
![]()
gdzie:
![]()
więc:
![]()
![]()
MHCl = 36,4609 g/mol
![]()
= 60,0534 g/mol
CNaOH = 0,1 mol/dm3
VNaOH (PK1) = 8,143±0,090cm3
VNaOH (PK2) = 14,443±0,142 cm3
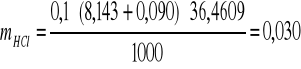
![]()
![]()
![]()
W badanej mieszaninie znajdowało się od 29 do 30 mg czystego HCl, oraz od 36 do 39 mg czystego CH3COOH.
6
Wyszukiwarka
Podobne podstrony:
Konduktometriaaa, NAUKA, chemia, lab
chemia10, NAUKA, chemia, lab
miareczkownie, NAUKA, chemia, lab
Równowaga w roztworach elektrolitów, NAUKA, chemia, lab
pat sciąga chemia zerówka, NAUKA, chemia, lab
Masa atomowa i cząsteczkowa, NAUKA, chemia, lab
Na ciała poruszające się w cieczy, NAUKA, chemia, lab
Oznaczenie miedzi, NAUKA, chemia, lab
grupy pierwsiatkow chemia, NAUKA, chemia, lab
adsorp, NAUKA, chemia, lab
chemia7, NAUKA, chemia, lab
chemia2, NAUKA, chemia, lab
Spektrofotometria S-3, NAUKA, chemia, lab
E -4, NAUKA, chemia, lab
Politechnika Białostocka, NAUKA, chemia, lab
więcej podobnych podstron