Adam Siry 29. III.1999
Sprawozdanie nr. 22
SPRAWDZANIE PRAW ELEKTROLIZY FARADAJA
Wstęp teoretyczny
Elektrolit - roztwór związku ulegający rozpadowi na jony; dysocjacja analityczna - rozpad spolaryzowanych cząsteczek na oddzielne jony; rekombinacja - zderzenie się jonów o przeciwnych znakach; stopień dysocjacji elektrolitu - stosunek liczby cząstek ulegających dysocjacji, do całkowitej liczby cząstek zawartych w elektrolicie; elektroliza - zjawisko przepływu prądu elektrycznego przez elektrolit i wydzielania się produktów rozkładu na elektrodach.
Pierwsze prawo Faradaja - masa substancji wydzielonej z elektrolitu na elektrodzie jest wprost proporcjonalna do natężenia przepływającego prądu oraz czasu.
Drugie prawo Faradaja - równoważnik elektro chemiczny substancji wydzielonej z elektrolitu jest wprost proporcjonalny do jej równoważnika chemicznego.
Przebieg ćwiczenia
podłączyć obwód według schematu
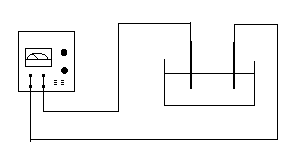
Sprawdzić poprawność obwodu elektrycznego zamykając obwód na krótki czas. Równocześnie regulować natężenie prądu w obwodzie, tak by gęstość nie przekraczała 0.5 A/dm3
Wyjąć katodę, oczyścić starannie papierem ściernym, wypłukać wodą. Wyznaczyć masę m1 katody korzystając z analitycznej wagi laboratoryjnej.
Umieścić ponownie katodę w elektrolicie, włączyć prąd uruchamiając jednocześnie zegar. Utrzymać stałą wartość natężenia prądu przez 30minut.
Po upływie tego czasu przerwać przepływ prądu. Opłukać katodę wodą, osuszyć i wyznaczyć masę m2 katody. Masę wydzielonej miedzi odliczyć ze wzoru m=m2-m1
Z układu okresowego pierwiastków odczytać masę atomową miedzi mCu , wartościowość miedzi w=2.
Wyniki i obliczenia
I |
M1 |
m2 |
m |
t |
k |
ΔK |
F |
ΔF |
[A] |
[kg] |
[kg] |
[kg] |
[s] |
[kg/A⋅s] |
|
|
|
0.25 |
0.04940 |
0.04954 |
0.00014 |
1800 |
0.0000003 |
0.00000000232 |
105910000 |
819037.3 |
m= m2-m1 = 0.000014
k=![]()
Δm=0.00001 kg
ΔI=0.0015 A
Δt=20 s
Δk=![]()
Δk=![]()
Δk=![]()
![]()
![]()
Δk= 0.000000002 + 0.00000000018 + 0.00000000034 = 0.00000000232
![]()
F=![]()
mCu (masa atomowa miedzi) - 63.546
w ( wartościowość miedzi) - 2
F=![]()
ΔF= ![]()
ΔF= ![]()
![]()
ΔF=![]()
![]()
IV.Wnioski
Wyszukiwarka
Podobne podstrony:
niepewnosc pomiarowa 15, Studia, Fizyka, LABORKI, fizyka-SPRAWOZDANIA GOTOWE, Fizyka ED1 Sprawozdani
więcej podobnych podstron