Kurs przygotowawczy do egzaminu maturalnego z chemii
MODUŁ 8P
Węglowodory
poziom podstawowy
Liceum Ogólnokształcące i Liceum Profilowane w Resku
PRZERÓBKA ROPY NAFTOWEJ
Stale rozwijająca się motoryzacja potrzebuje coraz większych ilości paliw do silników samochodowych. Zwiększeniu ilości produkowanej benzyny służy proces zwany krakingem, polegający na rozrywaniu długich łańcuchów węglowodorów - wchodzących w skład olejów - na łańcuchy krótsze, odpowiadające długością węglowodorom będącym składnikami benzyny.
Inny proces, mający na celu osiągnięcie określonego składy benzyny, nosi nazwę reformingu. Polega on na przemianie związków o prostych łańcuchach w związki
o łańcuchach rozgałęzionych i zamkniętych. Te pierwsze mają niskie liczby oktanowe,
a drugie odznaczają się wysokimi liczbami oktanowymi.
Liczba oktanowa paliwa informuje nas o jego odporności na detonacyjne spalania, objawiające się stukaniem silnika. Paliwo o wysokiej liczbie oktanowej spala się równomiernie i bez detonacji, co nie niszczy silnika.
Liczba oktanowa paliwa wynosząca X oznacza, że paliwo spala się tak jak mieszanina zawierająca X% 2,2,4-trometylopentanu o liczbie oktanowej równej 100 i (100 - X)%
n - heksanu o liczbie oktanowej równej zero.
Zadania
Wskaż, która z reakcji, opisanych podanymi równaniami, zachodzi podczas krakingu, a która podczas reformingu:
C18H38
C2H6 + C4H6 + C6H14 + C6H12
CH3 CH3
I I
CH3 - (CH2)5 - CH3
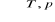
CH3 - C - CH - CH3
I
CH3
Oblicz, jaki procent undekanu C11H24 rozpada się na węglowodory nienasycone podczas krakingu:
C11H24 ![]()
C6H14 + C3H6 + CH4 + C
Zaproponuj wzory chemiczne związków, jakie można otrzymać, poddając heksan, z frakcji benzynowej, procesowi reformingu.
Wyjaśnij, co oznacza napis na dystrybutorze stacji benzynowej: etylina - 94.
Podaj, jaką liczbę oktanową ma benzyna, której właściwości przeciwstukowe i szybkość spalania są takie same, jak mieszaniny 14% n - heptanu i 86% 2,2,4 - trimetylopentanu. Podaj wzory półstrukturalne składników tej mieszaniny.
OBLICZENIA ZWIĄZANE Z WYPROWADZANIEM WZORÓW ZWIĄZKÓW ORGANICZNYCH NA PODSTAWIE ILOŚCI PRODUKTÓW ICH SPALANIA
Całkowite spalenie węglowodoru prowadzi do powstania dwutlenku węgla i pary wodnej. Z ilości tych produktów można obliczyć liczbę moli węgla i wodoru zawartych w spalanym węglowodorze i tym samum ustalić jego wzór elementarny (zwany też wzorem empirycznym).
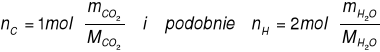
![]()
- masa CO2, [g]
![]()
- masa molowa CO2, [g/mol] ![]()
= 44 g/mol
![]()
- masa wody, [g]
![]()
- masa molowa wody [g/mol] ![]()
= 18 g/mol
Obliczone ilości moli węgla i wodoru przedstawia się w postaci proporcji (stosunku liczb), tak aby uzyskać liczby całkowite:
nC : nH = x : y
Otrzymujemy w ten sposób wzór elementarny (empiryczny): CxHy
Wzór elementarny często trzeba zwielokrotnić, aby uzyskać zgodność z masą molową węglowodoru lub innego związku organicznego:
CxHy - wzór elementarny (empiryczny)
(CxHy)z - wzór rzeczywisty związku organicznego
Wówczas liczbę Z wyznaczamy dzieląc masę molową związku przez masę molową wynikającą z wzoru elementarnego:
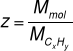
Przykład:
W wyniku spalenia próbki węglowodoru otrzymano 0,66 g CO2 i 0,27 g H2O.
Ustal: wzór elementarny i wzór rzeczywisty tego węglowodoru zakładając, że jego masa molowa wynosi 28 g/ml.
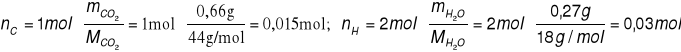
nC : nH = x : y = 0,015 : 0,03 = 15 : 30 = 1 : 2, z czego wynika wzór elementarny CH2
Z zależności 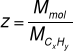
wynika, że 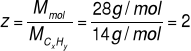
.
Wzór rzeczywisty to (CH2)2, czyli C2H4.
Odpowiedź: Wzór elementarny węglowodoru to CH2, a wzór rzeczywisty to C2H4.
Zadania:
W wyniku spalenia próbki węglowodoru o masie molowej 68 g/mol otrzymano 2,2 g CO2 I 0,72 g H2O. Ustal wzór rzeczywisty tego węglowodoru.
Po spaleniu próbki o masie 0,56 g węglowodoru o masie molowej 68 g/mol, otrzymano 1,76 g tlenku węgla(IV) I parę wodną. Ustal wzór tego węglowodoru.
OBLICZENIA ZWIĄZANE Z WYPROWADZANIEM WZORÓW ZWIĄZKÓW ORGANICZNYCH NA PODSTAWIE ZNAJOMOŚCI ICH WZORU OGÓLNEGO
Znajomość wzoru ogólnego dla danej grupy związków organicznych może być wykorzystana do ustalenia wzoru konkretnego związku należącego do tej grupy, jeśli znana jest także masa molowa tego związku.
Przykładowo, dla nasyconych alkoholi monohydroksykowych o wzorze
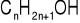
masa molowa wynosi: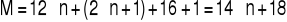
,
Znając wartość masy molowej M, można obliczyć n, a tym samym wyprowadzić wzór chemiczny tego alkoholu.
Przykład :
Ustal wzór chemiczny nasyconego kwasu monokarboksylowego, jeśli 1,56 g tego kwasu w reakcji z metalicznym sodem spowodowało wydzielenie 224 cm3 wodoru.
Obliczamy masę molową kwasu:
1,56 g 0,224 dm3
2 ROH + 2 Na → 2 RCOONa + H2
2 M 22,4 dm3
![]()
Wyznaczamy wzór chemiczny kwasu:
![]()
14n + 46 = 88 14n = 42 n = 3
Z tego wynika, że wzór kwasu to C3H7COOH. Jest to kwas masłowy (butanowy).
Zadania:
Ustal wzór chemiczny alkinu o masie molowej 54 g/mol.
Ustal wzór chemiczny alkanalu, którego masa molowa wynosi 72 g/mol.
Ustal wzór chemiczny jednonienasyconego kwasu organicznego monokarboksylowego, wiedząc, że jego masa molowa wunosi 100 g/mol.
ZADANIA MATURALNE
Informacja do zadania 1.
Dane są równania reakcji:
CH2 - CH - CH3 + Zn → CH2= CH - CH3 + ZnCl2,
I I
Cl Cl
CH3COOH + C2H5OH

CH3COOC2H5 + H2O
Zadanie 1. (2 pkt)
Z podanych równań reakcji A, B, C wybierz te, które przedstawiają reakcję substytucji
i reakcję eliminacji.
Zadanie 2. (3 pkt)
Jakie węglowodory powstają w wyniku reakcji metalicznego sodu z bromometanem oraz mieszaniną bromometanu i bromoetanu? Napisz równania zachodzących reakcji.
Zadanie 3. (1 pkt)
Wskaż poprawną nazwę poniższego związku:
CH3 - CBr - CH - C ≡ CH
I I
CH2 CH3
I
CH3
A. 3-bromo-3,4-dimetyloheks-5-yn B. 4-bromo-4-etylo-3-metylopent-1-yn
C. 4-bromo-3,4-dimetyloheks-1-yn D. 2-etylo-2-bromo-3-metylopent-4-yn
Zadanie 4. (2 pkt)
Metylobenzen (toluen) może reagować z bromem, tworząc w zależności od warunków różne produkty. Analizując równania reakcji zapisane poniżej, określ warunki (A) reakcji I i podaj wzór jednego z możliwych produktów (B) reakcji II.
Zadanie 5. (2 pkt)
Napisz wzory półstrukturalne (grupowe) dwóch alkanów zawierających 5 atomów węgla w cząsteczce.
Zadanie 6. (3 pkt)
W poniższej tabeli zestawiono temperatury topnienia n - alkanów pod ciśnieniem 1013 hPa.
Liczba atomów węgla w cząsteczce alkanu |
Temperatura topnienia [0C] |
10 |
- 30 |
15 |
10 |
20 |
36 |
Sporządź wykres zależności temperatury topnienia od liczby atomów węgla w cząsteczce. Na podstawie wykresu określ przybliżoną temperaturę topnienia n - alkanu o 12 atomach węgla w cząsteczce.
Zadanie 7. (4 pkt)
Zapisz równanie reakcji całkowitego spalania etanu i oblicz, ile dm3 tlenu, odmierzonych w warunkach normalnych, potrzeba do całkowitego spalenia jednego mola tego weglowodoru.
Zadanie 8. (1 pkt)
Wskaż poprawną nazwę węglowodoru o wzorze:
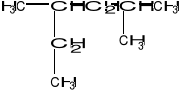
A. 2-etylo-4-metylopentan B. 2-metylo-4-etylopentan
C. 2,4-dimetyloheksan D. 3,5-dimetyloheksan
Informacja do zadań 9. i 10.
Dany jest ciąg reakcji opisany schematem:
CaC2 ![]()
A![]()
B![]()
C
Zadanie 9. (3 pkt)
Napisz wzory sumaryczne i nazwy systematyczne substancji A, B i C.
Zadanie 10. (3 pkt)
Napisz równania reakcji 1., 2. i 3. z powyższego schematu.
Zadanie 11. (1 pkt)
Napisz równanie reakcji powstawania CH3Cl z metanu i chloru.
Zadanie 12. (1 pkt.)
Reakcja chlorowania może być traktowana jako przykład reakcji redoks. Wskaż utleniacz w podanej reakcji substytucji: CH4 + Cl2 → CH3Cl + HCl
Zadanie 13. (3 pkt.)
W dwóch zbiornikach znajdują się: etan i eten. Zaprojektuj doświadczenie pozwalające na ich odróżnienie. W odpowiedzi podaj:
słowny opis przeprowadzonego doświadczenia,
obserwacje pozwalające na odróżnienie badanych substancji,
równanie wykorzystanych reakcji.
Zadanie 14. (2 pkt.)
W kopalniach węgla często dochodzi do wybuchu metanu.
Podaj właściwość chemiczną, która jest przyczyną tych wybuchów,
Wymień jedną właściwość fizyczną, która powoduje, że tak trudno jest wykryć ulatniający się metan.
Zadanie 15. (1 pkt)
Typowym przedstawicielem alkenów jest but-1-en. Napisz równanie reakcji addycji bromowodoru do but-1-enu (dla związków organicznych stosuj wzory półstrukturalne)
Zadanie 16. (3 pkt)
Dla równań chemicznych podanych w kolumnie A wybierz odpowiednia nazwę typu reakcji z kolumny B.
A |
B |
||
1. |
CH3-CH2OH → CH2=CH2 + H2O |
a. |
substytucja |
2. |
CH3-CH3 + Cl2 → CH3-CH2Cl + HCl |
b. |
polimeryzacja |
3. |
n CH2=CH2 → -[-CH2-CH2-]-n |
c. |
kondensacja |
------------------------------------------------------- |
d. |
eliminacja |
|
Zad. 17. Zadanie 24. (1 pkt)
Wskaż poprawną nazwę związku o wzorze:
Cl CH3
I I
CH3 - CH = C - CH - CH3
I
CH2
I
CH3
4-chloro-5-etylo-3-metyloheks-2-en, B. 4-chloro-3,5-dimetylohept-5-en,
C. 3-chloro-4,4-dimetyloheks-2-en, D. 3-chloro-2-etylo-4-metyloheks-4-en.
Informacja do zadań 25. i 26.
Mieszaninę gazów o objętości 900 cm3 składającą się z etanu i propenu przepuszczono przez płuczkę zawierającą wodny roztwór bromu. Po przejściu przez płuczkę objętość gazu zmniejszyła się i wynosiła 270 cm3.
Zadanie 18. (2 pkt)
Wyjaśnij, dlaczego objętość gazu uległa zmniejszeniu po przejściu przez płuczkę z wodą bromową. Odpowiedź uzasadnij, zapisując odpowiednie równanie reakcji chemicznej.
Zadanie 19. (3 pkt)
Oblicz, ile dm3 propenu i ile gramów etanu zawierała mieszanina gazów w warunkach normalnych.
Zadanie 20. (1 pkt)
Które z przedstawionych równań reakcji ilustrują reakcję addycji (przyłącania)?
CH3 - CH2 - CH3 + Cl2
CH2Cl - CH2 - CH3 + HClCH2 = CH2 + H2
CH3 - CH3C2H5Cl + NaOH
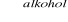
CH2 = CH2 + NaCl + H2OC6H6 + 3 H2
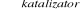
C6H12
Zadanie 21. (2 pkt)
Oblicz, ile dm3 tlenu odmierzonego w warunkach normalnych należy użyć do spalenia węglowodoru C4H8 (zgodnie z równaniem reakcji podanej w informacji wstępnej), aby otrzymać 10 moli CO2.
Zadanie 22. (2 pkt)
Narysuj wzór półstrukturalny (grupowy) jednego izomeru węglowodoru o wzorze sumarycznym C4H8 i podaj jego nazwę systematyczną.
Zadanie 23. (1 pkt)
Tabela przedstawia wzory czterech homologów węglowodorów nasyconych
n-alkanów oraz ich temperatury wrzenia.
wzór sumaryczny |
CH4 |
C2H6 |
C3H8 |
C4H10 |
temperatura wrzenia |
- 162 0C |
- 89 0C |
- 42 0C |
- 0,5 0C |
Na podstawie danych zawartych w tabeli napisz ogólną zależność pomiędzy długością łańcucha alkanów a temperaturą wrzenia.
Zadanie 24. (4 pkt)
Poniżej podano dwa określenia używane w chemii organicznej:
Związki o tym samym wzorze ogólnym, podobnej budowie i właściwościach, których kolejne cząsteczki różnią się o grupę metylenową.
Związki o tym samym składzie jakościowym i ilościowym, ale różnej budowy cząsteczek.
Napisz, co definiują określenia,
Na podstawie ogólnego wzoru węglowodorów nienasyconych CnH2n podaj po jednym przykładzie związków dla definicji I i II (napisz ich wzory półstrukturalne i nazwy systematyczne).
Zadanie 25. (1 pkt)
Węglowodór o nazwie 3-metylobut-1-en poddano reakcji z bromowodorem. Podaj wzór półstrukturalny i nazwę produktu głównego.
Zadanie 26. (3 pkt)
Połącz w pary słowny opis reakcji (oznaczony cyfrą) z typem procesu (oznaczonym literą).
1. |
Reakcja etenu z chlorem |
A. |
substytucja |
2. |
Reakcja benzenu z mieszaniną nitrującą |
B. |
eliminacja |
3. |
Reakcja wielu cząsteczek etenu przeprowadzona w optymalnych warunkach ciśnienia i temperatury |
C. |
addycja |
|
|
D. |
polimeryzacja |
4. |
Reakcja dwóch cząsteczek glicyny |
E. |
kondensacja |
Zadanie 27. (2 pkt.)
Połącz w pary równanie reakcji (oznaczone cyfrą) z odpowiednim typem procesu (oznaczonym literą)
typ procesu |
równanie reakcji |
||
A. |
substytucja |
1. |
CH3-CH2-OH |
B. |
kondensacja |
2. |
C2H4 + Cl2 |
C. |
addycja |
3. |
C2H6 + Br2 |
D. |
eliminacja |
|
|
Zadanie 28. (1 pkt.)
Przedstawione równanie reakcji: n CH2=CH2 ![]()
(-CH2-CH2-)n
przedstawia proces, który nazywamy :
substytucją,
polimeryzacją,
eliminacją,
polikondensacją.
Zadanie 29. (3 pkt.)
W dwóch nieoznakowanych cylindrach znajdują się etan i eten. Zaprojektuj doświadczenie pozwalające na rozróżnienie tych węglowodorów. Napisz wzór odczynnika, którego użyjesz do identyfikacji, przewidywane obserwacje oraz sformułuj wniosek.
Zadanie 30. (1 pkt.)
Wskaż wzór związku, który nie jest homologiem benzenu:
A. B. C. D.
Zadanie 31. (1 pkt.)
Wskaż poprawny wzór 3,3-dimetylobut-1-ynu.
CH3 CH3
l l
A. HC≡C-CH-CH3 B. HC≡C-C-CH3 C. CH3-C≡C-CH-CH3 D. C≡C-CH-CH3
l l l
CH3 CH3 CH3
Zadanie 32. (1 pkt.)
Wiedząc, że ropa naftowa jest mieszaniną węglowodorów mających różne temperatury wrzenia, zaproponuj metodę, którą zastosujesz do rozdzielenia tej mieszaniny.
Zadanie 33. (1 pkt.)
Wskaż, które równanie przedstawia reakcję addycji:
C2H5Cl → C2H4+ HCl
C2H4 + Cl2 → C2H4Cl2
C2H6 + Br2
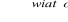
C2H5Br + HBrC2H5Br + Br2
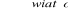
C2H4Br2 + HBr
Zadanie 34. (2 pkt.)
Napisz wzory półstrukturalne (grupowe) dwóch alkenów zawierających 4 atomy węgla w cząsteczce oraz podaj ich nazwy systematyczne.
Zadanie 35. (3 pkt.)
Napisz wzory półstrukturalne (grupowe) trzech alkinów zawierających 5 atomów węgla
w cząsteczce oraz podaj ich nazwy systematyczne.
Zadanie 36. (3 pkt.)
Stosując wzory półstrukturalne, napisz równania reakcji opisanych poniżej przemian:
całkowitego spalania metanu,
etenu z bromem,
benzenu z chlorem w obecności katalizatora.
Zadanie 37. (3 pkt)
Napisz równanie reakcji całkowitego spalania propanu i oblicz, ile dm3 tlenu odmierzonego w warunkach normalnych potrzeba do całkowitego spalenia 3 moli tego węglowodoru.
Zadanie 38. (1 pkt)
W wyniku addycji z chlorem pewnego węglowodoru otrzymano 1,1,2,2-tetrachloroetan. Węglowodorem tym był:
etan, B. eten, C. acetylem, D. etylen.
Zadanie 39. (4 pkt)
Acetylen jest ważnym surowcem w syntezie organicznej.
Wykonaj rysunek przedstawiający sposób laboratoryjnego otrzymywania acetylenu. Zaznacz wzory reagentów.
Zapisz równanie zachodzącej reakcji.
Podaj wzór elektronowy cząsteczki acetylenu.
Zadanie 40. (1 pkt)
Wskaż produkt uwodornienia but-2-enu:
n-butan,
cis-2-but-2-en,
but-2-yn,
cyklobutan.
Zadanie 41. (1 pkt)
Wskaż substancję, która nie jest związkiem aromatycznym:
ksylen,
etylobenzen,
metylocykloheksan,
anilina.
Zadanie 42. (1 pkt)
Wskaż grupę związków, w której występują tylko węglowodory nienasycone:
C2H2, CH4, C3H8,
C3H8, C4H8, C3H6,
C2H2, C2H4, C3H6,
C3H8, C2H2, C4H8.
Zadanie 43. (4 pkt)
Ropa naftowa jest mieszaniną ciekłych, gazowych i stałych węglowodorów. Stanowi ona nie tylko źródło energii, ale także surowiec do otrzymywania wielu cennych produktów mających zastosowanie w syntezie organicznej. Zdefiniuj następujące pojęcia:
destylacja frakcyjna ropy naftowej,
kraking katalityczny,
reforming katalityczny,
liczba oktanowa.
Zadanie 44. (1 pkt)
Wskaż związek, którego użyjesz, aby otrzymać propen.
A. Na2CO3 B. C3H7OH C. CaC2 D Al4C3 E. E. PVC
Zadanie 45. (4 pkt)
Gazowy węglowodór o gęstości 2,59 g/dm3 (warunki normalne) zawiera 82,76% węgla. Podaj jego wzór rzeczywisty, a także wzory półstrukturalne i nazwy systematyczne jego izomerów.
Zadanie 46. (1 pkt)
Reakcja toluenu z chlorem przebiega zgodnie z równaniem:
C6H5CH3 + Cl2 ![]()
C6H5CH2Cl + HCl
jest reakcją:
A. podstawienia elektrofilowgo B. addycji C. substytucji D. estryfikacji
Zadanie 47. (4 pkt) [zadanie 2. i 3. z zakresu następnego modułu]
Dokończ równania reakcji i podaj nazwy systematyczne produktów.
CH3-C=CH2 + Br2 →
I
CH3
CH3-CH-CH3
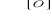
I
OH
CH3-C=O
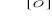
I
H
CH2=CH2 + H2O
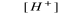
Zadanie 48. (2 pkt)
Oblicz wzór elementarny węglowodoru, który spalony w tlenie tworzy CO2 i H2O,
a masowa zawartość CO2 w mieszaninie poreakcyjnej jest równa 61,97%. Załóż, że reagenty zmieszano w stosunku stechiometrycznym.
Zadanie 49. (2 pkt)
Przyporządkuj pojęciom z kolumny I odpowiednio wybrane pojęcia z kolumny II:
kolumna I |
kolumna II
|
||
1. |
izomery konstytucyjne |
a |
Związki, które mają ten sam wzór sumaryczny, a różnią się budową cząsteczek |
2. |
izomery |
b |
To grupa związków o podobnej budowie i właściwościach, których cząsteczki różnią się o jedną lub więcej grup -CH2- |
3. |
szereg homologiczny |
c |
Różnią się kolejnością i sposobem powiązania atomów w cząsteczce |
|
|
d |
To liczba atomów węgla związana z rozpatrywanym atomem węgla |
|
|
e |
To substancje, których cząsteczki mają budowę pierścieniową i zawierają wiązania zdelokalizowane |
Zadanie 50. (3 pkt)
Określ rodzaj każdej z poniższych reakcji:
reakcja chlorowodoru z etenem,
otrzymywanie etenu z etanolu,
reakcja bromu z benzenem.
Węglowodory - poziom podstawowy - rozwiązania
Zad. 1. Reakcja substytucji: C lub B lub C i B
Reakcja eliminacji: A.
Zad. 2. CH3Br + CH3Br + 2 Na → CH3 - CH3 + 2 NaBr
CH3Br + CH3 - CH2Br + 2 Na → CH3 - CH2 - CH3 + 2 NaBr
Poprawny zapis współczynników w obu równaniach
Zad. 3. D (lub A)
Zad. 4. - za wskazanie warunku A reakcji: światło i ciepło lub światło lub ciepło lub temperatura lub hv(światło)
- za pdanie wzoru produktu B:
oprócz wzorów grupowych (półstrukturalnych) dopuszcza się również wzór z zaznaczonym zdelokalizowanym sekstetem elektronowym lub zapis C6H4CH3Br
Zad. 5. Za każdy wzór - 1 pkt
Zad. 6. Za sporządzenie wykresu - pkt, za odczytanie temperatury topnienia - około - 100C. Wynik powinien być zgodny z wykonanym wykresem.
Zad. 7. 2 C2H6 + 7 O2 → 4 CO2 + 6 H2O. Za równanie - 1 pkt, za współczynniki - 1 pkt
Za obliczenie objętości tlenu (78,4 dm3). Dowolną prawidłową metodą
Zad. 8. C
Zad. 9. substancja A: C2H2 etyn (lub acetylen)
substancja B: C2H4 eten (lub etylen) lub C2H6 etan
substancja C: C2H5Cl chloroetan
Zad. 10. reakcja 1: CaC2 + 2H2O → C2H2 + Ca(OH)2
reakcja 2: C2H2 + H2 → C2H4 lub C2H2 + 2H2 → C2H6
reakcja 3: C2H4 + HCl → C2H5Cl
Zad. 11. CH4 + Cl2 → CH3Cl + HCl
Zad. 12. chlor lub Cl2 (zapis Cl należy uznać za błędny)
Zad. 13. opis, np.: przez naczynie zawierające wodę bromową lub roztwór manganianu(VII) potasu przepuszczamy badane gazy
obserwacje, np.: zachodzi odbarwienie wody bromowej lub zmiana zabarwienie KMnO4/ wytrąca się brunatny osad
reakcja: CH2 = CH2 + Br2 → CH2Br - CH2Br
Zad. 14. właściwość chemiczna: łatwopalny, z powietrzem tworzy mieszaninę wybuchową
właściwość fizyczna: bezbarwny, bezwonny, bez zapachu
Zad. 15. CH3-CH2-CH=CH2 + HBr → CH3-CH2-CHBr-CH3
Zad. 16. 1 -d, 2 - a, 3 - b.
Zad. 17. C
Zad. 18. np.: zmniejszenie objętości mieszaniny gazów spowodowane było reakcją propenu (alkenu, węglowodoru nienasyconego) z bromem
CH2=CH-CH3 + Br2 → CH2Br-CHBr-CH3
Zad. 19. objętość propenu: V = 0,63 dm3
masa molowa etanu: M = 30 g/mol
masa etanu: m = 0,36 g
Zad. 20. B i D
Zad. 21. Np.: 6 · 22,4 dm3 tlenu utworzy 4 mole CO2
V dm3 tlenu utworzy 10 moli CO2 V = 336 dm3
Zad. 22. , np.: but-2-en, CH3-CH=CH-CH3
Zad. 23. ze wzrostem długości łańcucha rośnie temperatura wrzenia n-alkanów
Zad. 24. a) I - definicja szeregu homologicznego, II - definicja izomerów
b) np.: CH2=CH2 eten i CH2=CH-CH3 propen to homologi
np.: CH2=CH-CH2-CH3 but-1-en, CH3-CH=CH-CH3 but-2-en to izomery
Zad. 25. Produkt główny: CH3-CH-CH-CH3
I I
Br CH3
2-bromo-3-metylobutan
Zad. 26. 1 - C, 2 - A, 3 - D, 4 - E
Zad. 27. 1 - D, 2 - C, 3 - A.
Zad. 28. B
Zad. 29. wzór odczynnika, np.: Br2(aq) ;
obserwacja, np.:w jednym cylindrze intensywna barwa wody bromowej zniknęła, w drugim nie zaobserwowano odbarwienia (lub nie zaobserwowano żadnych zmian);
wniosek, np.: w cylindrze, w którym nastąpiło odbarwienie wody bromowej, znajduje się eten, a w cylindrze, w którym nie zaobserwowano zmian - etan.
Zad. 30. D
Zad. 31. B
Zad. 32. metoda destylacji
Zad. 33. B
Zad. 34. np.: CH2=CH-CH2-CH3 but-1-en, CH3-CH=CH-CH3 but-2-en
Zad. 35. np.: CH≡C-CH2-CH2-CH3 pent-1-yn, CH3-C≡C-CH2-CH3 pent-2-yn,
CH≡C-CH-CH3 3-metylobut-1-yn
I
CH3
Zad. 36. 1) CH4 + 2 O2 → CO2 + 2 H2O, 2) CH2=CH2 + Br2 → CH2Br-CH2Br
3) .
+ Cl2 →
+ HCl
Zad. 37.
3 mole V
C3H8 + 5 O2 → 3 CO2 + 4 H2O ![]()
1 mol 5·22,4 dm3
Zad. 38. C
Zad. 39. schemat doświadczenia
reakcja CaC2 + 2 H2O → Ca(OH)2 + C2H2
wzór elektronowy: H··![]()
··H lub H-C≡C-H
Zad. 40. A
Zad. 41. C
Zad. 42. C
Zad. 43. a) rozdzielenie ropy naftowej na grupy składników (frakcje) z wykorzysta-niem różnic temperatur wrzenia.
b) proces polegający na katalitycznym rozpadzie długich łańcuchów węglowych na krótsze fragmenty.
c) izomeryzacja łańcuchów prostych do rozgałęzionych oraz odwodornienie prowadzące do cyklizacji i aromatyzacji.
d) miara odporności benzyny na tzw. spalanie detonacyjne. Im wyższa liczba oktanowa, tym mieszanka paliwowa spala się bardziej równomiernie.
Zad. 44. B
Zad. 45. Za obliczenie masy molowej związku:
2,59g zajmuje objętość 1 dm3
M g zajmuje objętość 22,4 dm3 M = 58 g/mol
Za obliczenie masy węgla i wodoru:
mC = 82,76% · 58 g = 48 g - stanowi to 4 mole węgla,
mH = 58 g - 48 g = 10 g - stanowi to 10 moli wodoru wzór: : C4H10
Zad. 46. C
Zad. 47. 1) 1,2-dibromo-2-metylopropan, 2) propan-2-on, 3) kwas etanowy, 4) etanol
Zad. 48. CH4
Zad. 49. 1 - c, 2 - a, 3 - b. Za dwie odpowiedzi - 1 pkt, za trzy - 2 pkt.
Zad. 50. I - addycja, II - eliminacja, III - substytucja
Zad. 51. a) CH2=CH-CH2-CH3 + H2O → CH3-CH(OH)-CH2-CH3
b) ) CH3-C=CH3 + HCl → CH3-CCl-CH2-CH3
I I
CH3 CH3
8
Wyszukiwarka
Podobne podstrony:
04 - Stechiometria, chemia, matura podstawowa
00 - Tabele wstępne, chemia, matura podstawowa
06 - Reakcje chemiczne, chemia, matura podstawowa
WIELOFUNKCYJNE POCHODNE WĘGLOWODORÓW, CHEMIA MATURA, ĆWICZENIA
MATURA PODSTAWOWA CHEMIA ODPOWIEDZI
chemia - węglowodory, Liceum Matura, Chemia, Chemia(1)
Węglowodory not, Matura Chemia Rozszerzona, Podręczniki, Notatki
2004-12-01 - odp, Matura, matura, Chemia - Matura, Chemia - matura testy
08 Węglowodany redukcyjność
08 Zabiegi resuscytacyjne u dzi Podstawowe Zabiegi Resuscytacyj
weglowod, Chemia, Liceum, klasa II
więcej podobnych podstron