WSTĘP TEORETYCZNY
Zastosowanie koagulacji w procesie oczyszczania wód:
Jest to metoda oczyszczania wód powierzchniowych, rzadziej infiltracyjnych lub podziemnych. Jest to metoda oczyszczania wód zawierających koloidy oraz zawiesiny trudno opadające. Gdy wartość indeksu mętności Im jest < 0,5, to w wodzie obecne są zawiesiny trudno opadające , do usunięcia których wymagana jest koagulacja.
W wyniku koagulacji usuwane są z wody cząstki trudno opadające oraz koloidalne decydujące o mętności wody lub intensywności jej barwy. Wśród koloidów powodujących mętność dominują koloidy hydrofobowe( np. cząstki zawiesin nieorganicznych i bezwodne tlenki metali), zaś wśród decydujących o intensywności barwy-koloidy hydrofilowe( np. cząstki organiczne zawieszone, żywe i martwe mikroorganizmy oraz uwodnione tlenki metali).
Właściwie przebiegająca koagulacja zapewnia nie tylko duży stopień usuwania koloidów i zawiesin trudno opadających, ale również zasocjowanych z nimi innych zanieczyszczeń, w tym również mikrozanieczyszczeń. Tak więc efektem skutecznej koagulacji jest zmniejszenie mętności, intensywności barwy oraz wielu mikrozanieczyszczeń.
Koagulacja solami glinu i żelaza zapewnić może również duży stopień usuwania metali ciężkich. Efektywność takiego procesu głównie zależy od rodzaju metalu, głównie jego formy występowania w wodzie, rodzaju i dawki koagulanta, składu fizyczno-chemicznego wody, a przede wszystkim wartości pH.
Mechanizm procesu koagulacji:
Koagulację zoli można spowodować przez:
Dodanie koloidu, który zmniejsza potencjał elektrokinetyczny i ułatwia aglomerację koloidów obecnych w wodzie,
Dodanie koloidu o znaku przeciwnym do znaku koloidów obecnych w oczyszczanej wodzie,
Działanie promieniami β i γ ,
Ogrzewanie,
Działanie mechaniczne, np. wytrząsanie,
Dehydratację spowodowaną środkami odwadniającymi,
Wymrażanie
W oczyszczaniu wód praktyczne znaczenie mają dwie pierwsze metody, których wykorzystanie wymaga dodawania do oczyszczonej wody koloidów lub elektrolitów. Bardzo rzadko istnieje możliwość wykorzystania koloidów o odmiennym ładunku obecnych w innej wodzie, która mogłaby być zmieszana z wodą oczyszczaną, dając wystarczający efekt koagulacji.
W praktyce koagulację prowadzi się koagulantami, których produkty hydrolizy powodują koagulację elektrolitem oraz koagulację koloidem o znaku przeciwnym.
Koagulacja zachodzi w dwóch fazach:
W pierwszej- występuje bezpośredni po dodaniu koagulanta, trwającej sekundy, przebiegają reakcje fizyczne i chemiczne prowadzące do destabilizacji cząstek koloidalnych,
W drugiej- trwa znacznie dłużej, zwana jest flokulacją, w wyniku transportu i zderzeń cząstek zdestabilizowanych powstają kłaczki, które mogą być skutecznie usuwane z wody w procesach sedymentacji/flotacji i filtracji.
W wyniku właściwie przebiegającej koagulacji cząstek powodujących mętność wody powstają zwarte, ciężkie i dobrze sedymentujące kłaczki. Na ogół przy oczyszczaniu wód mętnych nie jest wymagane stosowanie obciążników. Warunkiem dobrych efektów koagulacji jest zastosowanie optymalnej ilości koagulanta oraz zapewnienie zasadowości wody niezbędnej do hydrolizy dodanego koagulanta hydrolizującego.
Równoczesna obecność koloidów powodujących barwę wody zwykle zwiększa wymaganą dawkę koagulanta. Wynika to stad, że zanieczyszczenia organiczne mają większą aktywność chemiczną i dopiero po ich całkowitej destabilizacji ma miejsce destabilizacja koloidów nieorganicznych powodujących mętność.
Podczas usuwania wód barwnych istnieje konieczność usuwania głównie substancji humusowych, naturalnych barwnych domieszek organicznych, które w środowisku kwaśnym lub obojętnym występują głównie jako ujemne koloidy
Stosowane koagulanty:
O wyborze koagulanta decyduje przede wszystkim jego przydatność do koagulowania usuwanych koloidów oraz pewność tworzenia trwałych, trudno rozpuszczalnych i podatnych na usuwanie z wody kłaczków. Ważne są również łatwość przygotowania roztworów i ich dawkowania, trwałość chemiczna roztworów koagulanta, dostępność na rynku oraz ich ocena.
Do koagulantów najczęściej stosowanych w oczyszczaniu wody należą sole glinu i żelaza tworzące w wyniku hydrolizy dodatnio naładowane połączenia skutecznie destabilizujące zanieczyszczenia koloidalne obecne w oczyszczonej wodzie. Do związków tych należą:
Siarczan glinowy: Al2(SO4)3 × 18 H2O
Siarczan glinowo-potasowy: Al2(SO4)3 × K2SO4 × 24 H2O
Siarczan żelazowy: Fe2(SO4)3 × 9 H2O
Siarczan żelazawy: FeSO4 × 7 H2O
Spolimeryzowany chlorek glinowy
Glinian sodowy: Na2Al2O4
Chlorek żelazowy: FeCl3 × 6 H2O
W Polsce najczęściej stosowanym koagulantem jest techniczny siarczan glinowy, zawierający 17% Al2O3. Może on być stosowany do usuwania zarówno barwy jak i mętności. Nie jest zalecany do usuwania glonów, ponieważ powstające kłaczki są zbyt lekkie i należałoby je sztucznie zmętniać wodą. Koagulant ten jest dość wrażliwy na niską temperaturę wody, jednak koagulacja w optymalnym zakresie pH znacznie zmniejsza wpływ temperatury.
Innym koagulantem glinowym jest glinian sodowy. Jest on szczególnie przydatny w oczyszczaniu wód miękkich i mających niską temperaturę. Dodatkową jego zaletą jest to, że nie powoduje on wzrostu stężenia siarczanów lub chlorków, co jest istotne w wypadku oczyszczania wód do niektórych celów przemysłowych.
Biorąc pod uwagę związki żelaza- można stwierdzić, że są one koagulantami na ogół tańszymi niż koagulanty glinowe. Są one mniej wrażliwe na niskie temperatury wody. Są skuteczne w szerszym przedziale pH, a powstające kłaczki są ciężkie i dobrze sedymentują. Ich wadą jest jednak to, że należy je ograniczać w stosowaniu do usuwania zanieczyszczeń barwnych, z którymi mogą tworzyć barwne i rozpuszczalne w wodzie związki kompleksowe.
Do oczyszczania takich wód można stosować koagulant mieszany, tj. mieszaninę soli glinu i żelaza.
Spośród dostępnych i najtańszych w kraju jest siarczan żelazawy FeSO4 × 7 H2O.
Dawki koagulantów:
Dawki koagulantów powinny być wyznaczone dla każdego przypadku doświadczalnie. Orientacyjne wielkości dawek technicznego uwodnionego siarczanu glinowego ( D, g/m3) można obliczyć ze wzoru:
D= (6-8) ![]()
, lub
D= 7![]()
.
W wypadku występowania równocześnie podwyższonej intensywności barwy (B) i mętności (M), należy przyjmować dawkę większą.
Dokładniej wielkość dawki koagulanta można wyliczać ze wzorów:
Dla n ≠ 1:
D= 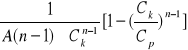
Dla n = 1:
D= 
Wyznaczona doświadczalnie dawka koagulanta i to najmniejsza jego ilość, która zapewnia największy stopień usuwania zanieczyszczeń z wody, jest dawką optymalną. Ponieważ o stopniu wykorzystania koagulanta decyduje pH wody, w badaniach należy wyznaczyć również optymalną wartość pH prowadzenia procesu. Jeżeli koagulacja będzie prowadzona przy korygowanej wartości pH, to dla ustalonej wartości pH ponownie należy określić optymalną dawkę koagulanta.
Substancje wspomagające koagulację:
Ich zadaniem jest przyspieszenie powstania kłaczków i ich sedymentacji, zwiększenie powierzchni właściwej kłaczków, a więc ich pojemności sorpcyjnej, zmniejszenie optymalnego dla koagulacji zakresu pH i zmniejszenie dawki koagulanta.
Substancjami wspomagającymi koagulację mogą być substancje nieorganiczne lub organiczne, a dawkowane są do wody równocześnie, z opóźnieniem lub wyprzedzeniem w stosunku do czasu dawkowania koagulanta podstawowego. Dawki substancji wspomagających są mniejsze niż dawki koagulantów.
Chemizm koagulacji:
Dodane do oczyszczonej wody koagulanty ulegają dysocjacji, a następnie hydrolizie. Ponieważ kationy stosowanych soli są wielowartościowe, hydroliza przebiega wielostopniowo.
Przebieg dysocjacji i hydrolizy soli glinu na przykładzie siarczanu glinowego:
Al2(SO4)3 → 2Al3+ + 3SO42- (dysocjacja)
2Al3+ + 2H2O ⇔ 2Al(OH)2+ + 2H+ (I stopień hydrolizy)
2Al(OH)2+ + 2 H2O ⇔ 2Al(OH)2+ + 2H+ ( II stopień hydrolizy)
2Al(OH)2 + 2 H2O ⇔ 2Al(OH)3 + 2H+ ( III stopień hydrolizy)
Al2(SO4)3 + 6 H2O ⇔ 2Al(OH)3 + 6 H+ + 3SO42- |
Sole żelazowe hydrolizują analogicznie.
Nieco inny jest chemizm soli żelazawych (II), w których produktem hydrolizy jest Fe(OH)2, a hydroliza jest dwustopniowa:
FeSO4 → Fe2+ + SO42- ( dysocjacja)
Fe2+ + H2O ⇔ Fe(OH)+ + H+ ( I stopień hydrolizy)
Fe(OH)+ + H2O ⇔ Fe(OH)2 + H+ ( II stopień hydrolizy)
FeSO4 + 2H2O ⇔ Fe(OH)2 + SO42- + 2H+ |
Sposoby prowadzenia koagulacji:
Koagulacja może być realizowana jako objętościowa, kontaktowa i powierzchniowa. W koagulacji objętościowej i kontaktowej- pierwszym etapem jest dodanie do oczyszczanej wody koagulanta, całkowite wymieszanie zapewniające jednorodność układu oczyszczania woda-koagulant oraz hydroliza koagulanta. Uzyskuje się to najczęściej w komorach szybkiego mieszania, a czas mieszania wynosi 1-3 min. Drugim etapem koagulacji jest flokulacja, w której zachodzą zjawiska prowadzące do powstania aglomeratów produktów dysocjacji i hydrolizy koagulanta z usuwanymi zanieczyszczeniami. W koagulacji objętościowej ta faza procesu jest realizowana w komorach wolnego mieszania, zaś w koagulacji kontaktowej w warstwie osadu zawieszonego.
Koagulacja powierzchniowa może być realizowana w złożu filtrów pospiesznych, przy przepływie oczyszczanej wody przez złoże filtracyjne w kierunku z góry na dół lub odwrotnym. W tym ostatnim przypadku proces nazywany jest filtracją kontaktową. Podczas koagulacji powierzchniowej produkty hydrolizy koagulantów powstają w oczyszczanej wodzie wypełniającej ośrodek porowaty oraz na powierzchni ziaren materiału filtracyjnego tworząc strukturę sieciową wypełniającą pory złoża. W tym rozwiązaniu koagulant może być dawkowany do wody bezpośrednio przed złożami, lub wcześniej do komór szybkiego mieszania. Dawkowanie koagulantów tuż przed złożem filtracyjnym zapewnia lepsze efekty oczyszczania i eliminuje komory szybkiego mieszania z układu urządzeń.
OBLICZENIA
W przeprowadzonym ćwiczeniu użyłyśmy następujące koagulanty:
siarczan żelaza (II)
glinian sodowy
siarczan glinowy
PIX 112
Obliczamy ilość koagulantu, jaką należy dodać do 1 dm3 wody surowej, dotyczy to glinianu sodowego i PIX 112. Należy również uwzględnić rozcieńczenie 1:10 roztworu podstawowego.
GLINIAN SODOWY
102g Al2O3 - 54g Al.
x - 2![]()
10-3 g Al.
x = 0,0038g Al2O3
100gglinianu - 18g Al2O3
y - 0,0038g Al2O3
y = 0,021g
y = 0,021g glinianu sodowego
V = ![]()
= ![]()
= 0,014 cm3
gdzie:
y - masa roztworu podstawowego [g];
d - gęstość roztworu podstawowego [g/cm3];
V - objętość roztworu podstawowego [cm3].
Ze względu na rozcieńczenie 1:10 roztworu podstawowego (glinianu sodowego) do 1dm3 wody surowej dawkujemy 0,14cm3 koagulantu rozcieńczonego.
PIX 112
100g - 11,65g Fe
x - 2![]()
10-3 g Fe
x = 0,017g
x = 0,017g PIX 112
V = ![]()
= 0,011cm3
gdzie:
x - masa roztworu podstawowego [g];
d - gęstość roztworu podstawowego [g/cm3];
V - objętość roztworu podstawowego [cm3].
Ze względu na rozcieńczenie 1:10 roztworu podstawowego (PIX 112) do 1dm3 wody surowej dawkujemy 0,11cm3 koagulantu rozcieńczonego.
Do wody surowej dawkujemy po 2cm3 SIARCZANU ŻELAZA (II) i 2cm3 SIARCZANU GLINOWEGO.
Pierwszą czynnością, którą wykonujemy jest badanie wody surowej. Określamy jej pH, mętność, barwę i utlenialność.
pH (odczytujemy na urządzeniu zwanym pH-metrem) - 9,1
MĘTNOŚĆ (określamy na podstawie wzorców mętności)
15 mg SiO2/dm3
BARWA - 50 mg Pt/dm3
UTLENIALNOŚĆ
Do kolb stożkowych odmierzamy odpowiednio:
- dla wody destylowanej (próba zerowa) : 100 cm3 wody
destylowanej,
do badanej próby bierzemy 10 cm3 wody surowej i dopełniamy 90 cm3 wodą destylowaną.
Przy miareczkowaniu zużyłyśmy: 0,3 cm3 KMnO4 w próbie zerowej i 3,0 cm3 KMnO4 w wodzie badanej. Utlenialność obliczamy ze wzoru:
X = ![]()
mg O2/dm3
X = 27 mg O2/dm3
Następnie do czterech reaktorów o pojemności 2dm3 nalewamy cylindrem miarowym po 1dm3 badanej wody. Do każdego z reaktorów dodajemy inny koagulant. Po dodaniu koagulantów przeprowadzamy szybkie mieszanie z prędkością 60 obr/min w czasie 1 minuty. Następnie obniżamy obroty do 18 obr/min i stosujemy mieszanie wolne w t = 30 min. Po upływie określonego czasu odstawiamy próby na 30 min w celu sedymentacji zawiesiny pokoagulacyjnej.
Następnie w każdej próbie badamy pH, mętność, barwę i utlenialność.
pH
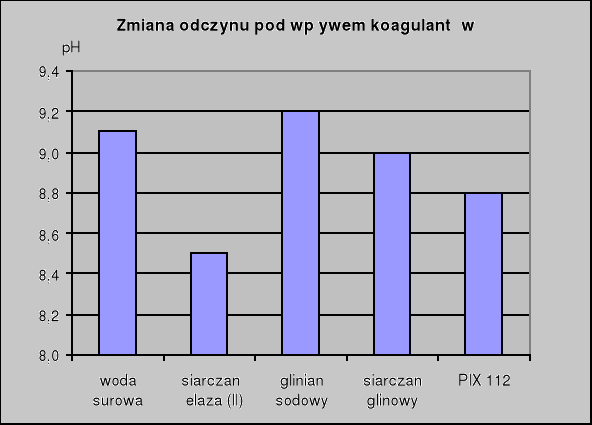
pH odczytujemy na urządzeniu zwanym pH-metrem. Polega to na zanurzeniu elektrody w próbce naszej wody i odczytaniu ze skali odpowiedniej wartości. Dla wody zawierającej dany koagulant pH wynosi:
siarczan żelaza (II) - 8,5
glinian sodowy - 9,2
siarczan glinowy - 9,0
PIX 112 - 8,8
MĘTNOŚĆ
Mętność określamy na podstawie wzorców mętności. Mętność dla wody zawierającej koagulant:
siarczan żelaza (II) - 8 mg SiO2/dm3
glinian sodowy - 5 mg SiO2/dm3
siarczan glinowy - 4 mg SiO2/dm3
PIX 112 - 6 mg SiO2/dm3
BARWA
Ze „SPEKOLA“ odczytujemy wartość ekstynkcji, następnie korzystając ze wzoru S = E![]()
750 odczytujemy barwę. Barwa dla wody zawierającej dany koagulant wynosi:
siarczan żelaza (II) - E = 0,063
S = 0,063![]()
750 = 47 mg Pt/dm3
glinian sodowy - E = 0,022
S = 0,022![]()
750 = 17 mg Pt/dm3
siarczan glinowy - E = 0,014
S = 0,014![]()
750 = 11 mg Pt/dm3
PIX 112 - E = 0,046
S = 0,046![]()
750 = 35 mg Pt/dm3
UTLENIALNOŚĆ
W celu określenia utlenialności należało do kolb stożkowych odmierzyć odpowiednio:
dla wody destylowanej (próba zerowa) : 100 cm3 wody
destylowanej,
dla wody zawierającej koagulant - siarczan żelaza (II) - 90 cm3 wody destylowanej i 10 cm3 badanej wody,
dla wody zawierającej koagulant - glinian sodowy - 90 cm3 wody destylowanej i 10 cm3 wody badanej,
dla wody zawierającej koagulant - siarczan glinowy - 90 cm3 wody destylowanej i 10 cm3 wody badanej,
dla wody zawierającej koagulant - PIX 12 - 90 cm3 wody destylowanej i 10 cm3 badanej wody.
Następnie każdą z czterech kolb dopełniałyśmy 10 cm3 kwasu siarkowego
(H2SO4), oraz 10 cm3 roztworu nadmanganianu potasowego (KMnO4). Roztwory wymieszałyśmy i na 30 minut wstawiłyśmy do łaźni wodnej.
W ciągu tych 30 minut należało sprawdzać, by roztwór nie odbarwił się (nie pozbył się koloru fioletowego).
Po upływie 30 minut kolby wyjęłyśmy i niezwłocznie dodałyśmy do każdej z nich 10 cm3 roztworu szczawianu sodowego 0,0125 n ( Na2C2O4) i na gorąco miareczkowałyśmy roztworem KMnO4 tak, by kolor roztworu z bezbarwnego zmienił się na bardzo jasno różowy.
Na zmiareczkowanie zużyłyśmy:
siarczan żelaza (II) - 2,7 cm3 KMnO4
glinian sodowy - 2,9 cm3 KMnO4
siarczan glinowy - 1,2 cm3 KMnO4
PIX 112 - 2,9 cm3 KMnO4
Utlenialność wody obliczamy ze wzoru:
X = ![]()
mg O2/dm3
gdzie:
f = 1,
b = 0,3, jest to odczyt wartości z próby zerowej.
Dla wody zawierającej dany koagulant utlenialność wynosi:
siarczan żelaza (II)
X = ![]()
mg O2/dm3
X = 24 mg O2/dm3
glinian sodowy
X = ![]()
mg O2/dm3
X = 26 mg O2/dm3
siarczan glinowy
X = ![]()
mg O2/dm3
X = 9 mg O2/dm3
PIX 112
X = ![]()
mg O2/dm3
X = 26 mg O2/dm3

WNIOSKI
Siarczan żelaza (II) spowodował obniżenie się wartości pH z 9,1 do 8,5.Spośród użytych koagulantów jest to spadek największy. Wartość mętności została zredukowana o 46,70% od wartości początkowej. Wpływ siarczanu żelaza (II) na barwę jest niewielki, gdyż obniżył ją jedynie o 6%. Utlenialność została zredukowana o 11,1%.
Kolejny użyty koagulant to glinian sodowy. Użycie tej substancji spowodowało zwiększenie się wartości pH o 0,1 do wartości 9,2. Mętność została zredukowana przez użyty koagulant o 66,7%. Glinian sodowy zredukował barwę badanej wody o 66% od wartości początkowej. Wartość utlenialności została zmniejszona jedynie o 3,7% co daje najgorszy rezultat spośród użytych koagaulantów.
Kolejny użyty koagulant to siarczan glinowy. Spowodował spadek wartości pH tylko o 0,1 (do 9,0 z 9,1). Użycie tego koagulantu spowodowało spadek mętności, barwy, utlenialności odpowiednio o 73,3%, 78% i 66,7%.
Ostatnim użytym koagulantem jest PIX 112. Spowodował on spadek wartości pH o 0,3 (od wartości 9,1 do 8,8). Wartości badanych parametrów (mętności, barwy i utlenialności) zmalały odpowiednio o 60%, 30% i 3,7%.
Po przeprowadzonych badaniach można stwierdzić, że najlepszym spośród użytych koagulantów jest siarczan glinowy. Wszystkie parametry badanej wody po użyciu tego koagulantu zostały zredukowane w podobnym stopniu (o ok. 70%) przy niewielkiej zmianie odczynu wody.
Wyszukiwarka
Podobne podstrony:
KOAGULACJA1sd, technologia wody i sciekow Jachimko
analiza wody, technologia wody i sciekow Jachimko
spr woda3 próbki, technologia wody i sciekow Jachimko
adsorpcja, technologia wody i sciekow Jachimko
wody powierzchniowe opis, technologia wody i sciekow Jachimko
Kinetyka frakcji-sprawozdanie, technologia wody i sciekow Jachimko
ieje sedymentacyjne 2-nita, technologia wody i sciekow Jachimko
index osadu, technologia wody i sciekow Jachimko
Chlorowanie ścieków, technologia wody i sciekow Jachimko
Chlorowanie ścieków-spr, technologia wody i sciekow Jachimko
Odkwaszanie, technologia wody i sciekow Jachimko
CHARAKTERYSTYKA WÓD, technologia wody i sciekow Jachimko
sprawozdanie z BZT, technologia wody i sciekow Jachimko
technologia ścieków - projekt, technologia wody i sciekow Jachimko, tech wody i sciekow-Kisielewicz,
Sedymentacja w lejach Imhoffa - sprawozdanie, technologia wody i sciekow Jachimko
INDEKS OSADU, technologia wody i sciekow Jachimko
odwadnianie, technologia wody i sciekow Jachimko
CZĘŚĆ TEORETYCZNA, technologia wody i sciekow Jachimko
Bróż, technologia wody i sciekow Jachimko
więcej podobnych podstron