CHEMIA ORGANICZNA
Chemia organiczna - dziedzina chemii zajmująca się badaniem budowy, właściwości oraz reakcji związków chemicznych zawierających węgiel, a także opracowywaniem różnorodnych metod syntezy tych połączeń. Ponadto związki organiczne zawierać mogą atomy innych pierwiastków, takich jak wodór, tlen, azot, fosfor, krzem oraz siarka
Związki organiczne, związki chem. pierwiastka węgla, z wyłączeniem związków prostych (tlenków węgla, węglanów, cyjanków, węglików i karbonylków metali), tradycyjnie zaliczanych do związków nieorganicznych; historycznie nazwa związków organicznych wywodzi się od związków chem. wytwarzanych przez organizmy żywe. Związki organiczne charakteryzuje kowalencyjny typ wiązań, wiązania jonowe występują w nich rzadko.
Węglowodory alifatyczne
Metan
Propan
![]()
1.A) ALKANY - węglowodory parafinowe (parafiny)
Wzór ogólny:
Grupa związków o podobnej budowie i właściwościach, których cząsteczki różnią się o jedną lub więcej grup -CH2
Właściwości fizyczne metanu:
gaz, bezbarwny, bezwonny, lżejszy dwukrotnie od powietrza, nierozpuszczalny w wodzie
Właściwości fizyczne innych alkanów:
nierozpuszczalne w wodzie, rozpuszczalne w rozpuszczalnikach organicznych
C1 - C4 - gazy
C5 - C17 - ciecze
C18 - ... - ciała stałe
Właściwości chemiczne:
1. Reakcja spalania alkanów [w zależności od ilości tlenu można uzyskać różne produkty]
2. Reakcja podstawienia (substytucji) atomu wodoru atomem fluorowca zachodząca w obecności światła
3. Metan jest związkiem biernym chemicznie - nie reaguje z roztworem nadmanganianu potasu i z wodą bromową. Jest odporny na działanie większości odczynników chemicznych.
Otrzymywanie alkanów:
1. Destylacja ropy naftowej
2. Reakcja Wurtza (reakcja dobudowy łańcucha)
3. Elektroliza wodnych roztworów soli kwasów karboksylowych (synteza Kolbego).
4. Uwodornienie węglowodorów nienasyconych.
5. Ogrzewanie octanu sodu z wodorotlenkiem sodu
6. Reakcja węgliku glinu z kwasem solnym
1.B) ALKENY [olefiny]
Cecha charakterystyczna: podwójne wiązanie węgiel - węgiel
![]()
wzór ogólny:
Izomeria cis - trans Jeden z typów stereoizomerii (stereoizomery różnią się geometryczną budową cząsteczki czyli przestrzennym usytuowaniem fragmentów cząsteczki względem siebie)
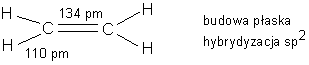
Budowa cząsteczki etylenu:
Wiązanie podwójne; Nierównocenność obu par elektronowych tworzących wiązanie; (jedno wiązanie jest typu sigma - ma charakter wiązania pojedynczego w alkanach - jest trwałe; drugie wiązanie typu pi - wiązanie nietrwałe, dlatego alkeny łatwo ulegają reakcjom chemicznym)
Właściwości fizyczne etenu:
gaz, bezbarwny, bezwonny, o gęstości mniejszej od gęstości powietrza,
nierozpuszczalny w wodzie, rozpuszczalny w innych rozpuszczalnikach organicznych. (np. w heksanie)
Właściwości chemiczne etylenu i innych alkenów:
1) ulegają reakcjom addycji do wiązania podwójnego.
A) przyłączanie bromu lub chloru
B) addycja cząsteczek chlorowodoru lub bromowodoru
C) addycja wody do wiązania podwójnego
2. Reakcja uwodornienia
3. Reakcje polimeryzacji
Etylen może reagować sam ze sobą, przy czy jego cząsteczki łączą się w długie łańcuchy zawierające tylko wiązania pojedyncze. Jest to reakcja polimeryzacji.
3. Odbarwia wodę bromową i roztwór nadmanganianu potasu
4. Utlenianie do tzw. epoksydów (tlen wbudowuje się w miejscu wiązania podwójnego)
5. Ulegają reakcji ozonolizy pod wpływem ozonu. (degradacja związków nienasyconych)
a) przyłączenie ozonu do wiązania podwójnego i utworzenie ozonków.
b) hydroliza ozonku z utworzeniem aldehydów, ketonów.
Otrzymywanie alkenów: (reakcje eliminacji):
1. Reakcja eliminacji wody zachodząca w obecności tlenku glinu jako katalizatora. (dehydratacja)
2. Ogrzewanie chlorowcopochodnej alkanu z alkoholowym roztworem zasady potasowej
3. Reakcja z cynkiem
4. Przemysłowe: na drodze krakowania wyższych alkanów
1.C) ALKINY
cecha charakterystyczna: potrójne wiązanie węgiel - węgiel
![]()
Wzór ogólny:
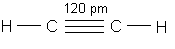
Budowa cząsteczki acetylenu:
wiązanie potrójne; nierównocenność trzech par elektronowych tworzących wiązanie;
jedno wiązanie jest typu sigma - ma charakter wiązania pojedynczego w alkanach w związku z czym trudno go rozerwać; dwa pozostałe to wiązania typu pi - wiązania nietrwałe, łatwe do rozerwania - dlatego alkiny łatwo ulegają reakcjom chemicznym.
Właściwości fizyczne acetylenu:
gaz
bezbarwny
bezwonny
lżejszy od powietrza
nie rozpuszczalny w wodzie, rozpuszczalny w innych rozpuszczalnikach organicznych;
ze względu na to że w podwyższonej temperaturze zachodzi wybuchowy rozkład acetylenu przechowuje się go po rozpuszczeniu w acetonie
właściwości chemiczne acetylenu i innych alkinów:
1) ulegają reakcjom addycji do wiązania potrójnego aż do całkowitego wysycenia wiązania.
a) przyłączanie bromu lub chloru
b) addycja cząsteczek chlorowodoru lub bromowodoru
c) addycja wody do wiązania podwójnego (otrzymywanie aldehydów i ketonów
2. Reakcja uwodornienia
3. Reakcje polimeryzacji
a) reakcja acetylenu z kwasem octowy
b) reakcja dimeryzacji acetylenu (łączenie dwóch cząsteczek)
c) otrzymywanie PCV
4. Odbarwia wodę bromową i roztwór nadmanganianu potasu
5. Spala się w tlenie w bardzo wysokiej temperaturze (około 3000 stopni). Reakcja ta ma zastosowanie w palnikach acetylenowo tlenowych do cięcia i spawania metali.
Otrzymywanie acetylenu:
1. Na skalę przemysłową przez pirolizę metanu (temperatura łuku elektrycznego)
2. Na skalę przemysłową z węgliku wapnia (karbidu)
Otrzymywanie alkinów:
1. Dehydrohalogenacja difluorowcoalkanów (od pochodnej alkanu mającej dwa atomy fluorowca na sąsiednich atomach węgla są odrywane dwie cząsteczki fluorowcowodoru)
2. Dehalogenacja (oderwanie czterech atomów fluorowca od tetrahalogenków)
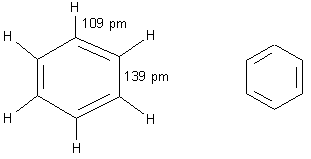
Węglowodory o budowie pierścieniowej, w których cząsteczkach między atomami węgla występują wiązania zdelokalizowane
Budowa cząsteczki benzenu
Budowa cząsteczki płaska
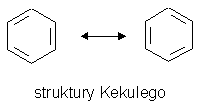
Obecność w cząsteczce wiązania zdelokalizowanego zbudowanego z sześciu elektronów (sekstetu elektronowego), Tworzy ono chmurę elektronową nad i pod pierścieniem.
Struktury Kekulego benzenu:
Rozmieszczenie elektronów w cząsteczce jest wypadkową obu struktur granicznych i nie może być zapisane tylko za pomocą jednego wzoru.
Właściwości fizyczne benzenu:
bezbarwna, lotna ciecz o charakterystycznym zapachu,
nie rozpuszczalna w wodzie, jest dobrym rozpuszczalnikiem niektórych związków organicznych.
Właściwości chemiczne benzenu:
A) benzen spala się kopcącym płomieniem, z powietrzem tworzy mieszaninę wybuchową.
B) benzen nie reaguje z wodą bromową i nadmanganianu potasu w zwykłych warunkach
C) ulega reakcji podstawienia w pierścieniu aromatycznym.
D)Reakcja nitrowania, z tzw. mieszaniną nitrującą (mieszaniną stężonych kwasów: azotowego i siarkowego. Jest to reakcja podstawienia atomu wodoru grupą nitrową (reakcja charakterystyczna dla związków aromatycznych.)
![]()
E) Reakcja uwodornienia (reakcja przyłączenia - podobieństwo do alkenów)
Otrzymywanie benzenu:
A) Trimeryzacja cząsteczek acetylenu
B) na skalę przemysłową w procesie cyklizacji (zamknięcia w pierścień zawartych w ropie naftowej alkanów) i odwodornienia powstałych cykloalkanów.
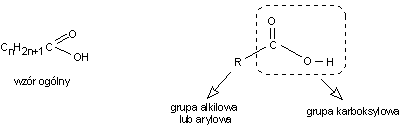
wzór ogólny:
Budowa cząsteczek:
W grupie karboksylowej wys. zjawisko mezomerii (elektrony podwójnego wiązania nie mają określonego położenia). Chmura elektronów jest rozmieszczona równomiernie wokół grupy COO- . W wyniku stabilizacji rezonansowej istnieje tendencja do odszczepiania protonu.
Właściwości fizyczne innych kwasów:
a) rozpuszczalność
C1-C4 dobrze rozpuszczalne w wodzie
C5-C12 rozpuszczają się w alkoholu
>C13 dobrze rozpuszczalne w rozpuszczalnikach organicznych
b) stan skupienia
C1-C8 ciecze
>C9 ciała stałe
c) łatwo krystalizują
d) są mało lotne
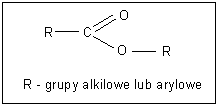
Wzór ogólny:
Estry są pochodnymi kwasów karboksylowych w których zamiast atomu wodoru grupy karboksylowej znajduje się grupa alkilowa lub arylowa
Otrzymywanie:
Reakcja estryfikacji - reakcja kwasu karboksylowego z alkoholem lub fenolem w obecności środowisku kwasowym
Właściwości fizyczne estrów:
ciecze
trudno rozpuszczalne w wodzie
o gęstości mniejszej od gęstości wody
przyjemny zapach
estry niższych i średnich kwasów karboksylowych oraz niższych i średnich alkoholi są nazywane olejkami eterycznymi (występują w owocach lub kwiatach i nadają im charakterystyczny zapach).
Reakcje charakterystyczne:
1. Reakcja kwasowej hydrolizy estrów - reakcja odwrotna do reakcji estryfikacji
2. Reakcja hydrolizy zasadowej pod wpływem jonów OH- - reakcja zmydlania
Zastosowanie:
rozpowszechnione w przyrodzie (nadają zapach olejkom roślinnym i owocom)
estry kwasów karboksylowych o długich łańcuchach to woski (wchodzą w skład wosku pszczelego i stanowią powłokę liści)
są stosowane do wyrobu esencji zapachowych, rozpuszczalników i farb (np rozpuszczalnik nitro to mieszanina octanów propylu, butylu i pentylu)
5.A) Alkohole jednowodorotlenowe (Monohydroksylowe)
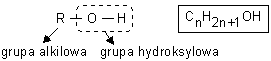
Właściwości fizyczne alkoholi:
1. Stan skupienia
C1 - C10 ciecze
> C10 ciała stałe
2. Rozpuszczalność w wodzie
C1 - C3 mieszają się z wodą w każdym stosunku
C4 - C5 dobrze rozpuszczalne w wodzie
> C10 nie rozpuszczają się w wodzie
3. Są stosowane jako rozpuszczalniki organiczne
4. Ich gęstość ~~0,8 g/cm3
Właściwości chemiczne:
1) tworzenie alkoholanów w reakcji z aktywnymi metalami (litowcami lub berylowcami)
2) podstawienie grupy hydroksylowej atomem fluorowca w reakcji z kwasami fluorowcowodorowymi.
3) reakcja eliminacji wody prowadząca do alkenów.
4) reakcja utleniania alkoholi pierwszorzędowych do aldehydów i drugorzędowych do ketonów.
5) reakcja estryfikacji z kasami karboksylowymi i nieorganicznymi.
Otrzymywanie:
a) hydroliza fluorowcopochodnych alkilowych.
b) addycja wody do alkenów.
c) hydroliza estrów
D) redukcja aldehydów do alkoholi I-rzędowych
E) redukcja ketonów do alkoholi II-rzędowych
2.B) Alkohole wielowodorotlenowe - Polihydroksylowe
Alkohole mające dwie lub więcej grupy wodorotlenowe -OH przyłączone do różnych atomów węgla.
2.C) Alkohole nienasycone - Alkenole
-zawierają wiązania wielokrotne
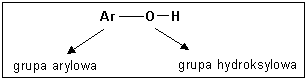
Fenole - hydroksylowe pochodne węglowodorów aromatycznych, w których grupa hydroksylowa związana jest z atomem węgla pierścienia aromatycznego
Wzór ogólny:
Właściwości fizyczne fenolu:
substancja krystaliczna o silnym charakterystycznym zapachu
czysty bezbarwny, w obecności związków żelaza przyjmuje barwę różową albo brunatną
powoduje trudno gojące się oparzenia, jego opary są trujące
słabo rozpuszczalny w wodzie
Właściwości chemiczne fenolu:
fenol jest słabym kwasem - ulega dysocjacji
Zwiększona kwasowość fenoli w porównaniu z alkoholami wynika z oddziaływania wolnych par elektronowych atomu tlenu z sekstetem elektronowym pierścienia aromatycznego. Następuje zmniejszenie polaryzacji wiązania C-O i zwiększenie polaryzacji wiązania O-H, co ułatwia oderwanie protonu.
Reakcje charakterystyczne:
1) reagują z roztworami wodorotlenków litowców dając sole - fenolany.
2) rekcje tworzenia barwnych związków kompleksowych z solami żelaza (III) - kolor fioletowy, granatowy lub czerwonobrunatny
3) reakcje podstawienia wodoru w pozycjach orto i para względem grupy hydroksylowej w pierścieniu aromatycznym.
a) reakcje nitrowania fenolu
b) chlorowanie lub bromowanie fenolu
3) reakcja ze kwasem bromowodorowym w obecności kwasu siarkowego nie zachodzi
4) Reakcja uwodornienia
5) reakcje estryfikacji z kwasami karboksylowymi.
Otrzymywanie:
a) hydroliza halogenków arylowych zachodząca w bardzo ostrych warunkach
(ogrzewanie ze stężonym roztworem NaOH w temperaturze ponad 370 C i pod ciśnieniem), rozkład utworzonego fenolanu kwasem węglowym.
b) destylacja smoły węglowej
Zastosowanie:
krezole są stosowane jako środki do dezynfekcji pomieszczeń sanitarnych. Lizol - roztwór krezoli w mydle potasowym
benzodiole służą do produkcji barwników
hydrochinon stosowany jako składnik wywoływacza fotograficznego
naftole są stosowane do wyrobu barwników, leków, środków zapachowych
fenol stosowany do produkcji tworzyw sztucznych, barwników, farb, materiałów wybuchowych wodny roztwór fenolu - karbol używany jest do dezynfekcji pomieszczeń
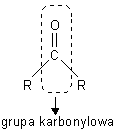
Wzór ogólny:
Ogólnie otrzymywanie
A) Utlenianie alkoholi I-rzędowych
B) Odwodornienie alkoholi I-rzędowych
C) Utlenianie alkenów powietrzem (proces Hackera)
D) Uwodnienie acetylenu (Reakcja Kuczerowa)
Właściwości fizyczne:
Stan skupienia:
C1 - występuje w stanie gazowym
>C2 - w stanie ciekłym
Charakterystyczny zapach:
C1 - C7 - mają nieprzyjemny zapach>C8 - mają przyjemny zapach
Wzór ogólny:
Otrzymywanie:
A) Utlenianie alkoholi II-rzędowych
B) Odwodornienie alkoholi II-rzędowych
C) Uwodnienie propynu (Reakcja Kuczerowa)
Właściwości fizyczne:
-ciecze
-lotne
-rozpuszczalne w wodzie i rozpuszczalnikach organicznych (dobre rozpuszczalniki organiczne)
-mała zdolność do krystalizacji

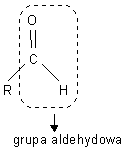
pochodne alkoholi o wzorze ogólnym:
Właściwości fizyczne:
bezbarwne, lotne ciecze, bardzo łatwo palne, dobre rozpuszczalniki, słabo rozpuszczalne w wodzie, w odróżnieniu od alkoholi mają niskie temperatury wrzenia i topnienia (nie są zdolne do tworzenia wiązań wodorowych )
wielowodorotlenowe aldehydy i wielowodorotlenowe ketony oraz związki, z których takie aldehydy lub ketony można otrzymać w wyniku hydrolizy.
Wyszukiwarka
Podobne podstrony:
Ćwiczenia – węglowodory alifatyczne, Studia, Biotechnologia, Chemia, Chemia organiczna, Wykłady II
fluorowcpochodne weglowodorow otrzymywanie, biologia, chemia organiczna
Węglowodory alifatyczne, Chemia
Węglowodory alifatyczne (1), Chemia
fluorowcopochodne weglowodorow wlasciwosci, biologia, chemia organiczna
weglowodory, Nauka, CHEMIA, Szkoła, Chemia Organiczna
kol3 popr i inne, UMCS biotechnologia I rok (2010-2011), Chemia organiczna
chemia organiczna weglowodory(1) id 112687
Chemia organiczna pochodne węglowodorów 4
Chemia org - Węglowodany, Studia WNOŻ SGGW 2008-2013, Inżynierskie, Semestr 2, Chemia organiczna, Ró
Referat Chemia Chemia organiczna i nieorganiczna, historia, właściwości, klasyfikacja, reakcje, mech
więcej podobnych podstron