Paulina Lewandowska
Paulina Piątek
Czwartek 745 Sprawozdanie z ćwiczenia 3 - statyka
|
Nr roztworu |
||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
0,1M NH4Cl |
13 |
12 |
9 |
7,5 |
5 |
3 |
2 |
0,1M NH4OH |
2 |
3 |
6 |
7,5 |
10 |
12 |
13 |
pH początkowe |
8,89 |
9,18 |
9,79 |
10,16 |
12,39 |
12,74 |
12,85 |
pH końcowe |
11,59 |
11,77 |
11,80 |
11,97 |
|
|
|
V 0,1M NaOH [cm3] |
14 |
12 |
6 |
3 |
|
|
|
Do przygotowanych roztworów po zmierzeniu ich pH początkowego dodajemy po 1ml NaOH o stężeniu 0,1 mol/dm3, aż do uzyskania znaczącego skoku pH. ( skok w granicach 0,5 jednostki)
|
Nr roztworu |
|
||||||
V NaOH [cm3] |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
H2O |
0 |
8,89 |
9,18 |
9,79 |
10,16 |
12,39 |
12,74 |
12,85 |
8,12 |
1 |
9,17 |
9,33 |
9,98 |
10,44 |
12,55 |
12,79 |
|
9,85 |
2 |
9,38 |
9,51 |
10,18 |
10,86 |
12,62 |
12,85 |
|
11,03 |
3 |
9,49 |
9,69 |
10,44 |
11,97 |
12,70 |
|
|
11,54 |
4 |
9,63 |
9,79 |
10,68 |
12,14 |
12,74 |
|
|
11,85 |
5 |
9,71 |
9,91 |
11,05 |
12,33 |
12,78 |
|
|
|
6 |
9,81 |
10,04 |
11,80 |
12,45 |
|
|
|
|
7 |
9,93 |
10,21 |
12,14 |
|
|
|
|
|
8 |
10,07 |
10,36 |
12,32 |
|
|
|
|
|
9 |
10,20 |
10,49 |
12,44 |
|
|
|
|
|
10 |
10,35 |
10,74 |
|
|
|
|
|
|
11 |
10,50 |
11,21 |
|
|
|
|
|
|
12 |
10,76 |
11,77 |
|
|
|
|
|
|
13 |
11,12 |
12,04 |
|
|
|
|
|
|
14 |
11,59 |
12,21 |
|
|
|
|
|
|
15 |
11,98 |
12,32 |
|
|
|
|
|
|
16 |
12,13 |
|
|
|
|
|
|
|
17 |
12,25 |
|
|
|
|
|
|
|
Stężenia jonów ![]()
:
obliczenia dla VNaOH = 0
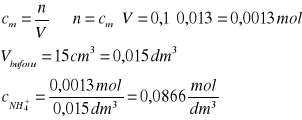
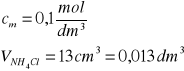
|
Stężenie jonów NH4+ |
||||||
V rozt. [dm3] |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
0,015 |
0,0867 |
0,0800 |
0,0600 |
0,0500 |
0,0333 |
0,0200 |
0,0133 |
0,016 |
0,0813 |
0,0750 |
0,0563 |
0,0469 |
0,0313 |
0,0188 |
|
0,017 |
0,0765 |
0,0706 |
0,0529 |
0,0441 |
0,0294 |
0,0176 |
|
0,018 |
0,0722 |
0,0667 |
0,0500 |
0,0417 |
0,0278 |
|
|
0,019 |
0,0684 |
0,0632 |
0,0474 |
0,0395 |
0,0263 |
|
|
0,020 |
0,0650 |
0,0600 |
0,0450 |
0,0375 |
0,0250 |
|
|
0,021 |
0,0619 |
0,0571 |
0,0429 |
0,0357 |
|
|
|
0,022 |
0,0591 |
0,0545 |
0,0409 |
|
|
|
|
0,023 |
0,0565 |
0,0522 |
0,0391 |
|
|
|
|
0,024 |
0,0542 |
0,0500 |
0,0375 |
|
|
|
|
0,025 |
0,0520 |
0,0480 |
|
|
|
|
|
0,026 |
0,0500 |
0,0462 |
|
|
|
|
|
0,027 |
0,0481 |
0,0444 |
|
|
|
|
|
0,028 |
0,0464 |
0,0429 |
|
|
|
|
|
0,029 |
0,0448 |
0,0414 |
|
|
|
|
|
0,030 |
0,0433 |
0,0400 |
|
|
|
|
|
0,031 |
0,0419 |
|
|
|
|
|
|
0,032 |
0,0406 |
|
|
|
|
|
|
Wykresy:
1. Uzasadnić nazwę: roztwór buforowy.
Słowo bufor oznacza ochronę przed jakimś konkretnym działaniem. Jest rozumiane jako zabezpieczenie przed czynnikiem mogącym spowodować niekorzystne zmiany, stan, stanowiącym swoiste zagrożenie. Roztwory buforowe to takie, które mają zdolność do utrzymania pH na stałym poziomie nawet po dodaniu pewnej ilości mocnego kwasu lub zasady albo rozcieńczania. W ten sposób chronią go przed nagłymi skokami wartości pH w reakcjach, w których wymagany jest konkretny odczyn środowiska, umożliwiając tym samym zajście reakcji.
2. Wnioski:
pH buforów zależy od stosunku stężeń molowych zasady i jej soli ( ale również w znacznym stopniu od stałej dysocjacji zasady)
Roztwory buforowe po dodaniu małych ilości mocnej zasady nieznacznie zmieniają pH, ponieważ następuje wtedy niewielka zmiana stosunku stężeń.
Woda reaguje zmianą pH natychmiast po dodaniu zasady, ponieważ nie należy ona do roztworów buforowych
Znaczna zmiana pH następuje po dodaniu większej objętości zasady, ponieważ roztwór traci swoje właściwości buforujące, gdyż przestają obok siebie już istnieć słaba zasada i jej sól
Roztwór pierwszy jest najlepszym buforem, gdy stosujemy mocną zasadę. Posiada największą pojemność buforową wynikającą z największego stężenia jonów
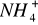

Roztwór czwarty, jako posiadający najmniejsze stężenie jonów
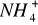
ma najmniejszą pojemność buforową. Woda nie posiada pojemności buforowej.
Im większa pojemność buforowa, tym więcej zasady sodowej należało dodać, aby zmienić pH roztworu.
Pomiary dla roztworów 5, 6 i 7 nie są kompletne ponieważ wartość ich początkowego pH była zbyt wysoka by można było zauważyć jej znaczną zmianę. Tak wysokie wartości pH mogły wynikać ze złego przygotowania roztworów np. ich zbytniego rozcieńczenia. Przy wysokiej wartości pH buforu może on związać więcej mocnego kwasu lub zasady, zatem nie dojdzie praktycznie do zmiany wartości pH, zmieni się jedynie pojemność buforowa.
Jeśli pomiary byłyby kompletne najmniejszą pojemność buforową wykazałby roztwór 7.
1
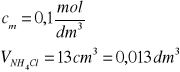
Wyszukiwarka
Podobne podstrony:
zadania fizyczna ćw. 4, Chemia fizyczna dr Cysewski farmacja CM UMK Bydgoszcz
KWASY KARBOKSYLOWE I ICH SOLE, farmacja cm umk, Farmacja III rok, chemia leków
tabelka pochodne kwasow karboksylowych, farmacja cm umk, Farmacja III rok, chemia leków
tabelka sulfonamidy i ich sole, farmacja cm umk, Farmacja III rok, chemia leków
UK PSYMP, farmacja cm umk, Farmacja III rok, chemia leków
tabelka zasady organiczne i ich sole, farmacja cm umk, Farmacja III rok, chemia leków
UK SYMPA, farmacja cm umk, Farmacja III rok, chemia leków
wejsciowki z laborek z chemii fiz, farmacja cm umk
infa ściąga mała, farmacja cm umk
Recepty dodatkowe, Łacina Farmacja CM UMK
chemia fizyczna pytania, Technologia żywności UWM, chemia fizyczna (Dr Kalinowski)
Recepty, Łacina Farmacja CM UMK
GENETYKA i parazyty KOLOKWIUM 2009, farmacja cm umk
Recepty tłumaczenie, Łacina Farmacja CM UMK
Nazwy roślin na łacinę, Łacina Farmacja CM UMK
Kolokwium II, farmacja cm umk
test farmacja 2012, Łacina Farmacja CM UMK
więcej podobnych podstron