IAD 10.10.2007
Laboratorium z fizyki
Sprawozdanie nr 23
Sprawdzanie praw elektrolizy Faraday'a
Ozimek Andrzej
Kurek Michał
L02
I. Wymagania do ćwiczenia
Mechanizm przepływu prądu przez elektrolity.
Prawa Faraday'a.
Wydzielana na elektrodzie masa jest proporcjonalna do ładunku przepuszczonego przez elektrolit
m=kQ=kIt
gdzie I - natężenie prądu płynącego przez elektrolit, t - czas jego przepływu
Współczynniki elektrochemiczne poszczególnych pierwiastków są wprost proporcjonalne do ich równoważników chemicznych
![]()
gdzie: F- stała Faraday'a = 9,65 * 10 7 C/kmol, µ/w - stosunek masy atomowej pierwiastka do jego wartościowości czyli równoważnik chemiczny.
II. Metodologia wykonania ćwiczenia.
Komplet urządzeń do wykonania ćwiczenia stanowią: szklane naczynie na elektrolit, elektrody miedziane, zasilacz, amperomierz, miernik do pomiaru czasu, waga laboratoryjna.
Połączyć obwód według schematu przedstawionego na rysunku
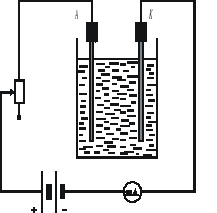
Schemat obwodu pomiarowego
Sprawdzić poprawność obwodu elektrycznego zamykając obwód na krótki czas. Jednocześnie wyregulować natężenie prądu w obwodzie tak, by gęstość prądu nie przekraczała
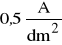
(j = I/S jest gęstością prądu). Natężenie prądu wyznaczyć w odniesieniu do zanurzonej w elektrolicie powierzchni elektrody).
Wyjąć katodę, osuszyć, oczyścić starannie papierem ściernym, przepłukać wodą. Wyznaczyć masę
katody korzystając z wagi analitycznej.Umieścić ponownie katodę w elektrolicie, włączyć prąd uruchamiając jednocześnie zegar. Utrzymywać stałą wartość natężenia prądu przez czas
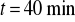
.Po upływie tego czasu przerwać dopływ prądu. Opłukać katodę wodą, osuszyć i wyznaczyć masę
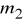
katody.Wartości zmierzonych wielkości zapisać w tabeli.
I |
|
t |
|
M |
k |
|
F |
|
[A ] |
[ kg ] |
[ s ] |
[ kg ] |
[ µ ] |
[kg/A∙s] |
[ kg/A∙s] |
[ C/kmol ] |
[ C/kmol ] |
0,270
|
0,072391 |
2400 |
0,072606 |
63,54 |
3,32∙10-7 |
3,32∙10-7 ±5∙10-9 |
9,57∙107 |
9,57∙107 ±1,4∙106 |
Wymiary płytki: 0,65dm x 0,42dm = 0,273 dm2 ,a że są dwie strony to powierzchnia jest równa 2∙0,273 dm2=0,546 dm2
III. Obliczenia
Masę wydzielonej miedzi obliczyć ze wzoru
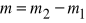
. Przekształcając wzór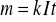
obliczyć równoważnik elektrochemiczny miedzi:
![]()
Z układu okresowego pierwiastków odczytać masę atomową miedzi
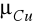
, wartościowość miedzi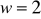
. Ze wzoru wyrażającego drugie prawo elektrolizy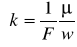
obliczyć stałą Faraday'a: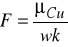
Niepewność standardową
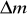
wydzielonej masy miedzi obliczyć jako niepewność typu B jako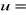
Δ/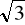
, gdzie Δ jest dokładnością pomiaru wagi analitycznej. Niepewność pomiaru natężenia prądu określamy korzystając z dokładności miernika. Podobnie postępujemy z niepewnością pomiaru czasu. Wartości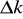
,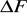
obliczyć jako niepewność złożoną.
Obliczam równoważnik chemiczny miedzi ze wzoru:
![]()
Obliczam stałą Faraday'a
![]()
Obliczam niepewności pomiarowe
Niepewność wagi analitycznej: Δm′=1 mg=0,001g=0,000001kg
Niepewność pomiaru masy: ![]()
Niepewność pomiaru czasu: Δt=1 s
Niepewność pomiaru natężenia prądu:
![]()
Niepewność pomiarowa równoważnika elektrochemicznego k:
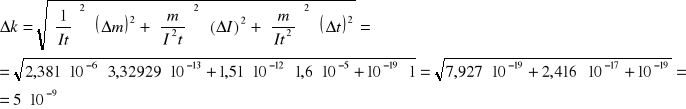
Niepewność pomiarowa stałej Faraday'a:
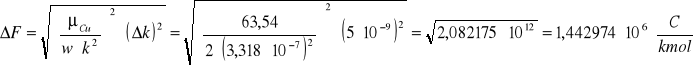
Wnioski:
Wartość tablicowa stałej Faraday'a wynosi 9,65∙107 C/kmol. Obliczona przeze mnie wartość wynosi 9,57∙107 ± 1,4∙106 C/kmol i wartość ta mieści się w granicy obliczonego błędu pomiarowego.
Wyszukiwarka
Podobne podstrony:
Wyznaczanie stałej siatki dyfrakcyjnej, Prz inf 2013, I Semestr Informatyka, Fizyka, SPRAWOZDANIA DU
SiS strona tytulowa spr, Prz inf 2013, I Semestr Informatyka, Fizyka, Wykłady-Fizyka, Sygnały i Syst
Tabela pomiarowa, Prz inf 2013, I Semestr Informatyka, Fizyka, [FIZYKA] Laborki, laboratorium stare
tabele 1B+, Prz inf 2013, I Semestr Informatyka, Fizyka, [FIZYKA] Laborki, laboratorium stare, 1b
ćw 23, Prz inf 2013, I Semestr Informatyka, Fizyka, [FIZYKA] Laborki, laboratorium stare, Fizyka Dam
ćw 1 obliczenia, Prz inf 2013, I Semestr Informatyka, Fizyka, [FIZYKA] Laborki, laboratorium stare,
spr5, Prz inf 2013, I Semestr Informatyka, Fizyka, [FIZYKA] Laborki, laboratorium stare, bartochowsk
obliczenia ćw23, Prz inf 2013, I Semestr Informatyka, Fizyka, [FIZYKA] Laborki, laboratorium stare,
Ćwiczenie nr 44, Prz inf 2013, I Semestr Informatyka, Fizyka, [FIZYKA] Laborki, laboratorium stare,
Wstęp teoretyczny ćw 44, Prz inf 2013, I Semestr Informatyka, Fizyka, [FIZYKA] Laborki, laboratorium
pierwsza strona sprawozdania własne, Prz inf 2013, I Semestr Informatyka, Fizyka, [FIZYKA] Laborki,
pierwsza strona sprawozdania, Prz inf 2013, I Semestr Informatyka, Fizyka, [FIZYKA] Laborki, laborat
Ćwiczenie 47, Prz inf 2013, I Semestr Informatyka, Fizyka, SPRAWOZDANIA DUZO, laboratorium
sprawko1bwstę pteoretyczny, Prz inf 2013, I Semestr Informatyka, Fizyka, [FIZYKA] Laborki, laborator
więcej podobnych podstron