![]()
Edyta Bartnik Warszawa dn. 4.03.2008
Anna Marchelewicz
Sylwia Misztela
Spektrofotometryczne wyznaczanie stałej kwasowości - metoda Batesa - Schwarzenbacha.
1.Cel ćwiczenia
Celem ćwiczenia jest wyznaczenie stałej kwasowości o-nitrofenolu w temperaturze 15oC.
2.Podstawy teoretyczne
W ćwiczeniu skorzystano z metody Batesa-Schwarzenbacha (która jest połączeniem metody potencjometrycznej i spektrofotometrycznej) wyznaczania stałej kwasowości. W ujęciu teorii kwasów i zasad Brönsteda i Lowry'ego równowagę kwasowo-zasadową pomiędzy słabym kwasem, a rozpuszczalnikiem (zazwyczaj wodą) można przedstawić następująco:
![]()
Dla takiego równania reakcji można przedstawić następujący wzór określający stałą równowagi termodynamicznej:
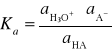
Aktywność rozpuszczalnika jest praktycznie stała, równa jedności, a ponieważ interesują nas roztwory rozcieńczone, może zostać pominięta.
Wyrażenie na stałą kwasowości można również zapisać w skali logarytmicznej w następujący sposób:
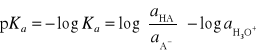
Jak już wcześniej zostało wspomniane, do wyznaczenia stałej kwasowości posługujemy się metodą Batesa-Schwarzenbacha, będącą kombinacją pomiarów potencjometrycznych i spektrofotometrycznych. Aktywność jonów wodorowych ![]()
określamy poprzez aproksymację wartości wyrażenia -log![]()
za pomocą funkcji kwasowości, wyznaczanej na podstawie pomiarów siły elektromotorycznej odpowiednich ogniw, a zdefiniowanej następująco:
![]()
Do wstępnego oszacowania wartości ![]()
badany kwas miareczkowany jest pehametrycznie roztworem 0,1 M zasady sodowej. Z krzywej miareczkowania wyznaczany jest następnie punkt połowicznego zobojętnienia kwasu, w którym ![]()
. Następnie dobieramy bufor o takiej funkcji kwasowości, że ![]()
. Wówczas popełnia się najmniejszy błąd wyznaczania wartości ![]()
. Metoda spektrofotometryczna służy natomiast do wyznaczenia równowagowego stosunku stężeń formy zdysocjowanej i niezdysocjowanej kwasu w roztworze buforowym: ![]()
.
Wyprowadzenie wyrażenia na stałą kwasowości, z którego korzysta się w metodzie Batesa-Schwarzenbacha jest następujące:
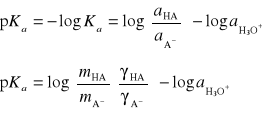
![]()
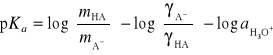
Aproksymując wyrażenie -log![]()
za pomocą funkcji kwasowości otrzymujemy zależność:
![]()
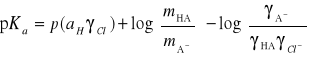
ponieważ dla rozcieńczonych roztworów kwasów możemy przyjąć, że:
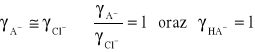
więc wyrażenie: 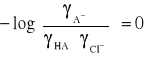
Zatem równanie przybiera postać:
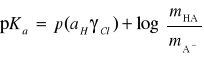
Ponieważ rozważamy roztwory rozcieńczone kwasów możemy również przyjąć, że:
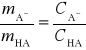
Zatem wyrażenie na stałą kwasowości przyjmuje postać:
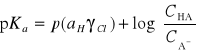
Aby móc wyznaczyć równowagowy stosunek stężeń formy dysocjowanej i niezdysocjowanej kwasu w roztworze buforowym: 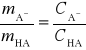
obecne w roztworze formy graniczne kwasu: HA i A- muszą jednocześnie spełniać podstawowe prawa absorpcji światła, a mianowicie: prawo Bouguera-Lamberta-Beera oraz prawo addytywności absorbancji. Wówczas można zapisać:
![]()
gdzie: D - gęstość optyczna
A - absorbancja
C0 - stechiometryczne stężenie kwasu
ၥHA, ၥA, ၥ - molowy współczynnik absorbancji dla światła monochromatycznego o określonej długości fali, odpowiednio dla formy: kwasowej, zasadowej oraz dla roztworu buforowego, w którym obie formy są w stanie równowagi.
Po przekształceniu poprzedniego wzoru otrzymujemy wyrażenie:
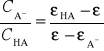
Jeżeli pomiary absorbancji wszystkich roztworów przeprowadzi się dla tego samego stężenia, jednakowej długości fali, w kuwetach o tej samej grubości oraz w tej samej temperaturze to wówczas:
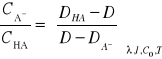
Ostateczny wzór na pKa, z którego korzystamy w metodzie Batesa-Schwarzenbacha przyjmuje postać:
![]()
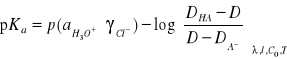
gdzie ![]()
jest funkcją kwasowości
Jest to podstawowy wzór służący do obliczania stałej kwasowości. Kolejne wartości absorbancji D, DHA, DA (wyznaczonych za pomocą spektrofotometru) są wartościami absorbancji badanego roztworu w odpowiednio dobranym buforze, 0,1M roztworze NaOH i w 0,1M roztworze HCl. Bufor dobierany jest w taki sposób, aby ![]()
(pKa wyznaczony wcześniej metodą potencjometryczną, gdyż pH ≅ pKa w punkcie połowicznego zobojętnienia). Stężenia kwasu w buforze oraz w roztworach NaOH i HCl powinny być takie same i sobie równe, aby absorbancja mieściła się w zakresie 0,1<A<1.
Warunkiem koniecznym, umożliwiającym zastosowanie metod spektrofoto-metrycznych do wyznaczania pKa jest istnienie różnic w widmach form granicznych kwasu, tj. formy dysocjowanej A- i niezdysocjowanej HA. Zachodzi to wówczas, gdy miejsce protonowania lub deprotonowania jest częścią ugrupowania chromoforowego lub z nim sprzężone. Ponadto, aby uzyskiwane wyniki były dokładne, obie formy graniczne muszą spełniać prawo Lamberta-Beera (odchylenia od niego nie występują na ogół w roztworach o sile jonowej I ≤0,1).
3.Aparatura
pH-metr (N-5122)
elektroda szklana i kalomelowa (elektroda odniesienia)
T - ultratermostat (U10 z pompą ssąco - tłoczącą, termostatujący komorę kuwet spektrofotometru i naczynie do miareczkowania pehametru)
MM - mieszadło magnetyczne
UV-VIS spektrofotometr ( WSU-2P )
kuwety kwarcowe 5 cm
zlewki, pipety jednomiarowe, kolby miarowe (500 cm3, 50 cm3 )
4.Wykonanie ćwiczenia
Wyznaczenie przybliżonej wartości pKa z pomiaru pH punktu połowicznego zobojętnienia.
Włączenie termostatu i ustawienie temperatury na 15ႰC.
Włączenie potencjometru, wykalibrowanie go przy pomocy roztworów buforowych (fosforanowego i boraksowego).
Sporządzenie roztworu 20,3mg o-nitrofenolu.
Pehametryczne miareczkowanie sporządzonego roztworu roztworem 0,2M NaOH (wcześniej określono wielkości dodawanych porcji)
Sporządzenie wykresu zależności pH = f(VNaOH) i wyznaczenie z niego, metodą stycznych równoległych punktu końcowego. Odczytanie z wykresu wartości pH ≅ pKa w punkcie przegięcia, odpowiadającej połowicznemu zobojętnieniu kwasu.
Część spektrofotometryczna:
Sporządzenie roztworów o-nitrofenolu w 0,1M HCl i 0,2M NaOH o takich samych stężeniach (stężenie kwasu dobieramy, wykorzystując jako wstępne przybliżenie informacji o widmie p-nitrofenolu, tak aby zmierzone wartości absorbancji zawarte były w granicach od 0,1 do 1,0 dla wystarczająco dużej części widma przy użyciu kuwet 5cm).
Na podstawie wyznaczonej przybliżonej wartości pKa wybranie buforu i sporządzenie w nim roztworu kwasu o wyznaczonym przez nas i znanym stężeniu, identycznym jak w kwasie i zasadzie.
Zmierzenie absorbancji sporządzonych roztworów w szerokim zakresie długości fal stosując jako odnośniki odpowiednio: 0,1M HCl , 0,2M NaOH i czysty roztwór buforowy, zwracając uwagę na dokładne termostatowanie kuwet.
Sporządzenie wykresu zależności absorbancji 3 badanych roztworów w funkcji długości fali, dla których zmierzone (a nie interpolowane) wartości absorbancji posłużą do wyznaczenia stałej kwasowości.
Wyznaczanie pKa badanego kwasu:
Korzystając ze wzoru 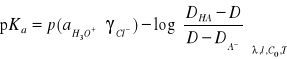
obliczanie wartości pKa dla 3 długości fali dla których różnice (DHA- DA_) są największe.
Obliczanie długości fali odpowiadających punktowi izozbestycznemu (na podstawie dokładności, z jaką jest on określony).
Oszacowanie dokładności wartości pKa.
5. Opracowanie wyników
Pomiary pH roztworu o-nitrofenolu dla różnych objętości dodanego 0,2M NaOH
Lp. |
pH |
VNaOH/ml |
Lp. |
pH |
VNaOH/ml |
1 |
4,52 |
0 |
18 |
7,13 |
0,76 |
2 |
4,54 |
0,02 |
19 |
7.27 |
0,80 |
3 |
5,26 |
0,04 |
20 |
7,40 |
0,86 |
4 |
5,73 |
0,20 |
21 |
7,57 |
0,90 |
5 |
5,92 |
0,24 |
22 |
8,08 |
0,96 |
6 |
5,93 |
0,28 |
23 |
8,56 |
1,00 |
7 |
6,08 |
0,30 |
24 |
9,84 |
1,06 |
8 |
6,08 |
0,32 |
25 |
10,16 |
1,10 |
9 |
6,12 |
0,34 |
26 |
10,36 |
1,16 |
10 |
6,13 |
0,36 |
27 |
10,51 |
1,20 |
11 |
6,24 |
0,38 |
28 |
10,62 |
1,26 |
12 |
6,24 |
0,40 |
29 |
10,78 |
1,30 |
13 |
6,45 |
0,50 |
30 |
10,85 |
1,36 |
14 |
6,64 |
0,56 |
31 |
10,90 |
1,40 |
15 |
6,72 |
0,60 |
32 |
10,99 |
1,46 |
16 |
6,93 |
0,66 |
33 |
11,03 |
1,50 |
17 |
6,93 |
0,70 |
|
|
|
W przybliżeniu pH= pKa=6,5 .Na podstawie tej wartości wybraliśmy bufor nr 11, tak aby ![]()
.
A jego funkcja kwasowości wg R.G.Bates, R.Gary: J.Res.NBS, 65A,495 (1961)
w T =15 oC wynosi:
![]()
7,006
Pomiary absorbancji roztworów o-nitrofenolu dla różnych długości fali w temperaturze 15 oC
Długość fali/nm |
|
|
|
|
|
330 |
0,218 |
0,536 |
0,382 |
0,320 |
|
340 |
0,246 |
0,597 |
0,440 |
0,351 |
|
350 |
0,334 |
0,520 |
0,485 |
0,186 |
|
360 |
0,453 |
0,488 |
0,479 |
0,035 |
|
370 |
0,614 |
0,347 |
0,453 |
-0,267 |
|
380 |
0,810 |
0,227 |
0,427 |
-0,583 |
|
390 |
0,924 |
0,105 |
0,401 |
-0,819 |
|
400 |
0,970 |
0,014 * |
0,374 |
-0,956 |
|
410 |
0,975 |
|
0,339 |
|
|
420 |
0,877 |
|
0,294 |
|
|
430 |
0,713 |
|
0,244 |
|
|
440 |
0,536 |
|
0,174 |
|
|
*) Pomiar pominięty w obliczeniach, ponieważ zmierzona wartość absorbancji nie jest zawarta w granicach 0,1-1,0
Z wykresu D = f(ၬ) wybraliśmy trzy długości fali, dla których wartości D są zmierzone (nie interpolowane) i dla których spełnione są warunki:
Różnica gęstości optycznej form granicznych ![]()
jest jak największa
Nachylenie wykresów jest jak najmniejsze ![]()
Wybraliśmy następujące długości fal:
ၬ1 = 340nm
ၬ2 = 380nm
ၬ3 = 390nm
Na podstawie wzoru 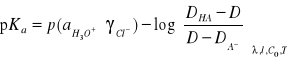
wyznaczyliśmy wartości pKa dla poszczególnych długości fal.
pKa dla wybranych długości fali |
Wartość pKa |
pKa(340) |
7,098 |
pKa(380) |
7,288 |
pKa(390) |
7,253 |
pKa(śr) |
7,213 |
Długość fali odpowiadająca punktowi izozbestycznemu oszacowaliśmy z wykresu i wynosi ona około ၬ ≈ 361,4nm, a gęstość optyczna odpowiadająca temu punktowi D ≈ 0,472
Błąd wyznaczenia pKa obliczyliśmy z różniczki zupełnej. Przyjęliśmy błąd funkcji kwasowości za równy zero. Doprowadziło nas to do ostatecznego wzoru :
![]()
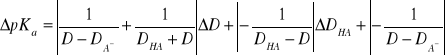
![]()
Po podstawieniu wartości liczbowych, dla ![]()
otrzymaliśmy ostateczną wartość stałej kwasowości pKa =...........
8.Wnioski
Badana substancja |
o-nitrofenol |
Temperatura pomiarów |
T =15 ºC |
Wartość pKa |
pKa =7,213 |
9. Zestawienie wyników.