Sprawozdanie nr 6
Doświadczenie 4.1 Badanie wpływu stężenia na szybkość reakcji chemicznej.
Celem doświadczenia jest zbadanie wpływu stężenia na szybkość reakcji chemicznej.
Korzystałem z probówek, cylindrów miarowych, stopera oraz z następujących odczynników: 0,25 M H2SO4, Na2S2O3, H2O2, H2S2O3
Najpierw przygotowałem roztwory Na2S2O3 o różnych stężeniach. Do probówek z roztworem Na2S2O3 dodałem po 3 cm3 0,25 M H2SO4. Następnie za pomocą stopera zmierzyłem czas reakcji, a wyniki umieściłem![]()
m w tabeli.
W probówkach zaszły reakcje:
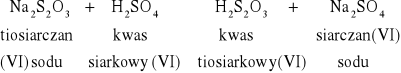
NR |
OBJĘTOŚĆ ROZTWORU Na2S2O3 [ cm3 ] c = 0,5 mol/dm3 |
OBJĘTOŚĆ WODY [cm3 ] |
STĘŻENIE c H2S2O3 = c Na2S2O3 [mol/dm3] |
CZAS REAKCJI [s] |
SZYBKOŚĆ REAKCJI [mol/dm3·s-1] |
1 |
10 |
0 |
0,5 |
6,2 |
0,0806 |
2 |
8 |
2 |
0,4 |
10,2 |
0,0392 |
3 |
6 |
4 |
0,3 |
12,5 |
0,024 |
4 |
4 |
6 |
0,2 |
18 |
0,0111 |
5 |
2 |
8 |
0,1 |
35 |
0,0029 |
6 |
1 |
9 |
0,05 |
68 |
0,00024 |
I . Obliczam stężenie H2S2O3
1.
Dane: Szukane:
V1 = 10 cm3 = 0,01 dm3 n = ?
C1 = 0,5 mol/dm3 ![]()
![]()
V2 = 10 cm3 = 0,01 dm3
C = n ÷ V
n = V1 · C1
n = 0,01 dm3 · 0,5 mol/dm3
n = 0,005 mol
![]()
= n ÷ V2
![]()
= 0,005 mol ÷ 0,01 dm3
![]()
= 0,5 mol/dm3
2.
Dane: Szukane:
V1 = 8 cm3 = 0,008 dm3 n = ?
C1 = 0,5 mol/dm3 ![]()
= ?
V2 =10 cm3 = 0,01 dm3
C = n ÷ V
n = V1 · C1
n = 0,008 dm3 · 0,5 mol/dm3
n = 0,0004 mol
![]()
= n ÷ V2
![]()
= 0,004 mol ÷ 0,01 dm3
![]()
= 0,4 mol/dm3
3.
Dane: Szukane:
V1 = 6 cm3 = 0,006 dm3 n = ?
C1 = 0,5 mol/dm3 ![]()
= ?
V2 =10 cm3 = 0,01 dm3
C = n ÷ V
n = V1 · C1
n = 0,006 dm3 • 0,5 mol/dm3
n = 0,0003 mol
![]()
= n ÷ V2
![]()
= 0,0003 mol ÷ 0,01 dm3
![]()
= 0,3 mol/dm3
4.
Dane: Szukane:
V1 = 4 cm3 = 0,004 dm3 n = ?
C1 = 0,5 mol/dm3 ![]()
= ?
V2 =10 cm3 = 0,01 dm3
C = n ÷ V
n = V1 · C1
n = 0,004 dm3 · 0,5 mol/dm3
n = 0,002 mol
![]()
= n ÷ V2
![]()
= 0,002 mol ÷ 0,01 dm3
![]()
= 0,2 mol/dm3
5.
V1 = 2 cm3 = 0,002 dm3 n = ?
C1 = 0,5 mol/dm3 ![]()
= ?
V2 =10 cm3 = 0,01 dm3
C = n ÷ V
n = V1 · C1
n = 0,002 dm3 · 0,5 mol/dm3
n = 0,001 mol
![]()
= n ÷ V2
![]()
= 0,001 mol ÷ 0,01 dm3
![]()
= 0,1 mol/dm3
6.
Dane: Szukane:
V1 = 1 cm3 = 0,001 dm3 n = ?
C1 = 0,5 mol/dm3 ![]()
= ?
V2 =10 cm3 = 0,01 dm3
C = n ÷ V
n = V1 · C1
n = 0,001 dm3 · 0,5 mol/dm3
n = 0,00005 mol
![]()
= n ÷ V2
![]()
= 0,00005 mol ÷ 0,01 dm3
![]()
= 0,05 mol/dm3
II. Obliczam szybkość reakcji
1.
Dane: Szukane:
∆t = 6,2 s Vśr = ?
c H2S2O3 = 0,5 mol/dm3
Vśr = ∆c ÷ ∆t
Zał.: c H2S2O3 = c Na2S2O3
Vśr = c H2S2O3 ÷ ∆t
Vśr = 0,5 mol/dm3 ÷ 6,2 s
Vśr = 0,0806 mol/dm3·s-1
2.
Dane: Szukane:
∆t = 10,2 s Vśr = ?
c H2S2O3 = 0,4 mol/dm3
Vśr = ∆c ÷ ∆t
Zał.: c H2S2O3 = c Na2S2O3
Vśr = c H2S2O3 ÷ ∆t
Vśr = 0,4 mol/dm3 ÷ 10,2 s
Vśr = 0,0392 mol/dm3·s-1
3.
Dane: Szukane:
∆t = 12,5 s Vśr = ?
c H2S2O3 = 0,3 mol/dm3
Vśr = ∆c ÷ ∆t
Zał.: c H2S2O3 = c Na2S2O3
Vśr = c H2S2O3 ÷ ∆t
Vśr = 0,3 mol/dm3 ÷ 12,5 s
Vśr = 0,024 mol/dm3·s-1
4.
Dane: Szukane:
∆t = 18 s Vśr = ?
c H2S2O3 = 0,2 mol/dm3
Vśr = ∆c ÷ ∆t
Zał.: c H2S2O3 = c Na2S2O3
Vśr = c H2S2O3 ÷ ∆t
Vśr = 0,2 mol/dm3 ÷ 18 s
Vśr = 0,0111 mol/dm3·s-1
5.
Dane: Szukane:
∆t = 35 s Vśr = ?
c H2S2O3 = 0,1 mol/dm3
Vśr = ∆c ÷ ∆t
Zał.: c H2S2O3 = c Na2S2O3
Vśr = c H2S2O3 ÷ ∆t
Vśr = 0,1 mol/dm3 ÷ 35 s
Vśr = 0,0029 mol/dm3·s-1
6.
Dane: Szukane:
∆t = 68 s Vśr = ?
c H2S2O3 = 0,05 mol/dm3
Vśr = ∆c ÷ ∆t
Zał.: c H2S2O3 = c Na2S2O3
Vśr = c H2S2O3 ÷ ∆t
Vśr = 0,05 mol/dm3 ÷ 68 s
Vśr = 0,00074 mol/dm3·s-1
Wykres zależności szybkości reakcji od stężenia ![]()
Jak widać na wykresie wraz ze spadkiem wartości stężenia H2S2O3 maleją wartości szybkości reakcji.
Doświadczenie 4.2 Wpływ temperatury na szybkość reakcji.
Celem doświadczenia jest zbadanie wpływu temperatury na szybkość reakcji.
Korzystałem z probówek, zlewki, stopera, termometra oraz z następujących odczynników: 0,25 M H2SO4, Na2S2O3, 0,5 M H2S2O3
W jednej probówce przygotowałem 5 cm3 H2S2O3, a w drugiej 5 cm3 H2SO4. Następnie w różnych temperaturach przeprowadziłem reakcje dodania kwasu do tiosiarczanu. Wyniki pomierzyłem stoperem i zapisałem w tabelce.
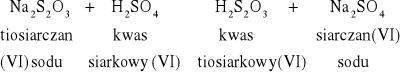
NR PARY |
STĘŻENIE c H2S2O3 = c Na2S2O3 [mol/dm3] |
TEMPERATURA [°C] |
CZAS REAKCJI [s] |
SZYBKOŚĆ REAKCJI [mol/dm3·s-1] |
WSPÓŁCZYNNIK TEMPERATUROWY Θ |
1 |
0,25 |
60 |
2 |
0,125 |
1,501 |
2 |
0,25 |
50 |
3 |
0,0833 |
|
|
|
|
|
|
1,666 |
3 |
0,25 |
40 |
5 |
0,05 |
|
|
|
|
|
|
1,199 |
4 |
0,25 |
30 |
6 |
0,0417 |
|
|
|
|
|
|
1,5 |
5 |
0,25 |
20 |
9 |
0,0278 |
|
I . Obliczam stężenie H2S2O3
1.
Dane: Szukane:
V1 = 5 cm3 = 0,005 dm3 n = ?
C1 = 0,5 mol/dm3 ![]()
= ?
V2 = 10 cm3 = 0,01 dm3
C = n ÷ V
n = V1 · C1
n = 0,005 dm3 · 0,5 mol/dm3
n = 0,0025 mol
![]()
= n ÷ V2
![]()
= 0,0025 mol ÷ 0,01 dm3
![]()
= 0,25 mol/dm32.
2.
Dane: Szukane:
V1 = 5 cm3 = 0,005 dm3 n = ?
C1 = 0,5 mol/dm3 ![]()
= ?
V2 = 10 cm3 = 0,01 dm3
C = n ÷ V
n = V1 · C1
n = 0,005 dm3 · 0,5 mol/dm3
n = 0,0025 mol
![]()
= n ÷ V2
![]()
= 0,0025 mol ÷ 0,01 dm3
![]()
= 0,25 mol/dm3
3.
Dane: Szukane:
V1 = 5 cm3 = 0,005 dm3 n = ?
C1 = 0,5 mol/dm3 ![]()
= ?
V2 = 10 cm3 = 0,01 dm3
C = n ÷ V
n = V1 · C1
n = 0,005 dm3 · 0,5 mol/dm3
n = 0,0025 mol
![]()
= n ÷ V2
![]()
= 0,0025 mol ÷ 0,01 dm3
![]()
= 0,25 mol/dm3
4.
Dane: Szukane:
V1 = 5 cm3 = 0,005 dm3 n = ?
C1 = 0,5 mol/dm3 ![]()
= ?
V2 = 10 cm3 = 0,01 dm3
C = n ÷ V
n = V1 · C1
n = 0,005 dm3 · 0,5 mol/dm3
n = 0,0025 mol
![]()
= n ÷ V2
![]()
= 0,0025 mol ÷ 0,01 dm3
![]()
= 0,25 mol/dm3
5.
Dane: Szukane:
V1 = 5 cm3 = 0,005 dm3 n = ?
C1 = 0,5 mol/dm3 ![]()
= ?
V2 = 10 cm3 = 0,01 dm3
C = n ÷ V
n = V1 · C1
n = 0,005 dm3 · 0,5 mol/dm3
n = 0,0025 mol
![]()
= n ÷ V2 ![]()
= 0,0025 mol ÷ 0,01 dm3
![]()
= 0,25 mol/dm3
II. Obliczam szybkość reakcji
1.
Dane: Szukane:
∆t = 2 s Vśr = ?
![]()
= 0,25 mol/dm3
Vśr = ∆c ÷ ∆t
Zał.: ![]()
= ![]()
Vśr = ![]()
÷ ∆t
Vśr = 0,25 mol/dm3 ÷ 2 s
Vśr = 0,125 mol/dm3·s-1
2.
Dane: Szukane:
∆t = 3 s Vśr = ?
![]()
= 0,25 mol/dm3
Vśr = ∆c ÷ ∆t
Zał.: ![]()
= ![]()
Vśr = ![]()
÷ ∆t
Vśr = 0,25 mol/dm3 ÷ 3 s
Vśr = 0,0833 mol/dm3·s-1
3.
Dane: Szukane:
∆t = 5s Vśr = ?
![]()
= 0,25 mol/dm3
Vśr = ∆c ÷ ∆t
Zał.: ![]()
= ![]()
Vśr = ![]()
÷ ∆t
Vśr = 0,25 mol/dm3 ÷ 5 s
Vśr = 0,05 mol/dm3·s-1
4.
Dane: Szukane:
∆t = 6 s Vśr = ?
![]()
= 0,25 mol/dm3
Vśr = ∆c ÷ ∆t
Zał.: ![]()
= ![]()
Vśr = ![]()
÷ ∆t
Vśr = 0,25 mol/dm3 ÷ 6 s
Vśr = 0,0417 mol/dm3·s-1
5.
Dane: Szukane:
∆t = 9 s Vśr = ?
![]()
= 0,25 mol/dm3
Vśr = ∆c ÷ ∆t
Zał.: ![]()
= ![]()
Vśr = ![]()
÷ ∆t
Vśr = 0,25 mol/dm3 ÷ 9 s
Vśr = 0,0278 mol/dm3·s-1
III Obliczam współczynnik temperaturowy
1.
Dane: Szukane:
Vśr (T 60° C) = 0,125 mol/dm3 · s-1 Θ = ?
Vśr (T 50° C) = 0,0833 mol/dm3 · s-1
Θ = Vśr (T 60° C) ÷ Vśr (T 50° C)
Θ= 0,125 mol/dm3 · s-1 ÷ 0,0833 mol/dm3 · s-1
Θ = 1,501
2.
Dane: Szukane:
Vśr (T 50° C) = 0,0833 mol/dm3 · s-1 Θ = ?
Vśr (T 40° C) = 0,05 mol/dm3 · s-1
Θ = Vśr (T 50° C) ÷ Vśr (T 40° C)
Θ = 0,0833 mol/dm3 · s-1 ÷ 0,05 mol/dm3 · s-1
Θ = 1,666
3.
Dane: Szukane:
Vśr (T 40° C) = 0,05 mol/dm3 · s-1 Θ = ?
Vśr (T 30° C) = 0,0417 mol/dm3 · s-1
Θ = Vśr (T 40° C) ÷ Vśr (T 30° C)
Θ = 0,05 mol/dm3 · s-1 ÷ 0,0417 mol/dm3 · s-1
Θ = 1,199
4.
Dane: Szukane:
Vśr (T 30° C) = 0,0417 mol/dm3 · s-1 Θ = ?
Vśr (T 20° C) = 0,0278 mol/dm3 · s-1
Θ = Vśr (T 30° C) ÷ Vśr (T 20° C)
Θ = 0,0417 mol/dm3 · s-1 ÷ 0,0278 mol/dm3 · s-1
Θ = 1,5
Wykres zależności szybkości reakcji od temperatury
Jak widać na wykresie im wyższa jest temperatura tym wyższe wartości przyjmuje szybkość reakcji.
Doświadczenie 4,3 Badanie wpływu stężenia katalizatora na szybkość redukcji manganianu (VII) potasu w środowisku kwaśnym.
Celem doświadczenia jest zbadanie wpływu stężenia katalizatora na szybkość redukcji manganianu (VII) potasu w środowisku kwaśnym.
Korzystałem z kolb stożkowych, stopera, oraz z następujących odczynników: 2 M H2SO4, 0,1 M K2C2O4, 0,02 M MnSO4
Do sześciu kolb kolejno odmierzyłem po 25 cm3 szczawianu potasu K2C2O4 oraz po 25 cm3 kwasu siarkowego H2SO4 . Następnie do każdej z kolb dodałem odpowiednią ilość siarczanu (VI) manganu (II). Po dokładnym wymieszaniu do kolejnych kolb dodałem po 1 cm3 roztworu manganianu (VII) potasu. Następnie za pomocą stopera zmierzyłem czas reakcji, w wyniku której roztwór odbarwił się . Wyniki zapisałem w tabelce.
NR KOLBKI |
OBJĘTOŚĆ ROZTWORU MnSO4 [cm3]
|
OBJĘTOŚĆ KOŃCOWA MIESZANINY REAKCYJNEJ [cm3] |
STĘŻENIE KMnO4 [ mol/dm3] W MIESZANINIE
|
CZAS REAKCJI [min] |
SZYBKOŚĆ REAKCJI [mol/dm3·min-1] |
1 |
0 |
51 |
0,000390 |
3,53 |
0,0001104 |
2 |
1,0 |
52 |
0,000380 |
1,22 |
0,0003115 |
3 |
2,0 |
53 |
0,000377 |
1,07 |
0,0003523 |
4 |
3,0 |
54 |
0,000370 |
0,55 |
0,0006727 |
5 |
4,0 |
55 |
0,000360 |
0,48 |
0,0007500 |
6 |
5,0 |
56 |
0,000357 |
0,42 |
0,0008500 |
7 |
6,0 |
57 |
0,000350 |
0,37 |
0,0009459 |
I . Obliczam stężenie KMnO4
1.
Dane: Szukane:
V1 = 1 cm3 = 0,001 dm3 n = ?
C1 = 0,02 mol/dm3 ![]()
V2 = 51 cm3 = 0,051 dm3
C = n ÷ V
n = V1 · C1
n = 0,001 dm3 · 0,02 mol/dm3
n = 0,00002 mol
![]()
= n ÷ V2
![]()
= 0,00002 mol ÷ 0,051 dm3
![]()
= 0,00039 mol/dm3
2.
Dane: Szukane:
V1 = 1 cm3 = 0,001 dm3 n = ?
C1 = 0,02 mol/dm3 ![]()
V2 = 52 cm3 = 0,052 dm3
C = n ÷ V
n = V1 · C1
n = 0,001 dm3 · 0,02 mol/dm3
n = 0,00002 mol
![]()
= n ÷ V2
![]()
= 0,00002 mol ÷ 0,052 dm3
![]()
= 0,00038 mol/dm3
3.
Dane: Szukane:
V1 = 1 cm3 = 0,001 dm3 n = ?
C1 = 0,02 mol/dm3 ![]()
V2 = 53 cm3 = 0,053 dm3
C = n ÷ V
n = V1 · C1
n = 0,001 dm3 · 0,02 mol/dm3
n = 0,00002 mol
![]()
= n ÷ V2
![]()
= 0,00002 mol ÷ 0,053 dm3
![]()
= 0,000377 mol/dm3
4.
Dane: Szukane:
V1 = 1 cm3 = 0,001 dm3 n = ?
C1 = 0,02 mol/dm3 ![]()
V2 = 54 cm3 = 0,054 dm3
C = n ÷ V
n = V1 · C1
n = 0,001 dm3 · 0,02 mol/dm3
n = 0,00002 mol
![]()
= n ÷ V2
![]()
= 0,00002 mol ÷ 0,054 dm3
![]()
= 0,000370 mol/dm3
5.
Dane: Szukane:
V1 = 1 cm3 = 0,001 dm3 n = ?
C1 = 0,02 mol/dm3 ![]()
V2 = 55 cm3 = 0,055 dm3
C = n ÷ V
n = V1 · C1
n = 0,001 dm3 · 0,02 mol/dm3
n = 0,00002 mol
![]()
= n ÷ V2
![]()
= 0,00002 mol ÷ 0,055 dm3
![]()
= 0,00036 mol/dm3
6.
Dane: Szukane:
V1 = 1 cm3 = 0,001 dm3 n = ?
C1 = 0,02 mol/dm3 ![]()
C = n ÷ V
n = V1 · C1
n = 0,001 dm3 · 0,02 mol/dm3
n = 0,0002 mol
![]()
= n ÷ V2
![]()
= 0,0002 mol ÷ 0,056 dm3
![]()
= 0,000357 mol/dm3
7.
Dane: Szukane:
V1 = 1 cm3 = 0,001 dm3 n = ?
C1 = 0,02 mol/dm3 ![]()
V2 = 57 cm3 = 0,057 dm3
C = n ÷ V
n = V1 · C1
n = 0,001 dm3 · 0,02 mol/dm3
n = 0,00002 mol
![]()
= n ÷ V2
![]()
= 0,00002 mol ÷ 0,057 dm3
![]()
= 0,000350 mol/dm3
II. Obliczam stężenie MnSO4
1.
Dane: Szukane:
V1 = 0 cm3 = 0 dm3 n = ?
C1 = 0,02 mol/dm3 ![]()
V2 = 51 cm3 = 0,051 dm3
C = n ÷ V
n = V1 · C1
n = 0 dm3 · 0,02 mol/dm3
n = 0 mol
![]()
= n ÷ V2
![]()
= 0 mol ÷ 0,051 dm3
![]()
= 0 mol/dm3
2.
Dane: Szukane:
V1 = 1 cm3 = 0,001 dm3 n = ?
C1 = 0,02 mol/dm3 ![]()
V2 = 52 cm3 = 0,052 dm3
C = n ÷ V
n = V1 · C1
n = 0,001 dm3 · 0,02 mol/dm3
n = 0,00002 mol
![]()
= n ÷ V2
![]()
= 0,00002 mol ÷ 0,052 dm3
![]()
= 0,00038 mol/dm3
3.
Dane: Szukane:
V1 = 2,0 cm3 = 0,002 dm3 n = ?
C1 = 0,02 mol/dm3 ![]()
V2 = 53 cm3 = 0,053 dm3
C = n ÷ V
n = V1 · C1
n = 0,002 dm3 · 0,02 mol/dm3
n = 0,00004 mol
![]()
= n ÷ V2
![]()
= 0,00004 mol ÷ 0,053 dm3
![]()
= 0,00075 mol/dm3
4.
Dane: Szukane:
V1 = 3,0 cm3 = 0,003 dm3 n = ?
C1 = 0,02 mol/dm3 ![]()
V2 = 54 cm3 = 0,054 dm3
C = n ÷ V
n = V1 · C1
n = 0,003 dm3 · 0,02 mol/dm3
n = 0,00006 mol
![]()
= n ÷ V2
![]()
= 0,00006 mol ÷ 0,054 dm3
![]()
= 0,00111 mol/dm3
5.
Dane: Szukane:
V1 = 4,0 cm3 = 0,004 dm3 n = ?
C1 = 0,02 mol/dm3 ![]()
V2 = 55 cm3 = 0,055 dm3
C = n ÷ V
n = V1 · C1
n = 0,004 dm3 · 0,02 mol/dm3
n = 0,00008 mol
![]()
= n ÷ V2
![]()
= 0,00008 mol ÷ 0,055 dm3
![]()
= 0,00145 mol/dm3
6.
Dane: Szukane:
V1 = 5,0 cm3 = 0,005 dm3 n = ?
C1 = 0,02 mol/dm3 ![]()
V2 = 56 cm3 = 0,056 dm3
C = n ÷ V
n = V1 · C1
n = 0,005 dm3 · 0,02 mol/dm3
n = 0,0001 mol
![]()
= n ÷ V2
![]()
= 0,0001 mol ÷ 0,056 dm3
![]()
= 0,00178 mol/dm3
7.
Dane: Szukane:
V1 = 6,0 cm3 = 0,006 dm3 n = ?
C1 = 0,02 mol/dm3 ![]()
V2 = 57 cm3 = 0,057 dm3
C = n ÷ V
n = V1 · C1
n = 0,006 dm3 · 0,02 mol/dm3
n = 0,00012 mol
![]()
= n ÷ V2
![]()
= 0,00012 mol ÷ 0,057 dm3
![]()
= 0,0021 mol/dm3
III. Obliczam szybkość reakcji
1.
Dane: Szukane:
∆t = 3,53 min Vśr = ?
![]()
= 0,000390 mol/dm3
![]()
= 0 mol/dm3
Vśr = ∆c ÷ ∆t
Vśr = ∆c KMnO4 ÷ ∆t
Vśr = 0,000390 mol/dm3 ÷ 3,53 min
Vśr = 0,0001104 mol/dm3·min.-1
2.
Dane: Szukane:
∆t = 1,22min. Vśr = ?
![]()
= 0,00038 mol/dm3
![]()
= 0 mol/dm3
Vśr = ∆c ÷ ∆t
Vśr = ∆c KMnO4 ÷ ∆t
Vśr = 0,00038 mol/dm3 ÷ 1,22 min.
Vśr = 0,0003115 mol/dm3·min.-1
3.
Dane: Szukane:
∆t = 1,07 min. Vśr = ?
![]()
= 0,000377 mol/dm3
![]()
= 0 mol/dm3
Vśr = ∆c ÷ ∆t
Vśr = ∆c KMnO4 ÷ ∆t
Vśr = 0,000377mol/dm3 ÷ 1,07 min.
Vśr = 0,0003523 mol/dm3·min.-1
4.
Dane: Szukane:
∆t = 0,55 min. Vśr = ?
![]()
= 0,00037 mol/dm3
![]()
= 0 mol/dm3
Vśr = ∆c ÷ ∆t
Vśr = ∆c KMnO4 ÷ ∆t
Vśr = 0,00037 mol/dm3 ÷ 0,55 min.
Vśr = 0,0006727 mol/dm3·min.-1
5.
Dane: Szukane:
∆t = 0,48 min. Vśr = ?
![]()
= 0,000360 mol/dm3
![]()
= 0 mol/dm3
Vśr = ∆c ÷ ∆t
Vśr = ∆c KMnO4 ÷ ∆t
Vśr = 0,000360 mol/dm3 ÷ 0,48 min.
Vśr = 0,00075 mol/dm3·min.-1
6.
Dane: Szukane:
∆t = 0,42 min. Vśr = ?
![]()
= 0,000357 mol/dm3
![]()
= 0 mol/dm3
Vśr = ∆c ÷ ∆t
Vśr = ∆c KMnO4 ÷ ∆t
Vśr = 0,000357 mol/dm3 ÷ 0,42 min.
Vśr = 0,00085 mol/dm3·min.-1
7.
Dane: Szukane:
∆t =0,37 min. Vśr = ?
![]()
= 0,000350 mol/dm3
![]()
= 0 mol/dm3
Vśr = ∆c ÷ ∆t
Vśr = ∆c KMnO4 ÷ ∆t
Vśr = 0,000350 mol/dm3 ÷ 0,37 min. Vśr = 0,0009459 mol/dm3 · min.-1
Wykres zależności szybkości reakcji od stężenia katalizatora
Jak widać na wykresie im większe jest stężenie katalizatora , tym reakcja zachodzi szybciej.
Doświadczenie 4.4 Wpływ katalizatora na szybkość rozkładu nadtlenku wodoru.
Celem doświadczenia jest zbadanie wpływu katalizatora na szybkość rozkładu nadtlenku wodoru.
Korzystałam z probówek oraz z odczynników: MnO2, H2O2, 0,5 M FeCl3, 1 M H3PO4,
Do trzech probówek odmierzyłem po 3 cm3 10 % roztworu nadtlenku wodoru. Do pierwszej dodałem niewielką ilość MnO2 ( ditlenku manganu ), do drugiej 0,5 M FeCl3 (chlorek żelaza III ), a do trzeciej 1 M H3PO4( kwas fosforowy V ). Następnie obserwowałem jak szybko zachodzą reakcje rozkładu nadtlenku wodoru w poszczególnych probówkach.
I probówka
Rozkład H2O2 zachodzi bardzo szybko. Wydziela się ciepło. MnO2 w tej reakcji jest katalizatorem kontaktowym dodatnim, który przyspiesza rozkład nadtlenku wodoru.
II probówka
Rozkład H2O2 zachodzi szybko. Wydziela się ciepło. FeCl3 w tej reakcji jest katalizatorem homogenicznym dodatnim, który przyspiesza rozkład nadtlenku wodoru.
III probówka
Rozkład H2O2 zachodzi bardzo powoli. H3PO4 w tej reakcji jest katalizatorem homogenicznym ujemnym, który opóźnia rozkład nadtlenku wodoru.
Wyszukiwarka
Podobne podstrony:
chemia10, NAUKA, chemia, lab
miareczkownie, NAUKA, chemia, lab
Równowaga w roztworach elektrolitów, NAUKA, chemia, lab
pat sciąga chemia zerówka, NAUKA, chemia, lab
Masa atomowa i cząsteczkowa, NAUKA, chemia, lab
Na ciała poruszające się w cieczy, NAUKA, chemia, lab
Oznaczenie miedzi, NAUKA, chemia, lab
grupy pierwsiatkow chemia, NAUKA, chemia, lab
adsorp, NAUKA, chemia, lab
chemia7, NAUKA, chemia, lab
chemia2, NAUKA, chemia, lab
Spektrofotometria S-3, NAUKA, chemia, lab
E -4, NAUKA, chemia, lab
Politechnika Białostocka, NAUKA, chemia, lab
chemia tabelki 3, NAUKA, chemia, lab
Konduktometriaaa, NAUKA, chemia, lab
więcej podobnych podstron