Sprawozdanie nr 3
Potencjometria
Ćwiczenie P - 1
Wyznaczanie charakterystyki elektrody szklanej.
Cel i zakres ćwiczenia
Celem ćwiczenia jest wyznaczenie zależności potencjału elektrody szklanej od pH roztworu i określenie zakresu jej stosowalności w pomiarach pH.
Odczynniki i aparatura:
Elektroda szklana
Elektroda kalomelowa
Potencjometr
Roztwór NaOH o stężeniu 0,2 mol/dm3
Roztwór mieszaniny kwasów: CH3COOH, H3PO4, H3BO3 o stężeniu 0,04 mol/dm3 względem każdej z nich
Wykonanie ćwiczenia
Do siedmiu zlewek o pojemności 100 cm3 odmierzyć roztwór kwasów o stężeniu 0,04 mol/dm3 i roztwór wodorotlenku sodu o stężeniu 0,2 mol/dm3 w następujących ilościach:
Po dokładnym wymieszaniu otrzymuje się szereg wzorcowych roztworów buforowych
Zaczynając od roztworu o najniższym pH, zanurza się elektrody kolejno do poszczególnych roztworów i notuje się wskazania pehametru w mV
Po każdym pomiarze elektrodę należy spłukać wodą i lekko osuszyć bibułą
Wyniki pomiarów:
Nachylenie krzywej kalibracyjnej
Wnioski
Roztwór AgNO3 o stężeniu 0,1 mol/dm3
Elektroda srebrowa
Elektroda kalomelowa
Klucz elektrolityczny napełniony roztworem KNO3 o stężeniu 0,1 mol/dm3
Potencjometr
Przygotować analizowany roztwór do miareczkowania. W tym celu do zlewki o pojemności 250 cm3 przenieść analizowana próbkę i uzupełnić woda destylowana do objętości 150 cm3.
Zbudować ogniwo pomiarowe, zanurzając w miareczkowanym roztworze elektrodę srebrową, elektrodę kalomelową z kluczem elektrolitycznym.
Miareczkować próbę roztworem AgNO3 o stężeniu 0,1 mol/dm3, dodając roztwór w porcjach po 0,5cm3 oraz notując w tabelce sumaryczną liczbę dodawanych centymetrów sześciennych i odpowiadającą jej wartość SEM ogniwa pomiarowego.
Kwas solny o stężeniu 0,1 mol/dm3
Pehametr z elektrodą szklaną i kalomelową
Zestaw do miareczkowania
Wyznaczenie z wykresów Vp i Vm
Obliczanie zasadowości Zp i Zm
W milivalach
W stopniach
Obliczanie zasadowości
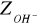
,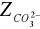
,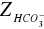
W mval/dm3
W stopniach
Dyskusja wyników:
Średnia arytmetyczna zbiorowości próbnej:
Wariacja zbiorowości próbnej:
Odchylenie standardowe pojedynczego wyniku:
Odchylenie standardowe średniej arytmetycznej:
Względne odchylenie standardowe- charakteryzuje wielkość rozrzutu wyników:
Przedział ufności:
Średnia arytmetyczna zbiorowości próbnej:
Wariacja zbiorowości próbnej:
Odchylenie standardowe pojedynczego wyniku:
Odchylenie standardowe średniej arytmetycznej:
Względne odchylenie standardowe- charakteryzuje wielkość rozrzutu wyników:
Przedział ufności:
Nr zlewki |
pH buforu |
Objętość roztworu kwasów [cm3] |
Objętość roztworu NaOH [cm3] |
I |
1,98 |
50 |
5 |
II |
3,29 |
50 |
10 |
III |
4,56 |
50 |
15 |
IV |
5,72 |
50 |
20 |
V |
6,80 |
50 |
25 |
VI |
7,96 |
50 |
30 |
VII |
9,15 |
50 |
35 |
Numer zlewki |
Wskazania pehametru [mV] |
I |
-242 |
II |
-162 |
III |
-103 |
IV |
-45 |
V |
+18 |
VI |
+90 |
VII |
+152 |
Nachylenie krzywej kalibracyjnej wynosi 28°.
Na podstawie przebiegu wykresu widać, że zależność potencjału elektrody szklanej od pH roztworu buforowego jest prostoliniowa w zakresie pH od 6 do 7. Oznacza to, iż w tym przedziale można stosować badana elektrodę.
Ćwiczenie P - 3
Oznaczanie równocześnie występujących jodków i chlorków metodą potencjometrycznego miareczkowania strąceniowego
1. Cel i zakres ćwiczenia
Celem ćwiczenia jest oznaczenie zawartości jodków i chlorków w próbce otrzymanej do analizy. Oznaczenie to polega na badaniu zmian potencjału elektrody srebrowej podczas dodawania azotanu srebra do analizowanego roztworu.
2. Odczynniki i aparatura
3. Wykonanie ćwiczenia
4. Wyniki pomiarów
Objętość AgNO3 [cm3] |
Wartość E [mV] |
Wartość ΔE |
Wartość ΔV |
Wartość ΔE/ ΔV |
0 |
-285 |
2 |
0,5 |
4 |
0,5 |
-287 |
-6 |
0,5 |
-12 |
1,0 |
-281 |
-4 |
0,5 |
-8 |
1,5 |
-277 |
-3 |
0,5 |
-6 |
2,0 |
-274 |
-3 |
0,5 |
-6 |
2,5 |
-271 |
-4 |
0,5 |
-8 |
3,0 |
-267 |
-3 |
0,5 |
-6 |
3,5 |
-264 |
-7 |
0,5 |
-14 |
4,0 |
-257 |
-7 |
0,5 |
-14 |
4,5 |
-250 |
-9 |
0,5 |
-18 |
5,0 |
-241 |
-14 |
0,5 |
-28 |
5,5 |
-227 |
-136 |
0,5 |
-272 |
6,0 |
-91 |
-120 |
0,5 |
-240 |
6,5 |
+29 |
-10 |
0,5 |
-20 |
7,0 |
+39 |
-18 |
0,5 |
-36 |
7,5 |
+57 |
-30 |
0,5 |
-60 |
8,0 |
+87 |
-3 |
0,5 |
-6 |
8,5 |
+90 |
-7 |
0,5 |
-14 |
9,0 |
+97 |
-20 |
0,5 |
-40 |
9,5 |
+117 |
-1 |
0,5 |
-2 |
10,0 |
+118 |
-12 |
0,5 |
-24 |
10,5 |
+130 |
-9 |
0,5 |
-18 |
11,0 |
+139 |
-18 |
0,5 |
-36 |
11,5 |
+157 |
-41 |
0,5 |
-82 |
12,0 |
+198 |
-111 |
0,5 |
-222 |
12,5 |
+309 |
-20 |
0,5 |
-40 |
13,0 |
+329 |
-11 |
0,5 |
-22 |
13,5 |
+340 |
-5 |
0,5 |
-10 |
14,0 |
+345 |
-9 |
0,5 |
-18 |
14,5 |
+354 |
-3 |
0,5 |
-6 |
15,0 |
+357 |
-3 |
0,5 |
-6 |
15,5 |
+360 |
-7 |
0,5 |
-14 |
16,0 |
+367 |
0 |
0,5 |
0 |
16,5 |
+367 |
0 |
0,5 |
0 |
17,0 |
+367 |
0 |
0,5 |
0 |
17,5 |
+367 |
17 |
0,5 |
34 |
18,0 |
+350 |
5 |
0,5 |
10 |
18,5 |
+345 |
-13 |
0,5 |
-26 |
19,0 |
+358 |
-17 |
0,5 |
-34 |
19,5 |
+375 |
-5 |
0,5 |
-10 |
20,0 |
+380 |
- |
- |
- |
5.Odczyt punktów końcowych miareczkowania jodków i chlorków
Wykres E=f(V)
PK1=6
PK2=12
Wykres ![]()
PK1=5,5 V1= PK1=5,5 cm3
PK2=12
V2= PK2- PK1 =12 cm3-5,5 cm3=6,5 cm3
Do obliczenia zawartości jodków i chlorków bierzemy pod uwagę punkty końcowe odczytane z wykresu E=f(V).
6.Obliczenia dotyczące zawartości:
b)chlorków
a) jodków
1 mol I- reaguje z 1 molem AgNO3
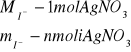
![]()
![]()
![]()
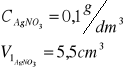
![]()
![]()
g I-
1 mol Cl- reaguje z 1 molem AgNO3

![]()
![]()
![]()
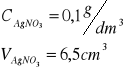
![]()
![]()
g Cl-
7.Wnioski
Przeprowadzone doświadczenie pozwoliło na równoczesne oznaczenie jodków i chlorków w otrzymanej do analizy próbie. Polegało ono na badaniu zmian potencjału elektrody srebrowej podczas dodawania do analizowanego roztworu azotanu srebra. Na krzywej miareczkowania potencjometrycznego wystąpiły dwa wyraźne punkty przegięcia: pierwszy dla AgJ a drugi dla AgCl. Kolejność ta wynika z dużej różnicy w iloczynach rozpuszczalności tych roztworów.
W próbie analizowanej przeze mnie znajdowało się 0,023g chlorków i 0,07 g jodków.
Ćwiczenie P - 6
Oznaczanie zasadowości wody metodą miareczkowania potencjometrycznego.
1. Cel i zakres ćwiczenia
Oznaczanie zasadowości polega na określeniu zawartości związków reagujących zasadowo wobec fenoloftaleiny i oranżu metylowego. Zawartość tych związków jest równoważna ilości miligramorównoważników kwasu mineralnego zużytego do miareczkowania próby w obecności danego wskaźnika.
2. Odczynniki i aparatura
3. Wykonanie ćwiczenia
Do zlewki o pojemności 200 cm3, ustawionej na mieszadle magnetycznym, odmierzyć 100 cm3 badanej wody i miareczkować roztworem kwasu solnego do osiągnięcia pH=4. Po przekroczeniu pH od 8,5 do 8,0 oraz 4,8 do 4,2 dodawać małe porcje roztworu kwasu.
4. Wyniki pomiarów
Objętość HCl [cm3] |
Miareczkowanie I |
Miareczkowanie II |
Miareczkowanie III |
0 |
11,29 |
11,55 |
11,55 |
1 |
11,23 |
11,47 |
11,49 |
2 |
11,13 |
11,37 |
11,40 |
3 |
11,02 |
11,25 |
11,28 |
4 |
10,89 |
11,11 |
11,14 |
5 |
10,76 |
10,97 |
11,00 |
6 |
10,65 |
10,84 |
10,88 |
7 |
10,53 |
10,71 |
10,78 |
8 |
10,42 |
10,60 |
10,66 |
9 |
10,32 |
10,51 |
10,55 |
10 |
10,23 |
10,42 |
10,46 |
11 |
10,15 |
10,32 |
10,37 |
12 |
10,08 |
10,22 |
10,27 |
13 |
9,99 |
10,12 |
10,17 |
14 |
9,89 |
10,03 |
10,08 |
15 |
9,79 |
9,93 |
9,98 |
16 |
9,66 |
9,81 |
9,86 |
17 |
9,53 |
9,67 |
9,72 |
18 |
9,35 |
9,49 |
9,56 |
19 |
9,06 |
9,22 |
9,31 |
20 |
8,34 |
8,62 |
8,51 |
21 |
8,04 |
8,15 |
8,13 |
22 |
7,79 |
7,90 |
7,89 |
23 |
7,62 |
7,75 |
7,71 |
24 |
7,48 |
7,62 |
7,60 |
25 |
7,38 |
7,50 |
7,45 |
26 |
7,28 |
7,39 |
7,34 |
27 |
7,19 |
7,29 |
7,24 |
28 |
7,10 |
7,18 |
7,15 |
29 |
7,00 |
7,09 |
7,04 |
30 |
6,90 |
7,00 |
6,95 |
31 |
6,80 |
6,88 |
6,84 |
32 |
6,67 |
6,77 |
6,71 |
33 |
6,51 |
6,60 |
6,55 |
34 |
6,24 |
6,34 |
6,30 |
35 |
5,55 |
5,60 |
5,63 |
36 |
4,66 |
4,69 |
4,71 |
37 |
4,44 |
4,45 |
4,38 |
38 |
4,31 |
4,32 |
4,23 |
39 |
4,23 |
4,24 |
4,14 |
40 |
4,16 |
4,18 |
4,06 |
41 |
4,12 |
4,13 |
4,02 |
42 |
4,08 |
4,09 |
3,97 |
43 |
4,07 |
4,06 |
3,94 |
Objętość |
Miareczkowanie I |
Miareczkowanie II |
Miareczkowanie III |
Vp |
20 |
20,5 |
20,3 |
Vm |
36,4 |
36,5 |
36,4 |
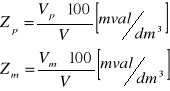
Vp- objętość kwasu solnego zużytego na miareczkowanie do pH=8,3 [cm3]
Vm- objętość kwasu solnego zużytego na miareczkowanie do pH=4,5[cm3]
V- objętość wody pobranej do miareczkowania [cm3]
Miareczkowanie I |
Miareczkowanie II |
Miareczkowanie III |
|
|
|
|
|
|
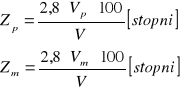
Vp- objętość kwasu solnego zużytego na miareczkowanie do pH=8,3 [cm3]
Vm- objętość kwasu solnego zużytego na miareczkowanie do pH=4,5[cm3]
V- objętość wody pobranej do miareczkowania [cm3]
Miareczkowanie I |
Miareczkowanie II |
Miareczkowanie III |
|
|
|
|
|
|
2Zp>Zm
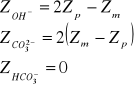
Zasadowość |
Miareczkowanie I |
Miareczkowanie II |
Miareczkowanie III |
|
|
|
|
|
|
|
|
|
|
|
|
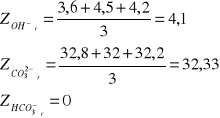
Zasadowość |
Miareczkowanie I |
Miareczkowanie II |
Miareczkowanie III |
|
|
|
|
|
|
|
|
|
|
|
|

a) w mval/dm3
![]()
xi-poszczególny wynik pomiaru
n-liczba wyników
Zp: ![]()
Zm: ![]()
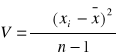
; n -1= k - liczba stopni swobody
Zp: ![]()
Zm: ![]()
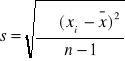
Zp: ![]()
Zm: ![]()
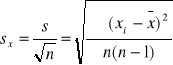
Zp: ![]()
Zm: ![]()
![]()
Zp: ![]()
Zm:![]()
95% dla k = 2 tstudenta = 4,303
![]()
[ ]
Zp: x=20,27±4,303·0,14=20,27±0,6 ![]()
Zm: x=36,43±4,303·0,03=36,43±0,13 ![]()
b) w stopniach
![]()
xi-poszczególny wynik pomiaru
n-liczba wyników
Zp: ![]()
Zm: ![]()
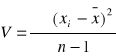
; n -1= k - liczba stopni swobody
Zp: ![]()
Zm: ![]()
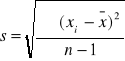
Zp: ![]()
Zm: ![]()
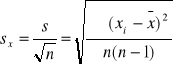
Zp: ![]()
Zm: ![]()
![]()
Zp: ![]()
Zm:![]()
95% dla k = 2 tstudenta = 4,303
![]()
[ ]
Zp: x=56,75±4,303·0,01=56,75±0,04 ![]()
Zm: x=102,01±4,303·0,01=102,01±0,04 ![]()
9.Wnioski
Przeprowadzone doświadczenie pozwoliło na oznaczenie zasadowości wody. Polegało ono na określeniu zawartości związków reagujących zasadowo wobec fenoloftaleiny i oranżu metylowego. W analizowanej przeze mnie próbce wody znajdowało się 4,1 [mval/dm3] jonów wodorotlenowych, 32,33 [mval/dm3] jonów węglanowych i 0 [mval/dm3] jonów wodorowęglanowych, natomiast w przeliczeniu na stopnie 11,48 [stopni] jonów wodorotlenowych, 90,53 [stopni] jonów węglanowych i 0 [stopni] jonów wodorowęglanowych.
1
Wyszukiwarka
Podobne podstrony:
8006
8006
09 Stopień krystalicznościid 8006 ppt
8006
8006
8006
monsun2 gif 800×600 pixels
tropik atlan gif 800×682 pixels
więcej podobnych podstron