TEST: Systematyka związków nieorganicznych (wersja I)
Każde pytanie lub twierdzenie ma tylko jedną poprawną odpowiedź. Należy ją wybrać.
1. W zlewce zmieszano rozcieńczone roztwory kwasu solnego i kwasu siarkowego(VI).
Jakie jony znajdują się w tak otrzymanym roztworze?
a) H+, HSO-4 , Cl-, SO42-
b) H+
c) Cl-, SO 42-
d) jony pochodzące z dysocjacji tego kwasu, którego jest więcej w roztworze.
2. Jeżeli do roztworu KOH wprowadzi się roztwór H2SO4, to w wyniku reakcji powstanie sól:
a) sól obojętna,
b) hydroksosól lub sól obojętna,
c) wodorosól,
d) wodorosól lub sól obojętna.
3. W trzech probówkach znajdują się następujące substancje:
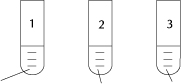
wodny roztwór NaOH H2O wodny roztwór H2SO4
Przeanalizuj tabelę i wskaż poprawną odpowiedź: a, b, c lub d.
Odpowiedź |
Odczyn kwasowy |
Odczyn zasadowy |
Odczyn obojętny |
a |
substancja |
substancja |
substancja
|
b |
substancja |
substancja |
substancja
|
c |
substancja |
substancja |
substancja
|
d |
substancja |
substancja |
substancja
|
4. Chlor tworzy szereg tlenków:
I. Cl2O II. ClO2 III. Cl2O6 IV. Cl2O7
Kwas chlorowy(VII) może powstać w reakcji z wodą tlenku (tlenków):
a) tylko IV
b) I i IV
c) II i III
d) tylko III
5. Wybierz grupę związków, w której znajdują się tylko sole:
a) Na2SO4, NaOH, K2CO3, CuSO4
b) KCl, NaHCO3, Al2(SO4)3, MgOHCl
c) KCl, HCl, Fe(NO3)3, PbO
d) NaHSO4, H2S, NaCl, K2CO3
6. Które z podanych substancji należą do kwasów?
I. HCl II. NaOH III. BaCl2 IV. KCl V. CaO VI. H2CO3
a) I i VI
b) I i III
c) I, V, VI
d) tylko I
7. Z podanych stwierdzeń wybierz prawdziwe:
I. Tlenki zasadowe są to tlenki reagujące z kwasami, a niereagujące z zasadami.
II. Tlenki zasadowe są to tlenki reagujące z zasadami, a niereagujące z kwasami.
III. Tlenki kwasowe są to tlenki reagujące z zasadami, a niereagujące z kwasami.
IV. Tlenki kwasowe są to tlenki reagujące z kwasami, a niereagujące z zasadami.
V. Tlenki zasadowe w reakcji z wodą tworzą zasady.
a) II, IV, V
b) I, IV, V
c) tylko I i III
d) I, III, V
8. Do czterech probówek zawierających cztery różne tlenki dodano wody i dokładnie wymieszano:
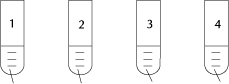
CO2 CaO CuO SO2
Stwierdzono, że kwasy powstały w:
a) probówkach 1 i 4,
b) probówkach 1 i 2,
c) probówkach 2 i 3,
d) tylko w probówce 4.
9. Które z doświadczeń należy przeprowadzić, aby wykazać amfoteryczne właściwości wodorotlenku glinu?
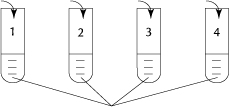
H2O H2SO4 AlCl3 KOH
Al(OH)3
a) doświadczenia 1 i 2,
b) doświadczenia 2 i 4,
c) tylko doświadczenie 2,
d) doświadczenia 1 i 3.
10. Wybierz grupę związków chemicznych, w której wszystkie związki mają charakter amfoteryczny:
a) Zn(OH)2, As2O3, MnO2, PbCl2
b) AlCl3, KOH, CrCl3, Al2O3
c) Al2(SO4)3, CaO, ZnO, Sb2O3
d) ZnO, Al(OH)3, Cr(OH)3, As2O3
11. Masa cząsteczkowa tlenowego kwasu pewnego pierwiastka wynosi 68,5 u, a stosunek masy wodoru do masy tlenu w cząsteczce tego kwasu wynosi 1 : 32. Kwasem tym jest:
a) HNO2
b) HClO3
c) HClO2
d) H2SO4
12. Które równanie reakcji poprawnie przedstawia proces otrzymywania wodorotlenku sodu?
a) Na2O + H2O 2 NaOH
b) 2 NaO + H2O 2 NaOH
c) 2 Na + 2 H2O 2 NaOH + H2↑
d) dwie odpowiedzi są poprawne
13. Zasady są to:
a) wodorotlenki metali ciężkich, np. miedzi, ołowiu,
b) wodorotlenki dobrze rozpuszczalne w wodzie,
c) wodorotlenki słabo rozpuszczalne w wodzie,
d) wszystkie wodorotlenki.
14. Do jakiego typu soli należą:
I. CaSO4 · 2 H2O III. KH2PO4 V. MgSO4
II. NaHCO3 IV. CaOHCl VI. MgAl2(SO4)4
Odpowiedź |
Wodorosól |
Hydroksosól |
Sól obojętna |
Sól obojętna |
a |
II, III |
VI |
I, V
|
IV
|
b |
IV |
II, III |
I, V
|
VI
|
c |
II |
III, IV |
I, V
|
VI
|
d |
II, III |
IV |
I, V
|
VI
|
15. Które z wymienionych niżej tlenków mogą reagować z wodorotlenkiem sodu?
I. CaO II. SO2 III. ZnO IV. P4O10
a) I, III, IV
b) II, IV
c) II, III, IV
d) III, IV
16. Poniższy chemograf przedstawia przebieg trzech reakcji:
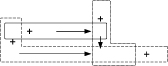
W tym chemografie substancjami X, Y, Z są:
Odpowiedź |
X |
Y |
Z |
a |
CaO |
H2 |
H2O |
b |
H2O |
CaO |
H2 |
c |
CaO |
H2O |
H2 |
d |
H2 |
CaO |
H2O |
17. Które z wymienionych kwasów można otrzymać w reakcji tlenków niemetali z wodą?
I. HCl II. H2SO3 III. H2S IV. HNO3
a) I, II, III, IV
b) II, III, IV
c) I, III
d) II, IV
18. W roztworze wodnym wodorotlenku magnezu znajdują się jony:
a) Mg2+ i OH2-
b) Mg+ i OH-
c) Mg2+ i OH-
d) Mg+ i OH2-
19. Które równanie reakcji poprawnie przedstawia proces otrzymywania siarczanu(VI) glinu?
a) Al(OH)3 + H2S Al2 (SO4)3 + H2O
b) 2 Al(OH)3 + 3 H2SO4 Al2(SO4)3 + 6 H2O
c) Al2O3 + 3 H2SO4 Al2(SO4)3 + H2O
d) 2 Al(OH)3 + SO3 Al2(SO4)3 + 3 H2O
20. Uczeń miał otrzymać chlorek miedzi(II) dowolnymi metodami. Którymi z zaproponowanych metod nie mógł otrzymać tego związku?
I. metal + kwas
II. tlenek metalu + kwas
III. wodorotlenek metalu + kwas
IV. tlenek metalu + tlenek niemetalu
V. metal + niemetal
VI. wodorotlenek metalu + tlenek niemetalu
a) I, IV, VI
b) II, III
c) III, V
d) II, V
Ca O2
Y
Y
X
Z
Ca(OH)2
Wyszukiwarka
Podobne podstrony:
3133
3133
3133
3133
3133
3133
3133
3133
więcej podobnych podstron