Fazy cyklu komórkowego
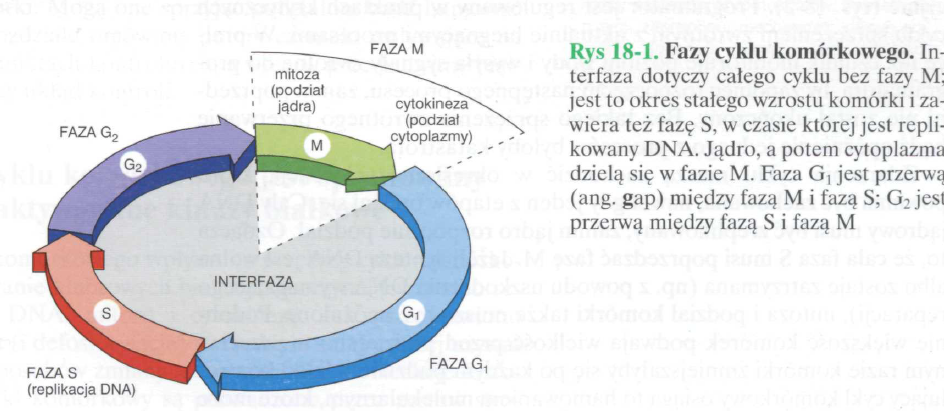
Cykliczne zachodzenie replikacji (faza S) i podziału komórki (faza M) nazywamy cyklem komórkowym.
Faza G1
intensywny anabolizm komórki
wzrasta ilość makrocząsteczek w komórce (białka, RNA i inne)- wzrost masy i objętości
synteza cyklin A, C, D, E
długosć fazy G1 decyduje o długości całego cyklu
w późnej fazie G1 występuje punkt R1 ( restrykcyjny), -kontrola materiału genetycznego, wyszukiwanie i naprawianie uszkodzeń. Bez naprawy komórka nie wejdzie w kolejną faze
Faza syntezy (S) DNA
stała długość fazy,
replikuje sie DNA
rozpoczyna się synteza cykliny B
Faza G2
przerwa w syntezie DNA, służy do przygotowania komórki do podziału, głównie białek wrzeciona i cykliny B
nadprodukcja składników potrzebnych do odtworzenia błony w TELOfazie i cytokiniezie
w później fazie G2 aktywuje sie kinaza białkowa CDK(przyczynia sie do zaniku błony jądrowej i kondensacji chromosomów przez fosforylacje lamin(białka otoczki jądrowej), białek cytoszkieletu i histonu H1)
trwa 3-4 h
pod koniec tej fazy obecny drugi punkt restrykcyjny R2- kontrola prawidłowej kondensacji i segregacji materiału genetycznego oraz tworzenie się wrzeciona podziałowego
Faza G0
stan spoczynku komórki, brak podziałów i replikacji
stan moze utrzymywac sie nawet wiele miesięcy
bodźce aktywują przejście z G0 do G1 (np. Aktywacja limfocytów przez mutageny, czy hepatocytów przez niedotlenienie)
w komórkach nowotworowych brak mechanizmów regulujących podział komórek i przejście lub pozostanie w fazie G0(w leczeniu cytostatykami eliminuje się komórki będące w innej fazie niż G0-pomyśl kiedy można zaobserwować nawrót nowotworu?)
Mitoza
Profaza, metafaza anafaza telofaza, cytokineza to wiemy dokładnie
Regulacja cyklu komórkowego:
w punktach restrykcyjnych na zasadzie pralki automatycznej: nie może nastąpić następna faza, jeżeli poprzednia nie została ukończona
Uruchamianie kaskad fosforylacji i defosforylacji lub łączenie się z cyklinami
cdk należą do kluczowych regulatorów synchronizacji w czasie i koordynacji różnych reakcji cyklu komórki, aktywowane po przyłączeniu cykliny,
Cykliny
- podjednostka regulatorowa białek cdk.
A B - cykliny mitotyczne,
D E - cykliny fazy G1
Regulacja cyklu komórkowego odbywa się przez uruchamianie kaskadowych reakcji fosforylacji i defosforylacji białek. Fosforylacja (przeniesienie grupy fosforanowej z ATP na odpowiednią resztę aminokwasową białka docelowego) jest katalizowana przez różnorodne kinazy białkowe, a defosforylacja przez fosfatazy. Substratami kinaz białkowych są różne białka jądra i cytoplazmy, a najczęściej fosforylowanymi aminokwasami tych białek są tyrozyna i treonina. Fosforylacja (i defosforylacja) jest jednym z najczęściej używanych przez komórkę sposobów zmiany aktywności białek.
Kinazy białkowe układu kontroli cyklu komórkowego są obecne w komórkach dzielących się podczas całego cyklu. Są jednak aktywowane tylko w odpowiednim okresie cyklu, po czym szybko tracą aktywność. Stąd aktywność każdej z tych kinaz cyklicznie zwiększa się i zmniejsza.
Aktywność kinaz białkowych zależy to od innego zestawu białek układu kontroli — od cyklin. Cykliny same nie mają aktywności enzymatycznej, ale muszą się przyłączyć do kinaz cyklu komórkowego, i kinazy te mogą zyskać aktywność enzymatyczną. Stąd kinazy układu kontroli cyklu komórkowego są nazywane kinazami białkowymi zależnymi od cyklin (Cdk - ang. cyclin-dpendent protein kinases). Nazwa cyklin pochodzi stąd, że przeciwnie niż poziom Cdk, ich stężenie zmienia się cyklicznie w cyklu komórkowym.
Cykliny występują w komórkach jako cykliny A i B oraz C, D i E. W czasie cyklu komórkowego cykliny A, C, D i E są syntetyzowane de novo i ich stężenie w komórce rośnie w miarę upływu cyklu, zaś cyklina B jest syntetyzowana w fazie G2. Maksymalne stężenie cyklin występuje w metafazie/ anafazie mitozy, po czym ulega ono obniżeniu na skutek trawienia ich przez proteazy.
Aktywacja kinaz zachodzi w dwóch krytycznych przedziałach czasowych (punktach kontrolnych) cyklu komórkowego: pod koniec fazy G2 ( punkt R2) oraz w fazie G1(punkt R1). Każdy rodzaj kompleksu cyklina-Cdk działa na różny zestaw białek docelowych w komórce
Stężenie różnych typów cyklin zwiększa się, a potem gwałtownie maleje na skutek degradacji na drodze ubikwitynacji w określonym czasie cyklu komórkowego. Wzrost stężenia każdego typu cykliny wspomaga aktywację jej partnerskiej Cdk, a nagły jego spadek przywraca tę Cdk do stanu nieaktywnego. Powolne gromadzenie się cyklin, aż do krytycznego poziomu, jest jednym ze sposobów pomiaru odstępów czasu między jednym etapem cyklu a następnym w układzie kontroli cyklu komórkowego.
Przejście z późnej fazy G2 do M. dokonuje się przez aktywację kinazy fazy M, znanej jako czynnik wywołujący dojrzewanie (MPF - maturation promoting factor). Jest ona heterodimerem białkowym składającym się z białka p34 i cykliny. W kompleksie tym białko p34 jest kinazą fosforylującą reszty seryny i treoniny wielu białek a cyklina nadaje aktywnemu kompleksowi powinowactwo do odpowiedniego substratu (białka, które ma być ufosforylowane).
Kinaza fazy M powstaje w fazie G2 w wyniku utworzenia kompleksu p34 z głównie z cykliną B. Kinaza MPF fosforyluje wiele kluczowych białek, zmieniając ich właściwości, np: rozpad otoczki jądrowej zachodzi przez w wyniku fosforylacji i demontażu biegnących pod otoczką jądrową filamentów laminy, podobnie fosforyluje białka towarzyszące mikrotubulom, co zmienia właściwości mikrotubul tak, że tworzą wrzeciono podziałowe, fosforyluje również histon H1 co powoduje kondensację chromosomów.
Regulacja fazy S odbywa się przez kontrolę przechodzenia komórki z G1 w S oraz przez kontrolę zakończenia syntezy DNA. Przypuszcza się, że białko p34 może łączyć się w fazie G1 głównie z cykliną D lub E, dając kompleks kinazy podobny do kinazy fazy M, nazywany kinazą fazy S. Aktywność takiej kinazy prowadzi komórki przez punkt restrykcyjny (w późnej fazie G1). Półokres trwania cyklin G1wynosi zaledwie ok. 15 min., co odpowiada klasie białek niestabilnych (białek U), które znane są od dawna i których nagromadzenie w komórce jest warunkiem przejścia G1 ® S.
Kinazy białkowe zależne od cyklin są regulowane nagromadzaniem i rozpadem cyklin
Regulacja stężenia cyklin ma ważny udział w synchronizacji zjawisk cyklu komórkowego. Na przykład, synteza składnika MPF — cykliny B, zaczyna się bezpośrednio po podziale i trwa stale podczas interfazy. Cyklina gromadzi się, stąd jej stężenie stopniowo zwiększa się i określa chwilę rozpoczęcia mitozy; jego późniejsze gwałtowne zmniejszenie się rozpoczyna wyjście z mitozy. Nagły spadek stężenia cykliny podczas mitozy jest spowodowany szybkim zniszczeniem cykliny w układzie proteolitycznym zależnym od ubikwityny. Wiele cząsteczek ubikwityny jest kowalencyjnie dołączonych do każdej cząsteczki cykliny, co kieruje ją do degradacji w proteosomach. Ta ubikwitynacja cykliny jest pośrednim wynikiem aktywacji kinazy MPF. Aktywacja MPF rozpoczyna proces prowadzący z opóźnieniem do ubikwitynacji i degradacji cyklin, co z kolei wyłącza kinazę.
Cykl komórkowy może zostać zatrzymany w G1 przez białkowe inhibitory Cdk
Większość mechanizmów molekularnych odpowiedzialnych za zahamowanie biegu cyklu komórkowego w punktach kontrolnych jest słabo poznanych. W niektórych przypadkach są za to odpowiedzialne swoiste białkowe inhibitory Cdk; blokują one powstawanie bądź aktywność jednego albo kilku kompleksów cyklina-Cdk. Jeden z lepiej poznanych punktów kontrolnych zatrzymuje cykl komórkowy w G1 po uszkodzeniu DNA, co zapobiega replikacji przez komórkę uszkodzonego DNA. Uszkodzenie DNA powoduje nie poznanym dotąd mechanizmem zwiększenie stężenia i aktywności białka regulatorowego genów, nazwanego białkiem p53. Zaktywowane białko p53 zwiększa transkrypcję genu kodującego białkowy inhibitor Cdk, nazywanego p21. To zwiększa stężenie białka p21, które wiąże się z kompleksami cyklina-Cdk fazy S, odpowiedzialnymi za wprowadzenie komórki do fazy S i blokuje ich działanie. Zatrzymanie cyklu komórkowego w G1 daje komórce czas na reperację uszkodzonego DNA, zanim zostanie on zreplikowany. Gdy brak jest białka p53 albo jest ono nieaktywne, zachodzi nieograniczona replikacja uszkodzonego DNA, co zwiększa częstość mutacji i możliwości pojawienia się komórek nowotworowych. Mutacje genu p53, które pozwalają dzielić się komórkom z uszkodzonym DNA, stanowią ważny element w rozwoju większości nowotworów u człowieka.
INHIBITORY KINAZ cdk - CKI (cyclin depending kinase inhibitors)
białko p21
-poziom zwiększa sie w komórkach starzejacych sie i zachamowanych w G0
-powiązane lub nie z białkiem p53
Białko p16
zapobiega fosforylacji pRb(aktywne białko ma zdolność zahamowania cyklu komórkowego) i jego inaktywacji
białko p27
-uniwersalny inhibitor cdk, kontroluje cykl komórkowy
białko p53
-hamuje cykl komórkowy, umożliwiając naprawę uszkodzonego białka lub kieruje je na drogę apoptozy.
-działa w R1 i R2
-zmutowane białko p53 jest onkogenem- brak regulacji cyklu komórkowego
Wyszukiwarka
Podobne podstrony:
16.CYKL KOMÓRKOWY I JEGO REGULACJA, studia-biologia, Opracowane pytania do licencjatu
Biologia Komorki Cykl Komorkowy Nieznany (2)
jądro interfazowe, STUDIA, biologia komórki
CYKL KOMÓRKOWY, biologia komórki
Biologia Komórki. zaganienia wykładowe, biologia, Biologia I rok, od adama, studia, biologia komórki
mikr elektronowy, Studia - biologia spec.biochemia UMCS, Biologia komórki i molekularna, Technika hi
Cykl komorkowy, farmacja, I sem, biologia
analiza, Studia - biologia spec.biochemia UMCS, Biologia komórki i molekularna, Technika histologicz
Biologia Komorki. zaganienia wykladowe, biologia, Biologia I rok, od adama, studia, biologia komórki
cytoszkielet, STUDIA, biologia komórki
CYKL KOMORKOWY, Biotechnologia i, Rok I, Biologia komórki, Biologia komorki materialy
BK-CW-calosc-druk, Studia, biologia komórki
Membranoszkielet, studia-biologia, Licencjat, sem 3-4, biologia komórki
Prelekcja 2 Cykl komórkowy, biologia
pytania z biologii komórki, biologia, Biologia I rok, od adama, studia, biologia komórki
Jądro, STUDIA, biologia komórki
więcej podobnych podstron